Introducción
La apicultura en México, es una actividad de la que dependen aproximadamente 40 mil productores, quienes en conjunto poseen más de 2 millones de colmenas, lo que permite que México sea el quinto país productor y tercer exportador de miel a nivel mundial (SAGARPA, 2014). Jalisco ubicándose en el tercer lugar nacional. La producción apícola, a pesar de la presencia de la abeja Africana (Apis mellifera scutellata) e infestación con ácaros (Varroa destructor), ha registrado una importante recuperación (crecimiento anual 3%) que se ha sostenido durante los últimos 5 años, superando en los últimos 4 años, las 56,300 toneladas de miel; de las cuales se han exportado cerca de 29,109, principalmente a Europa (Alemania e Inglaterra) y Estados Unidos de Norteamérica (USA), generando ingresos por 32.4 millones de dólares anuales; lo que confirma que la apicultura es fuente de divisas (SAGARPA, 2014).
Además de proveer de miel a la humanidad, las abejas son esenciales en la polinización agrícola a nivel mundial, e incluso producción de cera y propóleo. Pero a pesar de ello se ha observado una reducción de su población, atribuida a factores tales como: predadores, problemas de alimentación, exposición a pesticidas y enfermedades de diferente índole (Vanengelsdorp et al., 2009). Los autores Wu et al. (2011) reportan el efecto de residuos de pesticidas en las larvas, lo cual afecta su desarrollo y con ello la producción general de la colmena.
Por otro lado, según los autores (Natsopoulou et al., 2016; Nazzi y Le Conte, 2016) la temperatura y humedad, imperante en la colmena, propician la comunicación entre las abejas, y juegan un papel importante para la presentación de posibles infecciones. Por ejemplo, las abejas como individuo adulto, expuestas a las variaciones medio ambientales y posibles residuos de pesticidas, pueden presentar micosis (Nosema apis), que alteran desde su vuelo (Doselli et al., 2016; Fries, 2010; Goulson et al., 2015; Vanengelsdorp et al., 2009), capacidad polinizadora, hasta su reproducción y desarrollo.
En cambio, las larvas de la Apis mellifera, además de los ácaros, llegan a padecer de la enfermedad micótica, conocida como Ascosferosis (Cría yesificada o de cal), cuyo agente etiológico es el hongo Ascosphaera apis ( A. apis ) que invade a su anfitrión superando su sistema inmune (Albo y Reynaldi, 2010; Aronstein y Murray, 2010; Jensen et al., 2015) reduciendo de manera sustancial la cantidad de abejas productoras.
El A. apis es un hongo heterotálico, compuesto por hifas septadas hialinas; no presenta estados conidiales y cuyo cultivo se distingue morfológicamente sólo durante la reproducción (Albo y Reynaldi, 2001; Reynaldi et al., 2003). Como resultado de esta fase se originan los esporocistos, que miden 80 de diámetro en promedio, valor que puede variar por la temperatura y el medio de cultivo. La micosis a nivel mundial presenta indicios de aumento, probablemente por el calentamiento global (Aronstein y Murray, 2010).
Las larvas de la abeja ingieren las esporas del A. apis junto con el alimento suministrado por las nodrizas (Reynaldi et al., 2003, 2004); sin embargo, para que se desarrolle un brote de esta enfermedad, es necesario la concurrencia de causas predisponentes; que van a condicionar la proliferación del hongo en el tracto digestivo de las abejas. Una vez que la espora ha germinado en el intestino, las hifas atraviesan la pared intestinal, aprovechando los cambios asociados a la metamorfosis, y se extienden por todo el cuerpo, apareciendo en la superficie corporal cuando la larva alcanza la fase de pre-pupa. En esta superficie se desarrollan los cuerpos fructíferos (ascocistos), que producirán una nueva generación de esporas (Padilla et al., 2014).
Las larvas enfermas están cubiertas por un moho blanco esponjoso, convirtiéndose posteriormente en momias de color gris oscuro o negro, si los cuerpos fructíferos se forman (Reynaldi et al., 2003). Las esporas del hongo son altamente resistentes a condiciones ambientales extremas y pueden sobrevivir durante años (Aronstein y Murray, 2010); esta situación, junto con la necesidad de condiciones predisponentes, que no están bien definidos, implica que los brotes de la enfermedad pueden aparecer fácil e inesperadamente (Reynaldi et al., 2004).
La diseminación de la micosis (conocida como; cría de cal o yesificada), puede estar relacionada a la trashumancia de colmenas, con el objetivo de realizar multiplicación temprana del colmenar, para así incrementar la producción de miel y polinizar; de igual forma colabora la importación de pies de cría de zonas infectadas (Higes et al., 1998; Reynaldi y López, 2003).
Según los autores Padilla et al. (2014), los brotes de A. apis se observan en primavera y otoño principalmente, ya que su aparición está asociada a los factores antes mencionadas, que pueden variar en las diferentes regiones productoras. La región de los Altos de Jalisco como productora de miel, se caracteriza por la variación de climas y ambientes, pero no se han encontrado datos sobre la presencia de A apis.
Por lo tanto, el objetivo del presente estudio fue determinar la periodicidad en que se presentan las condiciones ambientales para el desarrollo del agente etiológico de ascosferosis (Cría de cal).
Material y Métodos
Descripción del área de estudio
La actual investigación se realizó en el municipio de Jalostotitlán, Jalisco, México; localizado en el noroeste del estado de Jalisco, donde la temperatura media anual es de 19.1ºC., con precipitación promedio de 620.9 milímetros, con régimen de lluvias en los meses de junio y julio (INEGI, 2003).
Diseño experimental
El presente estudio se realizó del mes de julio a octubre del 2016, periodo durante el cual se supervisaron 42 colmenas habitadas de abejas (Figura 1), provenientes de la cruza de las variedades; Carniola (Apis mellifera carnica), Italiana (Apis mellifera ligustica) y Africana (Apis mellifera scutellata). Las colmenas de tamaño y características Jumbo, fueron separadas en 3 grupos, con 14 colmenas (repetición) cada uno, y durante el ensayo, éstas se ubicaron en lugares separados con un mínimo de 6 km, uno de otro. Se llevó el registro de las colmenas afectadas a nivel larvario, con etiología a la A. apis., estableciendo la posible relación entre las condiciones ambientales y la presencia de enfermedad fúngica (Figura 2).

Figura 1 Apiario en el Municipio de Jalostotitlán, Jalisco; donde se realizaron las observaciones de Ascosphaera apis
Durante el seguimiento de la infección, se realizó la revisión de cada colmena, 3 veces por semanas; además del monitoreo continuo de la temperatura y humedad en la zona donde se ubicaron las cámaras de cría, con un higrómetro PCE- THB 40® (rango de medición de la primera fue: 0 a 50°C, resolución de 0.1°C, y de la segunda de 10 a 90%, con resolución de 0.1%). Los datos se registraron en la tarjeta de memoria de larga duración de los higrómetros, y cada 15 días se copiaron en un archivo de monitoreo de temperatura y humedad en una computadora; procedimiento que se realizó quincenalmente, desde la fecha de inicio de la infección (mes de julio), hasta su desaparición mes de (octubre).
Resultados y Discusión
Los resultados de la influencia de la temperatura ambiental, así como de la humedad imperante en el sitio de ubicación de la colmena, se presentan en la gráfica número 1, que a continuación se presenta. Como se puede observar en la misma gráfica, la cantidad de colmenas que resultaron positivas a la presencia de ascosferosis (%), disminuyó cuadráticamente, conforme avanzaba la quincena de medición (P < 0.05); y a medida que disminuía de manera lineal la temperatura del medio ambiente donde se encontraban las colmenas; con relación estadística significativa con la enfermedad de las larvas de abeja (R2 = 0.78; P < 0.05).
También en la Figura 3, se puede ver que la humedad ambiental mostró un comportamiento cuadrático, el cual fue inverso a la presentación de la micosis, sobre todo a medida que avanzaba el tiempo de supervisión realizada (P > 0.05). Jensen et al. (2009) encontraron que, bajo ciertas condiciones ambientales favorables, el A. apis puede conservarse por periodos prolongados y continuar siendo patógeno. Yoder et al. (2016) observaron que ambientes cálidos y condiciones de baja humedad están relacionadas con el desarrollo de la cría de cal, permitiendo se mantengan saludables las colmenas. Por otro lado, los hallazgos del actual estudio, coinciden con lo reportado por los autores Padilla et al. (2014), quienes relacionaron la época del año con el incremento del padecimiento de la cría de cal o yesificada.
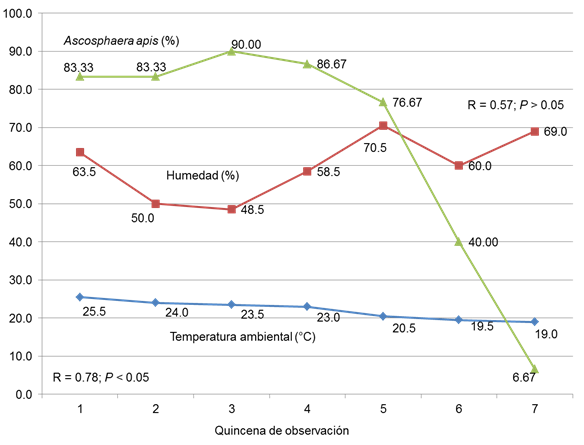
Figura 3 Relación de la temperatura y humedad ambiental con la presentación (%) de A. apis en larvas de abeja.
Se han probado diferentes fungicidas para el control de A. apis, pero ninguno ha resultado ser totalmente eficaz en condiciones de campo y con potencial efecto residual, tanto en la larva como en los productos apícolas. El-Shafai (2012) sugiere el empleo de extractos acuosos de ciertos vegetales para su control in vitro. De igual manera Sahinler y Kurt (2004), encontraron que el empleo de ácidos orgánicos y propóleo in vitro pueden ser alternativas en el tratamiento. Por otro lado, Vojvodic et al. (2012) en su trabajo sobre especies fungicas y la presentación de la patología, reporta una posible resistencia de la colmena de Apis mellifera, cuando hay presencia de poblaciones simbióticas, como de levadura (Saccharomices cerevisiae) o de bacilos.
La única opción práctica el aplicar medidas de manejo; como por ejemplo, empleo de genética resistente, la renovación de los cuadros para evitar la acumulación de esporas, o evitar abrir la colmena cuando las condiciones climáticas sean adversas (Padilla et al., 2014). Otros autores han relacionado las condiciones climáticas con la presencia de enfermedades relacionadas con parásitos del tipo microsporidios, como por ejemplo del género Neosema (Fries, 2010; Klee et al., 2007).
Cremer et al. (2007), así como los autores Evans y Spivak (2010), mencionan que los patógenos de las abejas alteran el comportamiento social de la colmena, lo que facilita la transmisión. Sin embargo, también pueden cambiar su estrategia a una defensiva y eliminadora del agente, reduciendo su efecto. Tal vez este fenómeno tuvo lugar en las colmenas analizadas en este estudio, ya que como se observa en la gráfica, la presencia de crías de cal, en las colmenas afectadas, tendieron a disminuir con el tiempo, pasando de 90 a 6.67%; observándose además el retiro de las larvas momificadas fuera de la colmena, comportamiento similar a lo reportado por los autores Palacio et al. (2010), así como por Evans y Spivak (2010), como una medida higiénica por parte de la comunidad.
Como se observa de manera general, la presentación de la A. apis en las colmenas de apiarios alteños es elevada, pudiendo ser de hasta 90%, como lo encontrado; siendo un problema económico para el productor, pues reduce sus ingresos. Los investigadores Reynaldi et al. (2015), reportan que la A apis también afecta a los estadios larvarios de otros géneros de abejas, como la denominada carpintera, lo que favorece su transmisión y con ello se reduce la polinización agrícola; aunque la presentación tiende a ser estacional y asociada a la temperatura imperante en la ubicación de las colmenas, resolviéndose posteriormente, aunque se pueden implementar medidas que favorezcan la recuperación.











 nueva página del texto (beta)
nueva página del texto (beta)



