Introducción
El zinc (Zn) es un nutriente esencial en la dieta de los cerdos (NRC, 2012; Hill et al., 2014). Es un mineral traza con demostrada importancia para la función de más de 300 enzimas (Bhowmik et al., 2010; Chasapis et al., 2012), influyendo en el equilibrio ácido-base, la competencia inmune y las funciones celulares básicas (Haase y Rink, 2009a; Kelleher et al., 2011). La acción metabólica del Zn incluye el metabolismo energético, la síntesis de proteínas, metabolismo de los ácidos nucleicos, la integridad del tejido epitelial, la reparación y la división celular, transporte y utilización de la vitamina A, y la absorción de vitamina E (Bhowmik et al., 2010; Borah et al., 2014).
Se ha demostrado que el Zn dietético mejora y previene la reducción de la integridad intestinal durante el estrés calórico (Sanz et al., 2014; Pearce et al., 2015), disminuye la permeabilidad intestinal de los lechones durante el destete (Zhang y Guo, 2009), promueve la restauración del epitelio intestinal (Hu et al., 2014; Song et al., 2015) y mejora el metabolismo proteico en el cerdo (Pearce et al., 2015). Debido a que los requerimientos de Zn se incrementan durante el estrés calórico (Lagana et al., 2007), se ha sugerido que la suplementación con Zn podría utilizarse para atenuar la disminución sérica del Zn durante periodos de altas temperaturas ambientales (Chand et al., 2014; Li et al., 2015).
Las dietas para cerdos son generalmente complementadas con Zn inorgánico (ZnSO4 u ZnO) para asegurar el aporte requerido, siendo la fuente inorgánica de ZnSO4 la de mayor biodisponibilidad (NRC, 2012).
En la granja donde se realizó el estudio la fuente de Zn utilizada es ZnSO4. Las dietas animales a menudo contienen antagonistas que reducen la biodisponibilidad de las formas inorgánicas de Zn, creando así una deficiencia. Varios estudios sugieren que las fuentes orgánicas de Zn son más biodisponibles que las formas inorgánicas, y la biodisponibilidad de las formas orgánicas respecto de las inorgánicas aumenta dramáticamente en presencia de antagonistas como el Ca, P, ácido fítico y fibra cruda (Bao et al., 2007; Nollet et al., 2007; Schlegel et al., 2013; Richards et al., 2015). Además, en un estudio reciente Ming-Zhe et al. (2016), observaron que el valor biológico del zinc orgánico a partir de metionina de zinc (Met-Zn), fue de 64% mayor que el del sulfato de zinc. Es por ello, que el objetivo del presente estudio fue evaluar la respuesta productiva de la cerda gestante y su camada, al consumo de dietas adicionadas con Zn orgánico a partir de metionina de zinc, bajo condiciones de clima tropical.
Material y Métodos
Se realizaron dos experimentos en la granja porcina “La Huerta”, localizada en la Sindicatura de Culiacancito, Culiacán, Sin., con coordenadas geográficas: 24° 49’ 38’ latitud Norte y 107° 22’ 47’ longitud Oeste, con una altitud de 60 msnm. El clima se clasifica como semiseco muy cálido (BS1(h’)), con temperatura media anual de 24.9°C, con máximas de 45ºC en los meses de julio y agosto, y mínimas de 7°C en diciembre y enero. La precipitación pluvial es de 671.4 mm, con precipitaciones máximas en los meses de julio, agosto y septiembre.
Experimento 1
Diseño experimental: se utilizaron 46 cerdas multíparas híbridas (Yorkshire x Landrace), a las que se les asignó uno de dos tratamientos, en un diseño experimental completamente al azar. Los tratamientos (T) consistieron en: T1 (SZn; n = 22); recibieron una dieta, a base de maíz-pasta de soya con aporte nutrimental de acuerdo a la etapa fisiológica, a partir de los 35 días de gestación (79 días, con un consumo de 2 kg alimento/día), y durante la lactancia (21 días con consumo de acuerdo a la demanda); T2 (CZn; n = 24) recibieron una dieta similar al T1, pero adicionada con 100 mg de Zn/kg de alimento, a partir de Metionina de Zinc (Met-Zn), durante el mismo periodo de tiempo y con el mismo manejo alimenticio.
El experimento se realizó durante los meses de enero a mayo de 2015 (época fresca); periodo durante el cual las cerdas estuvieron expuestas a un índice de temperatura y humedad (THI; Mader et al., 2006) entre normal (69 a 72; para los meses de enero a marzo), y alerta fisiológica (75 a 77; para los meses de abril y mayo). La temperatura ambiental promedio durante el periodo de estudio fue de 25.26°C y humedad relativa de 60.18%.
Experimento 2
Diseño experimental: se utilizaron 44 cerdas multíparas híbridas (Yorkshire x Landrace), a las se les asignó uno de dos tratamientos en un diseño experimental completamente al azar. Los tratamientos (T) consistieron en: T1 (SZn; n = 25); recibieron una dieta, a base de maíz-pasta de soya con aporte nutrimental de acuerdo a la etapa fisiológica, a partir de los 35 días de gestación (79 días, con un consumo de 2 kg alimento/día), y durante la lactancia (21 días con consumo a libre acceso); T2 (CZn; n = 19) recibieron una dieta similar al T1, pero adicionada con 100 mg de Zn/kg de alimento, a partir de Met-Zn, durante el mismo periodo de tiempo y con el mismo manejo alimenticio.
El experimento se realizó durante los meses de junio a octubre de 2015, periodo durante el cual las cerdas estuvieron expuestas a un THI entre peligro (80 a 83, durante los meses de junio, agosto y octubre), y emergencia fisiológica (> 83) para los meses de julio y septiembre. La temperatura ambiental promedio durante el periodo de estudio fue de 31°C y humedad relativa de 68.24%.
Manejo de los animales: las cerdas gestantes se alojaron en jaulas individuales (2.20 m x 0.60 m). Durante la gestación tuvieron libre acceso a agua de bebida y se proporcionaron 2 kg/d de alimento de una dieta para cerdas gestantes (Cuadro 1), servidos durante la mañana (07:00 h). Tres días antes de la fecha probable de parto fueron alojadas en jaulas individuales de maternidad (2.20 m x 1.50 m), en salas cerradas con ventilación forzada; teniendo agua a libre acceso, y la alimentación se realizó tres veces al día de acuerdo a la demanda de consumo, con una dieta para hembras lactantes (Cuadro 1).
Cuadro 1: Composición e información nutricional de las dietas utilizadas en gestación y lactancia
| Ingredientes | Gestación | Lactancia |
|---|---|---|
| Maíz | 793 | 692 |
| Pasta de soya | 160 | 254 |
| Aceite | 5 | 18 |
| Premezcla mineral | 42 | 36 |
| Aporte nutrimental | ||
| E.M.(Mcal Kg-1) | 3.272 | 3.351 |
| Proteína (%) | 14.165 | 17.953 |
| Lisina (%) | 0.866 | 1.081 |
| Fibra (%) | 2.463 | 2.492 |
| Fósforo (%) | 0.596 | 0.699 |
| Calcio (%) | 0.980 | 0.915 |
Mediciones: la medición del EGD se realizó a los 35 días de gestación (inicio de experimento), y tres días antes de la fecha probable de parto, a 65 mm a cada lado de la línea media, al nivel de la última costilla. Se registró el tamaño y peso de la camada al nacimiento, tamaño y peso de la camada al destete; así como el número de lechones muertos por camada durante la lactancia, y con base en ello se determinó el porcentaje de mortalidad durante este periodo. Además, se determinó la concentración de IgA en el calostro y la concentración plasmática de IgG e IgM en los lechones a los 14 d posdestete.
Toma de muestras: las muestras para determinar la concentración de IgA fueron colectadas manualmente, después de haber nacido el primer lechón; se tomaron 2 ml de calostro, el cual fue colocado en frascos estériles, identificados y mantenidos a temperatura ambiente durante 20 minutos; posteriormente se colocaron en hieleras a 4 °C para ser transportadas al laboratorio, donde fueron congeladas a -20 °C hasta el momento de su análisis.
Las muestras de sangre para determinar la concentración plasmática de IgG e IgM, fueron tomadas de los lechones a los 14 días posdestete de la vena yugular en tubos Vacutainer® para análisis de suero. La sangre se mantuvo a temperatura ambiente durante 20 minutos, para después colocarla en hieleras a 4 °C para ser transportadas al laboratorio, donde fueron centrifugadas a 3000 g durante 10 minutos para separar el suero, el cual fue congelado a -20 °C hasta el momento de su análisis.
Determinación de la concentración de inmunoglobulinas: la determinación del nivel de IgA en el calostro se realizó mediante una kit de ELISA (Pig IgA ELISA Kit Cat. No. E101-102 Lot No. E101-102-150306 de laboratorios Bethyl), y la determinación del nivel de IgG e IgM en suero de lechones a los 14 días posdestete, se realizó mediante un kit de ELISA (Pig IgG ELISA Kit Cat. No. E101-104 Lot No. E101-104-150206 y Pig IgM ELISA kit Cat. No. E101-117 Lot No. E101-117-150218 de laboratorios Bethyl).
Análisis estadístico: a los resultados de EGD, tamaño de camada al nacimiento, peso de la camada al nacimiento, peso de la camada al destete, tamaño de la camada al destete, concentración de IgA en calostro y concentración plasmática de IgG e IgM en cerdos 14 días posdestete, se les aplicó un análisis de varianza para un diseño completamente al azar (Steel y Torrie, 1985). Se fijó un alfa máximo de 0.05 para aceptar diferencia estadística y se consideró a cada cerda como la unidad experimental. El modelo matemático utilizado fue: Yijk= ( + Znj + Eijk; donde: Yi = variable de respuesta, µ = media general del experimento, Znj = El efecto del j- ésimo nivel de Zinc y Eijk = Error aleatorio. A la tasa de mortalidad durante la lactancia se le aplicó un análisis de X2, utilizando tablas de contingencia 2 x 2.
Resultados y Discusión
Los resultados del experimento 1 (Época fresca), se muestran en los Cuadros 2, 3, y 4; los del experimento 2 (Época de calor), se resumen en los cuadros 5, 6 y 7. El consumo de alimento adicionado con 100 mg de Zn/kg a partir de Met-Zn no modificó (P = 0.28) el EGD de la cerda durante la época fresca del año (11.58 vs. 12.77 mm); estos resultados coinciden con los obtenidos por Caine et al. (2009) quienes al proporcionar dietas adicionadas con 250 mg/kg de Zn orgánico (ZnAA), a partir del último tercio de gestación, no observaron modificaciones en esta variable; estos autores no reportaron las condiciones climáticas en las que se desarrolló el estudio.
En el presente estudio, la temperatura ambiental promedio durante el periodo en que se realizó el experimento 1 (Época fresca), fue de 25.26°C y humedad relativa de 60.18%; condiciones ambientales que no provocan estrés por calor en las cerdas en gestación y lactancia (Mader et al., 2006). Sin embargo, el consumo adicional de Met-Zn, elevó (P = 0.05) el EGD (16.64 vs. 14.87 mm) durante la época de calor (Exp. 2). La temperatura ambiental promedio durante este periodo de estudio fue de 31°C y humedad relativa de 68.24%, condiciones ambientales que provocan estrés calórico en las cerdas gestantes y lactantes (Mader et al., 2006).
El estrés por calor ocurre cuando hay un desbalance entre la producción de calor y su disipación del cuerpo de los animales (Marai et al., 2007; Hansen, 2009; Bernabucci et al., 2010; Lewis y Bunter, 2011). La respuesta homeostática general al estrés calórico incluye una disminución en el consumo de alimento y un incremento en el consumo de agua, así como de la temperatura rectal, la temperatura de la piel y la tasa respiratoria en los cerdos (Pearce et al., 2013; Li et al., 2015). La disminución en el consumo de alimento es una respuesta adaptativa reconocida en muchas especies de animales (Baumgard y Rhoads, 2012), para disminuir la producción de calor metabólico (Renaudeau et al., 2012).
Otros investigadores han sugerido que el estrés calórico disminuye el crecimiento y la concentración plasmática de Ca, K, Na, y Zn en los animales (Pearce et al., 2013); además de ocasionar una disminución en el consumo de nutrientes. El estrés calórico altera el metabolismo energético y la calidad de la canal en los cerdos, observándose que bajo ambientes con alta temperatura los animales ganan más tejido adiposo que lo energéticamente esperado (Pearce et al., 2013). Al respecto se ha informado que el Zn desempeña una importante función en el metabolismo de los lípidos en la célula, como parte funcional y estructural de algunas enzimas que intervienen en el metabolismo de los lípidos (Islam y Loots, 2007); y se ha sugerido que el consumo de dietas adicionadas con Zn incrementan la acumulación de grasa intramuscular en los lechones destetados a partir de la síntesis nueva de ácidos grasos libres, por una regulación en la expresión de genes trasportadores de ácidos grasos libres y por incrementar la actividad enzimática (Zhang et al., 2014). Qu et al. (2015), sugirieron la existencia de una respuesta celular autónoma al estrés calórico en los adipocitos de los cerdos, provocando una elevación de las reservas de lípidos en éstos, tal vez a través de la regulación positiva de los genes implicados en la absorción de ácidos grasos y la síntesis de triacilgliceridos.
Estos mismos autores, advirtieron que el estrés calórico aumenta la actividad de la lipoproteína lipasa (LPL) en el tejido adiposo de cerdos. Posteriormente Qu et al. (2016), informaron que el estrés calórico induce la expresión de la enzima fosfoenolpiruvato carboxiquinasa (PEPCK-C) en el tejido adiposo, provocando una elevación en la gliceroneogénesis, lo que podría explicar el aumento de la acumulación de grasa en los cerdos criados en ambiente con temperaturas elevadas.
La fosfoenolpiruvato carboxiquinasa (PEPCK) se encuentra en dos isoformas (PEPCK-C y PEPCK-M); la PEPCKC se expresa principalmente en el hígado, el riñón y el tejido adiposo; en tanto que la PEPCK-M está presente en una variedad de tejidos no gluconeogénicos, incluyendo páncreas, cerebro, leucocitos, corazón o neuronas (Méndez-Lucas et al., 2014).
En un estudio previo Méndez-Lucas et al. (2013) concluyeron que la PEPCK-M tiene potencial gluconeogénico per se y coopera con la PEPCK-C para ajustar el flujo gluconeogénico a los cambios en la disponibilidad de sustrato o energía en el ciclo de Krebs, sugiriendo un papel en la regulación del metabolismo de glucosa y lípidos en el hígado. Méndez-Lucas et al. (2014) sugirieron que la PEPCK-M es importante para mantener la progresión y sobrevivencia celular bajo condiciones de estrés.
Los resultados obtenidos en el presente estudio, sugieren que el mayor EGD observado en las cerdas que consumieron alimento adicionado con Met-Zn durante la época de calor, pudo estar influenciado por el Zn, mejorando la actividad enzimática en la síntesis y deposición de tejido adiposo.
El consumo de alimento adicionado con 100 mg de zinc/kg, no modificó (P > 0.05) el número de lechones nacidos totales (LNT), lechones nacidos vivos (LNV), peso de la camada al nacimiento (PCN), lechones destetados (LD) y peso de la camada al destete (PCD); tanto en la época fresca del año como en la época de calor. Estos resultados coinciden con los obtenidos por otros investigadores en estudios previos. Al respecto, Vallet et al. (2014) no observaron mejoras en estas variables en cerdas alimentadas con una dieta que contenía 0.07 % de sulfato de zinc desde los 80 días de gestación. Caine et al. (2009), al proporcionar una dieta adicionada con 250 mg/kg de un complejo de zinc-aminoácidos (ZnAA) a las cerdas durante el último tercio de gestación, no observaron efecto (p > 0.10) en el crecimiento de los cerdos durante la lactancia.
El consumo de alimento adicionado con 100 mg de Zn/kg durante la época fresca (Exp. 1), no modificó (P = 0.70) el porcentaje de mortalidad de los lechones durante la lactancia (15.5 vs. 17%); sin embargo, durante la época de calor (Exp. 2), el consumo adicional de Zn disminuyó (P = 0.006) el porcentaje de mortalidad durante la lactancia (11 vs. 26%).
El zinc es un componente de muchas enzimas y por lo tanto contribuye en varias rutas fisiológicas, incluyendo la actividad antioxidante de la enzima Cu/Zn superóxido dismutasa (Mistry y Williams, 2011), la actividad de las metaloproteasas (Balaban et al., 2012), en la transcripción (Swamynathan, 2010) y en la regulación de CO2 (anhidrasa carbónica; Sly y Hu, 1995). Cada uno de ellos podría contribuir a disminuir la mortalidad al nacimiento o antes del destete; sobre todo la regulación de CO2 por la anhidrasa carbónica.
Se ha sugerido que la asfixia durante el proceso de parto, contribuye tanto a la muerte fetal como a la mortalidad antes del destete (Alonso-Spilsbury et al., 2005). En relación a lo anterior, se ha informado que la mayor transferencia de zinc al feto se da durante el último tercio de la gestación (Mahan et al., 2009). Si es así, el zinc suplementario podría reducir la incidencia de muerte fetal durante el parto prolongado y la mortalidad antes del destete, aumentando la actividad de la anhidrasa carbónica, haciendo a los lechones más resistentes a altas concentraciones de CO2 durante el proceso de nacimiento, fundamentalmente en las cerdas sometidas a estrés calórico. Al respecto Ming-Zhe et al. (2016) informaron que el consumo de dietas adicionadas con 120 mg/kg de Zn a partir de Met-Zn, eleva la concentración sérica del Zn y la actividad de la anhidrasa carbónica en los lechones destetados. Caine et al. (2009) observaron que el consumo de dietas adicionadas con 250 mg/kg de Zn a partir de ZnAA, durante el último tercio de gestación de las cerdas, eleva la concentración sérica de Zn en los lechones lactantes; también indicaron que la administración gástrica por intubación de 40 mg Zn a partir de Met-Zn a los lechones lactantes al momento del nacimiento, a los 7 y 14 d de edad, mejoraba la condición de los lechones durante la lactancia. Vallet et al. (2014) obtuvieron una menor mortalidad predestete en cerdas alimentadas con una dieta adicionada con 0.07 % de sulfato de zinc, desde los 80 días de gestación hasta el parto.
Se ha sugerido que el Zn es requerido para apoyar la proliferación celular, y la diferenciación de tejidos en los órganos en desarrollo (Hyun-Ju et al., 2010; Zitka et al., 2010). Mahan et al. (2009) informaron que las cantidades de Zn, Cu y Se que se transfieren al feto porcino, aumenta a medida que progresa la gestación; pero la mayor cantidad se transfiere durante los últimos 15 días de gestación. Estos micro minerales se incorporan en varias enzimas y sistemas enzimáticos antioxidantes del cuerpo; por lo tanto, su mayor concentración en los fetos durante la gestación puede reflejar un mayor potencial de actividad antioxidante durante esta etapa. Esto es importante de considerar en líneas de cerdas de alta producción criadas bajo condiciones de estrés calórico, ya que, si la dieta de la cerda no contiene los niveles dietéticos adecuados de minerales para satisfacer las necesidades reproductivas, la cerda movilizará las reservas corporales antes del inicio de la lactancia, lo que puede comprometer la lactancia de la cerda y el rendimiento de su camada.
Los lechones provenientes de cerdas que consumieron alimento adicionado con Zn durante la época fresca, tuvieron una mayor (P = 0.001) concentración plasmática de IgG (267 vs. 390.8 ng/mL) a los 14 días posdestete (Cuadro 4); en tanto que la concentración de IgM no fue modificada (214.1 vs. 207.1 ng/mL), al igual que la concentración de IgA en el calostro (1057 vs. 1001 ng/mL). Durante la época de calor los niveles plasmáticos de IgG (373.3 vs. 310 ng/mL) e IgM (235.1 vs. 221.8 ng/mL) no fueron modificados por el consumo de dietas adicionadas con Met-Zn; sin embargo, en las cerdas que no recibieron Zn adicional, se observó una tendencia (P = 0.068) de incremento en la concentración de IgA en el calostro (1100.6 vs. 1017.9 ng/mL).
Estudios previos sugieren que las concentraciones de IgA e IgG en el calostro están influenciadas por la estación del año. Se ha observado que exponer a las cerdas a estrés por frío durante los últimos 10 días antes del parto, puede aumentar la absorción de IgG por los lechones (Bate y Hacker, 1985); sin embargo, cuando los lechones son sometidos a estrés por frío, reducen las concentraciones plasmáticas de IgG, presumiblemente por la reducción en la ingesta de calostro (Blecha y Kelley, 1981). También se ha informado que los valores de IgG disminuyen en verano y otoño, o cuando las cerdas son expuestas a altas temperaturas al final de la gestación (Machado-Neto et al., 1987). Inoue (1981) informó que los valores de IgA disminuyen en primavera, verano y otoño, pero aumentan en invierno. Los niveles más bajos de IgA en el calostro de las cerdas que consumieron alimento adicionado con Met-Zn, se pudo deber al efecto farmacológico del Zn sobre la flora patógena intestinal, disminuyendo o estabilizando su población en el intestino; así como al mantenimiento de la integridad intestinal, lo que evita que ésta sea permeable a las endotoxinas bacterianas. Se ha informado al respecto que la suplementación con ZnO se ha asociado con una disminución en el traslado de bacterias desde el intestino delgado a los nódulos linfáticos mesentérico (Huang et al., 1999) y con un incremento en la estabilidad y homogeneidad en la población de coliformes (Kautouli et al., 1999); así como protegiendo la integridad de la mucosa intestinal (Pearce et al., 2015).
Además de la barrera física que proporcionan los epitelios, el sistema inmunológico de la mucosa también utiliza otros tejidos linfoides asociados con el intestino (TLAI), para proteger al organismo y mediar respuestas innatas y adaptativas subsiguientes. Una característica distintiva de la inmunidad de la mucosa intestinal es la inducción de una respuesta inmune en las placas de Peyer y la producción subsiguiente de IgA, por linfocitos B en la lámina propia (Burkey et al., 2009), cuando es estimulada por un agente antigénico.
Los mayores niveles plasmáticos de IgG (267 vs. 390.8 ng/mL) observados en los lechones provenientes de cerdas que recibieron dietas adicionadas con Met-Zn durante la época fresca, se pudo deber al mayor consumo de esta inmunoglobulina a través del calostro y al efecto conocido del Zn de mejorar la respuesta inmune. Se sabe que el Zn es esencial para las células de alta proliferación, especialmente en el sistema inmunológico, e influye tanto en las funciones inmunes innatas como en las adquiridas (Maggini et al., 2007; Haase y Rink, 2009b; Mocchegiani et al., 2009). Deficiencias de Zn disminuyen la función de las células T y baja los títulos de anticuerpos (Richards et al., 2010). Se ha informado que la adición de Zn a partir de metionina de zinc, mejora la repuesta inmune celular y humoral en gallinas (Soni et al., 2013).
En un estudio reciente Ming-Zhe et al. (2016) informaron que tanto la suplementación con 120 mg/kg de Zn a partir de Met-Zn o de nano partículas de ZnO, eleva los niveles plasmáticos de IgG en lechones destetados.
Cuadro 2: Efecto del consumo de alimento adicionado con 100 ppm de Zinc orgánico en el desempeño productivo de cerdas gestantes y lactantes durante la época fresca del año.
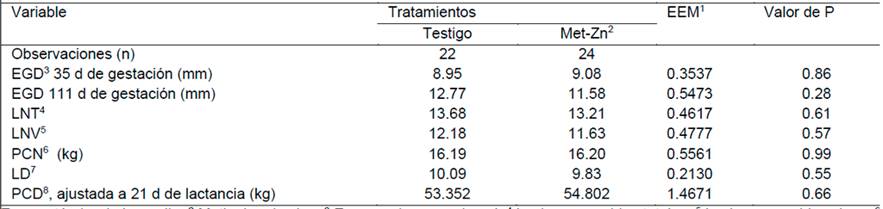
1 Error estándar de la media, 2 Metionina de zinc, 3 Espesor de grasa dorsal, 4 Lechones nacidos totales, 5 Lechones nacidos vivos, 6 Peso de la camada al nacimiento, 7 Lechones destetados y 8 Peso de la camada al destete
Cuadro 3: Efecto del consumo de alimento adicionado con 100 ppm de Zinc orgánico en la época fresca del año en la tasa de mortalidad durante la lactancia
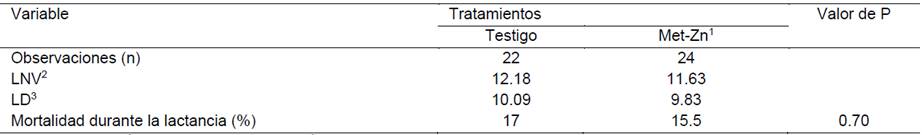
1Metionina de zinc, 2Lechones nacidos vivos, 3Lechones destetados
Cuadro 4: Influencia del consumo de alimento adicionado con Zn durante la época fresca en los niveles de IgA en el calostro y niveles plasmáticos de IgM e IgG en los lechones 14 días posdestete
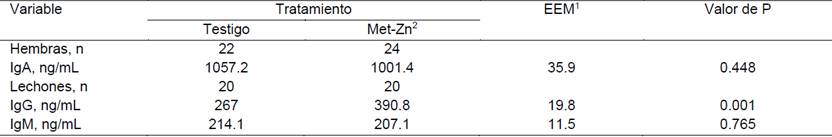
1 Error estándar de la media, 2 Metionina de zinc
Cuadro 5: Efecto del consumo de alimento adicionado con 100 ppm de Zinc orgánico en el desempeño de cerdas gestantes y lactantes durante la época cálida del año
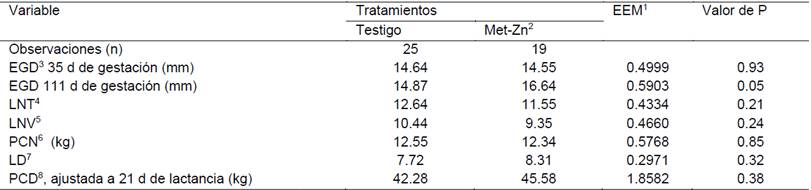
1 Error estándar de la media, 2 Metionina de zinc, 3 Espesor de grasa dorsal, 4 Lechones nacidos totales, 5 Lechones nacidos vivos, 6 Peso de la camada al nacimiento, 7 Lechones destetados y 8 Peso de la camada al destete
Cuadro 6 Efecto del consumo de alimento adicionado con 100 ppm de Zinc orgánico durante la época cálida del año en la tasa de mortalidad durante la lactancia
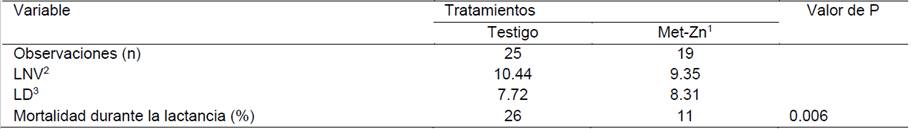
1Metionina de zinc, 2Lechones nacidos vivos, 3Lechones destetados
Conclusión
El consumo de dietas adicionadas con 100 mg de Zn por kg de alimento, aumenta el espesor de grasa dorsal y disminuye el porcentaje de lechones muertos durante la lactancia, en cerdas bajo estrés calórico; el consumo de alimento adicionado con Zn durante la época fresca incrementa los niveles de IgG en los lechones con 14 días posdestete.











 nueva página del texto (beta)
nueva página del texto (beta)



