Introducción
En el mundo se generan grandes cantidades de excremento procedente de la producción intensiva de los bovinos, en Estados Unidos se estima en más de 100 billones de kilogramos al día (Weinberg et al., 2011), y en Europa se calcula en 200 millones de toneladas por año (Mawdsley et al., 1995). El estiércol del ganado bovino contiene grandes cantidades de microorganismos potencialmente patógenos como bacterias, virus y parásitos (Dungan, 2010). Aunque Escherichia coli es un habitante normal del tracto gastrointestinal del bovino; esta bacteria es un indicador de contaminación fecal en el agua y los alimentos; algunas de sus cepas como la E. coli entero-hemorrágica son patógenas y causa severas infecciones en las personas con cuadros epidémicos caracterizados por diarreas hemorrágicas, colitis y síndrome urémico hemolítico (Callaway et al., 2009; Asakura et al., 2008).
Ante la importancia de reducir la contaminación que causan las excretas procedentes de los bovinos (Callaway et al., 2009; Setia et al., 2009), es necesario investigar sustancias naturales como los taninos que se han reconocido por su efecto benéfico sobre la salud de los animales y personas (Kumar et al., 2005; Villalba et al., 2010), estos compuestos son encontrados en plantas y se clasifican en hidrolizables y condensados (Frutos et al., 2004).
Existe evidencia que sugiere a los taninos como agentes antimicrobianos por su capacidad de modular la estructura física de las membranas celulares de los microorganismos como las bacterias, lo que puede conducir a la muerte de la misma (Taylor et al., 2005). Algunas investigaciones in vitro sugieren que los taninos pueden matar bacterias como Escherichia coli O157:H7 en el estiércol (Wells et al., 2005; Gutiérrez et al., 2011).
Sin embargo los resultados no son concluyentes, debido a que en otros trabajos no se ha observado evidencia de actividad de los taninos en el crecimiento de E. coli (Pinheiro et al; 2013). Por lo tanto el objetivo de este estudio fue evaluar el efecto del 10% de taninos hidrolizables en el crecimiento de E. coli en heces de vacas lecheras.
Material y Métodos
La investigación se llevó a cabo en el laboratorio de Microbiología del Institut National de Recherche en Sciences et Technologíes pour L’environnement et L’agriculture (IRSTEA), Rennes, Francia.
Recolección de muestras. Las muestras de heces fueron obtenidas a partir de pilas de almacenamiento de estiércol de vacas en producción de leche en un establo ubicado en Gevezé Bretaña, Francia, para las muestras de heces se utilizaron dos contenedores de plástico estéril con capacidad para 15 l; cada contenedor fue debidamente identificado y transportado a IRSTEA para su almacenamiento a 4°C. De cada uno de los contenedores se tomó una muestra compuesta (250 g) que se utilizó para determinar el contenido de materia seca de las heces (AOAC, 1990).
Diseño Experimental y Tratamientos. En un experimento completamente al azar con arreglo factorial 2 x 3 x 7, alícuotas de 100 g de heces (base húmeda), fueron asignadas de manera aleatoria a recibir la combinación de uno de dos niveles de taninos hidrolizables: 0 y 10% en base seca; con uno de tres valores de pH: 5.2, 6.5 y 8.3 y cultivados a siete diferentes tiempos de duración: 0, 2, 6, 9, 15, 22 y 30 días después de haber adicionado los taninos. Los taninos hidrolizables fueron adicionados en forma de extracto de taninos de castaño (Castanea sativa) NutriP (Silvateam; San Michele Mondavi, Italy). Los distintos valores de pH se obtuvieron por la adición de cantidades crecientes de ácido fórmico al 80% a las heces cuyo pH original fue de 8.3 tal cual fue obtenido en la granja. En cajas de Petri, se realizaron cultivos bacterianos de E. coli utilizando medio de cultivo TBX (Triptona, Bilis-X Glucorónido), se realizaron diluciones a la -1, -2, -3, -4 y -5, de cada dilución se sembraron 1 ml de cada triplicado por tratamiento con el método de extensión en placa y todos los cultivos se incubaron a 44 °C por 24 horas (Cruz et al., 2013).
Análisis estadístico. Todos los tratamientos se realizaron por triplicados. La población bacteriana se reportó como Log10 de UFC/g para normalizar los datos y se les aplicó un análisis de varianza para un diseño completamente al azar con arreglo factorial 2 x 3 x 7 (Hicks, 1973). La separación de medias se llevó a cabo por la prueba de diferencia mínima significativa (Berry et al., 2006; Varel et al., 2006). Todos los cálculos estadísticos fueron realizados con la Versión 9 del paquete computacional Statistix 2007.
Resultados y Discusión
El comportamiento de E. coli en heces de vacas en respuesta a la adición de dos niveles de taninos, a tres valores de pH y el cultivo a 7 diferentes tiempos, se muestra en el Cuadro 1. En general en las heces a las que se les adicionó 10% de TH se observó un mayor crecimiento (P < 0.01) de E. coli, en comparación con las que no se les agregaron TH (Log10 5.071 vs. Log10 4.401). Sí bien se sabe que los taninos tiene actividad antibacteriana, este efecto puede variar dependiendo el tipo de taninos y la bacteria estudiada, ya que existe evidencia científica que encuentran a estos compuestos ser más activos contra bacterias Gram positivas, debido a la composición menos compleja de la membrana celular que posee dicho grupo de bacterias (Shen et al., 2014).
Cuadro 1: Comportamiento de E. coli en heces de vacas en respuesta a la adición de dos niveles de tainos a tres valores de pH y el cultivo a 7 diferentes tiempos
| Extracto de taninos | 0% | 10% | EE1 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| pH | 8.3 | 6.5 | 5.2 | 8.3 | 6.5 | 5.2 | |||
| Días | |||||||||
| 0 | 5.877abc | 5.474bcde | 5.435cdef | 5.944ab | 5.431cdef | 4.910ghi | 0.088 | ||
| 2 | 5.922ab | 5.435cdef | 5.882abc | 6.234ª | 5.432cdef | 4.959fghi | 0.102 | ||
| 6 | 4.907ghi | 4.089klm | 5.065defgh | 6.263ª | 6.261ª | 4.967fghi | 0.199 | ||
| 9 | 4.607hij | 3.819lm | 4.766ghi | 5.520bcd | 6.076ª | 4.851ghi | 0.175 | ||
| 15 | 5.040ghij | 2.932op | 4.279jkl | 4.642ghij | 3.613mn | 5.117mn | 0.191 | ||
| 22 | 3.267no | 3.054op | 4.245jkl | 4.538ijk | 5.016efghi | 4.884ghi | 0.186 | ||
| 30 | 1.696q | 2.724p | 3.901lm | 2.966op | 3.910lm | 4.865ghi | 0.250 | ||
a, b, c,….q Literales distintas indican diferencia estadística (P < 0.01).
1 Error estándar de la media.
En este sentido Pinheiro et al. (2013) observó que compuestos como el ácido gálico y ácido elágico inhibieron el crecimiento de L. monocytogenes y S. aureus; en tanto que ese mismo efecto no se observó en bacterias como E. coli y hongos como Aspergillus niger. En los resultados obtenidos de esta investigación las heces con pH 6.5 se apreció un menor crecimiento (P < 0.01) de E. coli (Log10 4.525), en comparación con los tratamientos con pH de 5.2 (Log10 4.866) y 8.3 (Log10 4.816). En condiciones de pH cercanos a la neutralidad, los taninos pueden formar complejos con las proteínas en el exterior de la membrana celular de las bacterias, anteponiendo los sistemas para reducir la tolerancia de la bacteria en un ambiente osmótico bajo que causa la muerte de esta (Frutos et al., 2004); sin embargo las bacterias Gram negativas como E. coli poseen flujos de salida que actúan como primera defensa para excluir de forma selectiva algunos compuestos fenólicos para protegerse a sí misma de la toxicidad de estos compuestos (Shen et al., 2014).
Por otro lado algunos microorganismos como bacterias y hongos producen enzimas llamadas tanasas, las cuales degradan a los taninos por lo que estos compuestos les sirven como fuente de carbono y les permite seguir multiplicándose (Pinheiro et al., 2013; Goel et al., 2011).
Se ha reportado que algunas bacterias como E. faecalis y hongos como A. niger aumentaron su crecimiento cuando se adicionó acido tánico en muestras de heces de cabras (Goel et al., 2011). Además valores de pH en rangos de pH de 5 a 7, aumenta la actividad de estas enzimas, ya que algunas investigaciones mencionan que las tanasas mantiene una actividad óptima a pH de 6, lo que coincide con los resultados de este experimento, en el cual se apreció un mayor crecimiento de E. coli cuando existieron taninos en su medio de cultivo, lo que sugiere que las cepas de E. coli obtenidas de las heces de las vacas, no solamente soportaron la presencia de los TH, sino que de alguna manera los utilizaron como sustrato para soportar incluso un mayor crecimiento.
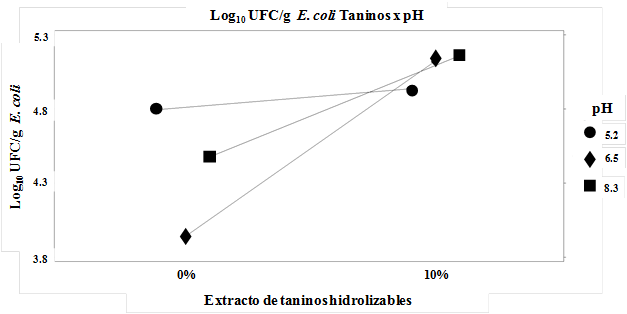
Se encontró una interacción taninos x pH (P < 0.01), en la que se observa que en presencia de taninos hidrolizables, el crecimiento de E. coli fue similar (P > 0.10) entre los valores de pH; sin embargo, en ausencia de taninos el crecimiento de E. coli fue menor cuando el medio presentó un valor de pH 6.5 (P < 0.01) en comparación con el observado con valores de pH fueron de 5.2 y 8.3, respectivamente.
En la Figura 1 se presenta gráficamente la interacción entre los taninos hidrolizables y el pH en el crecimiento de E. coli en heces de vacas. Se observaron interacciones (P < 0.01), Taninos x Día, y Taninos x pH x Día; el crecimiento de E. coli disminuyó (P < 0.01) a medida que se incrementó la cantidad de días desde valores de Log10 = 5.51 el tiempo 0, hasta valores de Log10 = 3.36 en el día 30; lo que puede explicarse debido al crecimiento exponencial normal que presentan las bacterias (Cruz et al., 2013).











 nueva página del texto (beta)
nueva página del texto (beta)