Introducción
El desarrollo de nuevas tecnologías que permitan la conservación y alargamiento de la vida útil de los alimentos se ha convertido en uno de los principales desafíos de la industria alimentaria. El envasado es una de las estrategias más utilizadas para el control de los productos al facilitar la manipulación, el transporte y el almacenamiento de los alimentos en la cadena de producción, actúa como medio de barrera, retrasando el deterioro al mantener los alimentos aislados de factores ambientales (Geueke et al., 2018). Sin embargo, la creciente exigencia por productos amigables con el medio ambiente ha dado paso al desarrollo de nuevos empaques (activos, inteligentes, biodegradables) (Kalpana et al., 2019).
Bajo este contexto, las películas creadas a partir de polímeros han tenido especial interés en los últimos años, debido a su compatibilidad, biodegradabilidad, no toxicidad y bajo costo de producción, haciendo posible su utilización como matrices transportadoras de diversos compuestos confiriéndoles la capacidad de aumentar su vida útil, protegiéndolos de daños físicos y biológicos (Yong et al., 2019).
Entre los biopolímeros más utilizados destaca el quitosano por ser una biomolécula obtenida a partir de la desacetilación de la quitina en medios alcalinos, proveniente del exoesqueleto de crustáceos, siendo, además, reconocido ante la Unión Europea y la Administración de Drogas y Alimentos de los Estados Unidos (FDA) como polímero seguro (Haghighi et al., 2019); también, de ser el único polisacárido con carga positiva, soluble en soluciones ácidas, con capacidad antimicrobiana para distintos microrganismos como bacterias (Gram positivas y negativas), hongos y levaduras (Azmy et al., 2019). Sin embargo, la variación en las características mecánicas (alta permeabilidad al vapor de agua, degradación ultravioleta y grado de hinchamiento) hacen necesaria la incorporación de otros polímeros que ayuden a la estabilidad de la matriz. Debido a las modificaciones en las propiedades que puede llegar a sufrir el quitosano hacen que su uso en la industria alimentaria sea limitado y crea la necesidad de incorporar compuestos que permitan mejorar sus características fisicomecánicas y disminuir las desventajas (Qin et al., 2019).
Actualmente, las nanopartículas se han utilizado en la formación de películas nanocompuestas (nanoarcilla, silicato de calcio, celulosa) ayudando a mejorar las características fisicomecánicas, como menor permeabilidad al agua y oxígeno y mayor resistencia a la tensión (Pawcenis et al., 2019). De igual forma, la incorporación de nanopartículas de plata (AgNPs) en una matriz de quitosano han podido destacar por su efecto antimicrobiano contra bacterias y hongos (Parthiban et al., 2018; Khalil et al., 2019), confiriéndole una alta estabilidad y baja toxicidad (Wu et al., 2018; Jamaleddin et al., 2019). De esta forma, el presente trabajo tiene como objetivo desarrollar y evaluar las propiedades fisicomecánicas y microbiológicas de biopelículas de quitosano con AgNPs para su posible utilización como recubrimiento alimenticio.
Material y métodos
Síntesis de nanopartículas de plata
La síntesis de AgNPs se realizó mediante el método de reducción de sales metálicas de plata (disolución coloidal) por el método Lee-Meisel (Chen et al., 2019), tomando como precursor nitrato de plata (AgNO3) y como agente reductor citrato de sodio. Se prepararon 2 L de una solución concentrada de AgNPs a una concentración de 500 ppm. Se colocó 1 g de AgNO3 en un vaso de precipitado con 900 mL de agua desionizada, se calentó hasta ebullición en una parrilla de agitación a 95 ºC y 400 rpm; posteriormente, se agregaron 22 mL de citrato de sodio al 1%, se dejó en agitación por 1 h y a continuación se agregaron 1,100 mL de agua desionizada dejando en agitación durante 5 minutos más y se aforó a 2 L. La solución fue almacenada a temperatura ambiente en un lugar oscuro hasta su uso.
Preparación de material biológico
Se utilizaron cuatro cepas bacterianas: Salmonella ATCC 6017, Escherichia coli ATCC 10586, Staphylococcus aureus ATCC 29213 y Pseudomonas aeruginosa ATCC 25619. Las cepas fueron activadas en tubos de caldo soya tripticaseína (10 mL) incubados por 24h a 37 ºC. Más adelante, se obtuvo una solución de 108 UFC/mL, se midió la densidad de la solución con ayuda de un espectrofotómetro Densimat (Biomerieux modelo 69280), los cultivos fueron ajustados para obtener un valor de 0.5 Mc Farland.
Cinética de crecimiento bacteriano
Se determinó la cinética de crecimiento de cada cepa activada, para probar el efecto antimicrobiano de las siguientes soluciones: AgNPs (20, 60 y 100 ppm), quitosano (1%) con AgNPs (Q-AgNPs; 20, 60 y 100 ppm), una solución de quitosano al 1% y un control (cada cepa sin tratamientos). Se adicionó 1 mL del inóculo (cepa bacteriana) a tubos de caldo Mueller Hinton, más 1 mL de solución a probar (con excepción del control), se incubaron a 37 ºC y movimiento constante a 200 rpm en una incubadora (bioSan Modelo ES-20). Se determinaron los valores Mc Farland cada hora durante 11 h, y a las 24 h después de la incubación. Las mediciones se realizaron por triplicado.
Desarrollo de películas
Se realizaron 52 películas, 26 películas de quitosano y 26 películas de quitosano con 100 ppm de AgNPs (Q-AgNPs) mediante el método casting descrito por Chang et al. (2019). En un matraz Erlenmeyer se colocaron 600 mL de agua desionizada, 13 mL de ácido acético (Sigma-Aldrich, St. Louis, MO, USA), 13 g de quitosano (190-310 kDa, grado de desacetilación de 75-85%, Sigma-Aldrich), la solución se agitó a 200 rpm a temperatura ambiente por cuatro horas. Paralelamente, en un vaso de precipitado se agregaron 500 mL de agua desionizada, 65 g de alcohol polivinílico (densidad media, Sigma-Aldrich) y 65 mL de glicerol (Sigma-Aldrich, St. Louis, MO, USA), se agitó a 200 rpm a 80 ºC por cuatro horas. Una vez que ambas soluciones cumplieron cuatro horas, se mezclaron en un matraz volumétrico y se agitó a 200 rpm por dos horas más; finalmente, se aforó a 1.3 L, con lo cual se obtuvo la solución de quitosano 1%, ácido acético 1%, alcohol polivinílico 5% y glicerol 5% (QAPG).
Se tomaron 650 mL de la solución QAPG, se vertieron 25 ml en cajas Petri (26 cajas) se dejaron reposar por 12 h a temperatura ambiente y, posteriormente, fueron colocadas en una estufa a 45 ºC por 24 h, una vez formadas las películas de quitosano se retiraron de la caja Petri y fueron envueltas en papel aluminio, envasadas en bolsas de plástico herméticas y almacenadas a temperatura ambiente hasta su uso.
Para el desarrollo de las películas con AgNPs (Q-AgNPs) se partió de la solución QAPG restante (650mL) a la cual se le adicionaron 162.5 mL de la solución de AgNPs [500 ppm], se agitó durante 30 minutos más a 200 rpm a temperatura ambiente, se vertieron 25 ml en cajas Petri (26 cajas) se dejaron reposar por 12 h a temperatura ambiente y, más adelante, fueron colocadas en una estufa a 45 ºC por 24 h, ya formadas las películas de quitosano se retiraron de la caja Petri y fueron envueltas en papel aluminio, envasadas en bolsas de plástico herméticas y almacenadas a temperatura ambiente hasta su uso.
Propiedades fisicomecánicas de las películas
Microscopía electrónica de barrido de emisión de campo (FE-SEM)
La FE-SEM se realizó en un equipo JEOL 7600 con alto vacío. Las membranas se colocaron en un desecador a vacío durante 24 h para eliminar humedad. Posteriormente, se colocaron en una portamuestra de aluminio con cinta adhesiva doble cara de aluminio-carbono y se introdujeron en una ionizadora para cubrir con una película delgada de oro, durante 5 min.
Las condiciones instrumentales fueron de un voltaje de aceleración de 0.5 kV y una distancia de trabajo (WD) entre 4.3 y 5.9 mm (Regiel et al., 2013).
Color
El color de las películas y las diferencias de estas fueron analizadas siguiendo el método descrito por Hasim et al. (2016), las mediciones se realizaron con un espectrofotómetro CM-600d (Konica Minolta, Inc.), las muestras fueron colocadas en una superficie con fondo blanco, tomando tres mediciones por muestra. Con ayuda de los parámetros de la escala CIELab donde L* representa luminosidad, a* tendencia al rojo y b* tendencia al amarillo, se determinó la diferencia de color total (ΔE*), la cual compara la diferencia de color general de una muestra experimental con una muestra de referencia con ayuda de la siguiente fórmula:
Donde: ΔL* representa la diferencia de luminosidad entre las películas, Δa* representa la diferencia de tendencia a rojo entre las películas y Δb* representa la diferencia de tendencia al amarillo entre las películas.
Cuanto mayor sea el valor de ΔE* obtenido, la diferencia de color entre las muestras y el control es mayor. Los valores de ΔE* entre 0 y 0.2 indican una diferencia de color indetectable, 0.2-0.5 para una diferencia muy pequeña, 0.5-1.5 para una pequeña diferencia, 1.5-3.0 para poco distintas, 3.0-6.0 para distinta, 6.0-12.0 para muy distintas y > 12 para una gran diferencia.
Resistencia a la tensión (RT), elongación (E) y el módulo de elasticidad (EM)
Las propiedades mecánicas de las películas (RT, E y EM) se determinaron con ayuda de una máquina de prueba universal Zwick/Roell (modelo Z005) de acuerdo con el método estándar ASTM D 882 (Mathew et al., 2019) mediante la aplicación de una celda de carga de 500 Newtons a una velocidad de cruceta de 5 mm/min. La separación inicial del agarre y la velocidad de la cruceta se estableció en 50 mm/min. Las películas con espesor conocido se cortaron en tiras rectangulares (5 x 2 cm2). Las mediciones se repitieron 5 veces, y los cálculos se realizaron con ayuda del software TestXpert® II (V3.31) (Zwick / Roell, Ulm, Alemania). El RT se determinó dividiendo la carga máxima para romper la película por el área de la sección transversal (espesor) de la película y se expresó en MPa. El EAB se calculó dividiendo el alargamiento de la película en la rotura por la separación inicial de agarre expresada en porcentaje (%). EM se obtuvo a partir de la pendiente inicial de la curva de tensión-deformación y se expresó en MPa.
Propiedades fisicoquímicas
Contenido de agua, solubilidad y grado de hinchamiento
Se determinó siguiendo la metodología descrita por Souza et al. (2017), con ligeras modificaciones
Las muestras de cada tratamiento se cortaron en cuadros de 2 x 2 cm y fueron pesados en una balanza analítica (ADAM Modelo PW 254) con una precisión de 0.0001 g, el cual fue considerado como peso inicial (M1). Posteriormente, las muestras fueron colocadas es un horno Felisa (modelo FE-293AD) a 55 ºC durante 24 h, transcurrido el tiempo se sacaron y pesaron nuevamente para obtener la masa seca inicial (M2), para después colocarlas en un vaso de precipitado cubriéndolas con 30 mL de agua desionizada y dejándolas a 25 ºC ± 2 ºC durante 24 h, pasado el tiempo fueron sacadas con pinzas quitando el exceso de agua superficial con ayuda de un papel filtro y pesadas nuevamente (M3). Las películas fueron colocadas una vez más en el horno a 55 ºC durante 24 h para determinar la masa seca final (M4). Se calculó el promedio de las tres repeticiones de cada parámetro con las siguientes fórmulas:
Permeabilidad al vapor de agua (PVA) y velocidad de transmisión del vapor de agua (VTVA)
La PVA y la VTVA se realizó siguiendo lo descrito por Chang et al., (2019), tomando como base el método ASTM E96, con algunas modificaciones.
Las películas se colocaron en vasos permeables con un diámetro interno de 6.4 cm y una profundidad de 7.5 cm con 10 mL de agua desionizada. Los vasos fueron colocados en una cámara ambiental con gel de sílice anhidro a 20 ºC y 51% de humedad relativa y un ventilador dentro para mover el aire interno y asegurar la homogeneidad de las condiciones. La VTVA se determinó por la pérdida de peso en los vasos en función del tiempo. Se calculó mediante regresión lineal (r2 > 0.99). Los vasos fueron pesados cada dos horas por 10 horas continuas y, posteriormente, cada 24 horas por 3 días. La VTVA (g/día m2) y PVA (g mm/kPa día m2) se calcularon mediante las siguientes fórmulas:
Donde: K es la pendiente de la variación del peso frente a la función lineal del tiempo (g/día), S es el área de la superficie de la película expuesta (m2), L es el espesor medio de la película (mm) y ΔP es la diferencia de presión de vapor a través de la película (kPa), calculada en función de la temperatura de la cámara y la humedad relativa dentro y fuera del vaso.
Grosor
El grosor de las películas fue determinado con ayuda de un micrómetro exterior de 0-25mm (OBI, China) con escala de 0.001 mm de exactitud tomando 9 mediciones en distintos puntos por muestra, los resultados obtenidos se expresaron como el promedio de las mediciones (Haghighi et al., 2019).
Análisis estadístico
Los datos obtenidos de la evaluación de la actividad antimicrobiana y propiedades fisicomecánicas de las películas fueron evaluados considerando un modelo completamente al azar, a través de análisis de varianza de un solo factor, utilizando el programa estadístico JMP® mediante el siguiente modelo:
Donde:
Resultados y discusión
Actividad antimicrobiana de AgNPs y quitosano
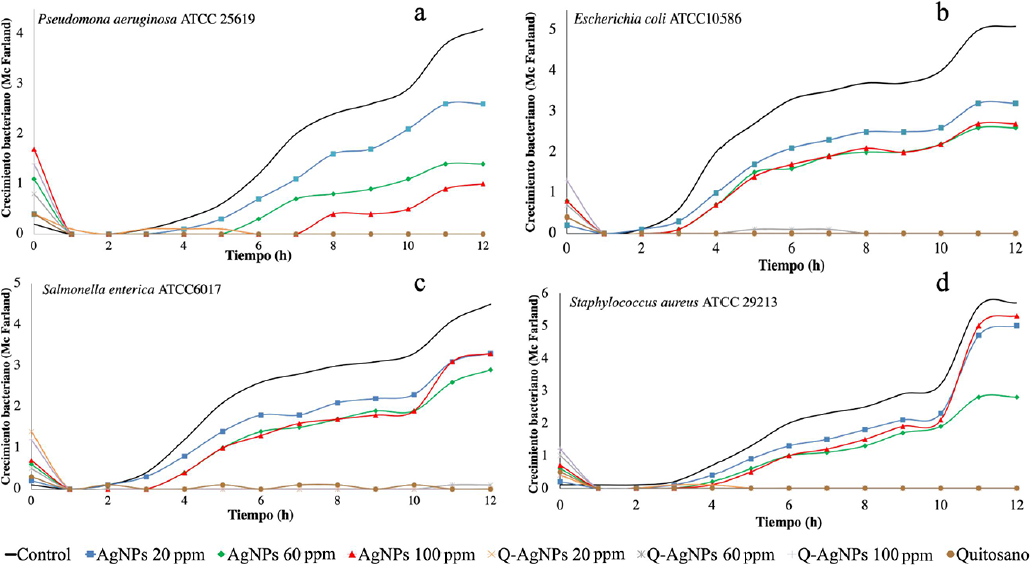
La Figura 1a ilustra el comportamiento que presentó P. aeruginosa ATCC 25619. El crecimiento de P. aeruginosa se inhibió en las soluciones de AgNPs con sus diferentes concentraciones 20, 60 y 100 ppm, esto fue observado como un retraso en el crecimiento y fue proporcional a la concentración de AgNPs haciendo que la fase de crecimiento logarítmico iniciara a la hora 5, 6 y 8, respectivamente. Por otro lado, las soluciones de quitosano y Q-AgNPs (20, 60 y 100 ppm) mostraron un efecto bacteriostático desde la primera hora.
Fuente: Elaboración de los autores.
Figura 1 Gráficos de cinética de crecimiento de Pseudomona aeruginosa (a), Escherichia Coli (b), Salmonella enterica (c) y Staphylococcus aureus (d), expuestas a soluciones acuosas de AgNPs, quitosano con AgNPs (en distintas concentraciones: 20, 60 y 100 ppm) quitosano al 1% y un control positivo.
Salmonella ATCC 6017 (Figura 1c) mostró el inicio de su crecimiento a partir de la hora 3 para el control y la solución de AgNPs con 20 ppm, mientras que el crecimiento en las soluciones AgNPs con 60 y 100 ppm fue a partir de la hora 4; del mismo modo, todas las soluciones de AgNPs mostraron un crecimiento por debajo del control. Mientras que las soluciones quitosano y Q-AgNPs (20, 60 y 100 ppm) mostraron un efecto bacteriostático para el crecimiento bacteriano.
El crecimiento de E. coli ATCC 10586 se muestra en la Figura 1b, donde se observa un ligero retraso en el inicio del crecimiento en todas las concentraciones de AgNPs, iniciando a partir de la hora 3. Por otra parte, las soluciones de AgNO3 100 ppm, quitosano y Q-AgNPs (20, 60 y 100 ppm) mostraron efecto bacteriostático.
El crecimiento de S. aureus (Figura 1d) mostró una fase lag más amplia que las otras cepas (Salmonella, E. coli y P. aeruginosa), para las soluciones de AgNPs (20, 60 y 100 ppm) observándose el inicio de la fase logarítmica a partir de la hora 4. El crecimiento logarítmico para estas soluciones siempre estuvo por debajo del control. Contrario a esto, las soluciones de quitosano y Q-AgNPs (20, 60 y 100 ppm) mostraron un efecto bacteriostático al no permitir el crecimiento de la bacteria.
El efecto antimicrobiano de las AgNPs depende de múltiples factores tales como el método de síntesis, la concentración, el tamaño de nanopartícula formada, pH, fuerza iónica, entre otros. Los resultados mostrados en las cepas analizadas al estar en contacto con las soluciones de AgNPs sugieren que su efectividad depende de la concentración de la solución, de tal forma que cuanto mayor sea la concentración de AgNPs mayor será el efecto inhibitorio. Esto es debido a que al aumentar la cantidad de nanopartículas se alcanza una mayor superficie de contacto en la pared celular de la bacteria por lo cual es más fácil que se ejerzan los mecanismos de acción con mayor facilidad y por periodos más prolongados; modificando la permeabilidad de membrana plasmática o actuando sobre el ADN de las bacterias (Mythili et al., 2018).
El efecto observado en el crecimiento de S. aureus, E. coli, Salmonella y P. aeruginosa al estar en contacto con soluciones de AgNPs indicó un retraso en el crecimiento, tanto para bacterias Gram negativas como Gram positivas. La inhibición inducida por las AgNPs fue dependiente de su concentración, soluciones con 20 ppm presentaron la menor inhibición, mientras que soluciones con una concentración de 100 ppm mostraron la mayor inhibición. Sin embargo, también se observó una menor inhibición sobre S. aureus. Estos resultados concuerdan con lo reportado por Ravichandran et al. (2016) quienes reportaron un mayor efecto antimicrobiano contra E. coli y P. aeruginosa mostrando halos de inhibición de 10 y 9 mm, respectivamente, al utilizar AgNPs con 100 μg/mL en comparación con los 8 mm de halo obtenidos para S. aureus. Por otro lado, resultados reportados por Mathew et al. (2020) indicaron un mayor efecto antimicrobiano contra bacterias Gram positivas (Bacillus subtilis) obteniendo halos de inhibición de 10 mm comparado con los halos de inhibición de P. putida y E. coli. (8.5 y 9.5 mm, respectivamente), al estar en contacto con AgNPs con 100 μg/mL.
La adición de AgNPs a la solución de quitosano en sus diferentes concentraciones demostró un efecto sinérgico que dio como resultado la inhibición total del crecimiento para todas las cepas, indicando un efecto bacteriostático, posiblemente al actuar simultáneamente los mecanismos de ambos compuestos (Senthilkumar et al., 2019). Donde, además de los mecanismos antes descritos de las AgNPs, los grupos amino del quitosano interactúan con la membrana plasmática permitiendo la fuga de contenido citoplasmático (Azmy et al., 2019). De igual manera, esto también implica una mayor estabilidad de las AgNPs conferida por el quitosano, el cual ayuda a la dispersión homogénea al captar las nanopartículas mediante un efecto quelante, gracias a los átomos de nitrógeno de los grupos amina del quitosano, esto mantiene estables las AgNPs permitiendo una liberación de iones plata por más tiempo (Kalaivani et al., 2018). Esto nos indica que la actividad antibacteriana mostrada por las soluciones de Q-AgNPs pueden ser utilizada para aplicaciones en la industria alimentaria.
Propiedades fisicomecánicas de las películas
Estructuras microscópicas de películas por FE-SEM
Las películas fueron caracterizadas por medio de FE-SEM para evaluar la topografía y morfología. Las micrografías superficiales de películas de quitosano y Q-AgNPs desarrolladas se muestran en la Figura 2. La micrografía de películas de quitosano se observa con una superficie morfológica homogénea a una resolución a 25000x (Figura 2; AI) y 50000x (Figura 2; AII) se pueden encontrar diversas manchas blancas en la película; sin embargo, a una resolución de 100000x (Figura 2; AIII) se puede observar que la superficie tiene una textura uniforme, lo cual indicó que no existe presencia de porosidad en la película, por lo tanto, es viable para una aplicación como recubrimiento de otro tipo de superficie. Mientras que la micrografía (Figura 2; BI) de la película Q-AgNPs mostró una morfología uniforme y suave sin ser visible la presencia de poros o huecos. Se observó la presencia de pequeñas aglomeraciones dispersas en toda la superficie, mientras que al aumentar la resolución a 100000x (BIII), fue posible observar aglomeraciones esféricas y cilíndricas de un tamaño aproximado entre los 100 y 200 nm correspondientes a las AgNPs.
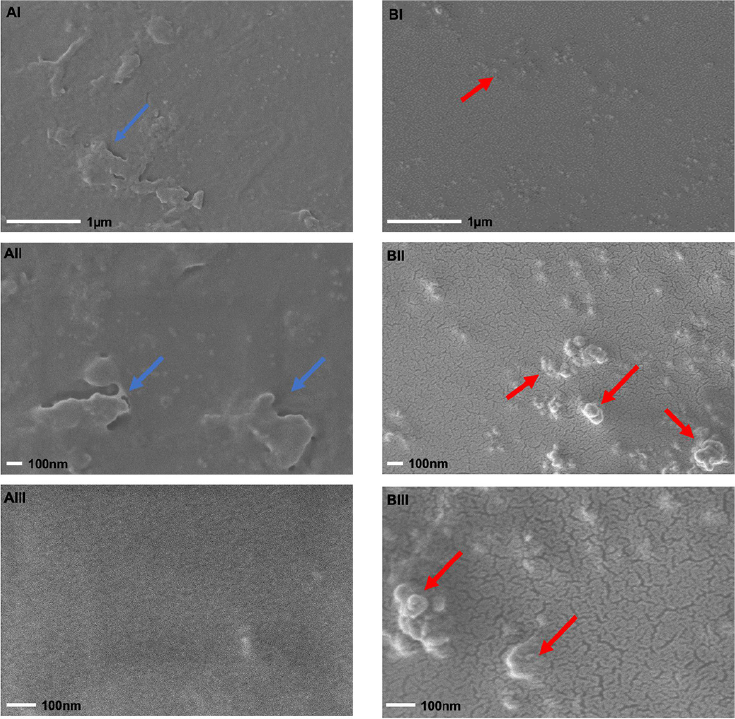
Fuente: Elaboración de los autores.
Figura 2 Micrografías de películas de quitosano a 25000x (AI), a 50000x (AII) y 100000x (AIII) y Q-AgNPs a 25000x (BI), a 50000x (BII) y 100000x (BIII) de resolución. Las flechas azules en las películas de quitosano indican imperfecciones superficiales que no afectan la homogeneidad y porosidad de la película. Las flechas rojas indican la presencia de AgNPs dispersas sobre la superficie de la película sin alterar su porosidad.
Las microestructuras observadas en las películas de Q-AgNPs indican la compatibilidad entre la matriz de quitosano y las AgNPs, lo cual se asocia con un efecto de reticulación entre la interacción electrostática de las AgNPs y los grupos funcionales del quitosano que disminuyen los enlaces hidrógeno intermolecular, corroborando que el quitosano promueve la aglomeración o dispersión de AgNPs al actuar como estabilizador (Kadam et al., 2019). Imágenes de películas de quitosano semejantes fueron reportadas por Zhang y Jiang (2020) atribuyendo la presencia de manchas blancas a la dispersión desigual del polímero; de igual forma, Elmehbad y Mohamed (2020) reportaron una mejora en las superficies que fueron adicionadas con AgNPs, mostrando superficies homogéneas con AgNPs dispersas uniformemente.
Color de películas
El color de un envase para alimentos es una de las características tomadas en cuenta por los consumidores, a través del cual el alimento es valorado para su compra o consumo, este puede ser similar al color del producto, permitir ligeros cambios que favorezcan la apariencia o proteger al alimento de los cambios fisicoquímicos (Ortega et al., 2017). El color de las películas se muestra en la Tabla 1, las películas de quitosano mostraron un patrón de color tendiente al azul debido a que el valor de b* fue negativo, siendo significativamente (P < 0.05; 1.49 unidades del valor de b) más bajo, con respecto a las películas de Q-AgNPs, las cuales presentaron una mayor tendencia al amarillo (b*) aunque con una menor luminosidad.
Tabla 1 Valores de color de películas de quitosano y Q-AgNPs.
| Película | L* | a* | b* | △E* |
|---|---|---|---|---|
| Quitosano | 93.11 ± 0.43a | 0.65 ± 0.22a | -2.01 ± 0.68b | 0.09 ± 0.12a |
| Q-AgNPs | 90.43 ± 1.18b | 0.62 ± 0.44a | 0.52 ± 2.10a | 0.61 ± 1.45a |
Nota: Luminosidad (L*), tendencia al rojo (a*), tendencia al amarillo (b*) y diferencia total de color (△E*). Los valores se dan como media ± DE (n = 12). Diferentes letras en la misma columna indican significativamente diferente (P < 0.05).
Fuente: Elaboración de los autores.
El cambio de color fue observado desde la adición de AgNPs a la solución de quitosano y esto concuerda con un patrón de cambio de color característico al sintetizar AgNPs, ya que este cambio es utilizado como indicador en la presencia y formación de AgNPs cambiando de tonalidades que van del amarillo hasta el negro entre mayor sea su concentración (Mathew et al., 2020; Parthiban et al., 2018).
La adición de AgNPs a la solución de quitosano dio como resultado películas con una superficie 2.68 (unidades del valor de L*) menos luminosa (P < 0.05), dicho efecto es atribuido a la dispersión de la luz generada por presencia de AgNPs, respecto a las películas de quitosano, lo cual podría indicarnos que películas con AgNPs podrían conferir una mayor protección de la luz y esta podría ser aplicada como protección para alimentos al retardar la oxidación de los lípidos y preservar las propiedades organolépticas del alimento.
Una tendencia similar fue reportada por Zhang y Jiang (2020), los cuales obtuvieron películas con tendencias al amarillo más elevadas y una disminución de luminosidad al adicionar AgNPs. Por otra parte, Yong et al. (2019) reportaron un patrón de color verdeazulado característico de las películas de quitosano, el cual va de -0.19 a -2.44 (-a*) y -0.94 a -6.03 (-b*), concluyendo que el color fue atribuido al pH de la solución; no obstante, las películas obtenidas en esta investigación mostraron una tendencia hacia el rojo con valores positivos y un valor de 1.61 más de luminosidad (L*), esta diferencia pudiese ser atribuida al método y soluciones utilizadas para el desarrollo de las películas.
A pesar de las variaciones observadas en a*, b* y L*, la diferencia de color total presentada no mostró diferencias significativas (P > 0.05) entre los tratamientos, teniendo una pequeña diferencia según la metodología descrita por Hasim et al. (2016), las mínimas diferencias reportadas son atribuidas a la presencia y distribución de AgNPs dentro de la matriz de quitosano (Salari et al., 2018).
En la apariencia general, en la Figura 3 (1C) se observan películas homogéneas, tanto de quitosano como de Q-AgNPs; aun así, la adición de AgNPs dió como resultado películas con predominación al color amarillo-marrón y menos luminosas, aunque esto no representó una diferencia significativa (P > 0.05) en la diferencia total de color (ΔE) entre las películas. Por otro lado, en las micrografías FE-SEM realizadas a cada una de las películas, se distinguieron conglomerados de AgNPs (Figura 3 1B, en círculo rojo) presentes en la superficie de la película de Q-AgNPs, mientras que en las películas de quitosano se percibió homogeneidad (Figura 3 1A).
Grosor, resistencia a la tensión (σT), elongación (E) y módulo de elasticidad (ME)
Las propiedades fisicomecánicas de un empaque representan la durabilidad y la capacidad de preservar los alimentos durante su manipulación en la cadena de producción (Homez et al., 2018), en la Tabla 2 se muestran los valores de grosor, resistencia a la tensión, elongación y módulo de elasticidad.
Tabla 2 Propiedades fisicomecánicas de películas de quitosano y Q-AgNPs.
| Película | Grosor (mm) | ME (Mpa) | σT (Mpa) | Elongación (%) |
|---|---|---|---|---|
| Quitosano | 93.11 ± 0.43a | 0.65 ± 0.22a | -2.01 ± 0.68b | 0.09 ± 0.12a |
| Q-AgNPs | 90.43 ± 1.18b | 0.62 ± 0.44a | 0.52 ± 2.10a | 0.61 ± 1.45a |
Nota: ME = Módulo de elasticidad, σT = Resistencia a la tensión. Los valores se dan como media ± DE (n = 5 y n = 12 para grosor). Diferentes letras en la misma columna indican significativamente diferente (p < 0.05). Fuente: Elaboración de los autores.
El grosor de las películas de Q-AgNPs fue significativamente menor (P < 0.05) que el de las películas de quitosano. En este sentido, Souza et al. (2017) mencionan que el contenido de sólidos acumulados en una superficie determina el grosor final de la película, por lo que si se aumenta la concentración de AgNPs el grosor de las películas podría aumentar, tal como lo reportan Shah et al. (2018) pasando de 25 mm (película control) a 52 mm con la adición de AgNPs; del mismo modo, Deepak Kadam et al. (2019) reportan un aumento en el grosor de las películas adicionadas con AgNPs. De este modo, lo observado en esta investigación indicó un efecto contrario al adicionar AgNPs, posiblemente debido a la alta compactación de las estructuras moleculares observadas, por lo que un aumento de sólidos no repercutió en el aumento de grosor de las películas, esto podría significar una mejor capacidad de manipulación al momento de recubrir alimentos.
La σT representa la capacidad de un material para resistir la fractura bajo tensión de tracción, elongación representa la flexibilidad de la película y ME muestra la rigidez (Shankar et al., 2016), las películas de Q-AgNPs no mostraron diferencias significativas (P > 0.05) en la σT y el ME en comparación con las películas de quitosano; por otro lado, la flexibilidad de las películas Q-AgNPs se vio reducida significativamente (P < 0.05) siendo 8.93 Mpa menos flexibles. Diversos factores pueden modificar las propiedades de una película, factores como el tipo de polímero, en tamaño y la forma de las nanopartículas (Kadam et al., 2019), o la interacción molecular entre las cadenas poliméricas y las AgNPs para formar enlaces hidrógeno y enlaces éster que determinan la estabilidad de la matriz al contener enlaces más fuertes o débiles para soportar algún factor alterante ya sea físico o químico (Zhang y Jiang, 2020; Roy et al., 2019). De tal forma, las aglomeraciones formadas por la adición de AgNPs pudieron actuar como nano relleno en los espacios estructurales de las películas de quitosano (Gu et al., 2021)
Propiedades fisicoquímicas de películas
Propiedades como la permeabilidad al vapor de agua, grado de hinchamiento, resistencia a la tracción y elongación son parámetros ampliamente utilizados en la industria de empaques, pues estos podrán determinar la capacidad de preservar las características de los productos alimenticios (Zhang y Jiang, 2020).
Contenido de humedad (H), solubilidad (S) y grado de hinchamiento (GH)
Los resultados de contenido de humedad, solubilidad en agua y grado de hinchamiento de películas se muestran en la Tabla 3; el contenido de humedad en las películas es un indicador relacionado con el espacio vacío que ocupan las moléculas de agua en la microestructura de la matriz polimérica, las cuales podrían afectar las propiedades fisicomecánicas y microbiológicas de las mismas. La adición de AgNPs a la matriz de quitosano afectó significativamente (P < 0.05) el contenido de humedad, con un incremento de 9.33% en comparación con las películas de quitosano; de igual manera, la solubilidad de las películas Q-AgNPs se incrementó significativamente, esto pudo deberse a la interacción molecular de los compuestos ya que, aunque el quitosano es un polisacárido poco soluble en soluciones neutras o básicas, al estar unidas con AgNPs sus enlaces pueden romperse con mayor facilidad, permitiendo mayor interacción con el medio acuoso haciendo que las películas puedan disolverse en agua a pH neutro (Haghighi et al., 2019). Fenómenos similares fueron observados por Yong et al., (2019) al mezclar quitosano con pulpa de papaya donde se ven modificados el contenido de agua y la solubilidad de las películas. Kadam et al. (2019) mencionan que las características del quitosano y el plastificante utilizado para la formación de las películas son factores que pueden modificar la solubilidad final. Por otra parte, el grado de hinchamiento se vio disminuido al adicionar AgNPs indicando la pérdida de la capacidad de absorber agua, un fenómeno similar fue reportado por Souza et al., (2016) al utilizar aceites esenciales en la matriz de quitosano. Se sabe que la naturaleza hidrofílica del quitosano representa un inconveniente al hincharse, disolverse o desintegrarse al estar en contacto con alimentos con altos contenido de humedad, esta desventaja se puede reducir al agregar AgNPs pues se podría bajar el grado de hinchamiento tal como se muestra en los resultados obtenidos. En el mismo sentido, Mathew et al. (2019) mencionan que existe la necesidad de una menor capacidad de absorción de agua en un material de envasado, probando que los nanocompuestos incorporados a una matriz mejoran significativamente esta propiedad.
Tabla 3 Propiedades fisicoquímicas de películas de quitosano y Q-AgNPs.
| Película | H (%) | S (%) | GH (%) | PVA (g mm/kPa día m2) |
VTVA (g/día m2) |
|---|---|---|---|---|---|
| Quitosano | 14.3 ± 0.88b | 42.5 ± 0.76b | 85.11 ± 3.83a | 0.8811 ± 0.004a | 0.2031 ± 0.001a |
| Q-AgNPs | 24.2 ± 3.08a | 47.8 ± 3.32a | 79.96 ± 5.87b | 0.8607 ± 0.004b | 0.1992 ± 0.001b |
Nota: Contenido de humedad (H), solubilidad (S) y grado de hinchamiento (GH), permeabilidad al vapor de agua (PVA) y la velocidad de transmisión del vapor de agua (VTVA). Los valores se dan como media ± DE (n = 12). Diferentes letras en la misma columna indican significativamente diferente (P < 0.05).
Fuente: Elaboración de los autores.
Permeabilidad al vapor de agua (PVA)
La PVA es uno de los indicadores más importantes para determinar si un material de empaque podrá evitar la transferencia de humedad entre el producto y el ambiente para mantener la estabilidad de un producto alimenticio, conservar sus propiedades y garantizar la vida útil del alimento, es por esto que el control de esta transferencia es un punto clave en la fabricación de envases, de esta manera el valor de PVA debería ser lo más bajo posible para reducir o evitar la transferencia de humedad de la atmósfera al alimento (Yong et al., 2019; Qin et al., 2019). En la Tabla 3, se muestra la VTVA y la PVA de las películas de quitosano y Q-AgNPs, donde se observa que hubo un efecto (P < 0.05) sinérgico en la disminución de ambos parámetros al adicionar AgNPs a la matriz polimérica, este efecto es atribuido a la formación de una barrera discontinua, aumentando la interacción entre las cadenas poliméricas más compactas, que hace vías masivas para la difusión en las moléculas de agua (Shankar et al., 2016; Salari et al., 2018; Roy et al., 2019). Por tal motivo, al observarse niveles bajos, tanto en la VTVA como en la PVA, las películas de Q-AgNPs podrían ser consideradas como una mejor opción para garantizar un alargamiento de la vida de anaquel de un alimento.
Conclusión
Se desarrollaron con éxito películas de quitosano y Q-AgNPs mostrando actividad bacteriostática in vitro contra bacterias Gram positivas y negativas. Al incorporar AgNPs a las películas de quitosano, estuvieron aglomeradas en la superficie de la película, lo que dio como resultado una superficie libre de poros, opaca, lisa y suave, además de una permeabilidad al vapor de agua y una velocidad de transmisión del vapor de agua bajos, lo cual le confiere funciones de barrera física ideal para proteger a los alimentos de factores ambientales como el oxígeno y la luz.
Las películas Q-AgNPs mostraron propiedades fisicomecánicas apropiadas para un envase para alimentos al ser un material compacto y resistente ante factores físicos
Bajo las condiciones de este estudio, se concluye que las películas Q-AgNPs son factibles para aplicarse como recubrimientos o empaques para alimentos.











 nueva página del texto (beta)
nueva página del texto (beta)




