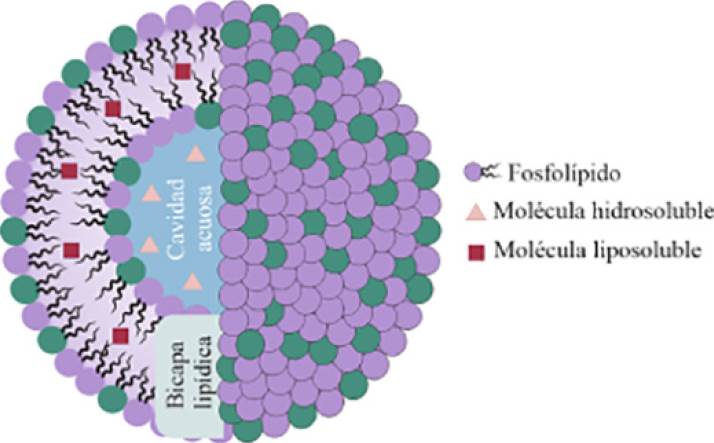
Liposomas: estructura y composición1
Los liposomas son pequeñas vesículas artificiales conformadas por una bicapa de fosfolípidos que rodean un núcleo acuoso (Figura 1). Estas vesículas varían en tamaño, composición, carga eléctrica y lamelaridad (unilamelares, multilamelares y multivesiculares) (Nsairat, 2022; Sivan, 2018).
Los liposomas pueden encapsular moléculas hidrofílicas en su cavidad acuosa, mientras que en su bicapa lipídica pueden albergar moléculas hidrofóbicas. Estas características estructurales han determinado su enorme relevancia en distintas disciplinas como la biología (dada su similitud con la membrana celular), la medicina, las ciencias farmacéuticas, cosméticas y dermocosméticas (Nakhaei, 2021).
Por su habilidad de encapsular moléculas de diversa naturaleza, los liposomas pueden funcionar como sistemas de liberación de fármacos. En este contexto, los liposomas pueden modificar de manera aparente aspectos como la solubilidad o estabilidad de un fármaco, lo cual favorecerá el comportamiento de dicho fármaco en un ambiente biológico. Además, los liposomas son biocompatibles y biodegradables (Sercombe, 2015).
Los liposomas se clasifican en función de su tamaño (que va desde la nanoescala hasta la microescala), y del número de sus bicapas o lamelas (Figura 2) (Liu, 2022).
Los fosfolípidos que forman los liposomas están constituidos por un extremo hidrofílico (cabeza) y un extremo hidrófobo (cola). La cabeza determina la carga superficial del liposoma (neutra, catiónica o aniónica) y generalmente está compuesta de colina, fosfato y glicerol. Por su parte, la cola hidrofóbica está conformada por una o dos cadenas de ácidos grasos de 14 - 18 carbonos (Nsairat, 2022). Los fosfolípidos pueden ser de origen natural (obtenidos de la soya o la yema de huevo) o sintético. Los fosfolípidos más comúnmente usados en la preparación de liposomas se muestran en la Tabla 1 (Van Hoogevest, 2014).
Tabla 1 Fosfolípidos naturales y sintéticos más comunes en la preparación de liposomas.
| Naturales | Sintéticos |
|---|---|
|
Fosfatidilcolina (PC) Fosfatidiletanolamina (PE) Fosfatidilserina (PS) Fosfatidilglicerol (PG) Fosfatidilinositol (PI) Ácido fosfatídico (PA) |
Dimiristoilfosfatidilcolina (DMPC) Dioleoilfosfatidilcolina (DOPC) Distearoilfosfatidilcolina (DSPC) Dipalmitoilfosfatidilglicerol (DPPG) Diestearoilfosfatidilglicerol (DSPG)
|
Fuente: Adaptado de Van-Hoogevest (2014).
Además de los fosfolípidos, los liposomas también pueden contener esteroles, siendo el colesterol el más común. El colesterol brinda estabilidad física y biológica ya que puede modificar la viscosidad o la rigidez de la bicapa a la vez que reduce su permeabilidad en presencia de fluidos biológicos como la sangre. En ausencia de colesterol, la bicapa podría sufrir una rotura (Nakhaei, 2021; Kawakami, 2017).
Liposomas como sistemas de liberación de fármacos
Los liposomas se pueden utilizar para encapsular fármacos hidrofílicos (en el núcleo acuoso), o hidrofóbicos (en la bicapa). El encapsulamiento protege al fármaco de la degradación. En caso de que el fármaco sea hidrofóbico, el encapsulamiento podría ayudar a superar las limitantes fisicoquímicas, biológicas y farmacéuticas asociadas con su baja solubilidad. Además, los liposomas pueden optimizar los parámetros farmacocinéticos del fármaco encapsulado, al prolongar su tiempo de vida media, controlar su liberación en función del tiempo y disminuir su toxicidad (Liu, 2022). Así, el diseño de un liposoma como sistema de liberación de fármacos (SLF) debe considerar lo siguiente:
Tamaño
El tamaño determinará la biodistribución y la velocidad de eliminación del liposoma. Si su diámetro es menor a 10 nm se eliminará por vía renal y si es mayor a 200 nm será retenido mayoritariamente por los hepatocitos, lo cual afectará la distribución del liposoma (Taléns, 2022).
Temperatura de transición de fase
La temperatura de transición de fase (Tc) es la temperatura a la cual los fosfolípidos cambian de estado físico. Por debajo de la Tc, los fosfolípidos están ordenados en una fase tipo gel y por encima de ella, se encuentran en una fase líquida. Los fosfolípidos con una Tc > 37 ºC forman liposomas de una bicapa poco fluida, y, por lo tanto, menos permeables a temperatura fisiológica. Mientras que fosfolípidos con una Tc < 37 ºC forman liposomas que liberan el fármaco encapsulado en la fase líquida de forma más rápida (Sharma, 1997). Así, la Tc determinará la fluidez de la bicapa, la liberación del fármaco in vivo y la estabilidad durante el almacenamiento.
Adicionalmente, la Tc se puede modificar con la adición de esteroles (Kawakami, 2017).
Interacciones con proteínas plasmáticas
Después de su administración, los liposomas que llegan a circulación sistémica pueden interactuar con las proteínas plasmáticas, lípidos y metabolitos por medio de interacciones electrostáticas, de Van der Waals e hidrofóbicas, resultando así en la formación de una corona proteica. A nivel biológico, la corona determina la interacción con células del sistema inmune; modifica o impide la salida del fármaco del liposoma; o, por el contrario, deforma la bicapa provocando la fuga del fármaco; limita las interacciones del liposoma con su blanco terapéutico; e induce efectos inmunogénicos debido a la pérdida parcial de la estructura secundaria de las proteínas de la corona (Marichal, 2020; Cai, 2019). Dado el impacto de la corona en el desempeño biológico del liposoma, es fundamental evaluar este aspecto durante los estudios in vitro/in vivo y definir el tipo de recubrimiento que pueda mitigar este fenómeno.
Dada la versatilidad y potencial de los liposomas como sistemas de liberación de fármacos (SLF), se han desarrollado diversas tecnologías para aumentar su estabilidad coloidal, hacerlos responsivos a algún estímulo fisicoquímico endógeno o exógeno; o bien, para dirigirlos a un blanco biológico específico.
Liposomas convencionales
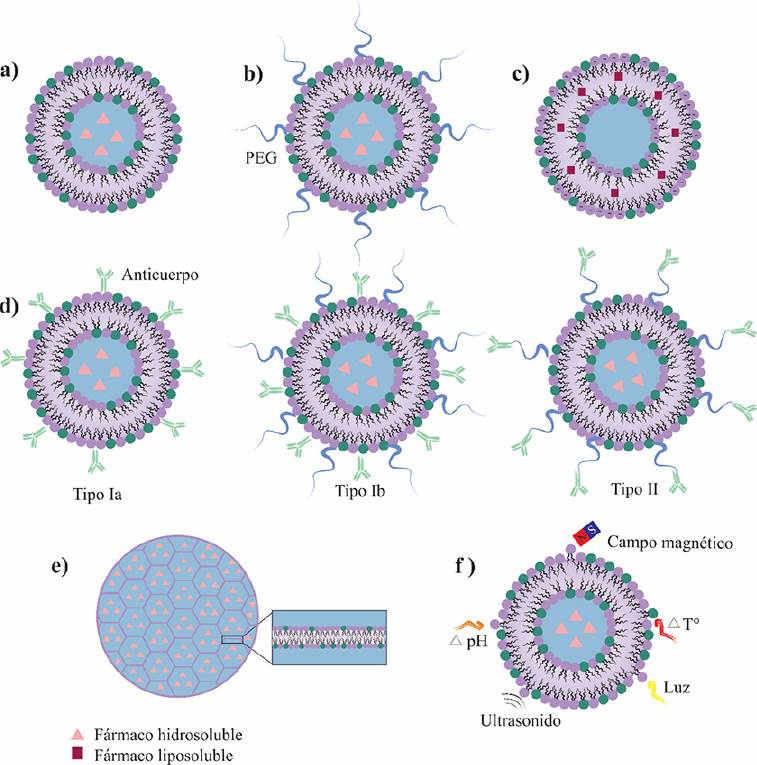
Son liposomas simples (Figura 3a), los cuales, después de su administración, suelen ser eliminados rápidamente de circulación sistémica al ser fagocitados por los macrófagos del sistema retículo endotelial (RES) (Sercombe, 2015).
Fuente: Elaboración de los autores.
Figura 3 Esquema de liposoma: a) convencional; b) Stealth®; c) iónico; d) inmunoliposoma; e) DepoFoam®, y, f) estímulo-sensible.
Liposomas Stealth®
Los liposomas Stealth® (sigilosos) tienen polietilenglicol (PEG) enlazado covalentemente a las cabezas polares de los fosfolípidos (Figura 3b). También se conocen como liposomas pegilados. La pegilación de la superficie del liposoma mejora su estabilidad coloidal. Reduce la interacción con proteínas plasmáticas y lipoproteínas. Además, lo hace invisible frente a RES, y, por lo tanto, optimiza la farmacocinética al prolongar el tiempo de vida media del fármaco en circulación sistémica (Čeh, 1997; Nsairat, 2022).
Los fosfolípidos más comunes en esta tecnología son: DSPE, DPPE y DOPE. El peso molecular del PEG suele ser de 2000 Da (Nosova, 2019).
Liposomas iónicos (catiónicos o aniónicos)
La carga de la superficie del liposoma puede ser positiva o negativa y se puede modular dependiendo del fosfolípido a utilizar. La carga superficial del liposoma genera un campo eléctrico que incrementa el espesor de la bicapa lipídica pudiendo así aumentar la cantidad de fármaco liposoluble encapsulado (Figura 3c).
Inmunoliposomas
Son liposomas con anticuerpos monoclonales (mAb) o fragmentos de anticuerpos (Fab o scFv) acoplados a su superficie (NCI 2019). Pueden ser liposomas convencionales (tipo Ia), pegilados (tipo Ib) y (tipo II) pegilados con anticuerpos acoplados en los extremos distales de las cadenas de PEG (Figura 3d). El objetivo del inmunoliposoma es dirigirse a un blanco terapéutico, de manera específica, por medio de la unión del liposoma a su receptor en la célula blanco. También se puede favorecer la internalización celular mediada por receptores de superficie y promover la acumulación del fármaco dentro de la célula, lo cual es altamente deseable si se trata de quimioterapéuticos (Kontermann, 2011).
DepoFoam®
Esta tecnología encapsula fármacos en una plataforma liposomal de tipo MVV. Estas estructuras se componen de un panal de numerosas cámaras acuosas de diferente tamaño, delimitadas por una única bicapa lipídica que, físicamente, se asemejan a burbujas de jabón (Figura 3e). Esta tecnología puede proporcionar mayor estabilidad, encapsular fármacos de forma más eficiente y asegurar una liberación sostenida de fármacos en comparación con los liposomas unilamelares (Angst, 2006).
Liposomas estímulo-sensibles
Son liposomas que incorporan materiales que responden a estímulos físicos (térmico, óptico, magnético) o químicos (pH, redox, enzimas) para promover o desencadenar la liberación de fármaco en respuesta a dichos estímulos y controlar así la liberación de un fármaco de manera temporal. Así, los liposomas funcionalizados con biomoléculas en su superficie para reconocer y dirigirse al blanco terapéutico, y que además incorporan materiales estímulosensibles, han resultado sumamente atractivos como potenciales terapias contra el cáncer (Figura 3f) (Lee, 2017).
Tecnologías liposomales en uso clínico
Los liposomas son las primeras nanomedicinas aprobadas para uso clínico utilizadas con éxito desde hace dos décadas (Tabla 2) como terapias antifúngicas, antinflamatorias, anticancerígenas e, incluso, terapias génicas (Bulbake, 2017).
Tabla 2 Tecnologías liposomales en uso clínico.
| Tec. Lip. (año) | Fármaco | Adm. | Indicación |
|---|---|---|---|
| Doxil® (1995) | Doxorrubicina | IV | Cáncer de ovario, mama, sarcoma de Kaposi. |
| DaunoXome® (1996) | Daunorrubicina | IV | Sarcoma de Kaposi. |
| Ambisome® (1997) | Anfotericina B | IV | Infecciones fúngicas invasivas graves. |
| Inflexal® (1997) | Hemaglutinina inactivada de las cepas A y B del virus de la influenza. | IM | Influenza. |
| DepoCyt® (1999 - 2017)* | Citarabina | IT | Meningitis neoplásica. |
| Myocet® (2000) | Doxorrubicina + ciclofosfamida | IV | Cáncer de mama y ovario metastásico. |
| Visudyne® (2000) | Verteporfina | IV | Neovascularización coroidea. |
| Mepact® (2004) | Mifamurtide | IV | Osteosarcoma de alto grado, resecable, no metastásico. |
| DepoDur™ (2004) | Sulfato de morfina | Epidural | Tratamiento para el dolor. |
| Epaxal® (2006) | Virus - hepatitis A inactivado (cepa RGSB). | IM | Hepatitis A. |
| Exparel® (2011) | Bupivacaína | IV | Tratamiento para el dolor. |
| Marqibo® (2012 - 2021)* | Vincristina | IV | Linfoma no Hodgkin y leucemia linfoblástica aguda. |
| Onivyde™ (2015) | Irinotecán + fluorouracilo y leucovorina. | IV | Adenocarcinoma de páncreas metastásico. |
| Mosquirix (2015) | Proteínas derivadas de Plasmodium falciparum y proteína S de la envoltura del virus de la hepatitis B. | IV | Malaria. |
| Vyxeos™ (2017) | Daunorrubicina y citarabina. | IV | Leucemia mieloide aguda. |
| Shingrix (2018) | Glicoproteína E recombinante del virus.de la varicela zóster. | IM | Herpes zóster y neuralgia post-herpética. |
| Arikayce (2018) | Sulfato de amikacina. | INH | Enfermedad pulmonar. |
| Moderna y Pfizer - BioNTech (2021) | Vacunas de ARNm de respuesta inmunitaria. | IV | COVID-19. |
| Zolsketil® (2022) | Doxorrubicina | IV | Cáncer de mama, ovario, mieloma múltiple y sarcoma de Kaposi. |
Nota: Esta lista incluye formas liposomales aprobadas por la FDA y la EMA.
Fuente: Adaptado de Taléns (2022), Liu (2022), Beltrán (2019), Bulbake (2017), EMA (2015).
Hemos representado gráficamente la información de la Tabla 2 para facilitar la identificación de las áreas de aplicación de los liposomas siendo evidente el predominio de las quimioterapias (Figura 4).

Fuente: Elaboración de los autores.
Figura 4 Áreas terapéuticas con tecnologías liposomales aprobadas clínicamente. Otros (sistema nervioso, ocular y respiratorio).
Liposomas en cáncer
El cáncer está entre los primeros cinco lugares de causas de mortalidad en México y a nivel mundial (INEGI, 2022; WHO, 2022). Se sabe que el cáncer se desarrolla por una proliferación celular descontrolada activada por vías de señalización y falta de apoptosis (muerte celular). Inicia en un sitio localizado, pero tiende a propagarse a diferentes partes del cuerpo (metástasis).
En el cáncer, el microambiente del tejido donde se desarrolla el tumor suele ser anormal. Hay ausencia de vasos linfáticos funcionales e hipoxia. El pH es más ácido que en el resto del cuerpo y hay sobrexpresión de algunas enzimas. Además, se forman vasos sanguíneos inmaduros, discontinuos y fenestrados de manera rápida y descontrolada, lo cual se conoce como efecto de permeabilidad y retención aumentada (EPR, por sus siglas en inglés) (Taléns, 2022). Las fenestraciones rondan entre 10-800 nm. Por lo tanto, si se tienen liposomas en ese rango de tamaño, se favorecerá su acumulación en el tejido tumoral (acumulación pasiva) (Hu, 2022), al mismo tiempo que son retenidos debido a la deficiencia del sistema linfático. Se considera que liposomas entre 100 y 200 nm se acumulan preferentemente en el tejido tumoral por el efecto EPR (Taléns, 2022).
Como las células tumorales sobrexpresan algunos receptores de membrana que promueven su crecimiento desenfrenado, la superficie de los nanoliposomas se puede funcionalizar con ligandos que reconozcan dichos receptores para dar paso a lo que se conoce como acumulación activa (selectiva o targeted) que, además, podría estar favorecida por la acumulación pasiva, mediada por el tamaño nanométrico del liposoma (Figura 5) (Mahato, 2017).

Fuente: Elaboración de los autores.
Figura 5 Representación de la acumulación: a) pasiva, y, b) activa.
Por lo tanto, liposomas en los que por su tamaño se favorezca la acumulación pasiva, con superficies funcionalizadas para que reconozcan una célula o tejido en particular y en los que se controle la liberación del fármaco por medio de un estímulo físico o químico (liposomas inteligentes) son las nanoplataformas de liberación de fármacos que más expectativas han generado en el desarrollo de terapias novedosas contra el cáncer.
Tecnologías liposomales como terapias contra el cáncer
Los liposomas son las primeras nanomedicinas aprobadas para terapias contra el cáncer. De un total de 20 formulaciones liposomales aprobadas para uso clínico (Tabla 2), 9 están indicadas para dicho padecimiento. De estas 9 formulaciones, 5 de ellas (Doxil®, Myocet®, Zolsketil®, DaunoXome® y Vyxeos™) contienen doxorrubicina o daunorrubicina, que son derivados de antraciclinas. Las antraciclinas son fármacos muy eficaces como quimioterapéuticos, pero con uso limitado debido a su cardiotoxicidad y una resistencia espontánea o adquirida al tratamiento (Aubel, 1984). A continuación, describimos las tecnologías liposomales utilizadas en terapias contra el cáncer.
Doxil®
Doxil® fue la primera formulación liposomal aprobada para el tratamiento de algunos tipos de cáncer. Consiste en liposomas Stealth®, tipo SUV, de 100 nm de diámetro, compuestos de HSPC, MPEG2000-DSPE y colesterol. Encapsula doxorrubicina en la cavidad acuosa. Se utiliza para el tratamiento del cáncer de ovario avanzado y sarcoma de Kaposi asociado con el VIH. Los comienzos de Doxil® datan de la década de los años sesenta del siglo XX, con varios intentos fallidos, y que actualmente han sido un pilar fundamental en el desarrollo de tecnologías liposomales, hoy en día exitosos (Tabla 3). El artículo Doxil® - The first FDA-approved nano-drug: Lessons learned es una excelente revisión sobre la historia del desarrollo de Doxil® (Barenholz, 2012).
Tabla 3 Requisitos y soluciones de la formulación liposomal de Doxil®.
| Requisitos | Solución |
|---|---|
| Prolongar tiempo en circulación sanguínea. |
Modificar la formulación liposomal usando HSPC (fosfolípido de alta Tc). Optimizar la proporción de colesterol en la bicapa lipídica aumentando su rigidez a 37 °C (temperatura corporal). Pegilación (liposoma Stealth®). |
| Carga significativa y estable de fármaco en la cavidad acuosa. | Carga remota/activa, mediante un gradiente transmembranal de sulfato de amonio, logrando un porcentaje de encapsulamiento del 90%. |
| Extravasación en tejido tumoral. | Liposomas tipo SUV para favorecer EPR. |
Fuente: Barenholz (2012).
Doxil® resultó más eficaz que la doxorrubicina libre, logró mejorar el perfil toxicológico de la doxorrubicina y mejoró sus características farmacocinéticas debido a su tamaño, pegilación y estabilidad de bicapa (Gabizon, 1994).
Myocet®
Son liposomas MLVs de 190 nm de diámetro, compuestos de EPC y colesterol. Encapsulan doxorrubicina y emplean la técnica de carga remota, con eficiencias de encapsulamiento del 99%. Se utiliza en combinación con ciclofosfamida como tratamiento de primera línea en pacientes con cáncer de mama. La lógica detrás de su diseño es similar a Doxil® (con el objetivo de mejorar el perfil de seguridad de la doxorrubicina y mantener su eficacia antitumoral) sin embargo, Myocet® es un sistema liposomal no pegilado por lo cual, libera más del 90% del fármaco durante las primeras 24 horas posteriores a su administración (Doxil® libera menos del 10 % de su doxorrubicina en el mismo periodo de tiempo). En ausencia de PEG, los liposomas son visibles ante RES pero al mismo tiempo se reduce la prevalencia de un efecto secundario que parece estar ligado a liposomas Stealth®, conocido como eritrodisestesia palmar-plantar (Waterhouse, 2001).
Daunoxome
Son liposomas SUVs no pegilados de 45-80 nm de diámetro, compuestos de DSPC y colesterol con daunorrubicina en la cavidad acuosa que se utiliza para el tratamiento del sarcoma de Kaposi asociado al VIH.
DaunoXome ha mostrado tasas de respuesta superiores al 50%. Además, mejora el perfil farmacocinético de daunorrubicina; aumenta su permanencia en circulación sistémica con una liberación sostenida de alrededor de 36 horas. Asimismo, ha mostrado una reducción considerable en la cardiotoxicidad del fármaco (Forssen, 1997).
Vyxeos
Son liposomas LUVs de 110 nm de diámetro, compuestos de DSPC, DSPG y colesterol. Son los primeros liposomas aprobados en terapia dual encapsulando dos fármacos en su cavidad acuosa: citarabina y daunorrubicina. Se utiliza para el tratamiento de leucemia mieloide aguda causada por quimioterapias previas y para mielodisplasias de diagnóstico reciente.
Las ventajas de Vyxeos se basan en la sinergia antitumoral mejorada de sus fármacos, en la reducción de la frecuencia de dosis administradas en comparación con los tratamientos tradicionales, y en el aumento de la tasa de supervivencia de los pacientes (EMA, 2022).
Zolsketil
Son liposomas Stealth®, tipo SUV, de 100 nm de diámetro, conteniendo doxorrubicina, compuestos de HSPC, MPEG2000-DSPE y colesterol. Zolsketil demostró ser bioequivalente a Doxil® y está indicado para pacientes con cáncer de mama, mieloma múltiple (en combinación con bortezomib) y sarcoma de Kaposi. De igual manera, los liposomas de Zolsketil pueden permanecer por largo tiempo en circulación sanguínea sin ser detectados por RES y se ha demostrado su acumulación selectiva en comparación con doxorrubicina libre (EMA, 2022).
DepoCyt™ * Aprobación retirada en 2017
Es el primer sistema DepoFoam™ en alcanzar un uso clínico. Son liposomas MVVs de 20,000 nm de diámetro, compuestos de DOPC, DPPG, trioleína y colesterol conteniendo citarabina en las cavidades acuosas, lo cual permite su liberación sostenida durante 14 días. Este sistema logró una dosificación menos frecuente. Demostró prolongar el tiempo de supervivencia y una mejor calidad de vida de los pacientes respecto a aquellos tratados con citarabina libre (Angst, 2006). En 2017, DepoCyt™ se retiró del mercado debido a problemas de producción a largo plazo no revelados (McDonald, 2017)
Mepact®
Son liposomas MLVs de 2,000-3,500 nm, compuestos de POPC y DOPS. Contienen el principio activo mifamurtida (muramil tripéptido fosfatidiletanolamina, MTP-PE). MTP-PE es un derivado lipofílico fabricado del dipéptido muramilo, componente de las paredes celulares bacterianas. Mepact® tiene como objetivo reducir el desarrollo y recurrencia de las metástasis al usar el MTP-PE como un ligando específico del receptor NOD2 que se encuentra en monocitos y en macrófagos.
Fue la primera inmunoterapia aprobada para el tratamiento de tumores óseos no metastásicos resecables de alto grado en niños, adolescentes y adultos jóvenes, posterior a una resección quirúrgica macroscópica completa. El uso de Mepact® ha demostrado prolongar la supervivencia de los pacientes sin que reaparezca la enfermedad y redujo el riesgo de muerte (EMA 2013).
Marqibo® * Aprobación retirada en 2022
Son liposomas LUVs de 130-150 nm de diámetro, se componen de SM y colesterol. Contienen sulfato de vincristina en la cavidad acuosa y se usan para tratar leucemia linfoblástica aguda cuando los pacientes no han respondido a terapias antileucémicas anteriores. Marqibo®, con un 95% de vincristina encapsulada, demostró aumentar el tiempo en circulación sistémica del fármaco, a pesar de no estar pegilado. Asimismo, su seguridad y eficacia fueron aceptables (Silverman, 2013). Marqibo® fue aprobado en 2012, bajo las regulaciones de aprobación acelerada de la FDA, a reserva de verificar su beneficio clínico en la etapa de post-comercialización, lo cual no se logró concretar debido a la dificultad de reclutamiento de pacientes, por lo que fue retirado en 2022 (FDA, 2022).
Onivyde™
Son liposomas Stealth® MLVs de 110 nm de diámetro, compuestos por HSPC, MPEG-DSPE y colesterol. Está indicado para el tratamiento de adenocarcinoma de páncreas metastásico que no respondió al tratamiento con gemcitabina. Se prepara con un gradiente de polialquilamida de alto pKa para facilitar la encapsulación de irinotecán. Así, Onivyde™ logra el 90% de encapsulación del fármaco, el cual se libera de manera prolongada. Onivyde™ se utiliza en combinación con leucovorina y fluorouracilo (Bulbake, 2017).
Liposomas en estudios clínicos
Los liposomas son los nanosistemas que mejor han enfrentado los desafíos de los estudios clínicos, en comparación con el resto de nanomateriales estudiados como posibles SLF.
Los ensayos clínicos son aquellos que se llevan a cabo en humanos para poner a prueba la eficacia de los fármacos y se dividen en 4 fases. En la fase I se administra la formulación a un grupo reducido de pacientes (5-15) a dosis bajas para conocer el potencial de la formulación frente a un padecimiento específico. En las fases II y III se incrementa el número de pacientes (25-100 y varios cientos, respectivamente), y la dosis administrada se aproxima a la ideal. En la fase IV, el número de pacientes aumenta a unos miles. En esta fase se estudia la seguridad del tratamiento a través del tiempo (American Cancer Society, 2020).
Son varios los sistemas liposomales que actualmente se encuentran en las fases clínicas I-III (Figura 6).

Fuente: Modificado de Bulbake (2017).
Figura 6 Diagrama de formulaciones liposomales fases clínicas I-III. Las flechas indican que hay flujo dinámico entre las fases.
Todos los liposomas en fases I y II contienen fármacos anticancerígenos, mientras que los ensayos de fase III incluyen, además de anticancerígenos, otros activos. A continuación, se describen brevemente los sistemas liposomales en fase III.
Arikace™
Son liposomas GUVs de 200-300 nm de diámetro, compuestos de DPPC y colesterol, conteniendo el fármaco amikacina. Su uso se contempla para tratar infecciones bacterianas al ser administrado por inhalación para liberar el fármaco de manera prolongada en los pulmones. Es la primera tecnología liposomal de administración pulmonar que ha llegado a evaluación clínica (Bulbake, 2017).
Stimuvax®
Es una vacuna liposomal tipo MLV, compuesta por DMPG, DPPC y colesterol. Se diseñó para tratar cánceres que expresan el antígeno mucina 1 asociado con tumores, como el carcinoma de pulmón de células no pequeñas. Desafortunadamente, en 2013 se suspendieron sus ensayos al no aumentar la supervivencia general de los pacientes (Kroemer, 2013).
T4N5
Es una loción liposomal MLV, compuesta por PC, PE, ácido oleico y hemisuccinato de colesterol (CHEMS). El sistema liposomal encapsula la endonucleasa V del bacteriófago T4, enzima de reparación del ADN. Se diseñó para tratar cáncer de piel y xeroderma pigmentoso (enfermedad genética caracterizada por una piel extremadamente sensible a la luz ultravioleta). T4N5 se administra por vía tópica para penetrar en las células dérmicas (Yarosh, 2001).
Liprostin™
Son liposomas MLVs conteniendo prostaglandina E-1 (PGE-1), un vasodilatador, inhibidor plaquetario, agente antinflamatorio y antitrombótico. Liprostin™ está dirigido a enfermedades vasculares, como reestenosis posterior a la angioplastia. La reestenosis se asocia con el bloqueo de los vasos sanguíneos en el corazón y las piernas luego de un cateterismo (Bulbake, 2017; Liprostin Group, 2020).
Lipoplatino™
Son liposomas LUVs de 110 nm de diámetro, compuestos de DPPG, SPC, MPEG-DSPE y colesterol. Contiene cisplatino y se encuentra en fase I para derrame pleural maligno; en fase II para cáncer de mama y cáncer gástrico. Asimismo, en fase II/III para cáncer de páncreas y ensayos de fase III para cáncer de pulmón de células no pequeñas (Fantini, 2011).
ThermoDox®
Son liposomas Stealth® termosensibles compuestos por DPPC, MSPC, DSPEPEG-2000 conteniendo doxorrubicina. En este caso, la liberación del fármaco será después de un ligero aumento de temperatura. ThermoDox® es el primer y único sistema termosensible que ha alcanzado las fases clínicas. Está dirigido a cáncer primario de hígado (carcinoma hepatocelular) y a cáncer de mama recurrente de la pared torácica. Se administra por vía intravenosa y el aumento de temperatura ocurre de manera localizada por medio de ablación por radiofrecuencia para generar hipertermia moderada (39.5-42 °C). El aumento de la temperatura modifica la permeabilidad de la bicapa, facilitando la liberación de doxorrubicina (Dou, 2017). ThermoDox® es un sistema muy novedoso cuyos resultados de pruebas in vivo fueron prometedores. Entró a fases clínicas de evaluación y los ensayos clínicos avanzaron rápidamente hasta que, en 2013, ya en fase III, se detuvieron, debido a la falta de evidencia sobre su eficacia (Liu, 2022).
El hecho de que Stimuvax® y ThermoDox® hayan fracasado en la fase III nos da una lección importante: los liposomas son sistemas prometedores pero impredecibles, reflejando así la necesidad de investigar a detalle la relación entre su tamaño, composición e interacción con las interfaces biológicas.
La investigación en liposomas
Para tener un panorama general sobre la investigación que ha predominado en cuanto al diseño y desarrollo de tecnologías liposomales, analizamos un conjunto de 4,340 publicaciones sobre liposomas como SLF, utilizando herramientas de la ciencia de datos.
Para ello, se utilizó la base de datos Scopus, de la cual se obtuvieron las investigaciones publicadas entre 1975-2022, obtenidas bajo los siguientes criterios de búsqueda:
Palabras clave: se seleccionaron artículos que tuvieran las palabras liposome, drug y delivery haciendo uso del código booleano AND: liposome AND drug AND delivery.
Tipo de documento: se seleccionaron únicamente artículos de investigación (excluyendo revisiones, capítulos de libro, memorias de congresos, comentarios, etcétera).
Idioma: se incluyeron solamente los artículos publicados en idioma inglés.
De esta manera se obtuvo un conjunto de 4,340 artículos, cuyos abstracts se descargaron para su posterior análisis, el cual se llevó a cabo siguiendo la metodología previamente desarrollada dentro de nuestro grupo de investigación, basado en ciencia de redes para detección de comunidades (Figura 7) (Rincón, 2021). El propósito de la minería de texto fue caracterizar el universo de 4,340 documentos e identificar patrones que nos permitieran mostrar el panorama de la investigación en este campo. La describimos brevemente a continuación.

Fuente: Modificado de Bulbake (2017).
Figura 7 Proceso de la minería de texto en artículos científicos sobre liposomas como sistemas de liberación de fármacos.
Pre-procesamiento: se realizó empleando la librería Natural Language ToolKit (NLTK) de Python 3.0 (McKinney, 2010). Esta etapa consistió en eliminar aquellas palabras “ruido” que pudieran interferir con el análisis; todas las palabras se transformaron a minúsculas; se removieron todos los símbolos de puntuación; y se eliminaron aquellas palabras que no aportan gran significado a las oraciones, como a, the, an, on, this, is, for, large, numerous, used, without, entre otras.
Minería: los datos pre-procesados se analizaron a través del mayor componente conectado (LCC), que detecta las conexiones dentro del conjunto de datos para así formar una red. Posteriormente, se aplicó el algoritmo de Louvain para detectar las comunidades dentro de la red con mayor densidad, es decir, grupos de artículos con contenido semántico similar. El análisis se llevó a cabo utilizando diversas herramientas de librerías en Python.
Interpretación: la detección de comunidades nos permitió conocer la frecuencia relativa de las palabras en cada una de dichas comunidades. Así, analizando las 3 palabras más frecuentes en cada comunidad, logramos identificar patrones dentro del universo de documentos.
Resultados
La Figura 8 muestra la suma acumulada de publicaciones de liposomas como SLF desde 1975 hasta 2022. Se observa que a mediados de los años 90, el interés por estas estructuras comenzó a emerger, y a partir del año 2000 hay un crecimiento acelerado en su investigación que se mantiene hasta la actualidad. De hecho, de 1975 a 1999 hay solamente 515 publicaciones, mientras que de 2000 a 2022, hay 3,825 artículos. Lo anterior refleja el punto de inflexión generado a partir de la aprobación clínica de doxorrubicina liposomal (Doxil®) y del inicio de los ensayos clínicos de ThermoDox®, dos parteaguas en la historia de liposomas como SLF.

Fuente: Elaboración de los autores.
Figura 8 Suma acumulada de publicaciones de liposomas como SLF, 1975-2022.
Debido a que la mayoría de artículos se han publicado después del año 2000, el análisis de detección de comunidades se realizó solamente para el conjunto de 3,825 artículos. Los resultados muestran que los artículos se agruparon en 6 comunidades. La red de comunidades, el tamaño de cada comunidad (la cantidad de artículos en cada una de ellas), así como las 3 palabras más frecuentes asociadas a cada grupo se muestran en la Figura 9.
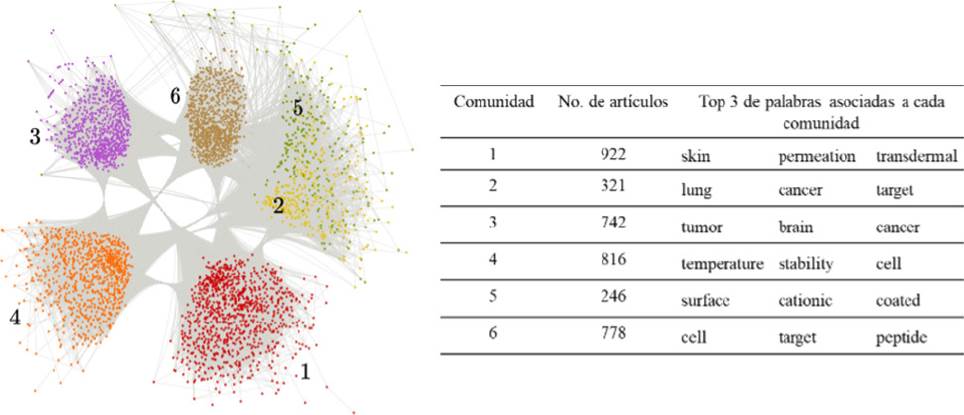
Fuente: Elaboración de los autores.
Figura 9 Representación gráfica de la red formada por las publicaciones de liposomas como SLF del 2000-2022, así como las palabras representativas de cada comunidad.
Resulta muy interesante que la comunidad 1 es la más grande y hace referencia a liposomas como sistemas de liberación tópica y transdérmica. Dentro de las estrategias utilizadas para promover la penetración de fármacos a través de la piel, se encuentran las nano y micro vesículas, de las cuales los liposomas han jugado un rol importante. Aunque los liposomas convencio nales no logran llegar a las capas más profundas de la piel, es posible que por medio de la modulación de la flexibilidad de la bicapa lipídica, su lamelaridad, tamaño y la carga superficial, se dé lugar a sistemas con una eficiencia similar a la de una inyección subcutánea. Así, liposomas ultradeformables menores a 150 nm son capaces de penetrar la piel y liberar el fármaco en sus capas profundas. Los liposomas catiónicos flexibles pueden acumularse, por medio de interacciones electrostáticas, en los folículos capilares, desde donde pueden difundir más fácilmente. Los fosfolípidos de la piel, que se encuentran cargados negativamente, pueden interactuar con los liposomas catiónicos, favoreciendo su penetración hasta capas profundas de la piel. Cabe destacar que los liposomas también se han considerado como potenciales modelos de membranas para estudiar la permeación en piel (El Maghraby, 2008).
Después del cáncer de mama, el cáncer de pulmón es el más común a nivel mundial, y en 2020 el que causó más muertes (WHO, 2022). Con la finalidad de mejorar las estrategias terapéuticas, se ha explorado ampliamente el uso de SLF, en particular, los liposomas, que han sido los más estudiados para tal fin. De hecho, son alrededor de 12 formulaciones liposomales las que se encuentran en ensayos clínicos, incluyendo aquellas que contienen doxorrubicina, cisplatino, paclitaxel, irinotecan y lurtotecan. Destaca el caso de la combinación de cisplatino liposomal en combinación con paclitaxel, así como el de la vacuna liposomal conteniendo tecemotida, que han demostrado ocasionar menos efectos adversos y tener resultados prometedores (Canão, 2022; Wang, 2020). La comunidad 2 resalta la importancia de los lipomas para este padecimiento.
La comunidad 3 agrupó los artículos en función de las palabras tumor, cerebro y cáncer. De todas las nanomedicinas, los liposomas han sido los más investigados para tratar los tumores cancerosos que se desarrollan en el cerebro. Si bien los liposomas convencionales no pueden atravesar la barrera hematoencefálica (BHE) asociada con tumores cerebrales, la modificación de la superficie de los liposomas con algunos ligandos (anticuerpos, péptidos, aptámeros, entre otros) para atravesar dichas barreras, ha mostrado resultados alentadores (Mojarad, 2021). Incluso, ya hay algunos prototipos de liposomas funcionalizados en ensayos clínicos fase I para malignidades cerebrales. Por ejemplo, 2B3-101 (G-technology™), un liposoma pegilado de ~95 nm, cargado con doxorrubicina, funcionalizado con glutatión en estado reducido (GSH), para que entregue su carga en el cerebro vía transportadores de GSH sin alterar la integridad de la BHE. Por otro lado, está 2B3-101, que ha llegado a fases clínicas I/IIa para pacientes con glioma recurrente y cáncer de mama con metástasis en cerebro. Otro caso es C225-ILs-Dox, un inmunoliposoma Stealth® conteniendo doxorrubicina. Esta nanovesícula está modificada en sus superficies por fragmentos Fab de cetuximab y está en estudios clínicos de fase I para gliomas. MM-398 es un liposoma convencional de ~110 nm conteniendo irinotecan que se encuentra en fase clínica I para glioma. Se ha postulado que el carácter altamente lipofílico de MM-398 le permite atravesar la BHE (Mojarad, 2021; Shaw, 2022).
Lo anterior evidencia la importancia de la modificación de las propiedades de superficie de los liposomas, las cuales determinan su comportamiento biológico y su efectividad como SLF. Más allá de introducir cargas positivas o negativas a la superficie del liposoma, la incorporación de moléculas para orientación activa (anticuerpos, péptidos, aptámeros, azúcares, proteínas) sigue siendo un área de investigación con grandes expectativas. Los liposomas también pueden estar recubiertos con materiales poliméricos para aumentar su estabilidad coloidal, evitar el reconocimiento por RES, favorecer su farmacocinética e impartir algunas otras propiedades biológicas. Además de PEG, los recubrimientos más comunes son: quitosano, polisacáridos, poli-L-lisina, ácido hialurónico y polielectrolitos (Dymec, 2022; Noble, 2014; Torchilin, 2008; Keith, 2022; Kristensen, 2014; Dass, 2006). Los liposomas pueden estar recubiertos por materiales sensibles a algún estímulo físico o químico que detone la liberación del fármaco (Lee, 2017), que junto con los liposomas biomiméticos (recubiertos por membranas celulares) están comenzando a cobrar enorme interés (Pratygyan, 2020). La importancia de las características de la superficie de los liposomas se ve reflejada en las comunidades 5 y 6.
Por último, la comunidad 4 indica que 816 artículos se agruparon en función de la palabra temperatura. Esta palabra puede estar relacionada con aspectos de estabilidad coloidal e integridad del liposoma a diferentes temperaturas, las cuales dependen de la Tc de los fosfolípidos que constituyen la vesícula. Si se conocen bien las Tc, se puede modular la permeabilidad de la bicapa y por lo tanto controlar la liberación del fármaco. Bajo esta premisa, Needham y colaboradores diseñaron en el año 2000 un liposoma con doxorrubicina cuya liberación rápida era desencadenada por un aumento moderado en la temperatura (~42 ºC). Esta formulación la conocemos actualmente como ThermoDox® (Ver Sección ThermoDox®), que, a partir de la eficacia mostrada en estudios preclínicos, se trasladó rápidamente a ensayos clínicos en 2006. A pesar de que los ensayos clínicos se detuvieron en 2013, ThermoDox® ha sido un parteaguas en el diseño de liposomas termosensibles, reflejado en un continuo incremento en el número de publicaciones desde 2006 (Dou, 2017).
Si bien la temperatura ha sido el estímulo físico más explorado para controlar la liberación de fármacos contenidos en liposomas, también se ha investigado ampliamente el control de la liberación por medio de luz (UV e infrarrojo cercano), campos magnéticos y ultrasonido (Lee 2017; Ashrafizadeh 2022). Asimismo, la liberación mediada por cambios en el pH, en presencia de algunas enzimas o en respuesta a los procesos de óxido-reducción extra e intracelular. Así, en las últimas dos décadas, los liposomas pasaron de ser simples vesículas anfifílicas, a nanosistemas “inteligentes” (estímulo-sensibles) con gran potencial de éxito.
Tendencias en investigación
La ciencias de los materiales junto con la nanotecnología han permitido el diseño y estudio de formulaciones liposomales inteligentes y multifuncionales. Por ejemplo, liposomas que mejoren las técnicas de diagnóstico introducien do agentes de contraste para resonancia magnética nuclear (gadoteridol) y tomografía computarizada (iohexol). O bien, agentes que permitan rastrear al liposoma. Si estas vesículas llevan además una carga de fármaco, se tendrá una plataforma que entregue el fármaco y haga diagnóstico de manera simultánea (es decir, un teranóstico) (Aryasomayajula, 2017).
A pesar de tener las bases y la intención de desarrollar sistemas exitosos, los liposomas son impredecibles y los desafíos por superar no son pocos. Por ejemplo, su inestabilidad fisicoquímica originada por procesos de oxidación e hidrólisis pueden provocar efectos secundarios no deseados y reducir su eficacia. Su inestabilidad coloidal en medios fisiológicos, formación de la corona de proteínas e interacciones con el sistema inmune pueden provocar fallas en la liberación del fármaco (Nakhaei, 2021). Por ello, a pesar de las ventajas que podrían ofrecer los liposomas responsivos a estímulos y las grandes expectativas que generan, en particular en terapias contra el cáncer, existen todavía numerosos retos que deben ser cuidadosamente abordados para su adecuado progreso a la clínica. La eficacia observada en modelos in vitro/in vivo deberá correlacionarse con aquella observada en estudios clínicos. La toxicidad de estos liposomas inteligentes también se debe estudiar a detalle. Por ello, la investigación en liposomas convencionales sigue siendo de enorme relevancia, pues, aunque no se consideren “inteligentes”, son y seguirán siendo una fuente de generación de valioso conocimiento para el diseño y desarrollo racional de nuevos liposomas, para cáncer y otros padecimientos; así como para el entendimiento de las barreras biológicas a las que se enfrentan las nanomedicinas. En otras palabras, para que las tecnologías liposomales en uso clínico sean cada vez más frecuentes y beneficien la salud de la población.
Conclusiones
Las propiedades únicas de los liposomas los han convertido en los nanosistemas más utilizados para la entrega de una amplia gama de agentes terapéuticos y de diagnóstico con diferentes propiedades fisicoquímicas. Su composición puede modificarse fácilmente para brindar propiedades específicas a la bicapa lipídica. De esta manera, se puede prolongar el tiempo en circulación sistémica del fármaco y superar limitantes asociadas con dicho fármaco como inestabilidad e insolubilidad acuosa. Al ser de escala nanométrica, se puede promover su acumulación en algunos tejidos tumorales por el efecto EPR. Cuando están funcionalizados en su superficie con ligandos de reconocimiento, se puede favorecer su acumulación únicamente en el tejido tumoral, reduciendo así los efectos adversos de los quimioterapéuticos que encapsulan. Los liposomas son las primeras nanomedicinas que han alcanzado el uso clínico y han cobrado particular relevancia en terapias contra el cáncer. Además, las tecnologías liposomales comienzan a destacar como nanomedicinas para tratar otros padecimientos. Los liposomas han demostrado una gran capacidad para superar algunas limitaciones de las terapias convencionales y, sin duda, en los años por venir serán las nanomedicinas las que seguirán estando a la cabeza en su traslado a la clínica.
Abreviaturas:
Fosfatidilcolina (PC)
Fosfatidiletanolamina (PE)
Fosfatidilcolina de soya (SPC)
Fosfatidilcolina de soya hidrogenada (HSPC)
Diestearoilfosfatidilcolina (DSPC)
Fosfatidilcolina de huevo (EPC)
1-palmitoil-2-oleoil-fosfatidilcolina (POPC)
Dipalmitoilfosfatidilcolina (DPPC)
Dioleoilfosfatidilcolina (DOPC)
Diestearoilfosfatidilglicerol (DSPG)
Dipalmitoilfosfatidilglicerol (DPPG)
Dioleoilfosfatidilserina (DOPS)
Dipalmitoilfosfatidiletanolamina (DPPE)
Esfingomielina (SM)
Miristoilestearoil fosfatidilcolina (MSPC)
Dimiristoilfosfatidilglicerol (DMPG)
N-(carbamil-metoxipolietilenglicol 2000)-1,2-diestearoil-sn-glicero-3-fosfoetanolamina (MPEG2000-DSPE)
Food and Drug Administration (FDA)
European Medicines Agency (EMA),
Tecnología liposomal (Tec. Lip.)
Año de aprobación (año)
Administración (Adm.)
Intramuscular (IM)
Intravenosa (IV)
Intratecal (IT)
Inhalación (INH)
Fármaco descontinuado (*)
Enhanced Permeability and Retention Effect (EPR).











 nueva página del texto (beta)
nueva página del texto (beta)