Introducción
A medida que se han creado los materiales plásticos han surgido problemas con respecto a su uso, en la actualidad hay más de 5,300 tipos de polímeros sintéticos comercializados (Wagner y Lambert, 2018), muchos no son biodegradables, por lo tanto, aportan un volumen importante a la basura que se genera. Los océanos son considerados el ecosistema global más afectado por los desechos plásticos.1 Un estudio de 2018 predijo que al menos 79 mil toneladas métricas de plástico oceánico están flotando dentro de un área de 1.6 millones de km2. También se ha demostrado la acumulación de estos residuos en las profundidades del mar, así como su ingesta por animales de la zona bentónica, asumiendo un comportamiento de sedimentación en las partículas plásticas. La sedimentación es posible si la densidad de los plásticos es superior a la del agua de mar (que es el caso de aproximadamente un tercio de todos los polímeros producidos), cuanto más pequeñas son las partículas, más rápido pueden alcanzar su densidad crítica de hundimiento. La degradación de los plásticos macroscópicos en piezas más pequeñas se produce típicamente por una combinación de procesos químicos y físicos que, en particular, pueden implicar la degradación foto, térmica o biológica, oxidación, degradación hidrolítica y desintegración mecánica, y provocan la ruptura de enlaces químicos en los polímeros sintéticos, afectando no solo a los polímeros en sí, sino también a los aditivos implementados dentro de los materiales, lo cual resulta en cambios en su estructura química y propiedades físicas (Lehner et al., 2019). En general, los procesos de degradación ambiental implican la fragmentación y/o transformación de plásticos en microplásticos, nanoplásticos (que serán definidos en la siguiente sección), después, en moléculas orgánicas no poliméricas y, finalmente, la transformación en otros compuestos (Wagner y Lambert, 2018), (Figura 1). Es evidente que la contaminación de plásticos en los océanos se ha convertido en un problema medioambiental alarmante, las primeras partículas pequeñas de plástico (< 5 mm) se detectaron en aguas abiertas en la década de los años 70 del siglo XX (Colton, Knapp y Burns, 1974), pero su formación en el medio ambiente está aumentando, y con ello la posible transferencia a los seres humanos a través de la cadena alimentaria, esto podría representar un desafío importante para la sociedad en materia de salud.

Fuente: Elaboración de los autores (imagen creada en BioRender.com).
Figura 1 Degradación de plásticos y su transformación en micro y nanoplásticos.
Micro y nanoplásticos: definición, tipos, y la preocupación emergente
Se cree que cuando se encuentran microplásticos (MPLs) en el medio ambiente, hay más nanoplásticos (NPLs) no detectados y, en efecto, la actual “exposición a microplásticos” es una mezcla de exposiciones a micro y nanoplásticos en conjunto. De tal forma, el tema engloba ambos términos: “microplásticos” se refiere comúnmente a partículas de plástico cuyo diámetro más largo es < 5 mm y es la definición utilizada por la mayoría de los autores, porque este tamaño puede incluir una gama de partículas pequeñas que los organismos pueden ingerir fácilmente, pero, se ha sugerido que el término se redefina como elementos < 1 mm para incluir solo partículas en el rango de tamaño micrométrico (Wagner y Lambert, 2018); Lambert et al., en 2014, describieron los macroplásticos como > 5 mm, los mesoplásticos como > 1 mm a ≤ 5 mm, los microplásticos como > 100 nm a ≤ 1 mm y los nanoplásticos ≤ 100 nm (Lambert, Sinclair y Boxall, 2014) (Figura 2). Sin embargo, aún no se ha establecido una definición común para el término “nanoplásticos”, si bien los nanomateriales de ingeniería se definen por tener al menos una dimensión en el rango de tamaño de 1 a 100 nm (Official Journal of the European Union, 2011), algunos autores los definen como partículas < 1000 nm y otros como < 100 nm (Koelmans, Besseling y Shim, 2015), (Browne, Galloway y Thompson, 2007). Generalmente, los MNPLs se dividen en categorías de MNPLs primarios o secundarios. Los primarios se fabrican como tales y se utilizan como gránulos de resina para producir materiales más grandes o directamente en productos cosméticos como exfoliantes faciales y pastas dentales o en chorreado abrasivo. En comparación con este uso deliberado, los MNPLs secundarios se forman a partir de la degradación y desintegración de desechos plásticos más grandes (Wagner y Lambert, 2018), por lo cual, algunos de ellos pueden ser considerados como contaminantes principalmente de los cuerpos de agua y de los alimentos. Es importante tener una comprensión clara de la interacción de los nanoplásticos con el medio ambiente y los organismos vivos, para poder evaluar los posibles riesgos a la salud. Es sabido que las nanopartículas exhiben generalmente propiedades químicas y físicas diferentes a las de los tamaños macroscópicos del mismo material (Murty et al., 2013), por ende, sus interacciones con los organismos vivos también pueden diferir mucho, e, incluso, los nanoplásticos pueden reaccionar de manera diferente a sus contrapartes de tamaño micronizado. Con base en esto, el tema de las interacciones de NPLs con el medio ambiente y los organismos son un área de interés emergente en la nanotoxicología. La investigación en torno a los efectos del plástico se ha centrado principalmente en los sistemas acuáticos y se dispone de datos limitados sobre el impacto de los nanoplásticos en la salud humana, se advierte que su formación en el medio ambiente está aumentando y, en consecuencia, lo hace la posible transferencia a los seres humanos (Science Advisory Board to the Commissioner of the, and New Jersey Department of Environmental Protection, 2015).
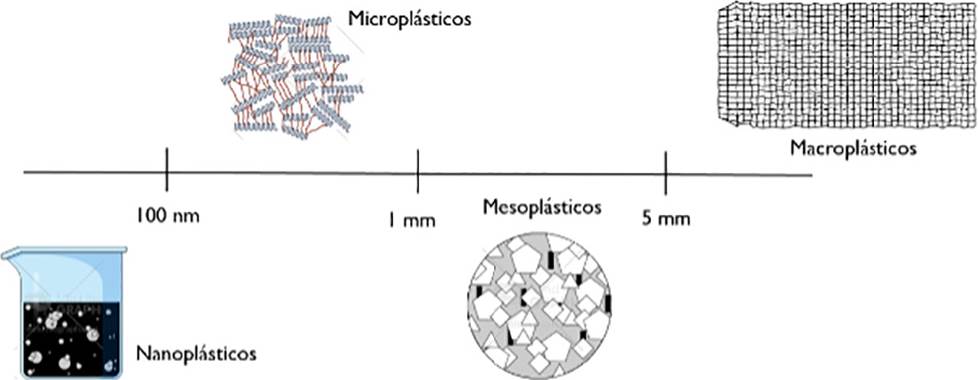
Fuente: Elaboración de los autores (imagen creada en Mindthegraph.com).
Figura 2 Descripción del rango de tamaño de partículas plásticas.
Ingestión: vía de exposición más importante a los nanoplásticos
Los nanomateriales pueden ingresar al cuerpo a través de seis rutas: intravenosa, dérmica, subcutánea, por inhalación, intraperitoneal y oral (Fischer y Chan, 2007). En el caso particular de la exposición a los nanoplásticos destacan, mayormente, la vía inhalatoria (o aérea) y la vía oral (o ingestión). Sin embargo, ante el conocimiento actual, la ingestión de partículas nanoplásticas representa la principal vía de entrada. Los MNPLs afectan un gran número de organismos, incluidos los consumidores primarios de la cadena alimentaria como el zooplancton, los bivalvos y los peces pequeños (Cole et al., 2013; J. Li et al., 2015). Varios estudios experimentales, al utilizar modelos de nanopartículas de poliestireno, han ubicado a las dafnias, mejillones, zooplancton, algas y varios grupos de animales como filtradores que pueden ingerir activamente partículas nanoplásticas o adsorberlas en sus superficies, habiéndose demostrado su presencia y acumulación en su tracto gastrointestinal, e incluso también en aves (Pitt et al., 2018; Cole y Galloway, 2015; Li, Tse y Fok, 2016), revelando que, a diferencia de las partículas microplásticas, los NPLs pueden traspasar la barrera gastrointestinal en los organismos acuáticos, y bioacumularse en el tejido subyacente (Lehner et al., 2019; Cole y Galloway, 2015) Se ha demostrado la acumulación y transferencia trófica de nanoplásticos dentro de especies de pescados y mariscos como camarones y bivalvos, pero también se han encontrado partículas microplásticas en otros alimentos como miel, cerveza, sal y azúcar, fortaleciendo la posibilidad de que los MNPLs se acumulen en la cadena alimentaria, resultando en exposición humana (Lehner et al., 2019) (Figura 3). Estudios recientes han dado a conocer la existencia de microplásticos en agua del grifo y agua embotellada, así como en agua potable de fuentes subterráneas (Kosuth, Mason y Wattenberg, 2018). Los fragmentos de fibras textiles con dimensiones en el rango micrométrico que son desprendidos de la ropa durante el lavado no son eliminados por los sistemas de filtrado de las plantas de tratamiento de aguas residuales y, por lo tanto, terminan en el medio ambiente (Browne et al., 2011). Incluso, los productos para el cuidado personal, como las pastas dentales y los exfoliantes faciales, a menudo contienen partículas microplásticas a base de polietileno que luego terminan en las aguas residuales (Fendall y Sewell, 2009), estos, conjuntamente, debido a diferentes factores abióticos, pueden transformarse en nanoplásticos. Además, la salud humana también puede verse afectada debido a la transferencia de los aditivos químicos del propio material plástico. En el humano, el tracto gastrointestinal (GI) tiene una superficie de aproximadamente 200 m2 (Lehner et al., 2019), representando el mayor lugar de exposición para la absorción de partículas plásticas, pues el epitelio intestinal es la mayor superficie del cuerpo en contacto con el medio exterior, que inclusive es mayor que la piel. La pregunta es ¿qué sucede dentro del órgano gastrointestinal en los seres humanos en el caso de los nanoplásticos? La información en torno a la interacción nanoplástica y el tejido intestinal proviene en su mayor parte de estudios in vitro con cultivos de células intestinales, en particular en las células epiteliales del colon. Diferentes estudios in vitro han investigado la internalización y translocación de nanopartículas de poliestireno en monocultivos de células intestinales o, incluso, en modelos complejos de células intestinales humanas. Estos trabajos utilizan MNPLs como modelo, no provieniente de muestras ambientales, sino que son sintetizados en laboratorio.
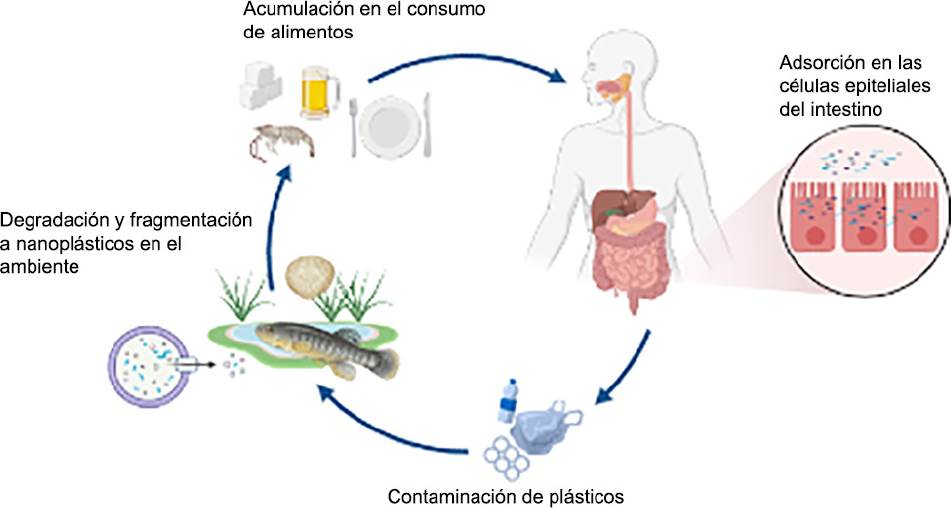
Fuente: Elaboración de los autores (imagen creada en BioRender.com).
Figura 3 Transferencia trófica de micro y nanoplásticos. La ingestión es la vía de exposición más común e importante de los NPLs.
Implicaciones biológicas de los nanoplásticos en el ser humano
Desde la superficie de la capa mucosa, el tejido epitelial intestinal posee un revestimiento de glándulas tubulares en el que se extienden criptas profundas, llamadas criptas de Lieberkuhn, y se caracterizan por la presencia de células columnares cilíndricas, como los colonocitos, enterocitos de absorción, células caliciformes, además de células madre y algunas células enteroendócrinas dispersas (Kierszenbaum y Tres, 2012; Junqueira y Carneiro, 2015). Las células caliciformes participan en el transporte de iones y agua, mientras que los enterocitos son células especializadas en la absorción de nutrientes. Los enterocitos poseen dominios celulares diferenciados, uno apical y otro basolateral (Megías, Molist y Pomba, 2019) (Figura 4), en su parte apical presentan microvellosidades cortas e irregulares, las cuales están densamente dispuestas formando una estructura denominada como ribete en cepillo, que aumenta la superficie apical de la célula hasta 100 veces, además, se encuentran los transportadores necesarios para la incorporación de moléculas que resultan de la digestión, mientras que en su parte basolateral se encuentran los transportadores necesarios para sacar del enterocito estas moléculas incorporadas que tendrán que pasar al torrente sanguíneo (Megías, Molist y Pombal, 2019).

Fuente: Elaboración de los autores (imagen creada en BioRender.com).
Figura 4 Tejido epitelial del colon (colonocitos).
En términos de evaluación de toxicidad, existe la necesidad de comprender las vías moleculares y celulares, y la cinética de los mecanismos de absorción, distribución, metabolismo y excreción que pudieran ser exclusivos de los nanoplásticos; estos, al ingresar al intestino, pueden presentar diferentes escenarios: la captación celular de nanopartículas depende en gran manera de sus interacciones con componentes biológicos, como proteínas, fosfolípidos o carbohidratos, debido a su tamaño, carga y química de superficie. El contacto previo con los fluidos intestinales puede causar la aglomeración de las partículas, y después ser excretadas, esto puede influir en la absorción en comparación con las partículas individuales, pero la reducción del tamaño junto con la naturaleza hidrofóbica de los nanoplásticos aumenta su capacidad para cruzar la barrera intestinal y las barreras endoteliales (Teles et al., 2020). Las partículas pueden ser captadas y absorbidas en los enterocitos, o por distintas células epiteliales y alcanzar así el lado basolateral, esto se produce principalmente por endocitosis. Una vez dentro de la célula, las nanopartículas se almacenan en el interior de vesículas y mitocondrias, y son capaces de ejercer respuestas celulares (Nowack y Bucheli, 2007), como estrés oxidativo, actividad antioxidante y citotoxicidad (Oberdörster et al., 2006). La captación de partículas en las células sin un transporte posterior al torrente sanguíneo no conduce a una distribución sistémica; sin embargo, también es posible que algunas partículas atraviesen el epitelio a través de la ruta paracelular, que es el paso mediante espacios entre las células epiteliales intestinales, pues el intestino puede presentar fugas en la monocapa de células, principalmente en la parte apical de las vellosidades, y al utilizar estos espacios, es posible el cruce de la barrera por partículas mucho más grandes que los límites de absorción de las células, y así, transportarse a los vasos sanguíneos (Paul et al, 2020) (Figura 5). Por otro lado, también se puede esperar que algunas partículas no crucen al torrente sanguíneo, sino que permanezcan dentro de las células intestinales, y es probable que estas partículas se liberen en el lumen intestinal al final del ciclo de vida de la célula, esto es, después de alrededor de 72 h (Paul et al., 2020). En principio, parece posible la captación y el transporte de partículas de hasta un tamaño máximo de 5 a 10 μm en las células intestinales. Una captación intracelular de partículas más grandes sería incompatible con el tamaño de las células epiteliales intestinales, que son de aproximadamente 10 μm. La EFSA está considerando que los microplásticos tienen una biodisponibilidad muy limitada, de menos del 0.3%, y que solo las partículas de plástico de tamaño inferior a 150 μm podrían, en principio, atravesar el epitelio intestinal (Paul et al., 2020), las cuales, ocasionalmente son encontradas en los tejidos, pero es probable que no reaccionen y se depositen sin estar biodisponibles sistémicamente, aunque al parecer, solo las partículas mucho más pequeñas de hasta 1.5 μm podrían distribuirse sistémicamente. Por lo tanto, es probable que se produzca una distribución sistémica de partículas de plástico que se encuentran en el rango de la nanoescala (Jani et al., 1990).
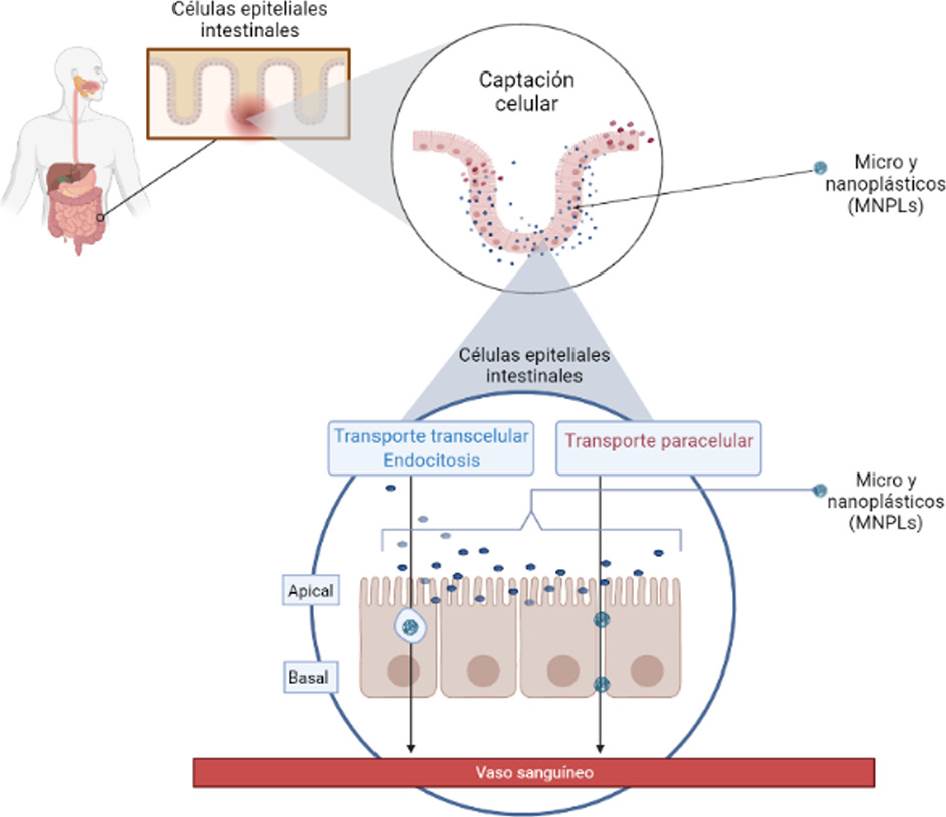
Fuente: Elaboración de los autores (imagen creada en BioRender.com).
Figura 5 Captación celular de micro y nanoplásticos en células de colon.
Evaluación in vitro del efecto de los micro y nanoplásticos en líneas celulares de colon
Walczak et al., en 2014, evaluaron tres modelos de células intestinales in vitro, y observaron que la carga superficial de nanopartículas de poliestireno (PSNPs) afectó su internalización celular, sin embargo, la química de la superficie pareció ser más importante, al tener, dos tipos de NPs de 50 nm con carga negativa, una diferencia de más de 30 veces en la translocación, subsecuentemente, afirmaron que la diferencia en la cantidad de proteína adsorbida en la superficie de las PS-NPs podría explicar la diferencia en su internalización, sin embargo, al parecer, la cantidad de proteína en la corona proteica no es el único parámetro que influye en su translocación a través de la barrera intestinal, pues las PS-NPs de 50 y 100 nm de diámetro con carga positiva tenían muchas menos proteínas adsorbidas pero se translocaron en mayor medida que las PS-NPs de carga negativa. Concluyeron que, para comparar la translocación relativa de diferentes NPs es suficiente con usar un modelo intestinal. Sin embargo, para calcular los valores de translocación absolutos se requieren experimentos in vivo (Walczak et al., 2014).
Con un enfoque más complejo Walczak et al., en 2015, sometieron PSNPs de 50 nm de cargas positivas (funcionalizadas con aminas), negativas (con ácido carboxílico) y neutrales, en dos formas: puras y digeridas, en un modelo de digestión gastrointestinal humana in vitro, y evaluaron el efecto sobre la corona de proteínas de las PS-NPs y su posterior translocación en un co-cultivo de células Caco-2 y HT29-MTX. Las PS-NPs neutrales, en su forma original y digerida, no afectaron la viabilidad celular hasta la concentración de 250 μg/mL. Las PS-NPs cargadas negativamente en forma prístina no afectaron la viabilidad celular sino hasta la concentración de 125 μg/mL, sin embargo, a una concentración de 250 μg/mL la viabilidad disminuyó en un 80%, y en la forma digerida, no afectaron la viabilidad celular sino hasta la concentración de 250 μg/mL. Pero, las PS-NPs cargadas positivamente, prístinas y digeridas, mostraron una citotoxicidad significativa, en concentraciones de 25 y 50 μg/mL, y ambas formas redujeron la viabilidad celular al 7% en la concentración de 250 μg/mL. La adsorción de proteínas en superficies de NPs da como resultado la formación de una “corona de proteínas” alrededor de las partículas, y se reportó que, tras la digestión in vitro, todas las PS-NPs tenían menos proteína adsorbida en diferentes cantidades en comparación con sus equivalentes prístinos, y que esto favoreció su translocación. Esto sugiere una correlación directa entre estos dos parámetros. Por otro lado, la diferencia en la translocación entre diferentes PS-NPs prístinas y digeridas no se correlacionó directamente con la diferencia en la cantidad de proteína adsorbida. La composición principal de la corona de proteínas de las PS-NPs prístinas era independiente de la funcionalización, tal como Walczak et al., en 2014, lo habían mostrado antes. Las PS-NPs generalmente se consideran estables y no degradables, y en efecto, las PS-NPs no se degradaron tras la digestión in vitro (Walczak et al., 2015).
En 2018, Inkielewicz-Stepniak et al. examinaron la interacción de PS-NPs de ~60 nm, modificadas con: amina, con carboxilo, y sin modificar, durante 72 h, con la mucina gastrointestinal y su efecto en las líneas celulares; CaCo-2, HT-29 y LS174T, con concentraciones crecientes de 20, 50 y 100 μg/mL de PSNPs. Encontraron una reducción en la viabilidad celular dependiente de la concentración tras la incubación con las PS-NPs funcionalizadas con -NH2 (carga positiva). Sin embargo, ni las PS-NPs funcionalizadas con -COOH ni las no modificadas, ejercieron ningún efecto sobre la viabilidad celular. Además, solo las PS-NPs con carga positiva, a 100 μg/mL, fueron capaces de inducir la muerte celular por apoptosis en las tres líneas celulares, independientemente de su capacidad para producir musina (Inkielewicz-Stepniak et al., 2018). Respecto a la interacción entre las PS-NPs y la mucina, se observó que el tipo de grupos funcionales presentes en la superficie de las NPs juega un papel importante como protector de la capa de mucina. Por ejemplo, las PS-NPs no funcionalizadas tienen un número significativo de grupos -SO3 expuestos en la superficie y, por lo tanto, un valor de potencial zeta negativo al igual que las PS-NPs modificadas con -COOH, mientras que las PS-NPs modificadas con -NH2 tienen un valor de potencial zeta positivo(Inkielewicz-Stepniak et al., 2018), planteando la hipótesis de que estas últimas pueden provocar la interrupción de las interacciones electrostáticas y los enlaces de hidrógeno debido a la competencia entre los grupos cargados de las PS-NPs y la mucina, lo cual conduce a la desestabilización de la estructura de la mucina, aumentando el tamaño de los agregados, ocasionando el atrapamiento de las NPs (Inkielewicz-Stepniak et al., 2018).
Wu et al., en 2019, tras exponer micropartículas de poliestireno (PS-MPs) de 0.1 y 5 μm en células Caco-2, después de 12 h, localizaron las micropartículas alrededor del núcleo celular, y su superposición con los lisosomas, pero, el nivel de las PS-MPs de 5 μm que entró en las células fue inferior a las de 0.1 μm, mostrando una actividad más potente en estos últimos. Sin embargo, ninguno de los tamaños de las PS-MPs indujo cambios significativos en la integridad y fluidez de la membrana en las células Caco-2. La inhibición de la actividad del transportador ABC de la membrana plasmática fue el segundo efecto tóxico de las PS-MPs observado en este estudio. Los transportadores ABC son ATPasas asociadas a la membrana que desempeñan funciones importantes en la salida celular de sustratos xenobióticos y el sistema de defensa celular. Estudios anteriores de Wu y col. han demostrado que los nanomateriales cero, uni y bidimensionales pueden bloquear la actividad del transportador ABC a través de la inhibición competitiva de sustratos o el daño de la membrana plasmática, por esta razón se plantea que las PS-MPs actúan como quimiosensibilizadores para incrementar los efectos adversos de los sustratos xenobióticos en la función de los transportadores ABC. Sin embargo, los efectos y los mecanismos subyacentes no se han reportado hasta la fecha. El daño de la membrana podría no explicar la inhibición de la actividad del transportador ABC causada por ambos tamaños de PS-MPs, ya que este estudio mostró que los inhibidores de los transportadores ABC, PSC833 y MK571, aumentaron la acumulación de PS-MP de 0.1 μm en las células Caco-2, lo cual indica que las PS-MPs de 0.1 μm podrían actuar como sustratos de los transportadores ABC. Por tanto, la inhibición competitiva podría explicar la reducción detectada en las actividades del transportador ABC. Las PS-MPs expuestas no alteraron significativamente la viabilidad celular a medida que la concentración de exposición aumentó hasta 200 μg/mL, Sin embargo, sí aumentó significativamente la generación de ROS intracelulares. En particular, las PS-MPs de 0.1 y 5 μm a la concentración de ≥ 20 μg/mL y ≥ 1 μg/mL, respectivamente, indicaron la aparición de una despolarización mitocondrial. Los resultados de citotoxicidad revelaron que las PS-MPs de 0.1 μm causaron menos citotoxicidad en comparación con las de 5 μm (Wu et al., 2019).
En 2019, Cortes et al. expusieron células de colon Caco-2 durante 24 y 48 h a un rango de concentraciones de 0 a 200 μg mL−1 de nanopartículas de poliestireno de forma redonda de aproximadamente 50 nm de diámetro. Las PSNPs no ejercieron ningún tipo de citotoxicidad, al menos hasta la concentración de 150 μg mL-1, la concentración más alta (200 μg mL-1) indujo un efecto citotóxico leve, alcanzando valores de supervivencia relativa del 80%. En todas las concentraciones evaluadas las PS-NPs se internalizaron en las células Caco-2. Se observó que en la concentración más baja de 1 μg mL-1 las PSNPs se internalizaron en el núcleo y se acumularon en los lisosomas y vacuolas en el citoplasma, ocasionando una alteración en la morfología de las crestas mitocondriales. Además, se observó que las PS-NPs se internalizaban en un 59% de las células a partir de la concentración de 25 μg mL-1, y en un 86% a partir de la concentración de 100 μg mL-1. En conjunto, los resultados mostraron una fácil absorción y captación de PS-NPs en las células Caco-2, así como respuestas celulares, que aumentaban de manera dependiente de la concentración. Entre los efectos biológicos causados por los MNPLs, está la inducción de estrés oxidativo intracelular, por lo que midieron los niveles intracelulares de especies de oxígeno altamente reactivas (ROS, por sus siglas en inglés) en las células expuestas, y observaron que las PS-NPs no producían estrés oxidativo. Los autores confirmaron la ausencia de estrés oxidativo analizando los cambios en los niveles de expresión de los genes superóxido dismutasa 2 (SOD2) y glutatión S-transferasa P (GSTP1) relacionados con la producción de ROS. La ausencia de cambios significativos en la expresión de dichos genes confirmaría la baja o nula inducción de estrés oxidativo asociado con la exposición de estas células a los PS. No obstante, el comportamiento del gen hemo-oxigenasa 1 (HO1), tanto para tiempos de exposición de 24 como de 48 h, es especialmente interesante, al correlacionarse con el aumento del nivel de ARNm y de proteína en respuesta a condiciones de estrés oxidativo. Los niveles de ROS no se detectaron directamente, algunos procesos subyacentes de respuesta al estrés se producen como respuesta a la exposición de PS-NPs. Esto estuvo respaldado por un aumento de ambos marcadores de estrés general, HO1 y la proteína de choque térmico 70 (HSP70), que es un indicador de inducción de estrés celular general. A pesar de la baja citotoxicidad, se observaron cambios en los niveles de expresión del gen HSP70, utilizado como indicador general de la inducción de estrés, principalmente en la exposición durante 48 h. En la misma dirección, los cambios observados en los niveles de expresión de genes implicados en la respuesta inflamatoria (principalmente para IL-1β, 48 h después de la exposición) apoyan una ligera inducción de estrés celular. Las respuestas inmunes, especialmente las respuestas inflamatorias, tienen un papel clave en la regulación de los mecanismos de genotoxicidad, y la recopilación de estos datos se ha convertido en un requisito reglamentario para todas las sustancias químicas nuevas, al ser considerados la carcinogenicidad y los efectos hereditarios de los nuevos compuestos como importantes problemas de salud pública (Cortés et al., 2019).
De manera similar, Domenech et al. en el 2020 reportaron la ausencia de efectos citotóxicos significativos inducidos por las PS-NPs en modelos de cocultivo de células Caco-2/HT-29 diferenciadas, y células Caco-2/HT-29/células Raji-B, ya que no detectaron la producción significativa de ROS intracelulares en ninguna de las concentraciones probadas para ninguno de los modelos ensayados. Analizaron los cambios en la expresión de genes asociados con diferentes vías de estrés celular mediante RT PCR en tiempo real en las monocapas de Caco-2/HT29 y no se detectaron cambios significativos en la expresión de los tres genes HO1, GSTP1 y SOD2, relacionados con ROS. Además, la falta de cambios en la expresión del gen HSP70, que es un indicador de estrés celular general, confirmó la falta de toxicidad asociada con la exposición a las PS-NPs, sin embargo, detectaron una ligera tendencia a aumentar la expresión de estos genes de manera dependiente de la dosis, especialmente para el indicador celular de estrés HSP70. Las ROS pueden interactuar con el ADN produciendo diferentes tipos de daño genotóxicos, incluidos los aductos 8-oxodG. Para detectar este tipo de lesiones, utilizaron la enzima FPG que las identifica específicamente, no obstante, no se detectaron bases de ADN oxidadas. Los resultados indicaron que las PS-NPs no fueron genotóxicas (Domenech et al., 2020).
Actualmente no hay datos disponibles sobre concentraciones de microplásticos que podrían ser ingeridos, ni hay datos suficientes sobre el posible efecto de los entornos complejos presentes dentro de toda la vía de ingestión como la saliva y los fluidos gastrointestinales, sobre el comportamiento de las partículas plásticas. Se requiere más investigación para determinar los efectos de los MNPLs, y también se debe considerar la exposición crónica de las partículas a la barrera intestinal. Los posibles escenarios podrían imitar la ingesta de alimentos contaminados con partículas de polímeros. Excepto el trabajo con PS-NPs, hasta ahora se han realizado pocos estudios de toxicidad in vitro con micro y nanoplásticos, en la Tabla 1 se muestra una descripción general.
Tabla 1 Resumen de la literatura revisada utilizando modelos in vitro para estudiar el efecto de los micro y nanoplásticos en células de colon.
| Referencia | Tipo y tamaño de partículas utilizadas | Modelo celular | Clasificación de efectos |
|---|---|---|---|
| Walczak et al. (2014) | - PS con -NH2, con -COOH, y sin modificar: 50 y 100 nm. | - Líneas celulares Caco-2, HT29-MTX y células M. | Tóxicos y no tóxicos, en conjunto. |
|
Resultados: - Mayor translocación para PS de 50 nm. - La presencia de moco redujo la translocación de PS neutrales, pero aumentó en las cargadas negativamente. | |||
| Walczak et al. (2015) |
- PS con -NH2, con -COOH, y sin modificar: 50 nm. - Hasta 250 μg/mL. - 24 h de exposición. |
- Co-cultivo de células Caco-2 y HT29-MTX. | Tóxicos y no tóxicos, en conjunto. |
|
Resultados: - Citotoxicidad significativa mediante PS-NPs puras y digeridas, cargadas positivamente. - La digestión modificó las proteínas adsorbidas y aumentó la translocación de todas las PS-NPs. | |||
| Magri et al. (2018) |
- Polietileno (PET): 100 nm, ablación con láser, diferentes características. - 1-30 μg/mL. - 24, 48 y 96 h de exposición. |
- Modelo celular Caco-2. | No tóxicos. |
|
Resultados: - Sin citotoxicidad, sin liberación de deshidrogenasa láctica (LDH). - Captación celular cerca de los lisosomas y translocación a través de las capas intestinales. - Sin efectos tóxicos tras 24 h de exposición. - Las PET-NPs no indujeron estrés oxidativo | |||
| Stepniak et al. (2018) |
- PS con -NH2, con -COOH, y sin modificar: 60 nm. - 20, 50 y 100 µg/mL. - 72 h de exposición. |
- Líneas celulares Caco-2, HT-29 y LS174T. | Tóxicos y no tóxicos, en conjunto. |
|
Resultados: - Reducción en la viabilidad celular mediante PS-NPs cargadas positivamente, y apoptosis a los 100 µg/mL de PS, en las tres líneas celulares. | |||
| Cortes et al. (2019). |
- PS: 50 a 100 nm. - PS fluorescente: 40 a 90 nm. - 0 a 200 μg mL−1. - 24 y 48 h de exposición. |
- Línea celular Caco-2. | No tóxicos. |
|
Resultados: - Sin citotoxicidad. - Fácil absorción. - Cambios estructurales, sin efectos tóxicos significativos independientemente del tiempo. | |||
| Wu y col. (2019) | - PS: 100 y 5000 nm. - 1-200 μg mL −1. | - Células de colon Caco-2. | Tóxicos y no tóxicos, en conjunto |
|
Resultados: - Sin citotoxicidad. - Débil toxicidad sobre el estrés oxidativo y la integridad de la membrana. - Interrupción del potencial de la membrana mitocondrial, especialmente con PS de 5000 nm. - Inhibición del transportador ABC ubicado en la membrana plasmática. | |||
| Domenech et al. (2020) |
- PS: 50 nm. - 0-200 μg/mL. - 24 h de exposición. |
- Cocultivos: Caco-2/HT29 y Caco-2/HT29+Raji-B. | No tóxicos. |
|
Resultados: - Sin citotoxicidad. - Sin efectos adversos en la integridad y permeabilidad de los modelos. - Gran absorción de MNPLs y una translocación a través de las membranas. - Internalización dependiente de la concentración, sin inducción de daño genotóxico u oxidativo en el ADN. | |||
| Lehner et al. (2020) |
- Polipropileno (PP), poliuretano (PU), poliamida (PA), caucho de neumáticos polidisperso. - 50-500 μm. |
- Cocultivo de Caco-2/ HT29-MTX con macrófagos y células dendríticas derivados de monocitos de sangre humana. | No tóxicos. |
|
Resultados: - Sin citotoxicidad. - Sin liberación de citocinas inflamatorias. - Sin cambios en la integridad de la barrera epitelial. | |||
Fuente: Elaboración de los autores.
Estudios in vivo de los efectos tóxicos de los micro y nanoplásticos
Se espera que aumente la presencia de nanopartículas artificiales en alimentos y productos farmacéuticos, y si el impacto en la salud humana de la exposición aguda a nanopartículas es desconocido, lo es aún más el proveniente de la exposición oral crónica. Mahler et al. en 2012 mostraron que la exposición oral aguda y crónica a PS-NPs puede influir en la absorción y el transporte de hierro en un modelo in vitro del epitelio intestinal y un modelo in vivo de asa intestinal de pollo, respectivamente. Las células intestinales que estuvieron expuestas a altas concentraciones de nanopartículas mostraron un mayor transporte de hierro debido a la disrupción de la membrana celular. Los pollos expuestos de forma aguda a partículas carboxiladas de 50 nm de diámetro tenían una absorción de hierro más baja que las aves no expuestas o crónicamente expuestas. La exposición crónica a PS-NPs provocó la remodelación de las vellosidades intestinales, lo cual aumentó la superficie disponible para la absorción de hierro. Esto es interesante porque es posible que se produzcan alteraciones similares en la absorción de nutrientes en relación con otros elementos inorgánicos como el calcio, el cobre y el zinc, que requieren sistemas de transporte pasivos o activos para su absorción a través del epitelio intestinal. Además, las nanopartículas hidrófobas podrían interrumpir la formación de micelas, las interacciones de las micelas con la capa epitelial y/o la difusión de nutrientes a través de la membrana de fosfolípidos (Mahler et al., 2012).
Por otro lado, Lu et al., en el 2018, reportaron los efectos sobre el metabolismo de los lípidos hepáticos en ratones a los que se les administró agua potable durante 5 semanas con microplásticos de PS de 0.5 y 50 μm en concentraciones de 100 y 1000 μg/L. Observaron una disminución en la secreción de moco del intestino, y la composición de la microbiota intestinal se vio afectada; además de una disminución del peso corporal (Lu et al., 2018).
Por el contrario, en 2019, Stock et al. alimentaron a ratones macho por 28 días con MPLs esféricos de PS fluorescente de tamaños de 1, 4 y 10 μm, para analizar el transporte en el epitelio intestinal y la respuesta al estrés oxidativo. Los resultados del estudio demostraron que existía absorción celular de una fracción menor de MPLs. Se examinó el intestino (duodeno, yeyuno, íleon y colon), pero no se observaron respuestas positivas. Todos los animales parecían sanos durante todo el experimento y no mostraron signos clínicos de enfermedad u otros síntomas potencialmente relacionados con el tratamiento. El examen histológico de las secciones de tejido intestinal reveló una morfología de tejido normal sin hallazgos patológicos perceptibles. Por lo que los datos demostraron la ausencia de lesiones detectables histológicamente y de respuestas inflamatorias. Estos resultados sugieren que la exposición oral a PS-MPLs en las condiciones experimentales elegidas no presenta riesgos agudos relevantes para la salud de los mamíferos (Stock et al., 2019).
Algo interesante es la observación de que al combinar la exposición de microplásticos con nanoplásticos su efecto tóxico es mayor (Liang et al. 2021), pero aún la información respecto a los estudios in vivo también es limitada, y con algunos resultados científicamente controversiales. En la Tabla 2 se muestra una descripción general.
Tabla 2 Resumen de la literatura revisada utilizando modelos in vivo para estudiar el efecto de los micro y nanoplásticos.
| Referencia | Estudio y partículas utilizadas | Clasificación de efectos |
|---|---|---|
| Mahler et al. (2012) |
- Suministración a pollos. - PS: 50 nm - recibieron 2 mg/kg dosis de nanopartículas carboxiladas. |
No tóxicos. |
|
Resultados: -La exposición oral aguda a PS-NPs interrumpió el transporte de hierro y la exposición crónica causó la remodelación de las vellosidades intestinales. | ||
| Lu et al. (2018) |
- Estudio de 5 semanas en ratones. - PS: 0.5 y 50 µm. - 100 y 1000 µg/L (1.456 x 1010 partículas por L para 0.5 µm y 1.456 x 104 para 50 µm). - Dieta básica, administración oral con exposición continua. |
Tóxicos y no tóxicos, en conjunto. |
|
Resultados: - Trastorno del metabolismo hepático y de la microbiota intestinal. - Disminución de la secreción de moco colónico y triglicéridos séricos. | ||
| Stock et al. (2019) |
- Alimentación a ratones por 28 días. - Mezcla de PS: 1, 4 y 10 µm. - 4.55 x 107 y 1.49 x 106 partículas, 10 mL por kg por peso corporal. - Sonda oral 3 veces por semana. |
No tóxicos. |
|
Resultados: - Menor captación en las células intestinales. - Sin bioacumulación en diferentes tejidos. - Sin inflamación, estrés oxidativo o efectos tóxicos. | ||
| Liang et al. (2021) |
- PS: 50 nm, 500 nm y 5000 nm. - Células epiteliales intestinales de ratón. |
Tóxicos y no tóxicos, en conjunto. |
|
Resultados: - PS de 50 nm indujo mayor apoptosis que las de 500 nm. Pero al combinarlos, su efecto fue aún más severo. - Generación de ROS a bajas concentraciones. | ||
Fuente: Elaboración de los autores.
Conclusiones
Diversos resultados han mostrado que los MNPLs pueden cruzar la barrera epitelial del sistema digestivo, pero sin ejercer efectos peligrosos aparentes. Hasta ahora, la mayoría de los experimentos se han realizado con poliestireno PS y en la línea celular de adenocarcinoma de colon humano Caco-2 y co-cultivos derivados de la misma, al ser un modelo bien establecido de enterocitos humanos, es destacado su uso en los estudios toxicológicos. Otros polímeros como polipropileno PP, polietileno PE y tereftalato de polietileno PET son el principal material polimérico presente en el medio ambiente, por ello, los autores de estos trabajos documentados sugieren que los MNPLs de estos tipos de polímeros deben considerarse en los estudios futuros con diferentes modelos biológicos. La contaminación de micro y nanoplásticos es un importante problema medioambiental y una posible amenaza para la salud. Si bien, las células intestinales son capaces de internalizar en gran cantidad los MNPLs y sus efectos biológicos detectados no fueron significativos, con todo y eso, la postura de los autores continua en señalar la importancia de realizar evaluaciones, y que el riesgo para la salud de la exposición a partículas micro y nanoplásticas en los seres humanos no debería ser subestimado, pues una de las características de los micro y nanoplásticos es que, gracias a su alta área superficial estos pueden absorber otros contaminantes orgánicos a su superficie y actuar como nanoportadores, esto abriría paso a la propuesta de nuevos experimentos de estudio. Por las características tan variables de los materiales plásticos con respecto a otros, estos pueden diferir en sus efectos toxicológicos, así como su interacción con los medios de cultivo celular para los ensayos in vitro, por esa razón, se requiere el desarrollo de modelos de cultivo celular capaces de adaptarse a las propiedades fisicoquímicas de las distintas partículas poliméricas, y de esta forma, obtener una estimación más precisa de los efectos de los MNPLs en los modelos celulares que se estudien.
Sorprendentemente, dada la revisión de literatura, el número de estudios que utilizan células humanas para evaluar los efectos biológicos asociados con la exposición de MNPLs es escaso. Teniendo en cuenta que la ingestión es la vía más importante de exposición a los MNPLs, el uso de células intestinales representa una buena elección.











 nueva página del texto (beta)
nueva página del texto (beta)


