Introducción
La nanotecnología es una ciencia multidisciplinaria que relaciona física, química, biología y ciencia de los materiales para la creación y construcción de nanomateriales, esta ciencia consta del entendimiento, manipulación y control de la materia. Las nanopartículas (NPs) son un tipo de nanomaterial cuyas dimensiones abarcan hasta los 100 nanómetros (nm) y sus características únicas y específicas, las hacen aplicables a muchos rubros de la industria y ciencia en comparación con los materiales a granel. (Fahmy et al., 2018; Shamaila et al., 2016). Las NPs son catalogadas por la base del material o sustancia que se utiliza para su formación, como se observa en la Tabla 1 (Khan et al., 2019).
Tabla 1 Clasificación y aplicación de las NPs.
| Base de las NPs | Aplicación | Autores |
|---|---|---|
| Metal (Ag, Au, Fe y Cu) | Adsorbentes de metales pesados en medio acuoso, catalizadores. | Kanichi y Ahmed (2018) |
| Carbón | Adsorbentes de gases y soporte para catalizadores. | Han et al. (2019) |
| Poliméricas | Medicina y microbiología. | Urrejola et al. (2018) |
| Semiconductoras | Electrónicas, optoelectrónicas, termoeléctricas y sensores. | Ali et al. (2017) |
| Cerámicos | Aplicación de fármacos. | Thomas et al. (2015) |
| Lípidos | Portadores y administradores de fármacos. | García-Pinel et al. (2019) |
Fuente: Elaboración de los autores.
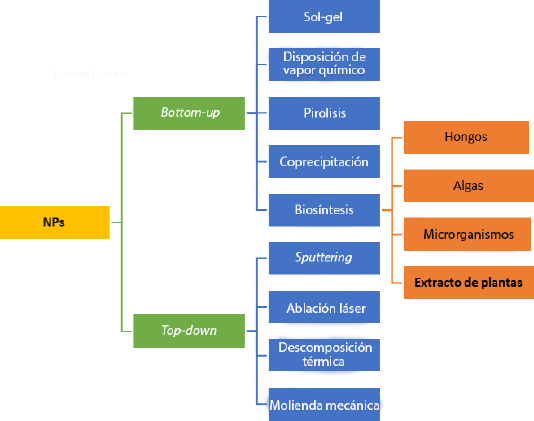
La nanotecnología posee aplicaciones en muchos rubros de la ciencia, desde la medicina, farmacéutica, cosmética, electrónica, eléctrica y remediación ambiental, entre muchos otros campos (Nasrollahzadeh et al., 2019). En la actualidad, existen diversas técnicas físicas, químicas, biológicas y multidisciplinarias utilizadas para la obtención de NPs (Figura 1) y se suelen condensar en rutas llamadas top-down (arriba-abajo) y bottom-up (abajo-arriba). Los métodos top-down son conocidos por la reducción de un material hasta su escala nanométrica por medio de técnicas destructivas y los métodos bottom-up o constructivos tienen como principio la acumulación y agregación del material desde los átomos para la producción de un material (Ealias y Saravanakumar, 2017). Sin embargo, las técnicas físicas son costosas y las técnicas químicas resultan ser dañinas para la salud y el medio ambiente, por eso, se ha optado por procesos más económicos y amigables con el medio ambiente llamadas rutas verdes pertenecientes a los métodos bottom-up que constan de 4 pilares: algas, hongos, microrganismos y extractos de plantas (Kanichi. y Ahmed, 2018). Las NPs sintetizadas por extractos de plantas presentan ventajas frente a sus homólogas como: la variación en tamaños, formas, la reducción de los tiempos de síntesis y bajo costo de operación (Iravani, 2011).
La variación de los tamaños y formas se debe al control de los parámetros durante la síntesis, es decir, el efecto del tiempo de reacción, cantidad de metabolitos secundarios presentes en los extractos de plantas, el pH, la temperatura y la concentración de los precursores metálicos (Bandeira et al., 2020). El proceso de reacción para la obtención de las NPs metálicas (NPs-MTC) aún no se ha comprobado (Kanichi. y Ahmed, 2018), por ende, solo se plantea por medio de suposiciones. El proceso de síntesis de NPs utilizando extractos de plantas se puede resumir de manera teórica en tres etapas de reacción (Figura 2): etapa de activación, etapa de crecimiento y etapa de estabilización o de terminación (Malik et al., 2014). La etapa de activación es donde los iones metálicos son recuperados de los percusores salinos y reducidos por los metabolitos secundarios presentes en los extractos vegetales, posteriormente se desarrolla un proceso de nucleación en el cual la energía libre de Gibbs aumenta, permitiendo la formación de las NPs. En la segunda etapa de crecimiento, las NPs de pequeños tamaños se aglomeran entre sí por fuerzas electromagnéticas y de Van der Waals para formar un sinfín de NPs en tamaños y formas, este proceso es conocido de igual manera como la maduración de Ostwald, en donde incrementa la estabilidad termodinámica de las NPs. La fase de terminación o estabilización es donde los metabolitos secundarios presentes en el extracto se encargan de la estabilización de las NPs, reduciendo la energía termodinámica desfavorable en la superficie impidiendo que estas se aglomeren y crezcan de tal forma que rebasen la escala de los 100 nm, en dicha fase se determina la forma y el tamaño de las NPs obtenidas (Singh et al., 2018; Kanichi. y Ahmed 2018; Shamaila et al., 2016).
Las NPs-MTC sintetizadas por extractos de plantas presentan diversas ventajas como: baja toxicidad, bajo costo, biocompatibles con células humanas y también pueden exhibir propiedades antibacterianas, antivirales y anticancerígenas (Rajan et al., 2015).
Metabolitos secundarios como agentes reductores
Los metabolitos secundarios son considerados como los “elementos clave” en la síntesis verde de NPs, al jugar estos el papel de agentes reductores y estabilizantes, esto se debe a las estructuras químicas de los metabolitos, lo cual confiere un mayor potencial reductor, estabilizador y protector (Marslin et al., 2018). La Tabla 2 muestra los principales extractos vegetales, así como los metabolitos encontrados en ellos, las condiciones de síntesis y los principales resultados obtenidos para las nanopartículas sintetizadas.
Tabla 2 Extractos, metabolitos y condiciones utilizadas para la síntesis de NPs.
| Autores | Extracto | Matabolitos secundarios | Condiciones | Caracterización | Tamaño de partícula (nm) | Morfología | Magnetización (emu/g) | Aplicación |
|---|---|---|---|---|---|---|---|---|
| Das et al. (2020) | Jatropha curcas | Amidas, aminas secundarias y proteínas. | pH = 9-14 T = 25 °C t = 60 min | DLS, UV-vis, FTIR, XRD, SEM | 20-42 | Forma esférica. | - | Tratamiento de aguas residuales. |
| Das et al. (2020) | Cinnamomum tamala | Eugonol (polifenol) y carbonilos. | pH = 9-14 T = 25 °C t = 5 0min | DLS, UV-vis, FTIR, XRD, SEM | 26-35 | Forma esférica. | - | Tratamiento de aguas residuales. |
| Parajuli, Sah y Paudyal (2020) | Azadirachta indica | Fenoles. | pH = 10-11 T = 80 °C t = 60 min | FTIR, XRD, SEM | 8.4 | Forma esférica. | - | Remoción de arsénico (As) en agua. |
| Azadi, Karimi-Jashni y Zerafat (2018) | Persicaria bistorta | Fenoles. | pH = 11 T = 70 °C t = 120 min | XRD, TEM, FTIR, MVS | 45.5 | Semi esférica. | 62.5 | Tratamiento de aguas residuales. |
| Pan et al. (2019) | Red peanut skin | Polifenoles y aminas alifáticas. | pH = 9-14 T = 25-60 °C t = 30 min | SEM, XRD, UV-vis, FTIR | 10.5 | Forma esférica. | - | Remoción de cromo. |
| Khalilzadeh et al. (2020) | Hoja Hybridus | Flavonoides y polifenoles. | T = 50 °C t = 150 min | XRD, SEM, TEM, MVS, TGA, FTIR | 25 | Forma esférica. | 10.66 | Actividad catalítica. |
| Abdullah et al. (2018) | A. pseudocotula | Terpenoides y polifenoles. | pH = 10 T = 25 °C t = 60 min | FTIR, XRD, DLS, TGA DSG ,TEM, MVS | 308-505 | Forma esférica. | 51.2-57.6 | Colectores de derrames de petróleo. |
| Clarina et al. (2018) | Polpala Flower | Alcoholes, aldehídos y aminas. | T = 60 °C t = 150 min | FTIR, XRD, UV-vis, SEM | 38 | Esférica irregular. | - | - |
| Sirdeshpande et al. (2018) | Calliandra haematoce- phala | Polifenoles, ac.carboxílicos, proteínas. | pH = 11 T = 90 °C t = 60 min | UV-vis, XRD, FTIR, SEM, Bet | 85-87 | Esférica con forma de perla. | - | Degradación de colorante. |
| Weng et al. (2018) | Euphorbia cochinchinensis | Grupos carboxilos e hidroxilos. | T = 69.85 °C t = 120 min | TEM, FTIR, BET, XRD | 10-30 | Forma esférica. | 35.9 | Eliminación de doxorrubicina. |
Fuente: Elaboración de los autores.
Se ha encontrado que las plantas poseen una capacidad para híper-acumular y reducir los iones metálicos inorgánicos presentes en el medio de interacción (Song y Kim, 2009) la reducción de dichos iones metálicos inorgánicos se debe a la presencia de biomoléculas o metabolitos secundarios (Figura 3) que en su mayoría son polifenoles que actúan como agentes reductores y estabilizadores en la síntesis de NPs, dichos metabolitos secundarios se pueden encontrar en diferentes partes de la planta como: flor, hoja tallo y raíz (Bolade et al., 2020).
Estos metabolitos secundarios son conocidos por sus cualidades antioxidantes, y son utilizados contra el estrés oxidativo el cual es producido por radicales libres (Prakash y Kumar, 2011). Se han estudiado ampliamente estos compuestos presentes en los extractos de plantas, pues por su poder antioxidante estos metabolitos pueden neutralizar a los radicales libres (Burlacu et al., 2019) son grupos de átomos que poseen un electrón desapareado libre. Por lo cual estos compuestos resultan ser sumamente reactivos, los metabolitos secundarios tienden a atraer a los electrones que completan las moléculas estables, esto con el fin de alcanzar un equilibrio electroquímico, la molécula que pierde el electrón se convierte en un nuevo radical libre, generando una reacción en cadena (Ndiaye et al., 2021). Los metabolitos secundarios y sus propiedades antioxidantes neutralizan los radicales libres pues estos biocompuestos donan sus átomos y electrones de hidrógeno, propiciando una reacción de tipo redox (Burlacu et al., 2019). Diversos autores han mencionado que la selección del extracto vegetal se determina considerando plantas con un alto contenido del grupo funcional -OH (polifenoles), que generalmente se correlaciona con propiedades antioxidantes e indica un potente agente reductor. Kanagasubbulakshmi y Kadirvelu (2017) sintetizaron NPs-Fe3O4 utilizando Lagenaria siceraria encontrando que los grupos funcionales -OH (polifenoles) y C = O (aminoácidos) tienen una fuerte capacidad para unirse con los iones metálicos, y reducirlos generando las NPs-Magnetita, de igual forma Nnadozie y Ajibade 2020 obtuvieron NPs-Fe3O4 empleando los fitoquímicos presentes en los extractos de Chromolaena odorata como agentes reductores y estabilizantes. En-contraron en sus espectroscopías infrarrojas por la transformada de Fourier (FT-IR) espectros pertenecientes a los compuestos polifenólicos (con grupos -OH) y compuestos aromáticos (C = O). Moran et al. (1997) demostraron que los anillos aromáticos de los compuestos fenólicos son altamente nucleofílicos, lo cual genera los quelantes de fitoquímico-Ion reducido. Mandloi, Jain, y Sharma (2021) detectaron la interacción de flavonoides como agentes reductores y estabilizantes en la síntesis de NPs.
Efecto de los metabolitos secundarios obtenidos de extractos de plantas en la síntesis de NPs-Fe3O4
El uso de extractos de plantas con un alto contenido de metabolitos secundarios en la síntesis de NPs-MTC es eficiente por su bajo costo y toxicidad (Kanichi. y Ahmed, 2018). La reducción y estabilización de iones metálicos se puede lograr con una combinación de biomoléculas, como enzimas, polisacáridos, taninos, compuestos fenólicos, saponinas, terpenoides, entre otros, los cuales generan una estabilización que puede ser electrostática o estérica (Burlacu et al., 2019). Muchos de estos biocompuestos se han encontrado en las síntesis de NPs gracias a los estudios de FT-IR (Huang et al., 2014)
Las NP-MTC estables tienen una propiedad repulsiva contra las fuerzas termodinámicas de atracción ya sean fuerzas de Van der Waals o atracciones electrostáticas. Esta propiedad se logra a través de: estabilizaciones electrostáticas, estabilizaciones estéricas y la combinación de estas dos, mejor llamada como la estabilización electro-estérica (Figura 2) (Astruc, 2008; Cao, 2004).
La estabilización electrostática es sensible al electrolito agregado, mientras que la repulsión estérica es sensible a cambios en la solvencia y masa molar de la capa adsorbida de polímero. En muchos casos, la estabilidad se ve afectada por una combinación de mecanismos. Este es el caso de la estabilización electrostática, un régimen intermedio en el que tanto los efectos electrostáticos como los estéricos contribuyen a la estabilidad de la dispersión. En este caso, el componente electrostático puede originarse a partir de la carga superficial de la partícula y/o sitios cargados en el polímero adsorbido (Finch, 1983). La estabilización electrostática funciona mediante una doble capa eléctrica que resulta de la presencia de fuerzas termodinámicas repulsivas entre las NPs por la intervención de un compuesto iónico, usualmente es por la adición de contra iones que permiten la estabilización de las NPs. Las repulsiones electrostáticas evitan la aparición de agregación en la fase de solución y están influenciadas por algunas variables sustanciales como la concentración de los metabolitos secundarios, pH, tiempo de reacción y temperatura, (Raveendran, Fu y Wallen, 2003; Marslin et al., 2018) en cambio, la estabilización estérica en soluciones coloidales, también llamada estabilización polimérica, implica la adición de moléculas de algún tipo de polímero con el fin de impedir la agregación de las NPs. Las moléculas poliméricas unidas a la superficie de la nanopartícula evitan que las dos nanopartículas se acerquen entre sí, creando un obstáculo estérico que evita que las nanopartículas se aglomeren (Chakraborty y Panigrahi, 2020). En la síntesis verde de NPs-MTC se suele dar la interacción de estas dos formas de estabilización (Figura 4) formando una estabilización electro-estérica, esta combinación de estabilizaciones genera un tensoactivo iónico con extremos de cadena larga y grupo de cabeza polar generando una doble capa eléctrica alrededor de las NPs y proporcionando repulsión estérica dentro de las NPs, lo que conduce a un sistema de estabilización mutua (Stankus et al., 2011).

Fuente: Elaboración de los autores.
Figura 4 Tipos de estabilizaciones: (a) estabilización electrostática; (b) estabilización estérica.
La complejidad de esta estabilización estérica está dada por el fenómeno que ocurre con la interacción de la NPs-MTC y los fitoquímicos implicados en la síntesis, un ejemplo de esto sería el proceso estudiado por Wang, Fang y Mallavarapu (2015) el cual propone una estructura de hierro-polifenoles; en dicho estudio los polifenoles tienen el papel reductor y estabilizador en la síntesis de NPs, ya que estos compuestos permiten la reducción del Fe+3 en Fe+2. Sin embargo, este proceso no reduce el Fe+2 en Fe0 en su totalidad ya que el Fe+2 se estabiliza fuertemente por los ligandos generados con los polifenoles (Figura 3), no obstante, este complejo de NPs-polifenol se oxida rápidamente con la presencia de O2 disuelto en la solución de reacción, este proceso es conocido como autoxidación. Por este proceso es que se da el característico color negro en la reacción de NPs-Fe3O4 (Wang, 2013).
En otro estudio, Herrera-Becerra et al. (2008) utilizaron un grupo de taninos pertenecientes a la alfalfa, según lo propuesto, usaron los taninos del extracto de alfalfa como el ácido gálico “R”, los cuales provocan la reducción de los iones metálicos en donde dicha reacción se ve directamente influenciada por el pH de la reacción. El posible proceso de reducción y estabilización se resume de la siguiente forma:
Veisi et al. (2019) sintetizaron NPs-Fe3O4 a partir de Rubia tinctorum. Los autores reportan que este extracto presenta abundancia de grupos funcionales carbonilos e hidróxidos fenólicos. Determinaron las capacidades de NPs-Fe3O4 para adsorber en su superficie NPs-Ag. En dicho estudio se propone el siguiente proceso de reducción de los iones de Fe3+ donde los fitoquímicos de polifenoles y grupos carbonilos funcionan como recubrimiento en la NPs-Fe3O4.
No solo los metabolitos secundarios actúan como agentes estabilizantes estéricos, también pueden funcionar como estabilizadores electrostáticos, dependiendo de la termodinámica de la reacción pueden agregar los contraiones necesarios para estabilizar a las NPs-MTC generando un sinfín de NPs-Fe3O4 en tamaños y formas (Kanichi. y Ahmed 2018).
Efecto del pH en la síntesis de NPs-Fe3O4
La nucleación esta influenciada por la variación del pH (Alvear et al., 2017). Diversos estudios han concluido que en condiciones ácidas (1-6 upH) se llegan a producir NPs, pero con poca estabilización y son propensas a la aglomeración, en condiciones alcalinas (8-12 upH) (Shou et al., 2011) las NPs son más estables, y de tamaños variados que se repelen entre sí, sin mencionar que se reduce el tiempo de obtención (Devatha y Thalla, 2018).
El pH del medio de reacción puede ser utilizado como estabilizador en la síntesis de NPs, además de tener un efecto importante en la nucleación y crecimiento de las NPs. Las concentraciones presentes en la reacción de iones de hidrógeno dan lugar a diferencias en el tamaño y forma de las NPs (Pal, Rai y Pandey, 2019).
Existe una serie de reacciones químicas que se deben cumplir para la obtención de las NPs-Fe3O4 tal como se muestra en la siguiente ecuación (4).
De acuerdo con la termodinámica que obedece esta reacción, la generación de Fe3O4 se consigue con pH de 8 a 14, con una relación estequiométrica de 1:2 con respecto a Fe2+/2 Fe3+ (Pabón-Guerrero et al., 2021). La Fe3O4 es un compuesto el cual reacciona con el O2 disuelto en la solución generando la autoxidación, por ello, en presencia de O2 la Fe3 O4 se convierte en maghemita (γ- Fe3O3) (EC. 5) que es otro estado de oxidación de los (Pabón-Guerrero et al., 2021)
Suponiendo una reacción en condiciones ácidas y anaerobias, los iones Fe2+ llegan a formar complejos de Hexa-aqua, mientras que, en condiciones básicas, la formación de la magnetita involucra reacciones tipo óxido-reducción. A través de la variación en el pH se puede controlar relativamente el tamaño y la distribución, sin embargo, estos siguen siendo factores cinéticos responsables de la nucleación (Pabón-Guerrero et al., 2021).
Varios estudios que revelan la importancia del pH en la síntesis de NPs-Fe3O4. El trabajo de Alvear et al. (2017) menciona que el proceso de nucleación para la obtención de las NPs-Fe3O 4 se ve influenciado por el pH, las NPs sintetizadas se aglomeran para reducir la energía termodinámica desfavorable (Van der Waals o fuerzas de carácter magnético) presente en la superficie de la NP. Una variación en el pH puede beneficiar para que las NPs-Fe3O 4 puedan crear cargas en las reacciones tanto de protonación (Fe−OH +H+ →Fe −OH+2) como de deprotonación (Fe - OH → Fe - O + H+) en el área superficial de las NPs. Las cargas que se crean alrededor de esta área superficial en condiciones ácidas o básicas apartadas de la carga neutra de la magnetita propician una estabilización electrostática impidiendo la agregación de estas mismas, esto es gracias a la repulsión conveniente de las cargas iguales en la superficie de las NPs, no obstante, esta estabilización no es suficiente para impedir todas las aglomeraciones de todas las NPs sintetizadas. Por esto es necesario recubrir la superficie de las NPs con algún polímero (Alvear et al., 2017), es en este paso donde intervienen los metabolitos secundarios en el proceso de síntesis para minimizar la diferencia de tamaños de las NPs obtenidas mediante una estabilización estérica fijándose en la superficie de las NPs-Fe3O4 tal como se muestran en las Figuras 5-6.
En otro estudio realizado por Azadi, Karimi-Jashni y Zerafat (2018), se evaluaron diferentes parámetros como: la temperatura, el tiempo, la concentración de los precursores metálicos y el pH en diferentes niveles para conocer la interacción y la significancia de cada uno de estos, encontrando que en el proceso de coprecipitación por síntesis verde las NPs-Fe3O4 a pH alcalinos, se genera una completa precipitación de las especies de hierro. Por lo tanto, generan núcleos más grandes y estables. El tamaño de las partículas también se ve influenciado por las condiciones de síntesis, pues parámetros tales como: la velocidad de agitación, los precursores de hierro usados, concentración de la solución alcalina, temperatura, tiempo y cantidad de metabolitos secundarios presentes, pueden afectar el tamaño de las partículas producidas.
Efecto de la temperatura en la síntesis de NPs-Fe3O4
Si bien se conoce que la temperatura de reacción es un factor importante en cualquier proceso que tenga como fin la generación de una especie química reactiva se ha descubierto que la temperatura en el caso de la síntesis de NPs-es importante para la determinación del tamaño, forma y rendimiento en la síntesis de NPs- (Shah et al., 2015; Pal, Rai y Pandey 2019).
Las temperaturas altas favorecen la creación de núcleos, mientras que las temperaturas bajas favorecen el crecimiento de estas (Figura 7a). Esto es debido a que el tamaño de las partículas es reducido con el aumento de la temperatura de reacción (Liu et al., 2020). Esto también está mediado por la cantidad de percusores metálicos existentes, pues sin una cantidad mínima, las NPs tienden a nuclearse y crecer mejor en temperaturas elevadas (Figura 7b) donde k1 es la nucleación de las NPs y k2 es el crecimiento

Fuente: Elaboración de los autores.
Figura 7 Comparación del crecimiento y nucleación de las NPs-Ag en temperaturas altas y tempera-turas bajas.
En el caso de las NPs-Fe3O4 se ha reportado que a temperaturas altas (> 90 ºC) se propicia una mayor generación y formación de NPs-Fe3O4. También se ha observado que la velocidad de formación de las sales de hierro a NPs-Fe3O4 puede volverse más rápida cuando se aumenta la temperatura de reacción, lo cual resulta en NPs-Fe3O4 más pequeñas (< 10 nm) (Azadi, Karimi-Jashni y Zerafat 2018).
En la síntesis de NPs-Fe3O4 realizada por Gnanaprakash et al. (2007), encontraron que, con temperaturas de reacción superiores a 90 ºC, los tiempos de reacción disminuían, presentando así una mayor velocidad de reacción en comparación a temperaturas más bajas. Para nanopartículas de 9 nm el tiempo requerido con una temperatura de 80 ºC fue de 3 h, mientras que con una temperatura de 25 ºC tomó alrededor de 3 meses. Estos hallazgos muestran que la velocidad de reacción para la obtención de Fe3O4 es fuertemente dependiente de la temperatura.
Efecto del tiempo de reacción y las concentraciones de sales de hierro en la síntesis de NPs-Fe3O4
En el proceso de síntesis, la nucleación da comienzo con una concentración específica de precursores hasta que estos se terminen en el proceso de nucleación. Los precursores sobrantes se precipitan sobre la superficie de los núcleos contribuyendo al crecimiento de las NPs. En consecuencia, al aumentar las concentraciones de los precursores se genera más material para la precipitación de los núcleos dando paso al crecimiento de las NPs (Vega-Chacón et al., 2016)
Las concentraciones de sales de hierro y el tiempo de reacción van de la mano en la síntesis de NPs-Fe3O4, ya que estas se relacionan con la nucleación y el crecimiento, como se muestra en la Figura 8. Se requiere una concentración mínima de saturación que ayude a superar las barreras de energía que requiere para que dé comienzo la nucleación en ese lapso donde se alcanza la concentración mínima de saturación empieza la agregación y creación de núcleos de los átomos de hierro reducidos. Al producirse núcleos dispersos en la solución coloidal estos empiezan el proceso de agregación el cual reduce la energía termodinámica desfavorable estabilizando las NPs, así, entre mayor sea el lapso de reacción mayor serán los diámetros de las NPs sintetizadas (Cao y Wang, 2004).

Fuente: Elaboración de los autores.
Figura 8 Relación de la nucleación y crecimiento con el tiempo de reacción y concentraciones de los precursores metálicos.
Karade et al. (2018) comprobaron que las NPs magnéticas en tiempos de síntesis prolongados (> 8 h) los tamaños de cristales aumentan de 7.5-12 nm, incrementando el tamaño conforme aumenta el tiempo de reacción, de aquí que se obtuvieran mayores propiedades magnéticas en aquellas NPs que tenían un tamaño superior a 7.5 nm, esto se comprueba por la teoría de Stoner Wohlfarth donde mencionan que al incrementar el tamaño de cristal se incrementan de la misma manera las propiedades magnéticas de las NPs.
En otro estudio realizado por Azadi et al., (2018), sintetizaron NPs-Fe3O4 utilizando extractos de la planta Persicaria bistorta como agente reductor y estabilizante y reportaron que al aumentar las concentraciones de 0.1-0.2 M, se genera la concentración mínima de saturación que propicia la precipitación de los núcleos permitiendo el crecimiento de estos, también se encontró que la magnetización de las nanopartículas de Fe3O4 aumenta, al incrementar la concentración de Fe3Cl2 de 0.1-0.2 M, En consecuencia, el aumento de las sales de hierro Fe3Cl2, induce a un incremento del tamaño de los cristales presentes en la síntesis, lo que da como resultado una mejora en la variable de la magnetización.
Conclusión
En la actualidad, se ha logrado sintetizar NPs a partir de procesos, físicos, químicos y biológicos. La mayoría de estos métodos aún presentan deficiencias en la producción de NPs como puede ser la estabilidad, la agregación, el control en tamaño, formas y distribución de las mismas, sin mencionar que muchas de estas rutas de producir NPs generan costos elevados por materiales, equipos, reactivos y gastos en pretratamientos; además de que los residuos en algunos tipo de síntesis son dañinos, tanto para la salud como para el medio ambiente, es por esto que las rutas verdes se presentan como una estrategia prometedora para dar solución a las problemáticas que conlleva sintetizar NPs.
Además, diversos autores mencionan que las NPs-MTC producidas utilizando extractos de plantas son más estables en comparación de sus homólogas y presentan más variedad en tamaños y formas. Las NPs sintetizadas por extractos de plantas pueden reducir los iones metálicos de una forma más eficiente que por otro tipo de rutas verdes, siendo más eficiente y económica para la producción a escala industrial. La capacidad de reducción de los iones metálicos y la estabilización de las NPs es gracias a los biocompuestos pertenecientes de las plantas que proporcionan los agentes reductores (OH) y estabilizantes durante la síntesis, como pueden ser polifenoles, aminoácidos, polisacáridos, alcaloides, taninos, enzimas/proteínas y algunos tipos de vitaminas. Aunque, en la síntesis verde también se depende de otros factores para lograr una óptima producción de NPs-Fe3O4 como: la temperatura, el tiempo, el pH y la cantidad de biocompuestos disponibles en los extractos, ya que cuentan con diversas funciones en la producción de las NPs, en el caso de la temperatura aumenta la velocidad de reacción y con esto la producción de núcleos de NPs, por otro lado la manipulación del tiempo en la síntesis genera un mayor crecimiento de las NPs por aglomeración de los núcleos en tiempos prolongados. Diversos estudios demuestran que el pH es de vital importancia en la síntesis de NPs-Fe3O4, ayudando no solo a la estabilización de las NPs-Fe3O4 agregando contra iones, sino también en la termodinámica de reacción proporcionando el ambiente idóneo para la síntesis de NPs-Fe3O4. Es por esto por lo que se debe centrar la atención en comprender los procesos biológicos, químicos y físicos en la síntesis verde por extracto de plantas en la producción de NPs.











 nueva página del texto (beta)
nueva página del texto (beta)