Introducción
La contaminación del agua debida a las diversas actividades antropogénicas es una preocupación mundial por causar problemas ambientales, sociales, económicos y especialmente de salud pública. Hoy en día, se ha reportado que esta constituye una de las principales causas de muerte y enfermedades humanas en todo el mundo, como lo indican las más de 2.2 millones de muertes al año y los innumerables casos de enfermedad que se hacen presentes cada día (Gleick, 2002). En general las aguas residuales son enviadas a plantas de tratamiento en las cuales a través de una serie de procesos físicos, químicos y biológicos se trata de eliminar los contaminantes presentes en el agua; sin embargo, debe mencionarse que la mayoría de las plantas de tratamiento de aguas residuales no están diseñadas, ni tienen la capacidad, de remover los contaminantes orgánicos refractarios (resistentes a la degradación), entre los que se encuentran los colorantes, pesticidas, fenoles y fármacos, entre otros. Un tipo de contaminantes que ha comenzado a causar preocupación en los últimos años son los denominados contaminantes emergentes (CE). La detección de estos contaminantes en el agua ha sido posible recientemente gracias al desarrollo de nuevas y más sensibles técnicas analíticas. Entre los contaminantes emergentes presentes en el agua se encuentran los fármacos, pesticidas, productos de cuidado personal, hormonas, plastificantes, retardantes de fuego, protectores solares, filtros UV, tensoactivos y colorantes, entre otros (Gavrilescu et al., 2015; Lellis et al., 2019). En los últimos años, como resultado del desarrollo de la tecnología de los nanomateriales basados tanto en carbono (fulerenos y nanotubos) como en metales (nanopartículas de plata y oro, y óxidos metálicos), algunos de estos se han detectado en aguas residuales de origen doméstico por lo que también son considerados una nueva clase de contaminantes emergentes (Marcoux et al., 2013). Una alternativa para la eliminación de este tipo de contaminantes de las aguas residuales, son los denominados procesos de oxidación avanzada (POA) (Deng et al., 2015), los cuales presentan algunas ventajas sobre las tecnologías convencionales de tratamiento de aguas, entre las que se pueden mencionar su amplia gama de aplicabilidad, alta velocidad y en algunos casos la mineralización completa de los contaminantes, esto es, su conversión a CO2 y agua como productos finales, siendo inocuos al medio ambiente. Los POA se definen como aquellos procesos que involucran la generación de radical hidroxilo en cantidad suficiente para tener efecto en la purificación del agua (Glaze et al., 1987). Entre los POA se encuentra la fotocatálisis utilizando semiconductores donde el radical hidroxilo se genera por procesos fotoquímicos y ha demostrado una alta efectividad para la oxidación de materia orgánica. En este caso: un semiconductor inmerso en solución acuosa es iluminado con luz, absorbe un fotón que sí tiene la energía requerida para producir un par electrón-hueco, estos portadores de carga podrán migrar a la superficie donde el hueco oxidará el agua para formar radical hidroxilo mientras que el electrón podrá ser donado a un aceptor de electrones, como el O2, formando radicales superóxido. Es importante mencionar que, actualmente, el desarrollo de fotocatalizadores eficientes buscando incrementar la separación de cargas para disminuir la tasa de recombinación, así como para reducir la energía de brecha prohibida para extender su absorción a la región visible de luz solar, es investigado por diversos grupos alrededor del mundo. En este trabajo se presentan las generalidades de la fotocatálisis discutiéndose las ventajas de utilizar fotocatalizadores inmovilizados en forma de película delgada, así como los resultados obtenidos al utilizar películas delgadas de TiO2 modificadas con zinc, preparadas utilizando una ruta de síntesis novedosa como la de fotocatalizadores para la degradación del colorante verde de malaquita.
Fotocatálisis
En las últimas décadas, la fotocatálisis ha sido ampliamente estudiada debido a sus aplicaciones potenciales para el tratamiento de aguas contaminadas con moléculas orgánicas. De manera general, la fotocatálisis se basa en las reacciones que ocurren en la superficie de un semiconductor, el fotocatalizador, bajo irradiación de luz UV cuyo resultado es la generación de agentes oxidantes y radicales reductores que, por distintas rutas de reacción, son capaces de descomponer cualquier tipo de materia orgánica en dióxido de carbono y agua, proceso denominado mineralización (Roman et al., 2013; Han et al., 2009). Es importante mencionar que el catalizador no forma parte de los reactantes, ni de los productos, ni se consume en la reacción química, la cual se lleva acabo a temperatura ambiente. Entre las ventajas más importantes de la fotocatálisis se pueden mencionar: la posibilidad de reutilizar el material fotocatalizador -lo que hace que este proceso sea barato-, así como la posibilidad de utilizar la energía solar como fuente luminosa.
Los semiconductores están caracterizados por la denominada brecha prohibida (Ebg, también denominada band gap) que es la brecha energética que separa la banda de valencia (BV) de la banda de conducción (BC). La Tabla 1 muestra los valores de Ebg de algunos semiconductores, así como las longitudes de onda equivalentes a esas energías.
Tabla 1 Energías de brecha prohibida de algunos semiconductores.
| Semiconductor | Band gap (eV) | Longitud de onda (nm) |
|---|---|---|
| CdSe | 1.7 | 730 |
| Fe2O3 | 2.2 | 565 |
| CdS | 2.5 | 497 |
| V2O5 | 2.8 | 443 |
| Bi2O3 | 2.9 | 427 |
| TiO2 | 3.2 | 390 |
| ZnO | 3.4 | 365 |
Fuente: Elaboración de los autores.
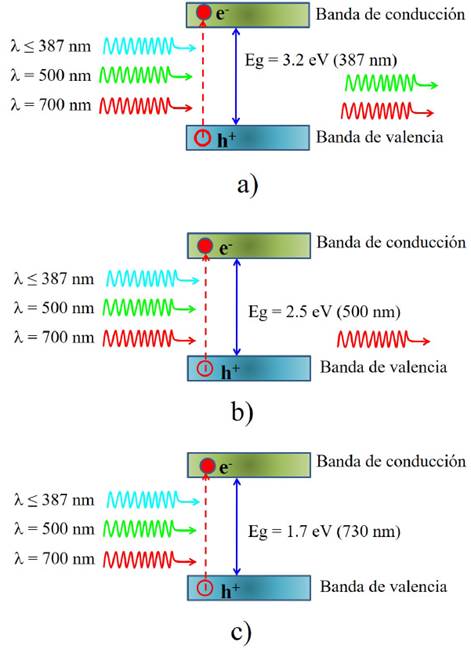
Cuando el semiconductor (fotocatalizador) es iluminado con luz de longitud de onda con una energía igual o mayor que su brecha prohibida, se promueven electrones desde la banda de valencia a la banda de conducción, pro duciendo así un electrón (e-) en la BC y dejando un hueco positivo (h+) en la BV. La Figura 1a muestra el ejemplo de un semiconductor con Ebg = 3.2 eV, en este caso se requieren longitudes de onda menores a 387 nm (región UV del espectro electromagnético) para generar el par electrón-hueco, longitudes de onda mayores, por ejemplo, correspondientes al verde no serán absorbidas y no producirán ningún efecto; la Figura 1b ilustra el caso de un semiconductor con Ebg = 2.5 eV, en este caso se requieren longitudes de onda menores o iguales a 500 nm (región visible del espectro electromagnético), esto significa que este semiconductor al ser iluminado con luz UV, azul y parte del verde producirán pares electrón-hueco; finalmente, en la Figura 1c se observa el caso de un semiconductor con Ebg = 1.7 eV, en este caso se requieren longitudes de onda menores a 730 nm (región visible del espectro electromagnético), de tal manera que el material será activado con cualquier longitud de onda de la región UV y visible del espectro electromagnético.
Fuente: Elaboración de los autores.
Figura 1 Absorción de fotones para la formación de pares electrón-hueco en semiconductores con diferente energía de brecha prohibida: a) 3.2; b) 2.5, y, c) 1.7 eV.
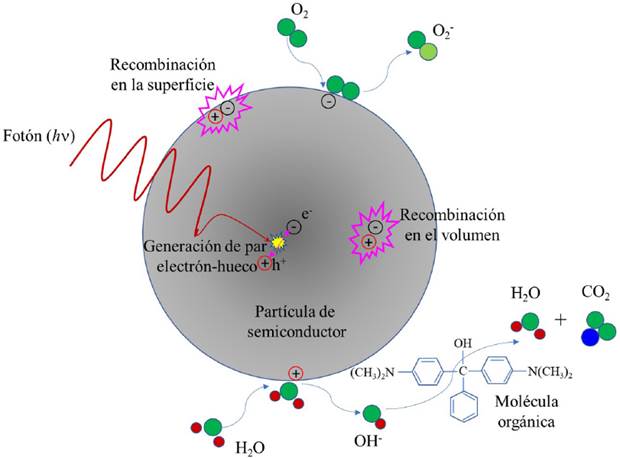
Si el electrón y el hueco migran a la superficie del fotocatalizador sin recombinarse, podrán producir reacciones redox con los compuestos adsorbidos en la superficie del fotocatalizador. El hueco, cargado positivamente, oxida los contaminantes directamente o a través de la oxidación del agua produciendo radicales hidroxilo (•OH) los cuales reaccionarán con los compuestos orgánicos degradándolos. Por su lado, los electrones reducen los átomos de oxígeno adsorbidos en la superficie del fotocatalizador, produciendo radicales superóxido (O2-•) y otros grupos reactivos. Estas reacciones de oxidación y reducción son el mecanismo fundamental de la fotocatálisis (Zhu et al., 2017). Durante el proceso de migración de los pares electrón-hueco a la superficie del semiconductor, pueden recombinarse dentro del volumen del material o bien en la superficie; evidentemente, estos procesos de recombinación tienen un efecto adverso al proceso de fotocatálisis, pues ya no producirán radicales •OH. Los procesos descritos anteriormente se muestran esquemáticamente en la Figura 2. Es interesante mencionar que un proceso similar existe en la naturaleza: la fotosíntesis, en la cual el bióxido de carbono y el agua que llegan a la hoja de una planta a través de la clorofila bajo la acción de la luz solar son transformados en azúcares y oxígeno.
El dióxido de titanio como fotocatalizador
El dióxido de titanio (TiO2, titania) es un semiconductor con una brecha prohibida del orden de 3.0 eV y ha sido considerado como el fotocatalizador ideal debido a sus propiedades fisicoquímicas: no es soluble en medio líquido, es barato y puede ser reusado, posee alta resistencia a la corrosión fotoquímica, la fotocatálisis se lleva a cabo a temperatura ambiente (Hashimoto et al., 2005). El TiO2 presenta 3 tipos de estructura cristalina: anatasa, rutilo y brookita, las dos primeras con estructura tetragonal y la última con estructura ortorrómbica. La fase rutilo es la estructura termodinámicamente estable, mientras que la anatasa y la brookita son metaestables y se transforman a rutilo cuando se les aplica calor. Las energías de brecha prohibida de cada una de esas fases son: 3.2, 3.0 y 3.1 eV, respectivamente. El TiO2 utilizado como fotocatalizador es principalmente la fase cristalina anatasa, debido a que al tener una mayor energía de brecha prohibida puede reducir el proceso de recombinación del par electrón-hueco favoreciendo un mayor grado de hidroxilación superficial que producirá más radicales hidroxilo y, en consecuencia, la degradación de más moléculas orgánicas. La fase rutilo puede absorber radiación electromagnética ligeramente más cerca de la región visible, 413 nm contra 387 nm de la anatasa, lo que haría suponer que el rutilo sería un mejor fotocatalizador; no obstante, debido a que su banda de conducción está más cerca del potencial de oxidación-reducción del hidrógeno, esto se traduce en un débil potencial de reducción. La fase brookita es la menos estudiada en aplicaciones fotocatalíticas pues es difícil obtenerla como fase aislada, sin anatasa y/o rutilo, aunque en años recientes se ha mostrado que es un buen candidato como fotocatalizador (Di Paola et al., 2013). Es importante mencionar que la titania es un fotocatalizador activo solo bajo irradiación UV, ya que debido a su band gap solo puede absorber longitudes de onda menores a aproximadamente 400 nm, que corresponde a la región ultravioleta (UV) del espectro electromagnético. Esto es una desventaja importante debido a que el uso de radiación UV implica generarla, por caso, mediante lámparas de descarga de vapor de mercurio, lo cual requiere el uso de energía eléctrica; por otro lado, si se quiere utilizar la luz UV presente en el espectro solar, solo absorbe una fracción pequeña (3 al 5%) de la luz solar (Escobedo et al., 2011). Otra desventaja importante es que la recombinación de los pares electrón-hueco fotogenerados ocurre en tiempos muy cortos < 1 ns para rutilo y de 10 ns para anatasa (ns, 10-9s) por lo que su eficiencia es muy baja (Xu et al., 2011). Por tanto, en los últimos años se han dedicado muchos esfuerzos para obtener fotocatalizadores basados en TiO2 capaces de absorber longitudes de onda en la región visible del espectro electromagnético, de 400 a 700 nm, para aprovechar mejor el espectro solar, y buscando también reducir la rapidez de recombinación de los pares electrón-hueco.
Modificación de TiO2
Entre las estrategias propuestas para mejorar la actividad fotocatalítica de la titania, la mezcla de fases, el dopado con metales y no-metales, así como el acoplamiento de semiconductores formando heteroestructuras (Han et al., 2009; Rehman et al., 2009), se han considerado buenas alternativas al permitir inducir efectos sinérgicos, que en algunos casos conducen a reducir el band gap, así como a promover la separación de los portadores de carga foto-inducidos disminuyendo los procesos de recombinación electrón-hueco. Por ejemplo, se ha reportado que mezclas de fases anatasa-rutilo en diferentes proporciones presentan mejor actividad fotocatalítica que las fases individuales, lo anterior atribuible a que la fase rutilo introduce una estructura de mesoporosidad y una distribución más amplia de poros; una mezcla de fases de titania ampliamente conocida y disponible comercialmente es la denominada Degussa P25 la cual está formada por 70%-80% de anatasa y 30%-20% de rutilo (Ohtani et al., 2010). Como ejemplo del dopado con metales y acoplamiento de semiconductores, se ha reportado que nanopolvos de TiO2 modificados con diferentes cantidades de bismuto preparados por el método sol-gel, a bajas concentraciones de Bi, se obtiene la fase anatasa con el Bi como dopante, a medida que se añade Bi se obtienen mezclas de anatasa y titanato de bismuto, dos óxidos acoplados; seguidas de mezclas de titanato de bismuto con óxido de bismuto, y, finalmente, a altas cargas de Bi se obtiene óxido de bismuto dopado con Ti. La caracterización de las propiedades ópti cas de estos materiales muestra que el band gap se reduce de 2.9 eV para la muestra sin bismuto hasta 2.2 eV para el contenido más alto de Bi de 43.6 % at., indicando que estos materiales son capaces de absorber luz de la región visible del espectro solar, longitudes de onda de hasta 560 nm. La respuesta fotocatalítica de estos materiales se probó en la degradación del colorante verde malaquita utilizando luz solar simulada, encontrándose que con la incorporación de 2.7 % at. de Bi se alcanzan grados de degradación del orden del 90% en 60 min. Cabe señalar que el grado de degradación alcanzado por el fotocatalizador comercial Degussa P25 bajo las mismas condiciones experimentales fue solo del 55%, por lo que la modificación con Bi mejora hasta en un 63% (Solís-Casados et al., 2016). En la literatura se pueden encontrar muchos casos en los cuales se muestra que las estrategias propuestas para mejorar la actividad fotocatalítica del TiO2 han dado buenos resultados (Colón et al., 2006; Gonzalez-Zavala et al., 2018, Solís-Casados et al., 2018).
¿Fotocatalizadores en forma de polvo o película delgada?
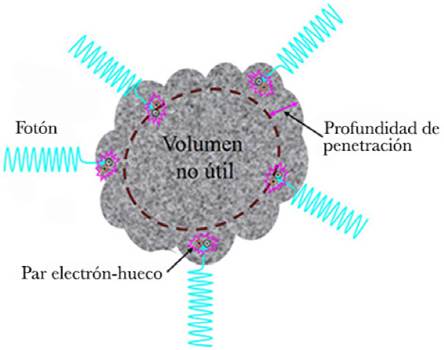
En términos generales, la mayoría de los fotocatalizadores se utilizan en forma de polvo, sin embargo, en ciertas aplicaciones, el uso de polvo podría tener asociados algunos problemas, entre los que se pueden mencionar: a) recuperar el polvo de la solución en que se utiliza, en general implica dificultades en la separación del fotocatalizador de la suspensión; b) aglomeración de partículas finas suspendidas en la solución, lo cual se incrementa cuando se utilizan altas concentraciones de polvo, por lo que solo se pueden utilizar pequeñas cantidades; se ha reportado que partículas de Degussa P25 con diámetros de 30-90 nm al dispersarse en agua desionizada se aglomeran formando agregados con diámetros del orden de 700 nm (Cabrera et al., 1996); c) otro problema está relacionado con la luz utilizada para activar el fotocatalizador, por un lado, como ya se ha dicho, se requiere luz con longitudes de onda cuya energía sea mayor o igual al band gap del semiconductor utilizado, por otro lado se debe considerar la profundidad de penetración de la luz, la cual es proporcional al inverso del coeficiente de absorción del semiconductor utilizado, z~1/α, en particular, para el TiO2, el coeficiente de absorción (α) que es función de la longitud de onda, a 500 nm es del orden de 3 x 104 cm-1, para 400 nm es de 4 x 104 cm-1, para 300 nm es de 7 x 104 cm-1 (Salvador, 1984), por lo que la profundidad de penetración de esas longitudes de onda es de 33, 25 y 14 nm, respectivamente. La Figura 3 muestra de manera general la profundidad de penetración para diferentes regiones del espectro electromagnético; considerando una suspensión de Degussa P25 irradiada con luz de 400 nm, solo el 25% del volumen de cada aglomerado será material susceptible de ser activado para producir pares electrón-hueco suponiendo que no hay difusión de la solución con contaminantes al interior del aglomerado, en la Figura 4 se ilustra lo anterior; d) un problema adicional es la longitud de recombinación del par electrón-hueco, la cual en TiO2 es de 10-100 nm (Hwang et al., 2012), lo que impone una restricción adicional al tamaño útil de las partículas de polvo. Lo anterior ha llevado a explorar el uso de TiO2 u otros semiconductores como fotocatalizadores en forma de película delgada.

Fuente: Elaboración de los autores.
Figura 3 Se ilustra la idea de profundidad de penetración para diferentes longitudes de onda.
Fuente: Elaboración de los autores.
Figura 4 Formación de pares electrón-hueco en una partícula de semiconductor en que se ilustra el volumen no utilizado para fotocatálisis.
Una película delgada puede definirse de manera general como aquella estructura material que tiene una de sus dimensiones muy pequeña en comparación con las otras dos. En la práctica se consideran películas delgadas aquellos materiales que tienen espesores desde unos cuantos nanómetros hasta algunos cientos de nanómetros, aunque esto no es muy específico. La Figura 5 enseña una película delgada de TiN con un espesor de 500 nm depositada sobre un sustrato de silicio mediante la técnica denominada ablación láser.
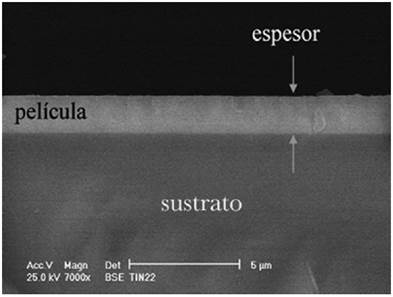
Fuente: Elaboración de los autores.
Figura 5 Micrografía de una película delgada de TiN con espesor de 500 nm.
Es importante señalar que, comúnmente, las propiedades de los materiales en forma de película delgada pueden ser significativamente diferentes de sus atributos en bulto, resultando algunas de sus propiedades mejores en película delgada. El uso de películas delgadas como fotocatalizadores resuelve algunos de los problemas mencionados anteriormente: a) al estar adherida a un sustrato no existe el problema de su recuperación de la solución tratada, con la ventaja adicional de que, con frecuencia, se puede usar una amplia variedad de materiales como sustrato (soporte), por mencionar: vidrio, metales, polímeros, concretos, etc., lo cual puede ser muy útil en aplicaciones ambientales; b) no existe el problema de aglomeración, pues el material semiconductor se encuentra inmovilizado sobre el sustrato; c) en cuanto a los problemas que involucra la radiación electromagnética utilizada, se resuelven en general pues, por ejemplo, las películas delgadas se pueden fabricar con espesores típicamente desde decenas hasta centenas de nm de manera controlada, adicionalmente, se reduce de manera importante la dispersión de luz y se incrementa su transmisión a través de la solución al no haber partículas suspendidas; d) una ventaja importante es que la cantidad de material utilizado es sustancialmente menor, típicamente se utilizan masas del orden de decenas a centenas de microgramo, esto es, al menos dos órdenes de magnitud menores a las cantidades utilizadas en el caso de polvos en que las masas son del orden de miligramos.
Métodos de producción de películas delgadas
Los métodos para preparar películas delgadas se clasifican en métodos físicos y métodos químicos denominados depósito físico en fase vapor (PVD, physical vapor deposition) y depósito químico en fase vapor (CVD, chemical vapor deposition) (Smith, 1995). El primero consiste en pasar un material de la fase sólida a la fase gaseosa (vapor) para, posteriormente, condensar el vapor sobre el sustrato, a este proceso se le conoce como “depósito de la película”. Existen diversas maneras para generar el vapor, la más común y simple es calentar el sólido para fundirlo y más adelante evaporarlo, esta es la denominada evaporación térmica. Otra forma es sublimar el sólido directamente a la fase vapor, mediante su bombardeo con partículas energéticas como iones o electrones, en este caso los iones desprenden átomos y/o iones del material sólido llegando incluso a formar un plasma, el siguiente estado de la materia después del gas. Un ejemplo de este tipo de técnica es la denominada pulverización catódica en la que se bombardea el material fuente (llamado “blanco”) con iones energéticos, típicamente de argón, desprendiéndose partículas del blanco como resultado de la colisión, que se depositan sobre el sustrato para formar la película delgada. Otra de las técnicas de PVD de reciente desarrollo se basa en el uso de luz láser de muy alta intensidad para pasar un sólido al estado de vapor mediante la denominada ablación láser; en este caso se hacen incidir pulsos láser de alta potencia sobre el sólido que, como resultado de la interacción, producen un plasma altamente energético utilizado para formar la película delgada. Es importante mencionar que las técnicas con utilización de plasmas permiten la formación de materiales que usualmente no se formarían bajo condiciones experimentales normales, pues en estos casos se usan condiciones extremas de presión y temperatura lo cual favorece la obtención de fases metaestables de los materiales, mismas que serían difíciles o imposibles de obtener mediante otras técnicas (Eason, 2006). En el depósito quími co en fase vapor, el material precursor de la película está en estado gaseoso o líquido y se pasa al estado de vapor el cual es arrastrado utilizando un gas inerte que se introduce a una cámara de vacío y se hace fluir dentro del reactor en la dirección del sustrato. Los vapores reaccionan y se condensan sobre el sustrato formando una película delgada, la reacción puede ser activada térmicamente mediante calentamiento del sustrato, en el proceso es necesario usar altas presiones para alcanzar altas velocidades de depósito. Los subproductos de la reacción son evacuados de la cámara por el sistema de vacío. En este caso, el espesor de la película se puede controlar con la temperatura, el gradiente de concentraciones, la densidad del gas, o bien, controlando la velocidad del flujo de gas de arrastre (Smith, 1995).
Aplicación de películas delgadas de TiO2 modificadas con Zn para la degradación del colorante verde de malaquita
En esta sección se presenta la aplicación de películas delgadas de TiO2 con diferentes contenidos de Zn utilizadas como fotocatalizadores para degradar el colorante verde de malaquita (VM). Este colorante es ampliamente utilizado en la acuicultura como parasiticida y en alimentos, salud, textiles, y otras industrias con diferentes propósitos. Se utiliza para tratar los ataques de hongos, infecciones y algunas otras enfermedades en una amplia variedad de peces y otros organismos acuáticos. Sin embargo, el uso del VM ha generado mucha preocupación, debido a sus efectos tóxicos, los cuales aumentan con la concentración y el tiempo de exposición. Se ha reportado que causa carcinogénesis, mutagénesis, fracturas cromosómicas y toxicidad respiratoria (Alderman, 1985; Srivastava et al., 2004). No obstante, a pesar de la gran cantidad de datos sobre sus efectos tóxicos, el VM todavía se utiliza como un parasiticida en la acuicultura y otras industrias, lo cual ha motivado investigar métodos para removerlo de aguas residuales. Las películas se obtuvieron utilizando una configuración híbrida en la cual se combina un plasma de Ti producido por ablación láser con un plasma de Zn producido por magnetrón sputtering.
Metodología experimental
Se implementó una configuración de depósito híbrida en la que se combinaron un plasma de TiO2 formado por ablación láser con un plasma de Zn producido por pulverización catódica (sputtering). La cámara de depósito fue evacuada a una presión base del orden de 5 x 10-6 Torr; una vez alcanzada esta presión la cámara se llenó con argón de alta pureza (99.99%) a una presión de trabajo de 3 x 10-3 Torr. El plasma de ablación láser se produjo ablacionando un blanco de TiO2 (1” de diámetro y ¼” de espesor) irradiándolo con el tercer armónico de un láser de Nd:YAG, con emisión en 355 nm, duración de pulso de 5 ns y trabajando a una frecuencia de 10 Hz durante 30 min. Se utilizó una energía por pulso de 50 mJ, la cual fue enfocada con una lente plano-convexa de 40 cm de distancia focal a un área de 1.2 mm, lo que resultó en una densidad de energía de 4.4 J/cm2 para todas las muestras. Las películas delgadas fueron depositadas sobre sustratos de vidrio y silicio (100) colocados paralelos a la superficie del blanco a una distancia blanco-sustrato de 7 cm a lo largo de la línea de expansión del plasma. Las condiciones experimentales utilizadas se establecieron con base en la obtención del TiO2 con las características deseadas determinadas de trabajos previos. El Zn se incorporó a la película por medio de un plasma de Zn generado por pulverización catódica; el plasma se produjo utilizando Ar a la presión de trabajo de 3 x 10-3 Torr empleando una potencia de 20 Watts para pulverizar un blanco de Zn de alta pureza de 2” de diámetro. En este caso la distancia blanco-sustrato fue de 12 cm. Los plasmas obtenidos interactúan en la superficie del sustrato colocado a 45° con respecto a la línea de propagación del plasma de ablación láser. Con el propósito de depositar películas con diferentes contenidos de Zn, como primer paso se determinó la tasa de depósito de zinc utilizando una microbalanza de cuarzo, con este dato se establecieron diferentes tiempos de depósito produciendo espesores totales de Zn de 45 y 75 nm controlados mediante un obturador mecánico. Se estudió el efecto de la cantidad de Zn incorporado en las películas sobre la composición química, la estructura cristalina, las propiedades ópticas, el espesor y la respuesta fotocatalítica. Las propiedades físicas de las películas delgadas se estudiaron de la siguiente manera: la composición se determinó mediante espectroscopía fotoeléctrica de rayos X (XPS, X-ray photoelectron spectroscopy); los espectros XPS fueron adquiridos en los regímenes de baja y alta resolución con un espectrómetro K-Alpha de Thermo Scientific. La microestructura de las películas se caracterizó por espectroscopía Raman, los espectros se obtuvieron utilizando un sistema micro-Raman LabRam 800 de Horiba Jobyn Ivon equipado con un microscopio confocal Olympus BX40 utilizando un objetivo de microscopio 100X, las muestras se excitaron utilizando el segundo armónico de un láser de Nd:YAG (532 nm), todos los espectros fueron calibrados utilizando la señal Raman del silicio monocristalino en 521 cm-1. Las propiedades ópticas se determinaron a partir de mediciones de espectroscopía UV-Vis realizadas en un espectrofotómetro Perkin Elmer lambda 35 en el modo de absorbancia de 300 a 700 nm. Las propiedades luminiscentes fueron estudiadas por espectroscopía de fotoluminiscencia utilizando un espectrofluorómetro FluoroMax 4, Horiba Jobyn Ivon, equipado con una lámpara de xenón de 150W como fuente de excitación. La actividad fotocatalítica se determinó en la degradación del colorante verde de malaquita en solución acuosa (10 μmol/L) activando las películas utilizando un simulador solar, SF150 de Sciencetech, a densidades de potencia del orden de 30 mW/cm2 manteniendo una distancia de 15 cm entre la superficie de la solución y la fuente de luz.
Caracterización de las películas delgadas
En términos generales, las películas obtenidas fueron semitransparentes y se caracterizaban por morfologías superficiales muy lisas con solo algunas partículas submicrométricas dispersadas sobre la superficie como revela la imagen de microscopía electrónica de barrido mostrada en la Figura 6.

Fuente: Elaboración de los autores.
Figura 6 Micrografía de una película delgada de TiO2 con 10.9% at. de Zn que muestra la morfología superficial.
Los espesores medidos por perfilometría variaron de 208 a 263 nm, mientras que los espesores másicos de las películas, estimadas a partir de mediciones de espectroscopía de retrodispersión de Rutherford (RBS, Rutherford backscattering spectroscopy), variaron de 83 a 105 g/cm2, los resultados se muestran en la Tabla 2.
Tabla 2 Composición de las películas delgadas determinada por XPS, así como sus espesores y espesores másicos.
| Muestra | Zn (% at.) |
Ti (% at.) |
O (% at.) |
Espesor lineal (nm) |
Espesor másico (μg//cm2) |
|---|---|---|---|---|---|
| M0 | 0 | 35.0 | 65.0 | 208 | 83 |
| M1 | 10.9 | 26.1 | 63.0 | 239 | 95 |
| M2 | 17.4 | 20.6 | 62.0 | 263 | 105 |
Fuente: Elaboración de los autores.
Los resultados de la composición, obtenidos por espectroscopía fotoelectrónica de rayos X (XPS) muestran que el contenido de Zn fue de 10.9 y 17.4 % at. En la Figura 7 podemos observar los espectros de alta resolución, con el propósito de determinar el entorno químico en que cada elemento se encuentra, correspondientes al oxígeno, titanio y zinc. La Figura 7a muestra los espectros de la región O-1s, dependiendo del contenido de Zn, la posición y la forma de este pico cambia indicando la presencia de diferentes estados químicos; para la muestra sin Zn el pico se encuentra en 529.8 eV y es casi simétrico en buen acuerdo con lo reportado para TiO2 (Abad et al., 2010). Para un contenido de Zn de 10.9% at. la banda, cuya deconvolución se muestra en la Figura 7a, se compone de dos señales con máximos en 529.8 y 531.4 eV; la primera se atribuye al TiO2 mientras que la segunda podría asignarse al ZnTi3O8, cuya composición nominal es Zn = 8.3% at., Ti = 25.0% at. y O = 66.7% at. en concordancia con los resultados de la composición mostrados en la tabla 2. Esto sugiere que esta muestra está formada por una mezcla de titania y el titanato de Zn, ZnTi3O8. Para la muestra con el 17.4% at. de Zn, los resultados de la deconvolución revelan la presencia d un pico en 530.7 eV y otro en 528.2 eV, de acuerdo con lo reportado en (Yanlong et al., 2015), el primero se atribuye a la formación de ZnTiO3, también en buen acuerdo con la composición nominal de este titanato que es Zn = 20.0% at., Ti = 20.0% at. y O = 60.0% at. como se puede ver de los resultados de composición mostrados en la Tabla 2; el segundo, podría asignarse a oxígeno atómico adsorbido en la superficie (Bare et al., 1995). La Figura 7b presenta los espectros de la región Ti-2p. Una vez más, dependiendo del contenido de Zn la posición y la forma de este pico cambian. Para la muestra sin Zn, el pico se encuentra en 458.9 eV y es atribuido al TiO2 (Phani et al., 2007). Para un contenido de Zn de 10.9 at. % el pico se desplaza a una mayor energía y se hace más amplio sugiriendo la presencia de diferentes estados de oxidación del Ti. El espectro correspondiente a la película con el contenido más alto de Zn aparece en 459.3 eV, valor reportado para el ZnTiO3. Por último, la región Zn-2p3/2 que se muestra en la Figura 7c revela un pico en 1021.4 eV atribuido a Zn2+ en ZnTiO3 (Yanlong et al., 2015).
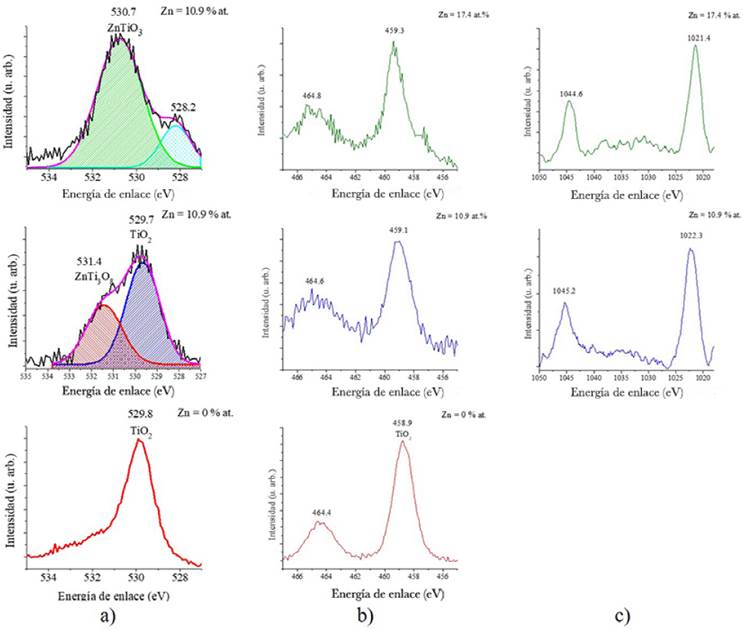
Fuente: Elaboración de los autores.
Figura 7 Espectros XPS de alta resolución para las regiones correspondientes a: O-1s (a), Ti-2p (b) y Zn-3d (c).
La caracterización microestructural se llevó a cabo utilizando espectroscopía Raman, cuyos resultados se exhiben en la Figura 8. El espectro de la película sin Zn presenta picos de 144, 236, 444 y 611 cm-1, los cuales son característicos de la fase rutilo del TiO2 (Haro-Poniatowski et al., 1994). Los espectros correspondientes a las muestras que contienen Zn presentan picos menos intensos y más amplios, lo cual es indicativo de desorden estructural, que se puede atribuir a las distorsiones causadas por la incorporación de Zn en la red del TiO2 y la formación de ZnTi3O8 y ZnTi3O8. En acuerdo con los resultados de XPS, los espectros Raman revelan la coexistencia de titania y titanatos de zinc. La muestra con 17.4 % at. de Zn presenta un pico intenso en 149 cm-1 con bandas adicionales en 250, 360, 450 y 610 cm-1, concordantes con las señales Raman del ZnTiO3 (Budigi et al., 2015).

Fuente: Elaboración de los autores.
Figura 8 Espectros Raman de las películas preparadas con diferente contenido de Zn.
La Figura 9 muestra los espectros de absorbancia obtenidos mediante espectroscopía UV-Vis. Se observa un efecto importante debido a la incorporación de Zn en el TiO2, el borde de absorción se desplaza a longitudes de onda menores, indicando un aumento de la energía de band gap. Se incluye el espectro de una película delgada de ZnO con propósitos de comparación. La energía del band gap se calculó utilizando el método de Tauc (Tauc et al., 1966), encontrándose que el valor del band gap se amplía de 3.0 eV para la muestra solo de TiO2 a 3.4 eV para muestra con el 17.4% at. de Zn. Esto parecería una desventaja ya que la muestra sin Zn se activará con longitudes de onda menores o iguales a 413 nm, mientras que la muestra con 17.4% at. de Zn requiere longitudes de onda menores a 364 nm; sin embargo, la ventaja que se tiene es que la recombinación de los pares electrón-hueco debería, en teoría, reducirse, lo cual podría redundar en una mejor respuesta fotocatalítica.
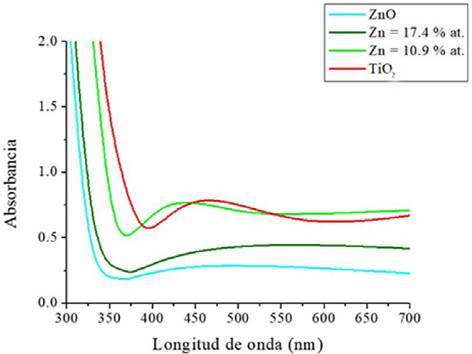
Fuente: Elaboración de los autores.
Figura 9 Espectros de absorción de las películas preparadas con diferente contenido de Zn.
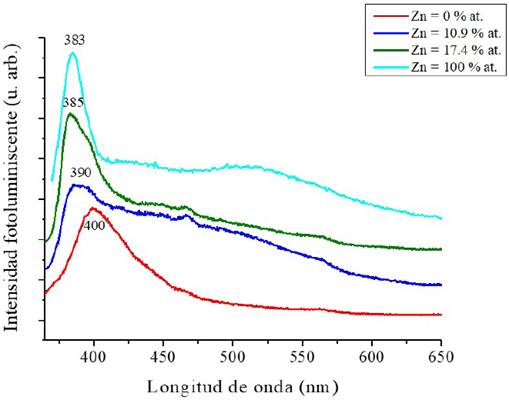
Se utilizó espectroscopía de fotoluminiscencia para determinar las tasas de recombinación electrón-hueco. La Figura 10 muestra los espectros de emisión fotoluminiscente obtenidos usando una longitud de onda de 350 nm como excitación. Se observa que las películas exhiben una intensa banda de emisión con su máximo en la región azul. En el espectro de la película de TiO2, la banda presenta su máximo en 400 nm (3.1 eV) en buen acuerdo con el valor de band gap determinado por espectroscopía UV-Vis. El ensanchamiento de este pico podría atribuirse a vacancias de oxígeno, mientras que la baja emisión en la región visible es indicativa de una baja concentración de defectos sugiriendo buena cristalinidad del material. Los espectros de las películas con Zn muestran un corrimiento al azul que indica un aumento en el valor del band gap, también en acuerdo con los datos de UV-Vis. El espectro de la muestra con 10.9% at. de Zn presenta su máximo en 390 nm (3.17 eV) y se caracteriza por una banda ancha de 420 a 600 nm que podría atribuirse a vacancias de oxígeno y defectos de estado (Fernández et al., 2005) lo que sugiere un material con un mayor número de defectos. Este resultado está de acuerdo con los resultados de espectroscopía Raman presentados previamente que revelaron una red altamente distorsionada. Para la muestra con 17.4% at. de Zn la banda de emisión se desplaza a longitudes de onda más bajas, 385 nm (3.22 eV), y se estrecha considerablemente indicando una concentración de defectos baja sugiriendo una mejora en la calidad cristalina, aunque persiste la emisión debida a vacancias de oxígeno y defectos de estado. Es importante observar que la incorporación de Zn en general aumenta la intensidad de la señal fotoluminiscente, indicativo de una mayor tasa de recombinación de pares electrón-hueco, situación que podría atribuirse al hecho de que las vacancias de oxígeno pueden enlazarse fácilmente a los electrones formando excitones traduciéndose en una mayor intensidad fotoluminiscente (Jing et al., 2004). El espectro fotoluminiscente de una película ZnO caracterizada por una banda de emisión estrecha en 383 nm (3.23 eV) se incluye como referencia.
Evaluación de la actividad fotocatalítica de las películas delgadas
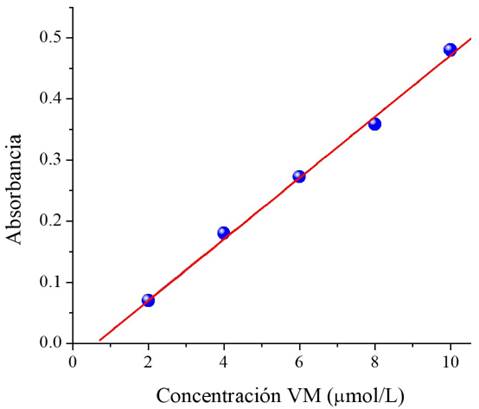
La actividad fotocatalítica se evaluó en la degradación del colorante verde malaquita (VM), usando una solución acuosa con una concentración de 10 μmol/L. Como primer paso, se determinó la relación de la absorbancia en función de la concentración del colorante. Para ello, se prepararon diferentes soluciones con concentraciones conocidas para establecer una curva de calibración, la cual se muestra en la Figura 11. Se observa una relación lineal entre la absorbancia y la concentración de verde de malaquita, cuya relación funcional se obtuvo mediante un ajuste lineal por mínimos cuadrados, con un coeficiente de correlación de 0.995, encontrándose la siguiente relación:
Donde A, es la absorbancia y CVM la concentración de verde de malaquita; por lo tanto, la concentración de VM en términos de A es:
Nota: El sistema de fotodegradación se preparó introduciendo la película delgada (1 cm2) en 25 ml de la solución de VM, posteriormente, el sistema de reacción se puso en agitación en la oscuridad para establecer el equilibrio de adsorción entre la solución del colorante y el fotocatalizador. La reacción dio inicio, iluminando el sistema con luz visible utilizando un simulador solar a densidades de potencia del orden de 30 mW/cm2. Posteriormente, la intensidad de la banda de absorción característica del VM, con su máximo en 619 nm, se midió mediante espectroscopía UV-Vis.
Fuente: Elaboración de los autores.
Figura 11 Curva de calibración absorbancia-concentración del verde de malaquita.
El grado de degradación del colorante se determinó a partir de la disminución del máximo de su banda de absorción característica utilizando la curva de calibración previamente obtenida. Esto se hizo tomando alícuotas de la solución tratada cada 15 minutos durante la reacción hasta 120 min; en la Figura 12 se observa un caso de cómo disminuye la intensidad de la absorbancia con el tiempo de reacción. Es importante mencionar que la señal fotoluminiscente está directamente relacionada con la rapidez de recombinación de las cargas fotogeneradas, los pares electrón-hueco, y en consecuencia se espera una respuesta fotocatalítica más baja de la muestra con 10.9% at. de Zn y una respuesta más alta para la muestra con 17.4% at.

Fuente: Elaboración de los autores.
Figura 12 Disminución de la intensidad de la curva de absorción característica del verde de malaquita como función del tiempo de reacción.
En la Figura 13 vemos el grado de degradación del colorante VM en función del tiempo de reacción. Se ve claramente que la película con 17.4% at. de Zn alcanza un grado de conversión máximo cercano al 58% después de 120 minutos de tiempo de reacción, casi un 100% mayor que la película solo de TiO2, que solo alcanza alrededor del 29%. La película que contiene el 10.7% at. de Zn alcanza el 40% de la degradación, como se espera.
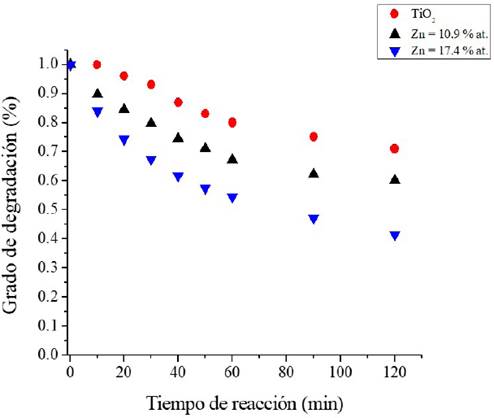
Fuente: Elaboración de los autores.
Figura 13 Grado de degradación del VM como función del tiempo de reacción para las tres películas evaluadas como fotocatalizador.
La constante cinética de la rapidez de reacción de la fotodegradación del verde de malaquita se determinó empleando el modelo cinético de pseudo-primer orden, mediante la ecuación:
donde C es la concentración al tiempo t, C0 es la concentración inicial y k es la constante de rapidez de la reacción. Graficando ln(C0 /C) vs t y realizando un ajuste lineal, la pendiente de la recta es la constante de rapidez. La Figura 14 muestra el gráfico de ln(C0 /C) vs tiempo de reacción, en los tres casos se observa un comportamiento lineal, lo que sugiere una cinética de primer orden. Las constantes cinéticas, k (mín-1), se determinaron a partir de ajustes lineales usando regresiones lineales por mínimos cuadrados. Los valores obtenidos se muestran en la Tabla 3.
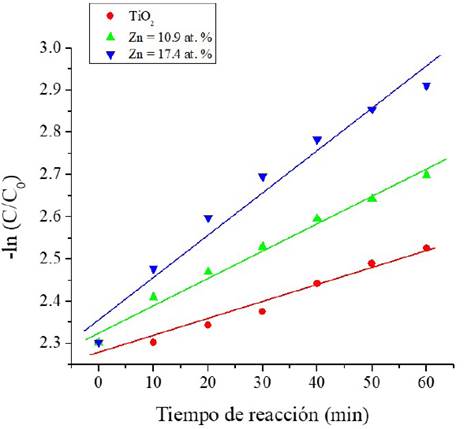
Fuente: Elaboración de los autores.
Figura 14 Gráficos para determinar las constantes cinéticas de rapidez de reacción para las tres películas probadas como fotocatalizador.
Tabla 3 Constantes cinéticas determinadas de la Figura 14.
| Muestra | kapp (mín-1) | R2 |
|---|---|---|
| TiO2 | 0.0040 ± 0.00035 | 0.956 |
| Zn = 10.9% at. | 0.0063 ± 0.00033 | 0.983 |
| Zn = 17.4% at. | 0.0098 ± 0.00081 | 0.960 |
Fuente: Elaboración de los autores.
Con el propósito de determinar si el uso de las películas delgadas preparadas tiene alguna ventaja sobre el uso de catalizadores en forma de polvo, se comparó con la actividad fotocatalítica de uno de los fotocatalizadores comerciales más conocidos, el Degussa P25 (Ohtani et al., 2010). En este caso se utilizaron 25 ml de solución de VM a la cual se le agregaron 50 mg del fotocatalizador lográndose un orden del 70% de degradación después de 120 min de irradiación, 2.4 veces mayor que la película delgada de TiO2 y solo 1.2 veces mayor que la película delgada con la mejor respuesta fotocatalítica. Parecería que el fotocatalizador comercial en forma de polvo es mejor al dar una mayor respuesta, aunque es importante resaltar dos ventajas inmediatas con el uso de películas delgadas, la recuperación del fotocatalizador de la solución es muy simple en el caso de la película delgada, y más importante aún, la cantidad de masa utilizada es mucho menor, 105 μg comparados con 50 mg (50,000 μg), esto es, 476 veces menos masa.
Conclusiones
Se presentaron las ideas generales de los procesos en los que se basa la fotocatálisis discutiéndose los problemas asociados con el uso de polvos como catalizadores, así como los asociados con la radiación electromagnética utilizada para la activación del catalizador. Se discutió la alternativa de usar materiales en forma de película delgada describiendo las ventajas principales que esto representa, siendo estas su fácil recuperación de la solución tratada, así como la muy baja cantidad de material utilizado. Se presentan los resultados obtenidos al sintetizar películas delgadas de TiO2 modificado con Zn mediante una ruta de síntesis novedosa en la que se combina un plasma producido con láser con un plasma producido por pulverización catódica, que permite obtener películas delgadas formadas por mezclas de TiO2 y dos titanatos de Zn dependiendo de la carga de Zn. Las películas delgadas se utilizaron como fotocatalizadores para la degradación del colorante verde de malaquita encontrándose que las películas con Zn logran mayores grados de conversión que la película solo de TiO2; en particular, la muestra con 17.4% at. de Zn alcanzó un grado de conversión máximo aproximadamente 100% mayor que la película solo de TiO2. Se mostro también que los materiales preparados tienen algunas ventajas importantes comparados con el uso de un fotocatalizador comercial.











 nueva página del texto (beta)
nueva página del texto (beta)