Introducción
Un catalizador es una sustancia que incrementa la velocidad a la que una reacción química se aproxima al equilibrio, sin aparecer en el producto final y sin desaparecer durante la reacción. Un catalizador puede también modificar la distribución de productos (selectividad). Normalmente, los catalizadores proporcionan un mecanismo que involucra un estado de transición diferente al del proceso no catalizado y una menor energía de activación (Zanella, 2014).
El oro es un metal que, a pesar de tener propiedades químicas muy interesantes, por mucho tiempo fue considerado como un material poco activo en catálisis. No obstante, a finales de la década de los ochenta, cuando Haruta y colaboradores mostraron que nanopartículas de oro soportadas (<10nm) era capaces de catalizar la reacción de oxidación de CO a baja temperatura (Haruta et al., 1989), se despertó un gran interés por parte de la comunidad científica por este metal en forma nanométrica. Hoy en día, los catalizadores basados en oro son objeto de una intensa investigación debido a su potencial aplicación en áreas como la catálisis (reacciones de abatimiento de la contaminación atmosférica) (Corti et al., 2007; Ruiz et al., 2011; Zanella, 2014), biología (nanopartículas de oro usadas como biosensores) (Ghazi et al., 2018; Ma et al., 2018), química (síntesis de compuestos, por ejemplo, azocompuestos aromáticos, polímeros, etc.) (Combita et al., 2014; Chen et al., 2008), ciencia de superficie (estudio de catalizadores modelo para explorar la relación estructura-propiedad de los catalizadores de polvo) (Dien et al., 2019), nanotecnología (fabricación de envases resistentes a la abrasión y con propiedades antimicrobianas) (Chaudhry et al., 2008), entre otras. Dentro de las reacciones de interés ambiental catalizadas por nanopartículas de oro soportadas, la oxidación de la molécula de monóxido de carbono (CO) es una de las más estudiadas, al ser uno de los contaminantes más abundantes en la atmósfera que resulta tóxico al ser respirado y puede causar múltiples afectaciones a la salud de las personas, por lo cual es muy importante transformarlo a sustancias menos tóxicas como el CO2. Dada su relevancia, en los últimos años diversos trabajos de investigación se han enfocado en determinar la influencia que tienen factores como el soporte, el estado de oxidación del oro, la forma y el tamaño de las partículas, pues la combinación de estos y algunos otros factores como el método de síntesis y las condiciones de activación tienen una influencia importante en la actividad presentada por los catalizadores de oro. En el caso del soporte, su naturaleza ha resultado un factor sobresaliente, al poder influir indirectamente en la forma y tamaño de las nanopartículas de oro debido a las interacciones metal-soporte (Janssens et al., 2006). Además, en la reacción de oxidación de CO, los óxidos reducibles pueden suministrar oxígeno y ayudar a la activación de este (Aiqin et al., 2013). Por otra parte, se ha reportado que las nanopartículas menores a 3 nm son las mayormente responsables de la actividad en reacciones catalíticas, debido a la presencia de un mayor número de sitios de baja coordinación (esquinas, bordes e imperfecciones) en la superficie de las partículas de oro (Haruta, 1997, 2003). En este aspecto, López-Acevedo y colaboradores señalaron que cúmulos de oro menores a 2 nm, también podrían adsorber O2 y por lo tanto disminuir la barrera de activación para la oxidación de CO, beneficiando la actividad (López-Acevedo et al., 2010). En cuanto al mecanismo de reacción, se sugiere que el CO es adsorbido en la superficie de las partículas de oro, en donde se oxida a CO2, mientras que la adsorción y activación del oxígeno molecular aún es un tema controversial. En general, se ha propuesto que el oxígeno puede adsorberse y activarse en: 1) partículas de oro atómico o molecular, 2) en la interfase entre las partículas y el soporte, o bien, 3) a través de oxígeno de la red del soporte de óxido metálico (Widmann et al., 2016). A pesar de que los catalizadores soportados de oro han resultado efectivos para catalizar una gran cantidad de reacciones además de la oxidación de CO, su aplicación se ha visto limitada debido a ciertos factores, entre los cuales se destacan la sinterización de las partículas, el cambio del estado de oxidación del oro, sensibilidad a la humedad o el envenenamiento del catalizador (Konova et al., 2004; Hao et al., 2009; Delannoy et al., 2013; Haruta, 2011). Por tal motivo, la investigación de sistemas bimetálicos basados en oro ha despertado interés en los años recientes, ya que la presencia del segundo metal elimina algunas de las restricciones ya mencionadas, gracias a la presencia de efectos estructurales (ensamble) y electrónicos (ligando), que pueden actuar individual o colectivamente para proporcionar una mayor actividad, selectividad y/o estabilidad (Aiqin et al., 2013; Aguilar-Tapia, 2017). Hoy en día, un gran número de catalizadores bimetálicos son estudiados debido a su aplicación en diversas reacciones químicas, por ejemplo, el sistema bimetálico Ir-Sn ha mostrado mejorar la selectividad en la reacción de deshidrogenación de propano, el sistema Ni-Co es un catalizador efectivo para la reformación en seco del metano, mientras que el catalizador Pt-Pd es un material que ha resultado prometedor para la fotoproducción de hidrógeno (Gallo et al., 2013; Horlyck et al., 2018; Caudillo-Flores et al., 2018). Por otra parte, los catalizadores bimetálicos basados en oro también son ampliamente investigados dada su eficiencia para catalizar diferentes reacciones, entre ellas, la oxidación de CO a baja temperatura, la degradación fotocatalítica de contaminantes orgánicos en agua, la hidrogenación selectiva de acetileno, etc. (Sandoval et al., 2015; Darabdhara et al., 2018; Pongthawornsakun et al., 2018).
Por su parte, el estaño es un semimetal empleado también en el área de catálisis, ya sea como soporte (SnO2) o como promotor en reacciones de oxidación. Los sistemas bimetálicos Pt-Sn y Pd-Sn han sido los más estudiados (Urresta et al., 2014; Wang et al., 2006; Taniya et al., 2012; Freakley et al., 2016). En particular, algunos estudios han mostrado que la combinación Pt-Sn muestra un efecto sinérgico en la reacción de oxidación de CO a baja temperatura, el cual es resultado de la formación de sitios Snn+-Pt, mismos que se forman in situ durante la reacción (Margitfalvi et al., 2001; Michalak et al., 2014). Por otro lado, pocos son los trabajos difundidos sobre la aplicación del sistema Au-Sn en la reacción de oxidación de CO (Wang et al., 2006, Yu et al., 2008). En uno de los trabajos más representativos (Sodomi et al., 2009), se plantea un efecto sinérgico resultado de la presencia de nanopartículas de óxido de estaño. Se sugiere que la reducibilidad de los óxidos de estaño modifica la densidad de carga de las partículas de oro, lo cual permite la activación del O2 y la estabilización de clusters pequeños de oro. A la fecha, no hay reportes relacionados con la síntesis de catalizadores Au-Sn preparados por depósito precipitación con urea (DPU) y dado que el oro y el estaño son metales miscibles entre sí, el objetivo del presente trabajo es sintetizar catalizadores bimetálicos Au-Sn/TiO2 y determinar la influencia que tienen los parámetros de la síntesis en la obtención de un catalizador bimetálico que, en comparación con los respectivos monometálicos, muestre un posible comportamiento sinérgico en la reacción de oxidación de CO.
Procedimiento experimental
Síntesis de catalizadores
Los catalizadores monometálicos y bimetálicos Au-Sn/TiO2 fueron preparados utilizando Na2O3Sn•3H2O y SnCl2 como precursores del estaño y HAuCl4•3H2O como precursor de oro (todos de la marca Sigma-Aldrich). En todos los catalizadores la carga nominal de oro fue 3% y de estaño 1.8% para mantener una relación molar 1:1 en los catalizadores bimetálicos. Los catalizadores monometálicos se prepararon por el método DPU (Zanella et al., 2002 y 2004), mientras que catalizadores bimetálicos se sintetizaron siguiendo dos procedimientos, el depósito secuencial y el co-depósito. En los catalizadores bimetálicos preparados por DPU secuencial se realizaron algunas modificaciones del procedimiento: 1) el orden del metal depositado, y, 2) un tratamiento intermedio con aire o hidrógeno a 300 ºC después de depositar estaño y previo al depósito del oro. Por otra parte, en los catalizadores preparados por co-depósito los precursores de los metales son colocados simultáneamente en el sistema. Una serie de 4 catalizadores preparados por este método fue preparada modificando las relaciones molares Au:Sn (1:2, 1:1, 1:0.5 y 1:0.25), en todos los casos el oro se mantuvo fijo al 3%. Las condiciones óptimas de activación se encontraron tratando térmicamente los catalizadores a diferentes temperaturas durante 2 horas bajo un flujo de aire o H2, utilizando una rampa de 2 ºC/min.
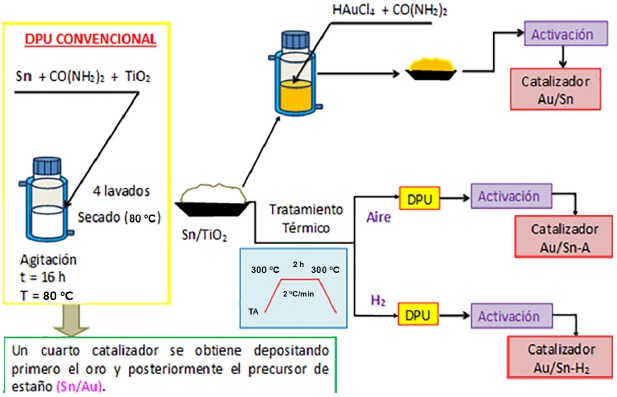
La Figura 1 muestra un diagrama general del procedimiento y las modificaciones hechas a este para preparar una serie de 4 catalizadores bimetálicos preparados por DPU secuencial a partir del precursor Na2O3Sn•3H2O. Otra serie de materiales fue preparada a partir de SnCl2.
Fuente: Elaboración de los autores.
Figura 1 Esquema de la síntesis por DPU secuencial a patir de Na2O3Sn•3H2O y las modificaciones hechas durante el procedimiento.
En la Tabla 1, se muestra la nomenclatura utilizada para cada uno de los catalizadores preparados y se especifican las condiciones de síntesis. En el caso de los catalizadores bimetálicos preparados por depósito secuencial, su nomenclatura incluye una diagonal que separa los símbolos de cada elemento depositado y señala que el primer elemento que aparece dentro del nombre corresponde al metal que se depositó en segundo lugar. El subíndice “Cl” indica que el precursor empleado fue cloruro de estaño.
Tabla 1 Nomenclatura de los catalizadores preparados y condiciones de síntesis.
| Nomenclatura | Precursor de Sn | Método de preparación | Orden de depósito de los metales | Tratamiento térmico intermedio |
|---|---|---|---|---|
| Au/TiO2 | ----- | DPU | ----- | ----- |
| Sn/TiO2 | Na2O3Sn•3H2O | DPU | ----- | ----- |
| SnCl/TiO2 | SnCl2 | DPU | ----- | ----- |
| Au/Sn | Na2O3Sn•3H2O | DPU Secuencial |
|
----- |
| Au/Sn-A | 300 °C en aire | |||
| Au/Sn-H2* | 300 °C en H2 | |||
| Sn/Au | 1) Au ; 2) Sn | ----- | ||
| Au/ SnCl* | SnCl2 |
|
----- | |
| Au/ SnCl-A | 300 °C en aire | |||
| Au/ SnCl-H2* | 300 °C en H2 | |||
| SnCl/Au* | 1) Au ; 2) Sn | ----- | ||
| AuSn 1:1 | Na2O3Sn•3H2O | co-DPU | Simultáneamente | ----- |
| AuSn 1:2 | ----- | |||
| AuSn 1:0.5 | ----- | |||
| AuSn 1:0.25 | ----- |
* Se obtuvo una coloración morada previa a la activación del material.
Fuente: Elaboración de los autores.
Caracterización
Un microanálisis químico por espectroscopía de dispersión de energía de rayos X (EDS) fue realizado utilizando un microscopio electrónico de barrido (SEM) marca Jeol, modelo 5900-LV con un sistema de microanálisis EDS marca Oxford, modelo ISIS.
Un microscopio electrónico TEM JEOL 2010 FasTem equipado con detectores GIF (Gatan image filter), una unidad STEM y HAADF (high angle annular dark fiel) o contraste Z fue utilizado para obtener el tamaño promedio de las partículas y su distribución en el soporte.
Algunos de los materiales preparados fueron caracterizados por UV-visible haciendo uso de un equipo CARY 5000 (UV-VIS-NIR) de la marca Agilent Technologies, equipado con una celda de reflectancia difusa Praying Mantis de la marca Harrick.
La adsorción de CO en catalizadores de oro seguida por espectroscopía infrarroja por reflectancia difusa mediante transformada de Fourier (DRIFTS) es una técnica en la que se emplea al CO como molécula sonda para obtener información del estado de oxidación de las especies de oro soportadas y, en este caso, la influencia del estaño en los sistemas bimetálicos. Para el desarrollo de esta técnica, el catalizador fresco fue colocado en el portamuestra de la celda DRIFT y activado in situ a las condiciones de estudio deseadas. Una vez concluida la activación, el sistema fue purgado con N2 por 10 min. Por último, se hizo pasar un flujo de 5% CO con balance N2 (40 ml/min) durante aproximadamente dos horas. Un equipo Nicolet iS50R FT-IR fue empleado para tomar espectros aproximadamente cada 2.7 min durante todo el proceso de adsorción.
Actividad catalítica
La eficiencia de los catalizadores en la reacción de oxidación de CO se determinó haciendo uso del sistema de micro-reacción en fase gas (in situ research, RIG-150), provisto de un reactor de cuarzo. Este sistema está acoplado a un cromatógrafo de gases (agilent technologies 7820A), el cual permite identificar los compuestos a la salida del reactor y cuantificar el grado de reacción. Para llevar a cabo el análisis, se colocaron 40 mg de catalizador fresco en el reactor de cuarzo y fueron activados in situ mediante un flujo de aire o H2 hasta la temperatura deseada, siguiendo una rampa de 2 ºC/min. La reacción consistió en hacer pasar a través del reactor una mezcla al 1% v/v CO y 1% v/v O2 en balance con N2 que consiste en: 60 mL/min de un gas acarreador (N2), 20 mL/min de 5% (v/v) CO en N2 y 20 mL/min de 5% (v/v) O2 en N2. La mezcla de reacción fue inyectada al cromatógrafo cada 5 minutos, para monitorear la conversión de CO a CO2 respecto a la temperatura. Se utilizó un recirculador para enfriar el reactor y poder monitorear la reacción a temperatura desde -5 ºC.
Resultados y discusión
Síntesis y caracterización de los catalizadores
Un total de 12 catalizadores bimetálicos fueron obtenidos a partir de los dos precursores de estaño seleccionados y los diferentes procedimientos de síntesis empleados.
Los resultados por EDS permiten saber qué porcentaje de cada uno de los metales fue depositado y de esta forma deducir si el método DPU es adecuado o no para depositar ambos metales. De acuerdo con la literatura (Zanella et al., 2005), en los catalizadores monometálicos de oro preparados por DPU este metal se deposita completamente y de acuerdo con los resultados obtenidos, sucede lo mismo con los catalizadores de estaño monometálico preparados a partir de ambos precursores. Por otro lado, se ha observado que cuando se sintetizan catalizadores bimetálicos, la carga real de uno o de ambos metales depositados puede verse disminuida, debido a la formación de especies solubles que se pierden durante los lavados que permiten eliminar especies que no reaccionan (Sandoval et al., 2011). En el caso del procedimiento para sintetizar catalizadores bimetálicos Au-Sn por co-depósito, se observa que el estaño se deposita en aproximadamente un 80% (Tabla 2).
Tabla 2 Caracterización por EDS de los materiales preparados.
| Catalizador | Carga teórica (%peso) | Carga real (% peso) | |
|---|---|---|---|
| DPU | |||
| Au/TiO2 | 3 | 3 | |
| Sn/TiO2 | 1.8 | 1.8 | |
| SnCl/TiO2 | 2 | ||
| DPU Secuencial | |||
| Na2O3Sn•3H2 | Au/Sn |
|
Au=3.1 ; Sn=1.8 |
| Au/Sn-A | Au=3.3 ; Sn=1.8 | ||
| Au/Sn-H2* | Au=3.2 ; Sn=1.9 | ||
| Sn/Au | Au=3.0 ; Sn=1.9 | ||
| SnCl2 | Au/SnCl* | Au=3.4 ; Sn=1.9 | |
| Au/SnCl-A | Au=3.2 ; Sn=2.0 | ||
| Au/SnCl-H2* | Au=2.5 ; Sn=1.8 | ||
| SnCl/Au* | Au=3.5 ; Sn=2.1 | ||
| co-DPU | |||
| Na2O3Sn•3H2 | AuSn 1:1 | Au=3.0 ; Sn=1.8 | Au=3 ; Sn=1.4 |
| AuSn 1:2 | Au=3 ; Sn=3.6 | Au=2.8 Sn=3.7 | |
| AuSn 1:0.5 | Au=3 ; Sn=0.9 | Au=3 Sn=0.7 | |
| AuSn 1:0.25 | Au=3 ; Sn=0.45 | Au=3.5 Sn=0.5 | |
* Color morado después del secado.
Fuente: Elaboración de los autores.
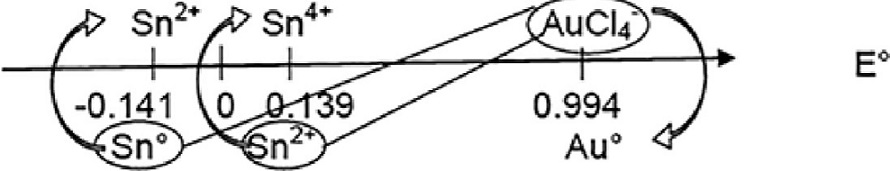
Se sabe que el catalizador monometálico Au/TiO2 sintetizado por el método DPU se caracteriza por presentar un color crema después de la síntesis y cambiar a morado al ser activado y obtener la fase activa (siempre y cuando se obtengan partículas pequeñas, típicamente < 3 nm). No obstante, al introducir el estaño en los catalizadores bimetálicos preparados por DPU secuencial, 4 de ellos presentaron un cambio de color previo a la activación, indicando que se lleva a cabo una reacción redox durante el proceso de síntesis, lo cual puede explicarse al analizar los potenciales de reducción de las especies de estaño y oro reportados en una escala de predicción de reacciones redox (Figura 2).
En los catalizadores bimetálicos preparados a partir de SnCl2, el precursor de estaño reacciona con los productos de descomposición de la urea formando sales, mismas que pueden depositarse o bien disolverse, para formar complejos a través de las siguientes reacciones:
En algunas de estas sales o complejos depositados en el soporte, el Sn debe seguir manteniendo un estado de oxidación 2+, por lo cual, al reaccionar con las especies del precursor de oro, este se reduce a oro metálico. El único catalizador bimetálico sintetizado a partir de SnCl2 que no mostró un cambio de color fue aquel cuya preparación incluyó un tratamiento intermedio con aire (Au/SnCl-A), razón por la cual, las sales o complejos de Sn2+ se oxidaron obteniéndose Sn4+ incapaz de reducir las especies de oro. Por otra parte, el único catalizador bimetálico de estaño sintetizado a partir de Na2O3Sn que cambio de color durante la síntesis fue el sometido a un tratamiento térmico intermedio con H2, lo cual provocó que las especies de Sn4+ presentes se redujeran a Sn2+ o incluso a estaño metálico y provocaran la reducción espontánea del oro.
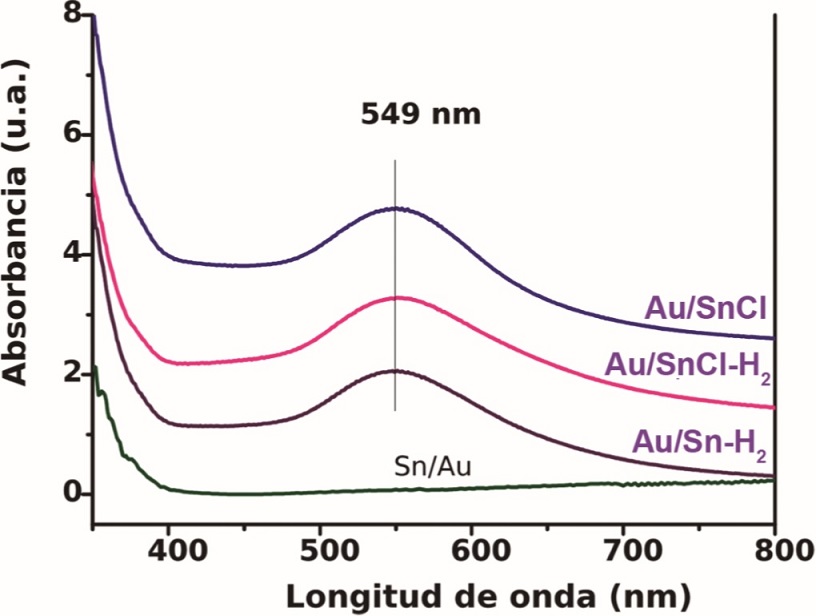
Lo anterior logró corroborarse mediante la caracterización por UV-visible de estos materiales, ya que cuando las nanopartículas son irradiadas con energía en el rango del UV-visible (400 - 800 nm), los electrones oscilan colectivamente dando lugar a la llamada banda de resonancia plasmónica (BRP), la cual es característica de cada material y en el caso de las nanopartículas metálicas de oro en solución, es observada cerca de los 520 nm (Villa et al., 2016). En la Figura 3, se presenta el espectro de absorción de una de las muestras que adquirieron un color crema después de la síntesis (Sn/Au), observándose que efectivamente en estos materiales no se detecta ninguna absorción en la zona característica del plasmón de oro (500-600 nm), mientras que el espectro UV-visible de los 3 catalizadores que presentaron un color morado durante la síntesis, mostraron también una banda de resonancia plasmónica en 549 nm, la cual es asociada con nanopartículas de oro metálico cuando están soportadas.
Fuente: Elaboración de los autores.
Figura 3 Espectros de UV-visible de los catalizadores bimetálicos Au-Sn/TlO2 que presentaron una tonalidad morada durante la síntesis y el catalizador Sn/Au que se caracterizó por una tonalidad color crema.
Por microscopía electrónica de transmisión (TEM) se obtuvieron micrografías representativas de contraste Z (Figura 4), a partir de las cuales se obtuvo el tamaño promedio de partícula y su distribución en los catalizadores más representativos. En general, se aprecian tamaños de partícula promedio similares, aunque también se observa que en los catalizadores preparados por co-depósito o en presencia de cloruros hay una tendencia a presentar un tamaño de partícula ligeramente mayor y una menor homogeneidad, no obstante, se puede asumir que cualquier mejora en el rendimiento catalítico podría ser atribuido a un efecto sinérgico dado por la interacción de los metales y el arreglo final de los átomos en la superficie de la partícula más que al tamaño de esta o a su interacción con el soporte. En la Tabla 3, se presentan los histogramas de cada uno de los catalizadores evaluados por esta técnica y se especifica el número de partículas utilizadas para el análisis estadístico (n), el diámetro promedio de partícula (d) y la desviación estándar (σ) obtenida.

Fuente: Elaboración de los autores.
Figura 4 Imágenes de contraste x de algunos de los catalizadores más representativos: a) Au/TlO2 TT300°C aire, b) Sn/Au TT400°C aire, c) AuSn 1:1 TT300°C aire y d) Au/SnCl-A TT300°C aire.
Pruebas catalíticas
Catalizadores preparados por DPU secuencial
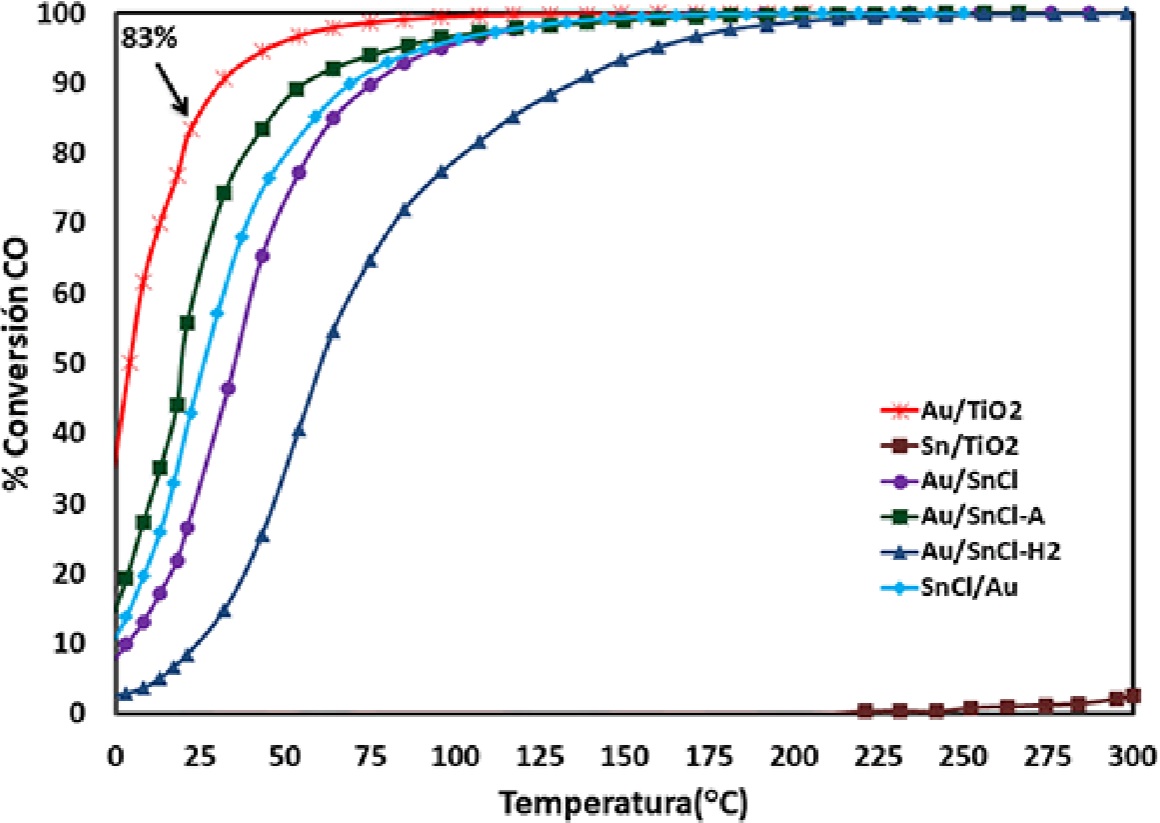
El rendimiento catalítico de los catalizadores preparados está íntimamente relacionado con los precursores utilizados. En este sentido, la actividad catalítica de los catalizadores preparados a partir de SnCl2 se vio seriamente afectada, como se observa en la Figura 5. Este comportamiento puede atribuirse principalmente a dos factores, ambos relacionados con la selección del SnCl2 como precursor: 1) la reducción del oro durante la síntesis (presencia de centros de nucleación previos a la activación), y, 2) la presencia de cloruros, pues si estos no son completamente eliminados durante la síntesis, pueden envenenar a los catalizadores de oro utilizados en la reacción de oxidación CO e inhibir su actividad por el envenenamiento directo del sitio activo o, como lo muestran algunos trabajos teóricos, dan lugar a una débil adsorción de O2 y una baja estabilidad del complejo intermedio CO•O (Broqvist et al. 2004). Dentro de este grupo de catalizadores, el único que no presentó un color morado fue el catalizador Au/SnCl-A, en el cual se evitó la reducción del oro debido a la obtención del SnO2 durante el tratamiento intermedio con aire a 300 ºC, sin embargo, probablemente debido a la presencia de los cloruros y un tamaño promedio de partícula de 4.3 nm se obtuvo una conversión de CO del 55% a temperatura ambiente con respecto al 83% alcanzado por el catalizador monometálico de oro.
Fuente: Elaboración de los autores.
Figura 5 Conversión de CO vs temperatura de los catalizadores monometálicos y bimetálicos Au-Sn/TlO2 preparados por DPU secuencial a partir de SnCl2 y activados a 300°C en flujo de aire.
La influencia que tiene el método de síntesis se observa claramente en los catalizadores preparados por DPU secuencial y las modificaciones realizadas en el procedimiento. A diferencia de los catalizadores preparados a partir de SnCl2, los sintetizados con Na2O3Sn•3H2O presentaron un mejor rendimiento catalítico, pero solo uno de ellos mostró un efecto sinérgico en la reacción de oxidación de CO. Es importante mencionar que los catalizadores fueron activados en flujo de aire a diferentes temperaturas, resultando 400 ºC la temperatura óptima de activación. En la Figura 6, se muestra la actividad alcanzada por estos materiales, observándose en primer lugar que el oro presenta aproximadamente 70% de conversión a temperatura ambiente, mientras que el Sn/TiO2 no es activo sino hasta temperaturas por arriba de los 250 ºC, de tal manera que cualquier mejora en la actividad catalítica a temperatura ambiente es resultado de un efecto de sinergia entre ambos metales más que un aporte individual. Por otro lado, se aprecia que un tratamiento intermedio no favorece la actividad catalítica e incluso se ve disminuida respecto a la referencia monometálica de oro, lo cual puede atribuirse a varios factores, entre ellos, una menor interacción Au-TiO2. En particular, al tratar térmicamente el precursor de estaño en aire, se obtiene SnO2 sobre el cual se podría ver favorecido el depósito de oro en lugar de hacerlo directamente sobre el TiO2. En cambio, cuando el tratamiento intermedio se hace en hidrógeno se obtiene estaño metálico, especie que propicia la reducción espontánea del oro durante la síntesis y que se distingue por adquirir una tonalidad morada. En este caso, se obtiene un catalizador (Au/Sn-H2) que a pesar de tener en su mayoría partículas relativamente pequeñas (3.5 nm) obtuvo apenas el 10% de conversión a temperatura ambiente, por lo cual también cabe la posibilidad de que haya migración del estaño hacia la superficie del catalizador durante el proceso de activación, propiciando en cierto grado la oclusión de las nanopartículas de oro. El catalizador que presentó sinergia en la reacción fue aquel cuya síntesis consiste en depositar en primer lugar el oro y posteriormente el estaño (Sn/Au TT400 ºC en aire), observándose un ligero incremento de la actividad a temperatura ambiente (~86%), lo cual probablemente se relaciona con la formación de óxido de estaño, el cual podría estar activando el oxígeno en la interfase de la nanopartícula de oro y el soporte o inclusive podría estarse comportando como una especie móvil durante la reacción de oxidación de CO. Al activar el catalizador a 400 ºC en un atmósfera reductora (H2) en lugar de aire, se nota que a pesar de tener un menor tamaño de partícula (3.1 nm) de acuerdo con los resultados de TEM, este catalizador logra solo un 4% de conversión de CO a 22 ºC, apreciándose un decremento significativo en comparación al 86% alcanzado cuando la activación se realiza con aire y se obtienen partículas con un tamaño promedio ligeramente mayor (3.7 nm), por lo cual se sugiere que al realizar la activación con H2, el estaño se está reduciendo y segregando aleatoriamente en el catalizador obstruyendo los sitios activos de oro o quizá se está formando una aleación con una mayor proporción de átomos de estaño en la superficie de la partícula.
Catalizadores preparados por co-DPU
El catalizador bimetálico preparado por co-depósito a partir de Na2O3Sn•3H2O también presentó un efecto sinérgico en la oxidación de CO al ser activado a 300 ºC en flujo de aire, presentando aproximadamente un 90% de conversión a temperatura ambiente (Figura 7). No obstante, a diferencia del catalizador bimetálico preparado mediante depósito secuencial, en el cual la actividad se vio inhibida cuando la activación se realizó en una atmósfera reductora, y en cuyo caso sucedió lo opuesto, es decir, se obtuvo un catalizador que también presenta un efecto sinérgico y es equiparable al mostrado cuando la activación se realiza en aire, lo cual podría ser resultado de una mejor distribución de las especies activas en el soporte durante la síntesis y probablemente a la formación de partículas bimetálicas con una mejor distribución de átomos en superficie cuando la activación se realiza con H2. Por otro lado, en algunos de los catalizadores bimetálicos sintetizados, la distribución de tamaño de partícula también podría estar jugando un papel importante en la actividad catalítica, como es el caso de los catalizadores bimetálicos preparados por co-depósito y activados en flujo de aire a 300 y 500 °C, en los cuales se obtuvo un tamaño promedio de partícula de 4 y 4.1 nm, respectivamente, con la diferencia de que, en el primero, aproximadamente el 56% de las partículas son de 3.5 nm, mientras que en el catalizador activado a 500 °C este mismo porcentaje corresponde a partículas mayores a 4-5 nm.
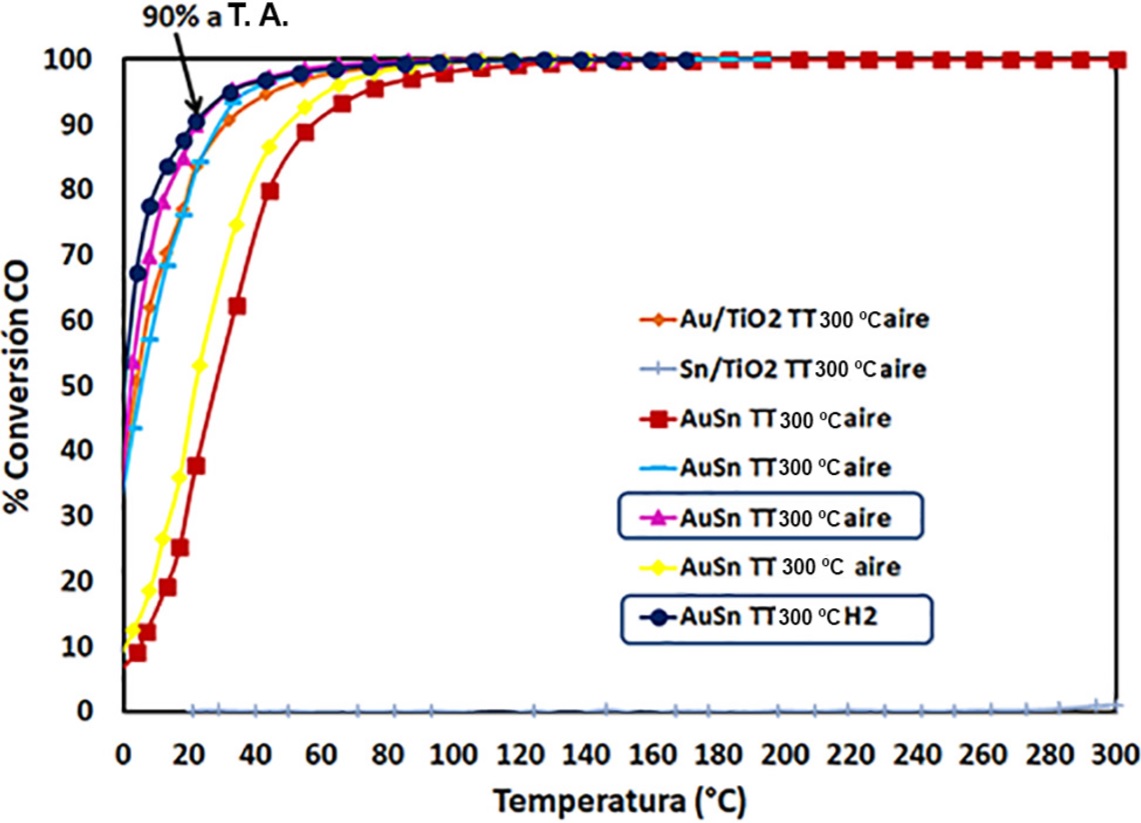
Fuente: Elaboración de los autores.
Figura 7 Conversión de CO vs temperatura de los catalizadores monometálicos y bimetálicos Au-Sn preparados por co-DPU a partir de Na2O3Sn•3H2O.
Al evaluar el desempeño de los catalizadores bimetálicos con diferentes relaciones molares se encontró que la actividad catalítica se ve desfavorecida cuando hay una mayor cantidad de estaño en el sistema (relación 1:2), mientras que se observa una mayor actividad a bajas temperaturas (56% de conversión a 0 °C) cuando los metales Au:Sn tienen una relación 1:0.5, es decir, hay una relación óptima de los metales que favorece la reacción de oxidación de CO (Figura 8).

Fuente: Elaboración de los autores.
Figura 8 Conversión de CO vs temperatura de los catalizadores bimetálicos Au-Sn/TlO2 con diferentes relaciones molares preparados por co-DPU a partir de Na2O3Sn•3H2O.
En general, en la Tabla 4, se observa de forma clara que el desempeño catalítico de los materiales no depende del tamaño de las nanopartículas y que por lo tanto la eficiencia catalítica de los materiales es resultado de otros factores como por ejemplo el arreglo estructural de los átomos de oro y estaño en cada uno de los sistemas bimetálicos.
Tabla 4 Porcentaje de conversión de CO y su relación con el tamaño de partícula de oro.
| Método de síntesis | Catalizador | Conversión (%) | Tamaño de partícula (nm) |
|---|---|---|---|
| DPU | Au/TiO2 TT400 °C aire | 70 | |
| Au/TiO2 TT300 °C aire | 83 | 3.2 | |
| DPU secuencial | Sn/Au TT400 °C aire | 86 | 3.7 |
| Sn/Au TT400 °C H2 | 4 | 3.1 | |
| Au/Sn-A TT400 °C aire | 54 | ||
| Au/Sn-H2* TT400 °C aire | 10 | 3.5 | |
| co-DPU | AuSn TT300 °C H2 | 89 | 3.5 |
| AuSn TT300 °C aire | 90 | 4 | |
| AuSn TT500 °C aire | 38 % | 4.1 | |
| AuSn 1:0.5 TT300 °C aire | 91 | 3.8 | |
| AuSn 1:2 TT300 °C aire | 83 |
Fuente: Elaboración de los autores.
Caracterización superficial de los materiales
Uno de los parámetros que controlan la velocidad de la reacción, objeto de varios estudios, es el estado de oxidación de los sitios activos, mismo que a la fecha sigue siendo un tema controversial. Se han realizado estudios que incluyen la síntesis de nanopartículas de oro soportadas en óxidos no reducibles (inertes), por ejemplo, SiO2 y Al2O3, los cuales no son capaces de activar el oxígeno o transferir carga al soporte. Estos catalizadores han sido sometidos a condiciones de presión, temperatura y presencia de atmósferas oxidantes y reductoras con la finalidad de formar especies de oro con diferentes estados de oxidación, para tratar de determinar bandas características en IR asignadas a CO adsorbido en especies específicas de oro. De manera general, se sabe que los catalizadores de oro pueden formar carbonilos con oro metálico, aniónico o catiónico, sin embargo, la asignación de algunas de estas bandas características aún es polémica (Chakarova et al., 2011; Roze et al., 2009). Por otro lado, al ser el DPU un método de preparación reproducible, se espera que al activar el catalizador de referencia Au/TiO2 con aire a 300 y 400 ºC, respectivamente, la principal diferencia aparente radique en el tamaño de partícula, pues de acuerdo con investigaciones previas, en las que catalizadores de Au/TiO2 son sometidos a diferentes temperaturas de activación y gas de tratamiento, se ha encontrado que el tamaño de nanopartículas de oro soportado crece al incrementar la temperatura de activación y se reduce cuando el gas de tratamiento es hidrógeno en vez de aire (Mahmood et al., 2014; Zanella y Louis, 2005). No obstante, hay una evidente diferencia en la forma como se adsorbe la molécula de CO en el catalizador monometálico activado a 300 y 400 ºC, respectivamente (Figura 9). Mientras que en la muestra monometálica activada a 300 ºC se ve favorecida la adsorción en sitios Aud --CO, en el oro monometálico activado a 400 ºC, al inicio hay una adsorción de CO preferencialmente en sitios de oro metálico que se caracteriza por el crecimiento de la banda en 2105 cm-1, misma que va disminuyendo gradualmente para dar paso a la formación de las bandas asignadas a la adsorción de CO en sitios de oro parcialmente reducido, es decir, a 400 ºC, se presenta una menor transferencia de carga de molécula de CO a las partículas de oro.
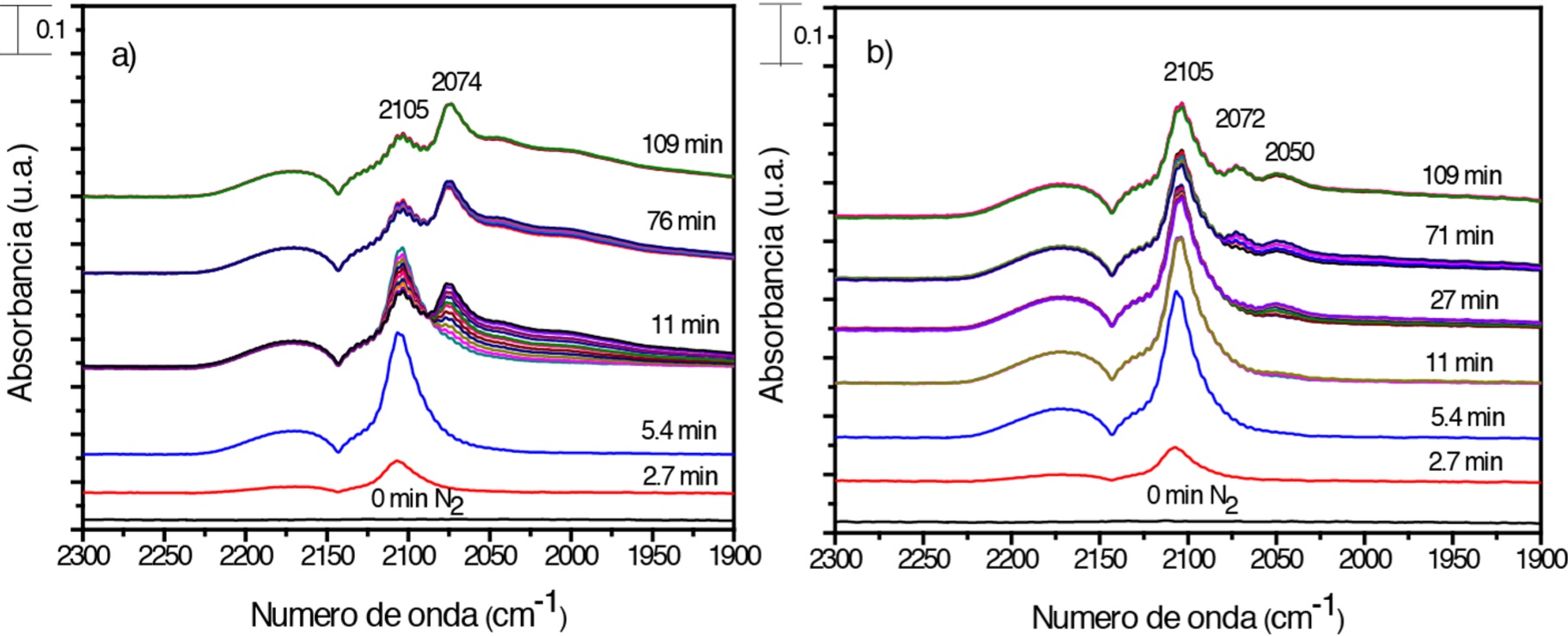
Fuente: Elaboración de los autores.
Figura 9 Espectros DRIFT de adsorción de CO a temperatura ambiente en el catalizador monometálico Au/TlO2 activado in situ con aire: a) 300°C, y, b) 400°C.
En el caso del catalizador monometálico Sn/TiO2, se ha reportado que el Sn no absorbe el CO a temperatura ambiente (Gallo et al., 2013), por lo que cualquier cambio en los espectros de adsorción de CO de los catalizadores bimetálicos con respecto a las referencias monometálicas es indicio de la interacción que existe entre ambos metales.
El comportamiento del catalizador bimetálico Sn/Au, respecto a la referencia de oro, presenta un ligero incremento en la intensidad de la banda relacionada con la formación de sitios Auδ, de lo cual se podría asumir que esta banda está relacionada con partículas de menor tamaño o, bien, que la presencia del estaño favorece la transferencia de carga a la partícula de oro, por lo cual el incremento en la actividad podría ser resultado de un efecto electrónico.
No obstante, cuando el catalizador es activado en una atmósfera reductora, también se presenta un efecto estructural que en vez de potenciar la reacción, la inhibe, lo cual se aprecia en los resultados de las pruebas de reacción y se comprueba al observar los espectros DRIFT obtenidos (Figura 10b), en los cuales se ve que la banda en ~2100 cm-1 tiene una intensidad tan baja que no sobrepasa la de las bandas características del CO gaseoso, solo después de los primeros 15 minutos comienza a formarse una pequeña banda en 2040 cm-1 y, finalmente, a aproximadamente 53 minutos aparece otra banda en 2070 cm-1, observándose que en ambos casos la intensidad es muy baja en comparación con la intensidad mostrada por la referencia monometálica. Este comportamiento sugiere que la activación en H2 favorece la segregación del estaño hacia la superficie de las partículas cubriendo de esta forma los sitios activos de oro e inhibiendo la reacción de oxidación de CO.
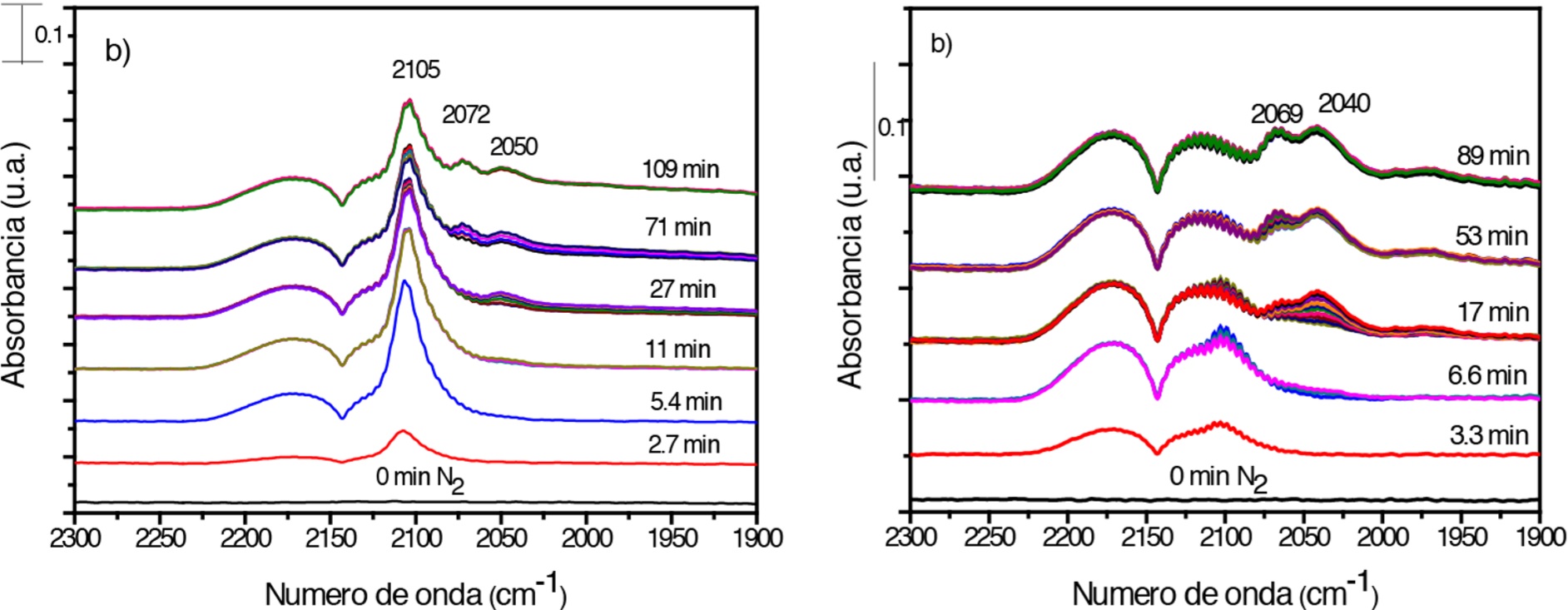
Fuente: Elaboración de los autores.
Figura 10 Espectros DRIFT de adsorción de CO a temperatura ambiente en el catalizador bimetálico Sn/Au activado in situ a 400°C en a) aire, y, b) H2
En el caso del catalizador bimetálico preparado por co-depósito y activado tanto en aire como H2, los espectros DRIFT no fueron muy diferentes entre sí, por lo cual resulta complicado explicar cómo participa el estaño en este sistema, sin embargo, se puede concluir que su presencia modifica la forma en que el oro adsorbe el CO y esto es resultado del método de síntesis, las condiciones de activación o incluso de una suma de ambos factores.
Conclusiones
El método DPU permite depositar estaño en TiO2 utilizando como precursores tanto Na2O3Sn•3H2O como SnCl2. En los sistemas bimetálicos sintetizados por el método secuencial, ambos metales se depositan al 100%, mientras que por co-depósito, el estaño se deposita en aproximadamente un 80% respecto a la carga teórica. La selección del precursor es el parámetro que mayor relevancia tuvo en la actividad catalítica presentada en la reacción de oxidación de CO. En particular, el SnCl2 no permitió la obtención de un catalizador eficiente en la reacción de oxidación de CO con ninguno de los dos métodos empleados. En cuanto a la síntesis de los catalizadores bimetálicos preparados por depósito secuencial, se aprecia que pequeñas variaciones como el orden en que son depositados los metales o un tratamiento intermedio en una atmósfera oxidante o reductora pueden influir significativamente en el desempeño catalítico de los materiales. De los cuatro catalizadores sintetizados por este método, solo el procedimiento que consistió en depositar en primer lugar el oro y posteriormente el estaño permitió obtener un catalizador que presentó un efecto sinérgico en la reacción de oxidación de CO, el cual, dadas las condiciones de activación (400 ºC en aire), se sugiere que es resultado de la activación de O2 favorecida por la presencia de especies de óxido de estaño. Por otro lado, en los catalizadores sintetizados por co-depósito se advierte la formación de partículas bimetálicas y se observa que la relación molar entre los metales también juega un papel importante; dentro de esta serie de catalizadores, la relación óptima para catalizar la reacción de oxidación CO fue Au:Sn 1:0.5, probablemente debido a que una mayor proporción de estaño en la superficie podría provocar la oclusión de los átomos de oro y por tanto inhibir la actividad catalítica. Los resultados obtenidos por DRIFTS muestran que efectivamente hay interacción entre los metales; sin embargo, no fue posible determinar con certeza su naturaleza. Finalmente, el presente trabajo muestra que el DPU es un método viable para la síntesis del sistema bimetálico Au-Sn, el cual posee propiedades interesantes que lo hacen un prospecto para ser evaluado en otras reacciones de interés ambiental.











 nova página do texto(beta)
nova página do texto(beta)