Introducción
La nanotecnología es el futuro que ya llegó. Ha migrado exitosamente del laboratorio a la vida cotidiana, y cada día es más común. Los nanomateriales tienen una gran diversidad de aplicaciones gracias a sus propiedades únicas, sustancialmente diferentes a las de los materiales macroscópicos. Estas nuevas propiedades permiten que los nanomateriales tengan un amplio rango de usos en diversas industrias, como la electrónica, de productos químicos, cosméticos, materiales y energía (Figura 1). Así, la nanotecnología permite crear materiales novedosos y ecológicos, mejorar procesos de producción, optimizar las tecnologías relativas al sector energético y concebir nuevas formas de curar enfermedades, entre otros usos.
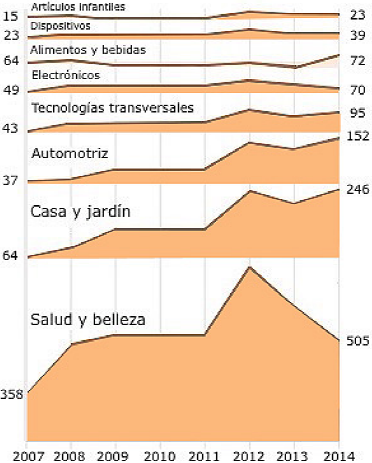
Fuente: Imagen modificada de Vence et al. (2015).
Figura 1 Los nanomateriales en la vida diaria. El número de productos basados en nanomateriales tiende a aumentar con el tiempo, en las áreas comerciales más comunes.
Una de las aplicaciones más prometedoras de los nanomateriales es en el campo de la medicina. Se prevé que el mercado mundial de la nanomedicina alcance 350,800 millones de dólares para el año 2025 (Grand View Reseach, 2017). El desarrollo de nuevas terapias y medicamentos basados en la nanotecnología crece rápidamente, debido a las ventajas con respecto a las terapias tradicionales. Esto ha impulsado la diversificación y producción masiva de los nanomateriales de interés biomédico (NMIB).
Es importante considerar que las propiedades únicas de los nanomateriales influyen en sus interacciones con los factores del entorno y con los seres vivos. Por tanto, es fundamental evaluar la toxicidad potencial que podrían presentan los nanomateriales de interés biomédico en el ambiente y en los sistemas biológicos (PEN, 2013; Malysheva, Lombi y Voelcker, 2015; Vance et al., 2015).
Los nanomateriales de interés biomédico son un componente clave en la clínica, y se usan ampliamente como herramientas de diagnóstico y tratamiento. Actualmente, existe una gran variedad de tipos de nanomateriales para diagnóstico, imagenología, transporte de fármacos, como tratamiento, por mencionar varios ejemplos. Algunas de las más comunes son las nanopartículas (NPs) orgánicas y las NPs metálicas.
Las nanopartículas orgánicas (liposomas, partículas tipo-virus, etc.) representan más de dos tercios de los sistemas aprobados para uso terapéutico en humanos (Yildirimer et al., 2011). Por lo general, son biodegradables y biocompatibles, pero son poco eficientes y tienden a ser inestables (Figura 2). Por otro lado, las nanopartículas inorgánicas (también llamadas NP metálicas) se componen de metales u óxidos metálicos (Figura 2). Según su naturaleza, presentan diferentes tamaños, forma, solubilidad y estabilidad. Por otro lado, presentan problemas de agregación, metabolización y acumulación. Su toxicidad es un tema de investigación constante, pues todavía no se conocen bien sus efectos a largo plazo.

Fuente: Liposoma; partícula tipo-virus; nanotubo de carbón; fullereno y grafeno y puntos cuánticos: uso libre o fuente indeterminada; nanopartículas metálicas: (Vázquez-Muñoz, Avalos-Borja y Castro- Longoria, 2014) y (Re, Moresco y Masserini, 2012); dendrímeros: (Nlate, Ruiz, Astruc y Blais, 2000).
Figura 2 Nanomateriales de interés biomédico (NMIB). Los nanomateriales presentan una gran diversidad de naturaleza química, forma y tamaño, lo que permite que tengan una amplia gama de aplicaciones.
Otros nanomateriales son los puntos cuánticos o las nanoestructuras de carbono (Figura 2), entre las más populares, como los nanotubos o los fullerenos. Sus propiedades las convierten en una buena opción en la clínica (Yildirimer et al., 2011; Chen et al., 2016).
Aplicaciones centrales de los principales NMIB: desde el laboratorio hasta la industria
La investigación en nanomedicina abarca una multitud de áreas. Se espera que los NMIB mejoren la detección, el etiquetado celular y diagnóstico in vivo. Para el tratamiento sirven de transporte dirigido y administración de fármacos, genes y proteínas; también pueden combatir células y tejidos enfermos, y algunos tienen actividad antimicrobiana -o mejoran la actividad de los antimicrobianos convencionales-, entre otros (Robbens et al., 2010; Yildirimer et al., 2011; Rai et al., 2015; Pelaz et al., 2017).
A los NMIB también se les llama nanofármacos, entendiendo éstos como nanomateriales que presentan actividad terapéutica por sí mismos, o que sirven para mejorar la actividad, estabilidad y/o transporte de los agentes clínicos convencionales. Los nanofármacos se han posicionado en el mercado mundial, de manera comercial, en una amplia gama de aplicaciones (Weissig, Pettinger y Murdock, 2014) (Tabla 1). La vía de administración de los NMIB varía según su naturaleza, tal como se muestra en la Figura 3.
Tabla 1 Ejemplos de nanofármacos disponibles comercialmente.
| Tipo | Producto | Descripción |
|---|---|---|
| Liposomas | AmBisome® | Anfotericina B encapsulada en liposomas de 70 nm. Transporte de fármacos: se acumulan preferentemente en los órganos del SFM. FDA, 1997, para infecciones fúngicas sistémicas (IV). |
| DepoDur® | Sulfato de morfina encapsulado en liposomas multivesiculares. Liberación controlada: la morfina se libera durante un período de tiempo prolongado. FDA, 2004, para el dolor crónico. | |
| NPs Metálicas | Feraheme™ | Nanopartículas de óxido de hierro superparamagnéticas recubiertas con dextrano. Segmentación de SFM: El hierro se libera dentro de los macrófagos y se transfiere a transferrina plasmática. FDA, 2009, para anemia por deficiencia de hierro en adultos con enfermedad renal crónica. |
| Virosomas | Rexin-G® | Gen para la forma mutante dominante negativa de la ciclina G1 humana. Partícula de 100 nm. Terapia génica dirigida: específico para colágeno específicamente expuesto. Filipinas, 2007, para todos los tumores sólidos. |
| SFM= sistema de fagocitos mononucleares, FDA= Administración de Medicamentos y Alimentos de los Estados Unidos, por sus siglas en inglés (Food and Drugs Administration). | ||
Fuente: Modificado de Weissig et al. (2014).
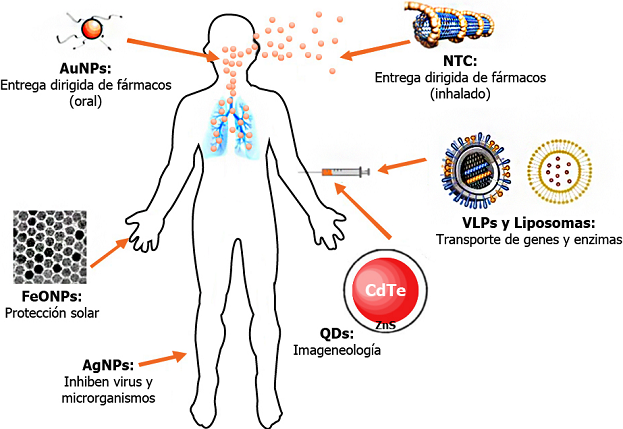
Fuente: Modificado de Yildirimer et al. (2011).
Figura 3 Aplicación de los nanomateriales de interés biomédico. La diversidad de nano-fármacos disponibles favorece que puedan tener aplicaciones -y vías de administración- diversas. NTC= Nanotubos de carbono; VLPS= Partículas Tipo Virus (por sus siglas en inglés Virus Like Particles); QDs= Puntos cuánticos (por sus siglas en inglés quantum dots), un ejemplo son los de núcleo de CadmioTelurio (CdTe) dopado con sulfuro de Zinc (ZnS); FeONPs= nanopartículas de óxido de hierro; AuNPs= nanopartículas de oro; AgNPs= nanopartículas de plata.
¿Los nanofármacos representan un reto para los sistemas biológicos (SB)?
El aumento en el uso de los nanomateriales favorece que se incremente la exposición ocupacional y pública a los nanomateriales. Los NMIB pueden ingresar al cuerpo humano a través de la piel, el tracto digestivo, las vías respiratorias y la sangre, además de que pueden cruzar la barrera hematoencefálica (Cupaioli et al., 2014). Después de que los NMIB cumplen su función, su destino a largo plazo no está claro, debido a que pueden tanto degradarse y ser eliminados o pueden bioacumularse en diferentes órganos y células (Chen et al., 2016; Pelaz et al., 2017).
La nanotoxicología estudia la toxicidad potencial de los nanomateriales en los sistemas biológicos. Esta disciplina es importante debido a la importancia de establecer tanto la eficacia como la seguridad de los NMIB en los seres vivos, para evaluar sus posibles implicaciones (Robbens et al., 2010; Gunsolus and Haynes, 2016). Para tal fin, se desarrollan nuevos métodos para que generen resultados confiables.
Toxicidad de los NMIB en los SB, desde los microrganismos hasta los animales
El incremento en el en el uso de los NMIB ha generado una preocupación por entender mejor cómo influyen sus propiedades en las interacciones con los seres vivos (Malysheva, Lombi y Voelcker, 2015). Actualmente hay incertidumbre sobre los efectos y mecanismos de toxicidad in vivo de estos nanomateriales. Como ejemplo, se asumen que la toxicidad de las AgNPs (nanopartículas de plata) en los sistemas biológicos depende de la complejidad de éste, aunque también se sugiere que no existe tal dependencia, por lo menos en modelos in vitro (Vazquez-Muñoz et al., 2017). Hay pocos trabajos que evalúan la toxicidad relativa de un mismo nanomaterial -de interés biomédico- en sistemas biológicos de distinto grado de complejidad. Para los fines de los estudios de la nanotoxicología, se puede considerar que la complejidad de un ser vivo abarca desde su organización a nivel intracelular -si es procariota o eucariota- y extracelular -si es unicelular o multicelular- hasta su capacidad para generar tejidos verdaderos. Así, bajo esta visión, una levadura es más compleja que una bacteria, pero menos compleja que una planta.
Algunos nanomateriales de interés biomédico alteran los procesos de señalización celular, interactúan con biomoléculas o perturban la estructura celular. Las nanopartículas metálicas pueden afectar la estabilidad de la membrana celular y en algunos casos forman agujeros en ésta. También se ha observado que algunas nanopartículas se bioacumulan, causan daños estructurales y/o inducen morfologías aberrantes en los organismos. En células eucariotas, se ha observado que algunos NMIB causan daños en el núcleo celular, mitocondrias y lisosomas, lo que puede inducir la apoptosis. Los NMIB pueden inducir una producción anormal de especies de oxígeno reactivo (ROS), generando estrés oxidativo. Por otro lado, se ha observado que algunos de estos nanomateriales son citotóxicos y genotóxicos (Yang et al., 2009; Elsaesser y Howard, 2012). Los nanomateriales pueden interactuar negativamente con el sistema inmune, teniendo como consecuencia problemas de inmunogenicidad (Arora, Rajwade y Paknikar, 2012). La funcionalización -con moléculas biocompatibles- de los NMIB ha logrado disminuir esta interacción no deseada (Yildirimer et al., 2011; Rai et al., 2015).
Los estudios de toxicidad in vivo muestran que algunas NPs pueden ser translocadas a los tejidos o incluso cruzar la barrera hematoencefálica (Chen et al., 2016). En el caso de las plantas, las interacciones con los NMIB son poco conocidas, pero se sabe que la biodisponibilidad de los NMIB en el suelo es muy baja (Capaldi Arruda et al., 2015). Por otro lado, las plantas expuestas o tratadas con NPs presentan respuestas diferentes, por lo que la toxicidad depende de la planta evaluada.
Nanotoxicología: retos y perspectivas
Efectos biológicos ¿difíciles de predecir?
Los nanomateriales presentan un riesgo ambiental difícil de prever, debido a sus propiedades físicas y químicas diversas. Evaluar su impacto real en el entorno presenta desafíos experimentales únicos, debido a su tamaño y sus interacciones con el medio y los sistemas biológicos. Además, son novedosos en términos evolutivos, tienen fácil acceso al cuerpo y luego se trasladan a sitios distantes en dosis bajas. (Gunsolus y Haynes 2016). Además, todavía existe un debate sobre la correlación entre el tamaño y la forma de los nanomateriales y su toxicidad. Parte de la falta del entendimiento se debe a la pobre caracterización de los nanomateriales. Otro reto actual es la falta de estandarización de las condiciones de experimentación con sistemas biológicos, por lo que es difícil comparar los resultados de diferentes estudios (Elsaesser y Howard, 2012; Cupaioli et al., 2014; Vazquez-Muñoz et al., 2017). Por otro lado, una estrategia para predecir la toxicidad consiste en recapitular los mecanismos conocidos de toxicidad; un ejemplo serían los iones metálicos en el caso de las nanopartículas inorgánicas. En la Figura 4 se recapitulan algunos aspectos relativos a los estudios de la toxicidad de los NMIB.
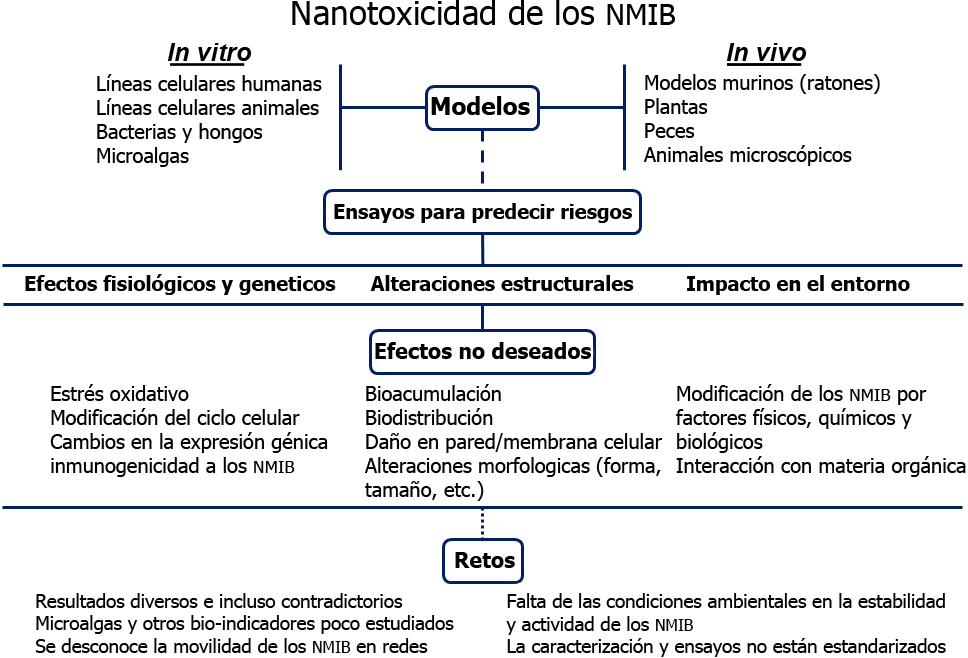
Fuente: Yildirimer et al., 2011; Arora, Rajwade y Paknikar, 2012; Sajid et al., 2014; Cox et al., 2016; Vale et al., 2016; Vazquez-Muñoz et al., 2017; Chen, Giesy y Xie, 2018.
Figura 4 Aspectos relevantes sobre los estudios de nanotoxicología de los NMIB. Algunos NMIB tienen efectos tóxicos que deben de ser considerados para predecir escenarios de riesgo.
¿Cómo los medimos en el mundo real?
En el ambiente y en los sistemas biológicos, los NMIB pueden estar en muy bajas concentraciones, y, además, son propensos a diversas transformaciones. Por lo que la detección de los NMIB es todo un reto tanto para los métodos de análisis como para los instrumentos analíticos. Asimismo, los métodos de caracterización existentes se adaptan mientras se desarrollan otros nuevos, para detectar y cuantificar NMIB, para, eventualmente, poder predecir escenarios de riesgo.
Otro punto por considerar es el de los modelos biológicos. No es suficiente trabajar in vitro con células humanas o in vivo con modelos animales. También se deben incluir microrganismos representativos de los principales grupos de seres vivos, para obtener un panorama global del riesgo que representa cada nanomaterial. Así, un nanofármaco anticancerígeno, por ejemplo, también debería ser evaluado en bacterias, microalgas y plantas, lo que permitiría observar su efecto potencial en el entorno.
La transcriptómica, proteómica y metabolómica (para ARNm, proteínas y moléculas pequeñas, respectivamente) son cada vez más frecuentes para analizar las consecuencias fisiológicas de los NMIB en los seres vivos (Gunsolus y Haynes, 2016). Por otro lado, técnicas de caracterización de materiales permiten evaluar tanto la bioacumulación como la biodistribución de los nanomateriales en las estructuras biológicas. Entre las técnicas comunes se encuentran los análisis de composición química y elemental como la espectroscopía de infrarrojos por transformada de Fourier, o la espectroscopía de rayos X de energía dispersiva (EDX); así como cuantitativas, como el análisis de plasma de acoplamiento inductivo (ICP) por medio de espectrofotometría de emisión óptica (OES).
Regulación: en México y el mundo
El efecto de los nanomateriales en el entorno ha impulsado el desarrollo de estrategias para su evaluación y manejo. Pero a pesar de estas preocupaciones a nivel mundial, las regulaciones para la evaluación de la seguridad de las nanopartículas siguen siendo deficientes (Robbens et al., 2010; Malysheva, Lombi y Voelcker, 2015). En EUA los nanomateriales están regulados bajo varias leyes, según el sector en donde se apliquen (como pesticidas, alimentos o cosméticos, por ejemplo). Por su lado, la Unión Europea regula los nanomateriales a través de la Comisión Relativa al Registro, Evaluación, Autorización y Restricción de sustancias químicas (REACH), y puede aplicar otra normatividad según corresponda a la actividad del nanomaterial. Los cosméticos que contienen nanomateriales también están regulados por la Comisión Europea (Vance et al., 2015; Nanotechnology, 2016).
México regula la nanotecnología mediante el Comité Técnico Nacional de Normalización en Nanotecnologías (CTNNN) del Centro Nacional de Metrología (CENAM) (Pérez Valencia, 2017). En este sentido se han creado Normas Mexicanas tales como la NMX-R-27687-SCFI-2014, donde se plantean terminología y definiciones para nano-objetos-nanopartícula, nanofibra y nanoplaca; la norma NMX-R-80004-1-SCFI-2014, denominada nanotecnologías; el Vocabulario-Parte 1: Conceptos básicos, y, finalmente, la norma NMX-R-80004-3-SCFI-2014, Nanotecnologías-Vocabulario-Parte 3: nano-objetos de carbono (Foladori et al., 2016). El uso terapéutico de los nanomateriales de interés biomédico requiere un marco de regulación ad hoc, que considere el beneficio terapéutico con el posible riesgo de daño. En este sentido, es importante destacar que el efecto en el entorno de los nanomateriales de interés biomédico se ha estudiado poco; asimismo, no hay una regulación clara para su manejo postratamiento.
Predicción de escenarios de riesgo
Es fundamental evaluar la toxicidad de los NMIB con base en estimaciones reales de la exposición en lugar de probar bajo condiciones irreales. Entre los parámetros a considerar se encuentran la concentración, estabilidad, modo y tiempo de exposición, efecto de las condiciones del entorno, entre otros. Un reto fundamental consiste en la dificultad para evaluar la exposición crónica de los NMIB en bajas dosis, debido a que los estudios de toxicidad utilizan modelos animales de vida corta (Elsaesser y Howard 2012).
Conclusiones
La nanomedicina es una de las áreas consolidadas de la nanotecnología. Por tal motivo, evaluar la toxicidad de los NMIB en el entorno es fundamental, pues su presencia es cada vez más común, lo que aumenta significativamente el riesgo de exposición no deseada. Los estudios de nanotoxicidad de estos nanomateriales no deben limitarse a los modelos de interés biomédico, sino incluir indicadores ambientales, pues, eventualmente, los NMIB llegan al entorno.
Aunque la investigación científica considera los peligros de los nanomateriales, el estado actual de la nanotoxicología tiene grandes limitaciones y retos. Por un lado, es complicado evaluar el efecto de la exposición crónica de los NMIB; por otro, los resultados de los diferentes estudios pueden ser muy diferentes, e incluso, contradictorios. A pesar de los esfuerzos mundiales para comprender la transición de la nanotecnología del laboratorio al mercado, todavía es necesario trabajar aspectos fundamentales, como una regulación adecuada y el uso de bases de datos sobre los productos de consumo con una base nanotecnológica.
Finalmente, el futuro ya llegó. Los nanomateriales de interés biomédico llevan más de 20 años en el mercado, y se han consolidado como la nueva generación de agentes terapéuticos, en lo que se desarrolla una mejor tecnología. Por tal motivo, es fundamental considerar tanto sus beneficios como el riego que representan.











 nova página do texto(beta)
nova página do texto(beta)


