Introducción
La nanotecnología representa en nuestros días un activo y dinámico campo de las ciencias aplicadas, dedicada al control y manipulación de la materia a una escala menor a un micrómetro. De acuerdo con la Comisión Europea, se consideran nanomateriales (NMs) aquellos que cumplen con alguna de las siguientes características: 1) al menos una de sus dimensiones es de 1 a 100 nm en el 50% de la distribución del tamaño de partícula; 2) tienen estructuras internas o superficiales en el rango de 1-100 nm, o, 3) tienen un radio de área específica/volumen (A/V) mayor a 60 m2/cm3 excluyendo materiales con tamaño menor a 1 nm (European Comission, 2012). Estas nanoestructuras (del orden de la milmillonésima parte de un metro) generadas y manipuladas intencionalmente por el conocimiento humano le confieren novedosas propiedades al no obedecer las leyes clásicas de la física y la química. Es así que, en la generación de un material nanoestructurado, se puede manipular su vía de síntesis, modular su tamaño, forma, superficie, ancho o largo, si es liso o rugoso, su adherencia o no a diversas superficies, generando con ello propiedades particulares, reportadas en el área de la electrónica, óptica, mecánica y magnetismo, entre otras. Por tal razón hoy en día el uso y la aplicación de NMs son muy comunes en todo el mundo, desde las diferentes fases de la investigación teórica y experimental, hasta su uso y aplicación masiva en la sociedad. Sin embargo, los riesgos potenciales o efectos benéficos en la salud, así como los mecanismos de acción a nivel celular, tisular y orgánico, no han sido dilucidados y validados del todo (Gaffet, 2011).
Esta versatilidad y novedosas aplicaciones de los NMs han generado grandes expectativas y controversias, desde su fabricación hasta su uso y aplicación de forma masiva y a diferentes niveles, como en electrodomésticos, electrónicos, comunicaciones, cosméticos, dispositivos médicos, nanofármacos, armamento, entre otros (Lem et al., 2012).
A pesar de su importante contribución en la sociedad, el uso de la nanotecnología genera intensos debates debido a posibles efectos adversos que pueden ocasionar los NMs cuando entran en contacto con organismos vivos, incluyendo a los seres humanos, lo que pudiera ocasionar serios daños a corto, mediano y largo plazo. A los posibles efectos adversos, se unen la falta de normas regulatorias para el uso, disposición y eliminación de los diversos NMs.
El objetivo del presente trabajo es dar a conocer el fundamento y potencial aplicación de diversos modelos biológicos experimentales que nos han permitido conocer un poco más acerca del efecto de los NMs cuando ingresan e interaccionan en un tejido, órgano o sistema determinado y, con ello, establecer en tiempo real, el perfil fisiológico de un nm determinado. Es decir, como el nm en estudio podría modificar o no las funciones propias de un órgano o sistema determinado en función de su tamaño, concentración, dosis, tiempo y vía de exposición. En otras palabras, este tipo de técnicas experimentales permite poner en contexto el papel y la aplicación de los sistemas fisiológicos como una alternativa preliminar de validación y evaluación de NMs.
Los modelos fisiológicos se han utilizado durante mucho tiempo como herramienta de gran utilidad para el estudio de moléculas endógenas como hormonas, neurotransmisores y otros mediadores bajo condiciones normales o fisiopatológicas como, por ejemplo, alteraciones cardiovasculares, respiratorias, digestivas, por mencionar algunas (Reddy, et al., 2005).
A la fecha, existe una gran gama de modelos experimentales que permiten medir diversos parámetros fisiológicos; sin embargo, algunos de ellos toman tiempos de ejecución prolongados para obtener resultados, que en ocasiones resultan poco confiables, con una alta inversión financiera, gran esfuerzo, y escasos datos que contribuyan a la dilucidación de sus efectos. El uso de los sistemas fisiológicos descritos en este artículo, específicamente los de órganos y tejidos aislados, nos permiten obtener información de diversos parámetros fisiológicos en tiempo real, así como determinaciones de indicadores bioquímicos asociadas con el efecto(s) ocasionado(s) por un NM(s) determinado(s), de forma confiable, rápida y a bajo costo (Meek et al., 2013).
Los modelos fisiológicos ex vivo de tejidos y órganos aislados utilizados para la evaluación de NMs permiten evaluar el funcionamiento particular de un tejido u órgano; por ejemplo, conductos relacionados con el sistema cardiovascular (aorta, arteriolas; mesentérica, etc.), sistema respiratorio (tráquea, bronquios, bronquiolos), sistema digestivo (intestino delgado o grueso); o bien, en el estudio de órganos como el corazón, riñón, pulmón, hígado, así como las comunicaciones bioquímicas involucradas entre los órganos y tejidos (Bachler et al., 2013; Christensen et al., 2010). Nuestro grupo de investigación se ha dado a la tarea de estudiar, evaluar y dilucidar las vías de señalización que confieren diversos NMs, a través de su perfil fisiológico, tal es el caso de las nanopartículas de plata (AgNPs), de oro (AuNPs), nanotubos de carbono (CNTs) y nanopartículas de magnetita (Fe3O4). Los resultados obtenidos a partir de estas investigaciones, nos han permitido profundizar en los mecanismos de acción que disparan estos NMs en diversas estructuras biológicas, así como reorientar las investigaciones futuras en el estudio y conocimiento de sus efectos toxicológicos, potenciales aplicaciones biomédicas, o bien en el establecimiento de medidas de bioseguridad.
A continuación, se describen algunos sistemas de tejidos y órganos aislados, los parámetros fisiológicos que brindan y su interpretación fisiológica, datos que permitirán continuar con estudios más detallados y finos en el conocimiento de los NMs y sus acciones a nivel biológico.
Sistema de tejidos aislados
El sistema de tejidos aislados es el método tradicional para investigar la fisiología y la farmacología de vasos sanguíneos aislados, vías respiratorias e intestinos. Se pueden realizar mediciones isotónicas o isométricas con transductores apropiados. La medición isométrica se utiliza comúnmente para evaluar la contractilidad manteniendo la longitud del tejido constante. Mientras que, en la medición isotónica, la longitud del tejido se acorta por el cambio de fuerzas. El sistema de anillo aislado, acoplado a transductores isométricos, se utiliza principalmente para monitorear la tensión en pequeñas secciones de tejido y anillos (Ko, et al., 2010). El transductor isométrico es un transductor o segmento de material conductor, que permite medir la presión, carga o par, basado en el efecto piezorresistivo, que es una propiedad que poseen ciertos materiales para cambiar su resistencia eléctrica cuando se somete a ciertos esfuerzos. A los anillos o segmentos del tejido en estudio, se les colocan en sus extremos dos ganchos metálicos, que se sumergen en cámaras de doble pared con solución fisiológica oxigenada a 37 ºC. Uno de los ganchos está fijado en el fondo de la cámara, mientras que el otro está conectado al transductor isométrico, acoplado a su vez a un sistema de adquisición de datos, los cuales son visualizados en una computadora por medio de un software especializado, que registra en tiempo real, tanto la tensión basal que se aplica a los anillos en estudio, como los efectos dilatadores (disminución de la tensión) o contráctiles (aumento de la tensión) ejercidos por un agente determinado (Cameron, 1986). De esta forma, el anillo en estudio puede ser tratado o no con sustancias bioactivas control, para contraer el anillo o incrementar su tensión, a través de aumentar su resistencia eléctrica. Adicionalmente, en la solución fisiológica que contiene al anillo, bajo un tratamiento determinado, se puede realizar la cuantificación de una variedad de mediadores o moléculas que se producen de ese tratamiento; tales como óxido nítrico, un radical libre de tiempo de vida media y con efectos duales, citotóxicos (altas concentraciones) o vasodilatadores (bajas concentraciones) (Chuang et al., 2016; Mohamed et al., 2012; Silva et al., 2014); derivados del ácido araquidónico como las prostaglandinas (Ge et al., 2013; Wischke et al., 2013) ; mediadores proinflamatorios, como histamina (Galanzha et al., 2007; Meiring et al., 2005), interleucinas (Basak et al., 2015; Dong et al., 2015; Gerloff et al., 2013), entre otros, o bien evaluar la expresión proteica en el mismo tejido u órgano en el cual se realizan las evaluaciones fisiológicas (Ramírez-Lee et al., 2017a,b; Ramírez-Lee, et al., 2018) (Figura 1).

Fuente: Imagen realizada con base en lo reportado por Bekersky et al., 1983; Epstein et al., 1982; Sivaraman et al., 2005; Rosas-Hernández et al., 2009; González et al., 2011; Bell et al., 2011; Ramírez-Lee et al., 2017a,b y 2018.
FIGURA 1 Órganos, tejidos y cultivos celulares primarios obtenidos a partir del modelo experimental murino.
Los modelos murinos permiten estudiar la estructura y función de diversos órganos, tanto en condiciones fisiológicas como patológicas y constituyen una herramienta esencial en el estudio de las respuestas inducidas por NMs. Estos modelos pueden clasificarse en orgánicos, tisulares y celulares. Los modelos orgánicos más utilizados son el corazón aislado y perfundido de Langendorff, la perfusión aislada de hígado y riñón. Dentro de los modelos tisulares se encuentra el uso de anillos aislados de aorta, tráquea, bronquiolos e intestino delgado (íleon), para la evaluación del tono del músculo liso. Derivado de los modelos tisulares, se realiza el aislamiento y cultivo primario de diversas células, principalmente el endotelio vascular y el músculo liso, tanto vascular como de vías aéreas. Los modelos experimentales expuestos involucran el uso de ratas de la cepa Wistar; sin embargo, pueden ser extensivos a otras cepas de rata (Sprague-Dawley, Wistar Kyoto, etc.) y a otros roedores, incluyendo cobayo y ratón.
Sistema de órganos aislados y perfundidos
Los órganos aislados, por ejemplo, corazón, riñón e hígado, que se separan de un sistema in vivo, como roedores de experimentación, pueden seguir manteniendo su viabilidad, funcionalidad y procesos metabólicos durante un tiempo limitado. En ese periodo de tiempo, el órgano en estudio tiene la capacidad de brindar y mantener parámetros fisiológicos y bioquímicos que aportan conocimiento básico acerca del comportamiento de una sustancia a nivel orgánico, sin tener la interferencia de otras estructuras y mediadores provenientes de un sistema in vivo. Es necesario mencionar que los órganos aislados son perfundidos; es decir, se pasa solución fisiológica a través de los vasos sanguíneos que irrigan al órgano en estudio, manteniendo las condiciones fisiológicas de oxigenación, pH y temperatura.
Corazón aislado y perfundido o preparación Langendorff
El modelo de corazón aislado y perfundido de Langendorff ha permitido obtener descubrimientos fundamentales en la comprensión actual de la biología y la fisiología cardiovasculares. Hay dos modalidades del modelo de Langendorff: a presión constante y a flujo constante (Bell et al., 2011). El principio básico del modelo de corazón aislado de Langendorff es mantener la actividad cardíaca, perfundiendo el corazón a través de las arterias coronarias usando una cánula aórtica insertada en la aorta ascendente. La solución de perfusión entra en el corazón de forma retrógrada a través de la cánula aórtica. La perfusión retrógrada es producida por una presión hidrostática (modelo de presión constante) o por una bomba (modelo de flujo constante) que cierra la válvula aórtica; de esta manera, la solución de perfusión fluye a través de la aorta, de manera contraria a como se lleva a cabo al flujo cardiaco in vivo. Con la columna de solución de perfusión dentro de la aorta, la vasculatura de la arteria coronaria se llena a través de dos estructuras conocidas como ostios coronarios (izquierdo y derecho) (Bell et al., 2011; Zimmer, 1998). Luego, la solución de perfusión cruza el lecho vascular, entra en la aurícula derecha a través de otro vaso conocido como seno coronario y es expulsada a través del ventrículo derecho y la arteria pulmonar (Dhein, 2005; Skrzypiec-Spring et al., 2007). El modelo de corazón aislado y perfundido de Langendorff en el modo de presión constante es ideal cuando se desea estudiar eventos que dependen de la autorregulación del corazón sobre el tono coronario, particularmente cuando hay una ligación en parte del lecho de perfusión, como en modelos de isquemia miocárdica regional. Por otro lado, la modalidad de flujo constante es adecuado para el estudio de la función del tono vascular coronario / músculo liso / endotelio (Bell et al., 2011). Este sistema nos permite monitorear de manera simultánea la presión de perfusión, como índice del tono vascular o el grado de relajación o contracción de los vasos coronarios que irrigan al corazón, medir la fuerza con la que el corazón se contrae, así como la conducción eléctrica en este órgano. Asimismo, con este modelo de estudio se pueden evaluar parámetros bioquímicos asociados con el tratamiento y el efecto fisiológico provocado por éste (Figura 2).
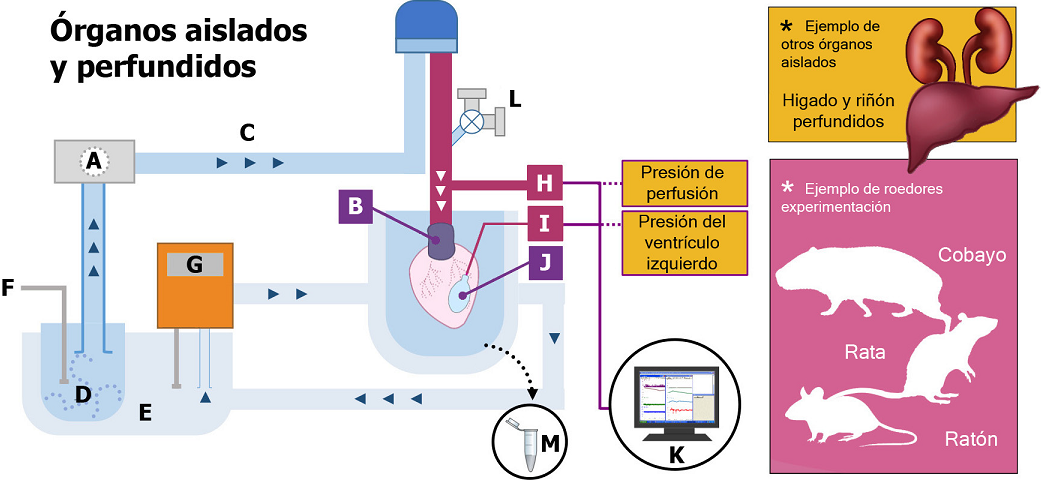
Fuente: Imagen realizada con base en lo reportado por Bekersky et al., 1983; Epstein et al., 1982; Sivaraman et al., 2005; Bell et al., 2011; Ramírez-Lee et al., 2017a,b y 2018.
FIGURA 2 Esquema de un ejemplo característico de órgano aislado y perfundido.
En el modelo de corazón aislado y perfundido de Langendorff (mostrado en la Figura 2), la solución de perfusión es propulsada a flujo constante por la aorta, a través de una bomba peristáltica (A) por medio de una cánula aórtica (B) y una serie de conductos (C). La solución de perfusión (D) se encuentra en un reservorio de doble pared (E) lleno de agua, el cual recibe gasificación (95% de oxígeno y 5% de dióxido de carbono) (F), además establece una temperatura constante (37 ºC) ajustada por un termostato (G). La presión de perfusión (PP) de la solución se refleja en la presión de la circulación coronaria, la cual es registrada en tiempo real por un transductor (H) situado por encima de la cánula aórtica. La presión del ventrículo izquierdo (LVP) es registrada por un segundo transductor (I) conectado a un globo de látex (J) situado en el ventrículo izquierdo. Los dispositivos están, a su vez, conectados a una computadora (K) que permite analizar en tiempo real, los cambios en PP y LVP en respuesta al tratamiento con NMs, el cual es administrado por un puerto de inyección (L) localizado cerca de la cánula aórtica. Durante el experimento, se colectan muestras del efluente venoso (solución de perfusión proveniente del órgano) para el análisis de diferentes metabolitos como óxido nítrico (M). La preparación de órgano perfundido no se limita al estudio de parámetros cardiacos, por el contrario, puede ser acoplado a otros órganos tales como el hígado y riñón(*). De manera similar, tanto el modelo de corazón aislado y perfundido, como el de otros órganos, pueden ser extensivos a otras especies, incluyendo cobayo, rata y ratón.
Otros órganos aislados y perfundidos: riñón e hígado
Lo sistemas fisiológicos que involucran el estudio de riñón e hígado aislado y perfundido brindan la ventaja de poder estudiar acciones directas de distintos compuestos o tratamientos, evitando la influencia nerviosa y de la circulación sistémica o general. La perfusión del riñón aislado se lleva también a cabo mediante una bomba peristáltica, en donde la solución de perfusión ingresa a través de la arteria renal a un flujo constante y su salida es a través de la vena renal, el efluente se colecta para futuras determinaciones bioquímicas. La presión de perfusión se evalúa con un transductor de presión y es registrada en tiempo real a través de un software especial. La recolección de orina, también se puede obtener en este sistema y llevar a cabo los análisis correspondientes. Para determinar la viabilidad de este órgano, una serie de parámetros bioquímicos pueden ser cuantificados y analizados con base en rangos de referencia ya establecidos para dicho sistema, esta validación permite establecer comparaciones cuando un nm sea evaluado. Los parámetros funcionales que brindan información en este órgano son: la presión de perfusión, flujo de perfusión, velocidad de filtración glomerular, reabsorción de glucosa y electrolitos, consumo de oxígeno y la concentración de orina (diluida o concentrada), (Bekersky et al., 1983; Epstein et al., 1982).
Al separar el riñón de la circulación general, se facilita la identificación precisa de los metabolitos generados por este órgano como resultado de una exposición a agentes xenobióticos (Bekersky et al., 1980). Asimismo, este sistema fisiológico es útil para establecer y estudiar mecanismos de acción relacionados con el tono vascular renal (dilatación o constricción del vaso sanguíneo) e inducidos por el agente en estudio, como fármacos, contaminantes, y ahora también, productos derivados de la nanotecnología.
Por otra parte, el hígado puesto en un sistema fisiológico de perfusión como órgano aislado, representa otra pieza clave que por sí misma brinda resultados valiosos. El hígado es considerado como la caja metabólica por excelencia, pues es donde se metabolizan y transforman una serie de sustancias endógenas y agentes xenobióticos (Sivaraman et al., 2005). El sistema de hígado aislado y perfundido se canula a través de la vena porta, la vía biliar y la vena cava en donde se puede controlar y registrar el flujo de perfusión controlado a una temperatura de 37 ºC y oxigenación constante. Asimismo, se pueden cuantificar en la solución que perfunde al hígado, una serie de moléculas y metabolitos derivados de la transformación hepática; por ejemplo, antioxidantes, citocinas, que proveen información sobre algún evento inflamatorio; enzimas como la alfa glutatión-S-transferasa, enzima citosólica predominantemente localizada en los hepatocitos y que representa un parámetro temprano de daño en la membrana de las células hepáticas. También se puede cuantificar lactato deshidrogenasa, una enzima localizada en el citosol y, si se detecta en el efluente hepático, es considerado como un marcador de daño como resultado del rompimiento de las células. Otras moléculas y enzimas de importancia para cuantificar en el efluente hepático son óxido nítrico, calcio, radicales libres, ácidos biliares, fosfatasa alcalina, transaminasas (Vernetti et al., 2016) (Figura 2).
Ejemplo de estudio: las nanopartículas de plata
Las nanopartículas de plata (AgNPs) han sido ampliamente utilizadas en la industria de la medicina y la química debido a sus propiedades antimicrobianas. Sin embargo, la información acerca de sus propiedades biofísicas, funciones y efectos en diferentes niveles de organización biológica, así como su impacto en la salud humana es ambigua o contradictoria. Durante los últimos años, nuestro laboratorio ha investigado los efectos biológicos que confieren las AgNPs a diferentes niveles, y sus posibles implicaciones tóxicas o benéficas en los sistemas cardiovascular (CVS) y respiratorio (RS), principalmente.
Hemos observado, en el sistema de anillos aislados de aorta de rata que las AgNPs exhiben una serie de eventos en función de la concentración, forma y tamaño; por ejemplo, las AgNPs esféricas, de 37.5 nm, inducen dos tipos de efectos: a bajas concentraciones de AgNPs se incrementa la vasoconstricción en anillos aislados de aorta de rata precontraídos o no con fenilefrina, mientras que con altas concentraciones de AgNPs, se observa un efecto vasodilatador en anillos de aorta precontraídos con fenilefrina. Las AgNPs poseen la capacidad de bloquear las acciones de potentes agentes vasodilatadores producidos en el organismo como es la acetilcolina (ACh). Particularmente, a altas concentraciones (50 y 100 µg/ml), las AgNPs estimulan la vasodilatación mediada por la activación de la óxido nítrico sintasa endotelial (eNOS), que produce bajas concentraciones de óxido nítrico (NO), un importante agente vasodilatador y antihipertensivo (Ramírez-Lee et al., 2018). Asimismo, dicho efecto fue dependiente del endotelio (E) (capa interna que rodea los vasos sanguíneos), cuando este se removió, se suprimió la producción de NO y se perdió el efecto vasodilatador (Rosas-Hernández et al., 2009). Un efecto semejante sucedió en corazones aislados y perfundidos, donde también percibimos dos tipos de efectos semejantes a los observados en vasos sanguíneos. Con estos efectos fisiológicos fue posible evaluar las respuestas inducidas por las AgNPs, así como el estudio de los posibles mecanismos de acción involucrados. Por lo cual se utilizaron cultivos celulares provenientes de los vasos coronarios que irrigan al corazón y que modulan la relajación y contracción. En estos estudios, se encontró que la viabilidad celular disminuyó y aumentó la citotoxicidad cuando las células fueron expuestas a bajas concentraciones (0.1 -10 µg/ml), mientras que altas concentraciones de las nanopartículas (50 y 100 µg/ml) estimularon la proliferación celular ligada al incremento de NO derivado de la activación de la sintasa de NO endotelial (eNOS). Este tipo de técnicas y modelos fisiológicos nos han permitido evaluar el perfil fisiológico de las AgNPs así como estudiar sus efectos en el sistema cardiaco en condiciones de diabetes e hipertensión. Bajo esas condiciones patológicas, se observó que las AgNPs generan toxicidad cardiaca al incrementar el estrés oxidativo y dañar las fibras musculares de corazón, y, en consecuencia, generar la pérdida de la función cardiaca (Rosas- Hernández et al., 2009; González et al., 2011 y 2016; Ramírez-Lee, et al., 2017ª y 2018).
Por otro lado, y a diferencia de los efectos observados a nivel vascular, en anillos aislados de tráquea (estructura que forma parte del SR), se demostró que AgNPs poseen un efecto contráctil similar al ejercido por la acetilcolina (ACh) en este sistema. Además, el evento contráctil estimulado por AgNPs depende de la activación del receptor muscarínico de ACh y a la generación de NO, que fue 25 veces superior en comparación con su control (sin tratamiento con AgNPs). Considerando que el músculo liso de vías aéreas (MLVA) es el blanco celular determinante del tono de las vías respiratorias, y tomando en cuenta que el primer enfoque experimental sugiere que las AgNPs podrían tener acciones sobre el mlva, la exposición directa de células de mlva a AgNPs en la caracterización de sus acciones en el sr. Los resultados a nivel celular indicaron que AgNPs exhiben un efecto anti-proliferativo asociado con la activación del receptor muscarínico de ACh y con la generación de NO derivado de la activación de la sintasa de óxido nítrico inducible, capaz de mediar efectos citotóxicos y citostáticos del sistema inmune (Ramírez-Lee et al., 2014). En esta investigación a nivel del SR y SCV, es importante destacar que los efectos inducidos por las AgNPs dependen del blanco celular, tisular y orgánico. Estas acciones nos permitirán integrar un panorama general acerca del comportamiento o perfil fisiológico de las AgNPs (u otros NMs), y, en consecuencia, tomar de decisiones sobre los futuros experimentos a realizar. Los trabajos actuales y futuros en nuestro grupo de investigación permitirán complementar los resultados previos y establecer una relación con la información de otros estudios, por ejemplo, cultivos celulares, determinaciones moleculares y modelos de estudio in vivo (Figura 3).
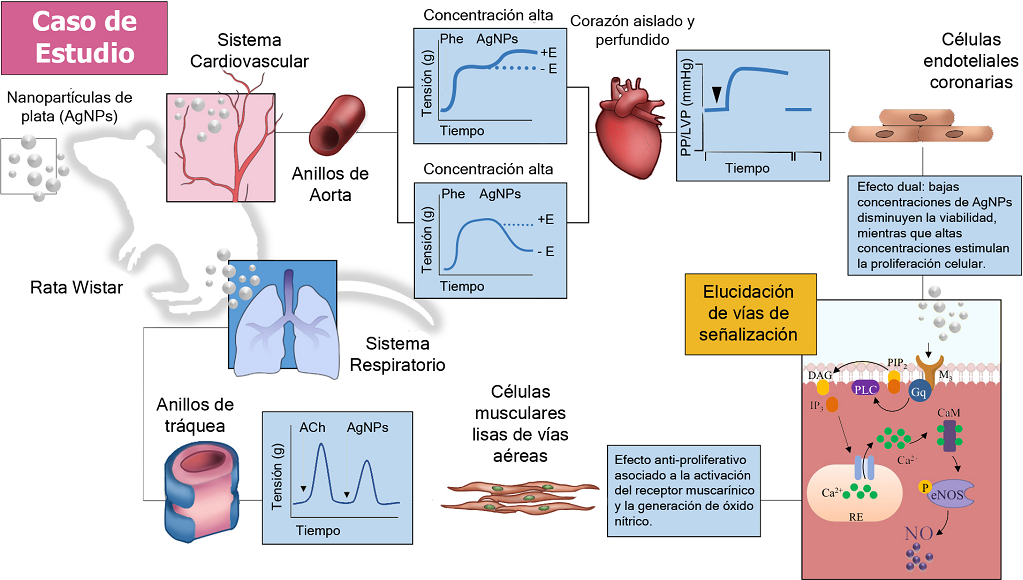
Fuente: Imagen realizada con base en lo reportado por Rosas-Hernández et al., 2009; González et al., 2011 y 2016; Bell et al., 2011; Ramírez-Lee et al., 2017a,b y 2018.
FIGURA 3 Efecto de las nanopartículas de plata (AgNPs) de 37.5 nm en el sistema cardiovascular y respiratorio.
La Figura 3 exhibe el esquema representativo que muestra la secuencia de enfoques fisiológicos en el estudio de las AgNPs, desde un sistema de tejido aislado; vasos (aorta) y tráquea, seguido por su evaluación en corazón aislado y perfundido de rata. Posteriormente se describe el estudio de los mecanismos de acción en cultivos celulares específicos como células endoteliales de vasos coronarios y músculo liso de tráquea. Las acciones de las AgNPs sobre el sistema respiratorio (SR) y cardiovascular (SCV) se estudiaron inicialmente en modelos fisiológicos de anillos aislados de aorta y tráquea de rata. Las AgNPs indujeron dos tipos de efectos; bajas concentraciones de AgNPs (0.1-10 µg/ml) estimularon la vasoconstricción, en anillos ailslados de aorta de rata precontraídos o no con fenilefrina, mientras que con altas concentraciones de AgNPs (50 y 100 µg/ml), se observó un efecto vasodilatador dependiente de NO en anillos de aorta precontraídos con fenilefrina. Tanto el efecto contráctil, como vasodilatador inducido por las AgNPs fue dependiente del endotelio (+E), ya que al removerlo (-E), ambas respuestas fueron abolidas. El segundo enfoque seleccionado en la caracterización de las acciones de AgNPs sobre el scv, fue el corazón aislado y perfundido de Langendorff. En este modelo, también se observó la presencia de dos tipos de efectos, semejantes a los observados en vasos sanguíneos. Estas evidencias mostraron que el endotelio (E) juega un papel importante en las acciones vasculares de AgNPs, considerando que las células endoteliales (CE) participan en la modulación del tono vascular, el tercer enfoque experimental incluyó la exposición directa de ce de vasos coronarios (CEC) a AgNPs, evidenciando que bajas concentraciones de AgNPs disminuyeron la viabilidad celular, mientras que altas concentraciones estimularon la proliferación celular ligada a la generación de NO derivada de la activación de la sintasa de NO endotelial (eNOS). Por otro lado, en el sr, se demostró en anillos aislados de tráquea, que AgNPs estimularon un efecto contráctil similar al ejercido por la acetilcolina (ACh) en este sistema. Mas aún, el efecto contráctil de las AgNPs fue dependiente de la activación del receptor muscarínico de ACh y de la producción de NO generado por la sintasa de óxido nítrico inducible (iNOS). Considerando que el músculo liso de vías aéreas (mlva), es el blanco celular determinante del tono de las vías respiratorias, y tomando en cuenta que el primer enfoque experimental sugiere que las AgNPs podrían tener acciones sobre el mlva, la exposición directa de células de mlva a AgNPs consistió en la caracterización celular de sus acciones. Los resultados indicaron y confirmaron que las AgNPs exhiben un efecto anti-proliferativo asociado con la activación del receptor muscarínico de ACh y a la generación de NO dependiente de la sintasa de óxido nítrico inducible (iNOS). Este estudio resalta la importancia del uso de modelos celulares, tisulares y orgánicos con la finalidad de poder tener un panorama general acerca de los efectos de AgNPs en el SR y SCV, que permita y facilite tomar decisiones sobre los futuros estudios a realizar.
Modelos complementarios a los fisiológicos: biosimulación, modelos in silico
Debido al creciente uso y aplicación de NMs en productos de consumo y dispositivos biomédicos, así como a la preocupación/incógnita sobre sus efectos adversos/tóxicos, la necesidad de estudiar y evaluar los riesgos a la salud humana, como consecuencia de la exposición a NMs, se ha convertido en un punto crucial en el desarrollo de las diferentes áreas relacionadas con la nanotecnología, principalmente para la nanomedicina. Hasta el momento, la información sobre los niveles de exposición a NMs y rangos de bioseguridad es escasa, lo cual, a su vez, limita la capacidad de establecer y definir los ensayos y pruebas necesarias para la evaluación de las acciones de los NMs en sistemas biológicos (Christensen et al., 2010). Por este motivo, el empleo de modelos experimentales que simulen las interacciones de los NMs con sistemas biológicos ha cobrado relevancia en los últimos años (Bachler et al., 2013). Un ejemplo claro es el modelo farmacocinético con base fisiológica (PBPK, por sus siglas en inglés physiologically based pharmacokinetics), el cual consiste en un método que estructura y contextualiza los datos disponibles a través de programas computacionales, sin necesidad de realizar experimentos (Bachler et al., 2013; Meek et al., 2013). PBPK establece una relación entre la dosis externa de NMs y las concentraciones internas orgánicas, sanguíneas y de excreción (Bachler et al., 2013). De esta manera, PBPK provee información detallada de la absorción, distribución, metabolismo y excreción (ADME) (Reddy et al., 2005) para los NMs en estudio. Gracias a los estudios in silico o de biosimulación, es posible reducir el empleo de animales de experimentación, tiempo, recursos financieros, generación de residuos contaminantes y alcanzar el óptimo uso de los resultados acerca de los efectos de los NMs generados hasta la fecha (Bachler, et al., 2013). En particular, para las AgNPs, de las cuales existe una información limitada sobre los productos en los que son utilizadas (Lem et al., 2012), los modelos in silico han sido considerados imperativos. Finalmente, estos modelos pueden ser validados con datos independientes y servir como un referente para la exposición humana a NMs a través de diferentes rutas (Bachler et al., 2013).











 nueva página del texto (beta)
nueva página del texto (beta)


