Introducción
Actualmente, el suministro de energía en el mundo está basado predominantemente en el uso de energías no renovables tales como el petróleo, carbón o gas natural. Estas fuentes geológicas se han acumulado durante millones de años debido a la actividad fotosintética y por lo tanto representan “energía solar almacenada” (Cox y col., 2015). El aumento en el consumo de energía en el último siglo nos ha llevado a una inevitable escasez de estos valiosos recursos con consecuencias económicas, sociales y políticas que ya estamos resintiendo hoy en día. La quema de combustibles fósiles también ha llevado a niveles inaceptables de contaminación ambiental debido a la emisión de cantidades gigantescas de CO2, el cual ha causado el efecto invernadero en la tierra. Por ejemplo, de las 37 billones de toneladas (37 GT) de emisiones de CO2 cada año, 30 GT provienen de emisiones de fuentes relacionadas con generación de energía (Lewis y Nocera, 2006). Por lo anterior, se necesita buscar alternativas que nos permitan reducir la dependencia mundial de los combustibles fósiles y al mismo tiempo reducir las emisiones de CO2 a la atmósfera.
La producción sostenible de combustibles tales como hidrocarburos o alcoholes, empleando fuentes solares a partir de la reducción de CO2 (por medio de la fotosíntesis artificial) resulta un medio prometedor para remplazar los combustibles fósiles y suplir los requerimientos de energía global a largo plazo. La reducción fotocatalítica de CO2 es un proceso complejo debido a que tiene asociada la producción de H+ a partir de la ruptura de la molécula de agua (water splitting, WS).
La conversión de CO2, así como también la ruptura de la molécula de H2O sólo son económicamente viables si se usa la luz solar como fuente de energía, debido a que es ubicua y abundante en la mayor parte de la tierra. En sólo 1 h, la superficie terrestre recibe suficiente energía, aproximadamente 4.320 J (Lewis y Nocera, 2006), para proporcionar el consumo energético de la humanidad durante un año entero (aprox. 4.120 J). Un cálculo simple muestra que las necesidades energéticas de una persona se pueden satisfacer con 34 l de H2O al día empleando tecnologías fotocatalíticas. El reto principal radica en poder lograr la captura y almacenamiento eficiente de esta energía. Adicionalmente, dicho escenario eliminaría la necesidad de una fuente de poder independiente, permitiendo la producción de energía en el sitio de uso, reduciendo los costos de transporte. Sin embargo, uno de los mayores inconvenientes para pasar a una economía basada en H2 es el costo de producción, para ello hay que diseñar nuevos materiales, más baratos y más efectivos que empleen luz solar para su activación.
¿Qué es la fotosíntesis artificial?
La fotosíntesis artificial se define como el uso de la (nano)tecnología, para capturar luz, transportar electrones, romper la molécula de H2O y capturar CO2 con el fin de generar combustibles (Sovacool y col., 2015). A modo de ejemplo, en la Figura 1 se comparan los procesos de fotosíntesis natural y artificial.

Fuente: Adaptada con permiso de MacMillan Publishers Ltd: Scientific Reports (Zhou y col., 2013), copyright 2013.
Figura 1 Esquema comparativo entre los procesos de fotosíntesis natural y artificial.
El CO2 se encuentra naturalmente presente en la atmósfera con una concentración de 389 ppm (en volumen). A través de los siglos, su función ha sido la de ser una fuente de carbón para la realización del proceso de fotosíntesis en organismos autótrofos (organismos que fabrican su propio alimento a partir de fuentes inorgánicas). Actualmente, como ya se mencionó, se ha producido un aumento en la concentración de este gas, producto de la quema de combustibles fósiles, ocasionando cambios negativos en el medio ambiente, tal como el efecto invernadero. Por lo tanto, uno de los mayores desafíos del próximo siglo será diseñar procesos que consuman este gas antropogénico (o bien, que no se genere más del ya existente).
Los sistemas fotosintéticos aprovechan la luz del sol para proveer energía, mediante la síntesis de carbohidratos, a la mayor parte de la vida en la tierra. Las etapas iniciales de captación de luz en dichos sistemas implica que la energía adsorbida se convierta en energía química con alta eficiencia, mediante un flujo de energía eficiente, direccional y regulado a través de una red de proteínas. De esta manera, las plantas y algunas bacterias utilizan la energía del sol para producir dos moléculas ricas en energía (el nucleótido ATP y la coenzima reducida NADPH), las cuales posteriormente participan en la fijación del CO2 durante el ciclo de Calvin (Nelson, 2011).
Así, empleando materiales semiconductores con el fin de imitar el proceso de fotosíntesis natural, se puede lograr la realización simultánea de dos reacciones principales: la ruptura (oxidación) de la molécula de H2O para generar O2 y H+ (y, más adelante, H2) y la reducción de CO2 a metano o metanol. El empleo de materiales semiconductores y luz para realizar distintas reacciones de oxidación y reducción simultáneas entran dentro del campo de la fotocatálisis heterogénea, la cual satisface los requerimientos necesarios para llevar a cabo la fotosíntesis artificial.
De manera simplificada, como se puede observar en la Figura 1, el proceso de fotosíntesis artificial por fotocatálisis heterogénea implica las siguientes etapas, similares a las de la catálisis heterogénea convencional: i) transferencia de los reactivos desde el fluido a la superficie del semiconductor; ii) adsorción de al menos uno de los reactivos; iii) reacción química sobre la superficie catalítica; iv) desorción del/de los producto/s, y, v) transferencia de los productos.
La diferencia principal de la fotocatálisis heterogénea con respecto a la catálisis convencional es el modo de activación del catalizador, dado que la activación térmica se remplaza por una activación mediante luz UV o visible.
El proceso de activación del semiconductor, comúnmente llamado fotocatalizador, se realiza cuando los electrones localizados en la banda de valencia (BV) absorben luz y se promueven a la banda de conducción (BC). La energía necesaria para que se pueda realizar este proceso se conoce como energía de banda prohibida (EBP), la cual determina la longitud de onda de la luz que puede absorber el semiconductor empleado como fotocatalizador. Cuando los electrones son excitados a la BC dejan un espacio vacío en la BV que se comporta como una carga positiva, que se denomina hueco (h+). De esta forma, la iluminación de un semiconductor con una longitud de onda adecuada, produce simultáneamente ambas especies portadoras de carga -electrones (e-) y huecos (h+)- capaces de realizar reacciones de reducción (e-) y/o oxidación (h+). En la Figura 2 se muestra el proceso de ruptura de la molécula de H2O, sobre un fotocatalizador de TiO2.
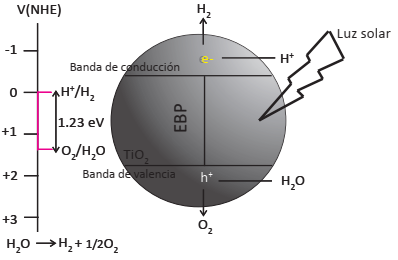
Fuente: Elaboración propia.
Figura 2 Representación esquemática del mecanismo convencional de la ruptura fotocatalítica de H2O.
Sin embargo, los electrones excitados pueden participar en múltiples reacciones, y, si además se combinan con un hueco (h+), pueden sufrir desactivación liberando la energía absorbida. Este proceso de desactivación se conoce como recombinación de cargas, y es uno de los principales factores responsables de las bajas eficiencias observadas en reacciones fotocatalíticas. En resumen, la eficiencia de los procesos fotocatalíticos depende fundamentalmente de cuatro variables: i) la absorción de luz; ii) la separación de cargas; iii) la migración de las cargas a la superficie, y, iv) la recombinación de las mismas (Chiou y col., 2009; Cushing y col., 2012; Yang y col., 2010).
Las razones de la baja eficiencia y alta dificultad para la reducción fotocatalítica de CO2 son tanto cinéticas como termodinámicas (Corma y Garcia, 2013). En particular, el proceso de reducción o separación de la molécula de H2O para producir H2 es muy demandante termodinámicamente como lo demuestra el cambio de energía libre de Gibbs (estándar) de formación (∆G0= 237.2 kJ∙mol-1) requerido. Más aún, resulta más difícil termodinámicamente la reducción de CO2 (∆G0 = 394.4 kJ∙mol-1) y requiere de una combinación similar en las etapas de activación. El proceso ideal y deseable es que se realicen de forma simultánea la reducción de CO2 y la oxidación del H2O para generar hidrocarburos. Se espera que las aplicaciones comerciales de la fotosíntesis artificial sean posibles si la eficiencia de la conversión de la energía solar se encuentra entre el 5-10 %, por tanto el objetivo de la investigación científica básica es alcanzar estos porcentajes de conversión.
Para lograr este objetivo es importante usar efectivamente la luz visible y el infrarrojo cercano y lograr separaciones eficientes de los portadores de carga. Aunque la fotosíntesis artificial idealmente involucra las reacciones simultáneas de la ruptura de H2O y la reducción del CO2, es común encontrar en la literatura trabajos donde sólo se estudie alguna de estas reacciones. A continuación se describirán por separado algunos de los semiconductores más empleados en la producción de H2 a partir de la reacción de ruptura de H2O y la reducción de CO2 por fotocatálisis heterogénea.
Ruptura de la molécula de agua para producir H2
La generación de H2 a partir de H2O requiere al menos dos pasos catalíticos críticos que son: i) la oxidación de dos moléculas de H2O en O2 y H+, y, ii) la subsecuente reducción de los protones a H2 molecular. Para llevar a cabo esta reacción, el potencial redox estimado es de ‒1.23 eV, por lo que esta reacción se puede realizar utilizando semiconductores con EBP mayores a este valor; sin embargo, existen otros requerimientos termodinámicos que se tienen que satisfacer, como, por ejemplo, que la diferencia de energía entre la BC y BV se encuentre en el rango para poder llevar a cabo la reacción. Uno de los semiconductores más estudiado en la reacción de ruptura de la molécula de H2O es el TiO₂; no obstante, la eficiencia fotocatalítica del TiO2 puro cuando se irradia con luz solar es baja, debido principalmente a la rápida recombinación de los pares electrón-hueco y la incapacidad de usar luz visible debido a su alta EBP (3.2 eV). Por ello, solamente la luz UV puede ser utilizada para activar el TiO2 puro, que representa sólo ~4 % del total de la radiación solar que llega a la Tierra. En contraste con la región UV, la región visible representa aproximadamente 43% de la energía solar incidente sobre la Tierra, es por esto que es deseable el desarrollo de materiales fotocatalíticos que sean efectivos y altamente sensibles a la luz visible, logrando un aumento de la eficiencia global del sistema. Además del TiO2, otros semiconductores del tipo MxNyOz (con M = Na, K y N = Ta, Nb, Sr, La, In), (Lin y Chang, 2010; Iwase y col., 2013), o Fe2O3 (Thimsen y col., 2011)ZnS, (Meng y col., 2012) o bien fotocatalizadores de TiO2/WO3 (Riboni y col., 2013) han sido utilizados en esta reacción.
Asimismo, se ha reportado el empleo de metales nobles como co-catalizadores de la reacción de separación de la molécula de H2O para aumentar la producción de H2 en varios órdenes de magnitud (Gärtner y col., 2012; Durán y col., 2014). Más adelante se describirán algunos aspectos relacionados con el empleo de estos co-catalizadores tanto en la producción de H2 como en la reducción del CO2.
En la práctica, las cantidades de H2 producidas por esta reacción son muy pequeñas aun utilizando fotocatalizadores modificados con alguna de las técnicas antes descritas. Es por esta razón, que adicionalmente se requiere la presencia de un agente de sacrificio (generalmente corresponde a una molécula orgánica o bien a sales inorgánicas). Su objetivo primario es consumir irreversiblemente los huecos (h+) fotogenerados (donadores de electrones), para disminuir la recombinación de cargas, y por lo tanto aumentar la eficiencia de la producción de H2. Se han utilizado para este fin moléculas orgánicas tales como alcoholes, aldehídos, glucosa y colorantes y también se han utilizado compuestos inorgánicos como S2-/SO32-, Fe3+, Ce4+, I3- (Chen y col., 2010).
Reducción de la molécula de CO2 para generar hidrocarburos ligeros
La conversión fotocatalítica de CO2 para la formación de un hidrocarburo simple como metano por reducción con H2O (CO2 + 2H2O→CH4 + 2O2) es un proceso más complejo que la ruptura de la molécula de H2O, debido a que se necesitan 8 electrones para reducir el CO2 a CH4. Además de metano, otros posibles productos son metanol y formaldehído. Las razones de la baja eficiencia y alta dificultad para la reducción fotocatalítica de CO2 son tanto cinéticas como termodinámicas (Corma y García, 2013). Los requerimientos termodinámicos de estos procesos producen limitaciones en la EBP de los materiales usados como fotocatalizadores. Teóricamente, se requiere un valor de EBP de al menos ‒1.33 eV para conjuntamente separar H2O y reducir CO2 (Indrakanti y col., 2009).
El paso inicial de la reducción fotocatalítica de CO2 es la generación de pares electrón-hueco por la absorción de fotones de mayor o igual energía que la EBP del fotocatalizador. La escala de tiempo de la recombinación de dichas especies es dos o tres órdenes de magnitud más rápida que cualquier otro proceso de transferencia de electrones (Jeyalakshmi y col., 2013). Así, cualquier mecanismo que inhiba la recombinación de los pares electrón-hueco podría generar un aumento en la eficiencia y mejorar las velocidades de foto-reducción de CO2. Asimismo, la cinética de esta reacción depende de muchos otros factores (intensidad de luz, fracción absorbida por el fotocatalizador, superficie específica, etc.) por lo que la homogenización de criterios con base en la comparación de trabajos publicados resulta compleja.
La selección más frecuente de los semiconductores empleados en esta reacción se realiza teniendo en cuenta la relación entre los niveles de energía de la BC y BV (que permitan ambas reacciones: la reducción de CO2 y la oxidación de H2O). Entonces, sería deseable la utilización de un fotocatalizador que presente una gran EBP; no obstante, se necesitaría de altas energías para que se active. Se ha propuesto que el TiO2 es el fotocatalizador más prometedor para la reducción de CO2 (Hou y col., 2011); sin embargo, el umbral de la banda de conducción y el voltaje fotoinducido (fotovoltaje) del TiO2 son apenas lo suficientemente altos para llevar a cabo la reducción directa del CO2 y la oxidación de H2O. Debido a estas restricciones, se han ensayado una gran variedad de semiconductores que incluyen (Tu y col., 2014): óxidos metálicos con una configuración electrónica d0, como el Ti4+, Zr4+, Nb5+, V5+, Mo6+, W6+, y óxidos con una configuración d10 como el In3+ y Ga3+.
Además de los respectivos óxidos metálicos, se han estudiado distintos sulfuros, nitruros y fosfuros de los metales antes mencionados. Aunque, al igual que el TiO2, estos semiconductores no son tan efectivos en la reducción fotocatalítica de CO2 por lo que normalmente se necesita un co-catalizador adicional depositado en la superficie del semiconductor (Corma y García, 2013). Entre los co-catalizadores más comunes se encuentran los metales nobles como el Pt, Cu, Ag, Sn y Au. En particular, el Pt generalmente favorece la formación de CH4 mientras que cuando se utiliza Cu, Au o Ag se forma preferencialmente CO. En el caso de la utilización de co-catalizadores con Sn, se observó una alta selectividad hacia formiato (Kim y col., 2015).
Estrategias para mejorar la eficiencia de los semiconductores usados en la fotosíntesis artificial
Una de las estrategias más empleadas para mejorar la eficiencia de las reacciones involucradas en la fotosíntesis artificial es el uso de co-catalizadores metálicos que corresponde a la incorporación superficial de metales nobles o de transición (Ni y col., 2007; Maeda y Domen, 2010; Fan y col., 2013). Algunos metales como el Au, Ag y el Cu presentan la particular absorción de luz visible por resonancia del plasmón superficial de sus nanopartículas. Las consecuencias de este efecto se detallarán más adelante.
Otra estrategia utilizada es el uso de sistemas binarios de semiconductores (combinando los valores de energía de banda prohibida altos y bajos, respectivamente) a fin de modular los procesos de absorción y recombinación de los portadores de carga (Chen y col., 2010; Ni y col., 2007).
Un procedimiento alterno para extender la sensibilidad hacia la región visible del espectro consiste en el uso de sustancias coloridas y/o sensibilizadores (Kudo y Miseki, 2009) como, por ejemplo, las porfirinas empeladas como captadores de luz involucradas en la transferencia directa de los electrones fotogenerados a la BC del semiconductor (Yang y col., 2011) evitando la recombinación de cargas. Aunque el dopado con aniones es menos frecuente, se cree que implica una reducción de EBP debido a la mezcla de los estados p del dopante (generalmente, N o C) con estados O 2p en la banda de valencia de, por ejemplo, el TiO2 (Chen y col., 2010). Esta modificación introduce estados de impureza local por encima de la BV del óxido semiconductor (TiO2), permitiendo la absorción de luz visible (Ji y col., 2010)
Asimismo, se han empleado estrategias vinculadas con aumentar la superficie específica del material y modificar la arquitectura de los mismos (e.g., semiconductores laminares). Varghese y col. (2009) generaron nanotubos de TiO2 dopados con N empleando Pt o Cu como co-catalizador para la reacción de reducción de CO2 con vapor de H2O bajo irradiación de luz solar natural. El rendimiento a metano se reportó en 111 ppm ∙ cm2∙ h-1 con una eficiencia cuántica de 0.74%. La alta velocidad de la conversión de CO2 se atribuyó a la alta área superficial y al espesor de pared a escala nanométrica.
Así, se infiere que las razones por las que un material resulta activo en reacciones fotocatalíticas están interconectadas por lo que la incidencia de uno o más factores ha de establecerse para cada sistema de reacción experimental. La gran interrelación de variables que existen genera interrogantes y, en consecuencia, permite la exploración de nuevos materiales a partir de la combinación de los ya existentes. Probablemente, la combinación de algunas (o todas) de estas estrategias genere materiales activos y estables en la región de luz visible que permitan su empleo en la reacción de fotosíntesis artificial.
El oro como co-catalizador en la fotosíntesis artificial
Cuando se utilizan metales como co-catalizadores, éstos no forman parte de la estructura del semiconductor, sino que se encuentran en una fase separada, generando una interfaz metal semiconductor (Primo y col., 2011). Para obtener fotocatalizadores estables y duraderos, el metal usado en este esquema debe ser químicamente estable, especialmente hacia la fotocorrosión. Por tal razón, los metales nobles como el oro son los más adecuados para este propósito. Las nanopartículas de oro no sólo proporcionan una ruta adecuada para direccionar el flujo de los portadores de carga fotoinducida, lo que ayuda a evitar la recombinación del par electrón-hueco, sino que además presenta absorción de luz visible debido a la resonancia del plasmón de superficie (RPS) (Primo y col., 2011; Silva y Jua, 2011; Hou y Cronin, 2013; Zhang y col., 2013). Asimismo, estos metales actúan como trampa de electrones, facilitando la separación de las especies cargadas fotogeneradas mejorando las actividades encontradas hacia la producción de hidrocarburos o hidrógeno.
Algunos autores han propuesto que cuando las nanopartículas de Au son fotoexcitadas, los electrones de las partículas de oro son inyectados hacia la banda de conducción del TiO2, permitiendo la generación de huecos en las partículas de oro y electrones en la banda de conducción del semiconductor. Esto es posible debido al efecto de resonancia plasmónica superficial (RPS) de las nanopartículas de Au. Así, los electrones en la BC generarán H2, mientras que los huecos serán suprimidos por el agente de sacrificio u oxidarán al H2O. (Primo y col., 2011; Silva y Jua, 2011). En la Figura 3 se presenta un esquema del funcionamiento teórico de un catalizador de Au/TiO2.
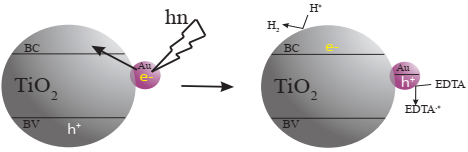
Fuente: Elaboración propia.
Figura 3 Propuesta de mecanismo para la producción fotocatalítica de H2 con luz visible sobre TiO2 que contiene nanopartículas de Au depositadas en la superficie. La luz visible se absorbe por la banda de resonancia plasmónica superficial característica de las nanopartículas de Au, que inyectan electrones a la banda de conducción (CB) del TiO2. Los electrones en la banda de conducción pueden afectar la reducción del agua, mientras que los huecos ubicados sobre las nanopartículas de Au son atrapados por un agente reductor (EDTA) el cual se oxida.
Hou y col. (2011) mostraron que la eficiencia cuántica se incrementa en un factor de 24 bajo luz visible al depositar nanopartículas de oro sobre TiO2 (2.1 × 10−5 % para Au/TiO2 y 8.8 × 10−7 % para TiO2 puro). Este incremento se atribuyó a los fuertes campos eléctricos creados por la RPS de las nanopartículas de oro, los cuales excitan a los pares electrón-hueco localizados en el TiO2, a una velocidad de varios órdenes de magnitud superior que la de la luz normal incidente. Asimismo, estos autores propusieron que en el rango de longitudes de onda empleado (254 nm UV), tanto los electrones excitados en el Au como en el TiO2 contribuyen a la reducción del CO2 con vapor de H2O (Hou y col., 2011).
Wu y col. (2008) evaluaron el efecto del tamaño de partícula de oro en la producción de H2, variando el tamaño de las nanopartículas de oro soportadas en TiO2 entre 3 y 10 nm (Wu y col., 2008). Ellos mostraron que la producción de H2 aumentó al reducir el tamaño de partícula y concluyeron que las partículas más pequeñas inducen una mejor separación de carga, generando más electrones y huecos disponibles. Así, el empleo de nanopartículas de Au depositadas en diferentes soportes resulta una alternativa propicia para evaluar la producción de H2 fotocatalítico.
En nuestro grupo, recientemente se estudió el efecto del tamaño de partícula de oro, la carga óptima de oro y del tratamiento térmico para la producción de H2 sobre catalizadores Au/TiO2 preparados por depósito-precipitación con urea (Oros-Ruiz y col., 2013). Se observó que la carga óptima de oro fue de 0.5 % en peso y que el tratamiento térmico óptimo se encontró entre 150 y 300 ºC en aire, produciendo un tamaño promedio de partícula de 2.8 ± 0.2 nm para las condiciones experimentales empleadas en nuestro laboratorio. Nuevamente, se concluyó que partículas de oro más pequeñas generaron los catalizadores más activos.
La elevada producción de H2 mostrada por los materiales de Au/TiO2 respecto de cuando se emplean otros metales -no nobles-, se atribuyó al método de depósito de las nanopartículas de Au (depósito - precipitación con urea), que permitió la formación de partículas de Au con tamaños pequeños, distribución uniforme y en alta interacción con el TiO2 (Zanella y col., 2005; Bokhimi y col., 2011).
Así, el uso de las nanopartículas de oro como co-catalizadores resulta una buena herramienta para incrementar la absorción de los semiconductores en la región visible, debido a que presentan absorción en dicha región debido a la resonancia plasmónica superficial (RPS) de las nanopartículas de Au.
Desafíos de la fotosíntesis artificial
Para el empleo del proceso fotocatalítico de reducción de CO2 con H2O como alternativa a los combustibles fósiles se requiere de múltiples investigaciones de base para la adecuación y uso de esta potencial fuente de energía sostenible.
Por un lado, se requiere proveer al sistema catalítico de los mecanismos que faciliten la transformación de dos de las moléculas termodinámicamente más estables (CO2 y H2O), cuyas conversiones alcanzadas hasta el momento son menores al 1 %, y con velocidades de reacción muy bajas. Se espera desarrollar catalizadores que tengan una máxima eficiencia para la absorción de energía solar y que cumplan con el requisito del nivel de energía de banda acorde para que las reacciones redox se produzcan eficientemente (Jeyalakshmi y col., 2013).
Otro problema asociado es que durante el proceso de reducción fotocatalitica de CO2, éste puede únicamente reducirse en presencia de un reactivo que se oxide simultáneamente. El problema radica en que si se emplea H2O como reactivo redox, se genera O2 e H2 por la separación de la molécula de H2O (un proceso que requiere en principio menor energía, como ya se expuso con anterioridad). Este comportamiento del H2O complica la reducción de CO2 debido a que puede ser considerada como un agente competitivo en dicha reacción. De hecho, bajo las condiciones de reducción fotocatalítica de CO2 la generación de H2 molecular es el producto principal registrado dado que está favorecido termodinámicamente. Por esta razón se necesita que, frente a cualquier proceso industrial para la reducción de CO2 se tenga contemplada la formación, uso y/o almacenamiento de grandes cantidades de H2. Una alternativa es el uso de aminas o alcoholes dado que son altamente eficientes como agentes de sacrificio y pueden someterse a oxidación. Así, se espera que no compitan con la reducción de CO2 en la captura de los electrones en la banda de conducción, mejorando la producción de hidrocarburos (Corma y García, 2013).
La fotorreacción de CO2 es un proceso altamente complejo ya que involucra la transferencia de múltiples electrones y es poco selectivo debido a que da lugar a un rango de compuestos C1-C3 cuyos mecanismos de reacción no han sido aún establecidos. La fotosíntesis artificial involucra dos etapas, separación de H2O y reducción del CO2, que deben sincronizarse para producir mayores rendimientos a hidrocarburos. En general, las etapas de reacción que involucran radicales iónicos hacen que la selectividad de los productos obtenidos sea un aspecto difícil de controlar (Jeyalakshmi y col., 2013). Dicha complejidad requiere que la racionalización del diseño de los materiales empleados no sea fácil de elucidar. Existen múltiples propiedades tanto de la fase activa y/o soporte, co-catalizadores, la incorporación de iones o la absorción de luz que deben tomarse en cuenta en el diseño de los catalizadores cuyas funcionalidades se encuentren integradas.
Por otro lado, los bajos rendimientos obtenidos son producto de la descomposición de los productos formados y la promoción de las reacciones inversas, cuyo control también es limitado. Los procesos de desactivación del catalizador también son complejos, y en su mayoría proceden a través de la formación de especies carbonáceas sobre la superficie, lo que implica que la función metálica responsable de la hidrogenación de dichas especies debe ser mejorada (aunque se tenga H2 presente debido a reacción de separación de la molécula de H2O, que se realiza en una etapa previa a la reducción de CO2).
Asimismo, se han encontrado escasos trabajos relativos a los mecanismos de reacción involucrados. Aún hacen falta investigaciones más profundas en ese sentido, por ejemplo, mediante métodos espectroscópicos in situ -soportados por estudios teóricos- sobre las etapas de activación así como sobre la caracterización de las modificaciones superficiales de los semiconductores para comprender mejor los fenómenos de desactivación y poder alcanzar mayores conversiones.
En la actualidad, en el país se reportan algunos trabajos vinculados principalmente con la producción de hidrógeno (Macías-Sánchez y col., 2012; Ruiz-Gómez y col., 2013; Gómez-Solís y col., 2014; Valencia-Sanchez y col., 2015), quedando el estudio del proceso de fotosíntesis artificial como un desafío pendiente a desarrollar en los próximos años.
Aspectos sociales
Los avances en fotosíntesis artificial tienen el potencial de transformar de manera radical la forma en que las sociedades convierten y usan la energía. Sovacool y col. (2015) mencionan en su artículo que la aceptación social de una nueva tecnología tiene múltiples dimensiones -la sociopolítica, la relacionada con la comunidad y la relacionada con el estado- que debe integrarse de manera adecuada para que los inversores y los usuarios acepten la fotosíntesis artificial (Sovacool y col., 2015). Los autores señalan que la aceptación en un futuro de la fotosíntesis artificial dependerá de la prevalencia de nueve factores, los que crearían ambientes propicios para su implementación; la falta de estas condiciones genera ambientes en los que la nueva tecnología seguramente sería rechazada. Las condiciones que menciona el autor como indispensables para que una tecnología de este tipo pueda adoptarse son (Sovacool y col., 2015): i) fuerte capacidad institucional; ii) compromiso político; iii) marcos legales y regulatorios favorables; iv) costos competitivos de instalación y/o de producción; v) mecanismos de información y retroalimentación; vi) acceso al financiamiento; vii) comunidad prolífica; viii) ubicación participativa del proyecto, y, ix) imagen pública positiva y reconocimiento exterior.
La fotosíntesis artificial tiene el potencial de mejorar la manera en la que las sociedades convierten y usan la energía. Estudios recientes (Faunce y col., 2013; Sovacool y col., 2015) revelan que ninguna nueva tecnología tiene el potencial para transformar de manera tan radical el planeta hacia la sostenibilidad como la fotosíntesis artificial (ya sea sola o combinada con otras tecnologías). Para que ocurra cualquier cambio tecnológico debe existir una red simultánea de condiciones técnicas, políticas, económicas y sociales y existir una sinergia entre todas ellas (Sovacool y col., 2015). Esto significa que los investigadores que trabajan en el tema de fotosíntesis artificial deben reconocer que una tecnología segura y que pueda insertarse en el mercado debe satisfacer los 9 factores previamente mencionados.
Conclusiones
Los avances recientes en el desarrollo de sistemas energéticos empleando reacciones con luz solar han sido numerosos. En particular, las reacciones que resaltan por su aplicación potencial son las de reducción de CO2 y la ruptura del H2O para obtener hidrocarburos ligeros (y/o alcoholes) y H2, respectivamente, mediante el empleo de la fotocatálisis heterogénea; sin embargo las limitaciones cinéticas y termodinámicas representan un desafío adicional para las investigaciones en fotocatálisis.
El desarrollo de fotocatalizadores activos y estables es otro aspecto en continuo y arduo crecimiento. Los requisitos que debe cumplir el material empleado como fotocatalizador, a la fecha, no corresponden a un único material, por lo que frecuentemente se realiza la combinación de estrategias de síntesis que permitan dicho objetivo. La modulación de la EBP para utilizar la luz visible está señalada como una estrategia acorde que permitirá el uso tecnológico de estos sistemas. Asimismo, el empleo de fotocatalizadores basados en Au/TiO2 modificado con metales de transición pareciera representar otra alternativa interesante para dichas reacciones.
En la búsqueda de materiales activos y estables, la interrelación entre las distintas propiedades finales del semiconductor y el desempeño mostrado en las reacciones de la fotosíntesis artificial es muy compleja. Así, la interpretación de los resultados y la asignación de responsables no resulta simple. A la fecha se sabe que existe mucha incertidumbre para lograr tecnologías que empleen la fotosíntesis artificial, pero el desafío no es únicamente tecnológico dado que implica un cambio cultural en la forma de consumo de energía.











 nova página do texto(beta)
nova página do texto(beta)


