Introducción
En los últimos años se ha incrementado el uso de nanopartículas metálicas principalmente de oro (nanoAu) y plata (nanoAg) en productos cosméticos de aplicación tópica. NanoAu también se pueden encontrar en productos etiquetados como “complementos alimenticios” (oro coloidal bebible), en ambos casos prometen efectos rejuvenecedores y están disponibles a la población general por ser productos de libre venta. Sin embargo, una de las principales aplicaciones propuestas para las nanoAu es el uso biomédico, actuando como transportadores selectivos de fármacos principalmente contra cánceres humanos, perspectiva fundada en: estudios in vitro, donde se describe que las nanoAu elevan las especies reactivas de oxígeno (Mateo et al., 2014), se transportan selectivamente al núcleo de células malignas, causando deformaciones en su morfología (Dam et al., 2012); daño al material genético, detención de la citocinesis, así como muerte celular por apoptosis (Kang et al., 2010; Selim y Hendi, 2012; Tsai et al., 2012; Chen et al., 2014). Sin embargo, se conoce poco sobre los efectos tóxicos tanto en células como en organismos sanos. Algunos efectos adversos reportados en modelos in vivo indican que las nanoAu pueden bioacumularse principalmente en hígado, corazón y cerebro; hasta por más de un mes después de una dosis intravenosa única (Fraga et al., 2014), causando respuesta inflamatoria crónica, congestión y dilatación de vasos sanguíneos en corazón e hígado (Abdelhalim, 2011; Abdelhalim y Jarra, 2012;). Respecto a los efectos de las nanoAu durante el desarrollo, se presentan resultados controversiales. Asharani y cols. (2011) describen defectos del desarrollo en crías de pez cebra expuestos a las nanoAu, entre otros cambios, funciones fisiológicas alteradas, principalmente bradicardia (función anómala del corazón). Sin embargo, recientemente se afirma que las nanoAu y las nanoAg son biocompatibles durante el desarrollo preimplantacional de los mamíferos (Taylor et al., 2014). A pesar de que las nanoAu menores a 50 nm de diámetro tienen la capacidad de atravesar la barrera hemato-placentaria y biodistribuirse en embriones de ratón (Yang et al., 2012).
Por otro lado, durante la cardiogénesis en aves y mamíferos, el proceso de septación consiste en pasar de circulación unidireccional a bidireccional mediante la formación de tres septos a todo lo largo del corazón (Cruz et al., 1989; Webb et al., 2003), proceso altamente sensible a estrés oxidante (Fisher et al., 2007). El corazón es el primer órgano en adquirir capacidad funcional aunque anatómicamente se encuentra incompleto. Inicialmente, el corazón se compone de un tubo de miocardio con capacidad contráctil, en humanos aparece al inicio de la tercera semana después de la fertilización (Davis, 1927) y en pollo en estadio 9HH (Stalberg y DeHaan, 1969) de la clasificación de Hamburger y Hamilton (1951). Posteriormente, sufre cambios morfológicos, se curva y tuerce debido a la adición de nuevas poblaciones celulares desde el “segundo campo cardiogénico” (Kelly et al., 2001; Waldo et al., 2001), estas células se internan al corazón desde su extremo cefálico (cono-tronco), y del extremo caudal (Cruz et al., 1989; 1991), en esta etapa la región del cono-tronco emerge sólo del primordio del ventrículo derecho (VD). Más tarde en el desarrollo se adiciona otra población celular que va migrando desde la cresta neural, finalmente, invaden la gelatina cardíaca de la porción cono-tronco y forman el septo aorticopulmonar, estructura temporal que causara la separación del cono-tronco, en los tractos de salida ventriculares así como tronco de las grandes arterias (Kirby et al., 1983). Posteriormente, el miocardio del cono-tronco debe acortarse mediante apoptosis, para la correcta alineación ventrículo arterial (Watanabe et al., 2001); en conjunto, la migración celular desde la cresta neural y la apoptosis del cono-tronco permiten que el ventrículo izquierdo (VI) adquiera su propio tracto de salida, dividiendo así la circulación en sistémica y pulmonar (circulación dual). Afectaciones en alguno de los eventos antes descritos producen defectos del desarrollo conocidos como cardiopatías congénitas “tronco-conales”, siendo la “doble salida del ventrículo derecho” (DsVD) una de las variantes de mayor incidencia en humanos (Hoffman y Kaplan, 2002). Por lo anterior, nos propusimos evaluar el efecto de nanoAu de 20nm, durante la septación cardíaca en el embrión de pollo. Encontramos que la exposición de nanoAu, puede causar interrupción del desarrollo embrionario así como cardiopatías congénitas tronco-conales del tipo DsVD acompañada de comunicación interventricular (CiV).
Materiales y métodos
Se utilizaron huevos fértiles de gallina (Gallus domesticus) libres de patógenos específicos adquiridos de la granja ALPES S.A. (Tehuacán, México), se incubaron a 37.8 °C y 60% de humedad hasta estadio 22HH. Posteriormente, se perforó una ventana de aproximadamente 1 cm² en los cascarones y se disecó la membrana vitelina. El grupo experimental estuvo formado por 30 embriones con características normales del desarrollo para el tiempo de incubación, se inyectó vía intra-pericárdica 5μl de nanoAu de 20 nm, solución coloidal en búfer de fosfatos [6.54 × 10⁹ nanoAu/ml] (Sigma-Aldrich No. 753610); posteriormente, se reincubaron los huevos en las mismas condiciones iniciales hasta estadio 36HH (corazón maduro). En otros 30 embriones (grupo control), se administró por la misma vía y dosis, solución de búfer de fosfatos. Los embriones, sin las características anatómicas para el tiempo de incubación, no fueron considerados para el experimento. Una vez transcurrido el periodo de incubación, se calculó el índice de mortalidad entre grupos, posteriormente se disecaron los corazones, se fijaron en formalina neutra y se almacenaron a 4 °C hasta ser procesados. Se analizó mediante microscopio estereoscópico acoplado a cámara fotográfica (Carl Zeiss, Stereo Discovery V.12): la silueta cardíaca, las relaciones anatómicas entre segmentos cardíacos y se realizó microcirugía de la pared libre del VD de todos los corazones del experimento. Las relaciones anatómicas se analizaron mediante el empleo del “análisis secuencial segmentario” (ASS), método ampliamente aceptado sobre el abordaje anatómico que revela cardiopatías congénitas o adquiridas (Anderson et al., 1984).
Resultados y discusión
Con el propósito de conocer el efecto que tienen las nanoAu de 20 nm en la interrupción del desarrollo embrionario, medimos la tasa de mortalidad de los embriones en ambos grupos, encontramos en el grupo experimental 17 embriones muertos, correspondientes al 56.6% del total de embriones expuestos. Por el contrario en el grupo control, sólo encontramos 2 decesos 7.1%. La relación entre ambos grupos arrojó un incremento de 7.9 veces la mortalidad en el grupo experimental (Tabla 1). Acceder directamente al embrión implica por sí mismo, un posible riesgo de muerte embrionaria principalmente por contaminación; sin embargo, al tener un grupo control “tipo Sham”, en el cual se realizan los mismos procedimientos del grupo experimental con excepción de la administración de nanoAu, pudimos comparar ambos grupos y evidenciar sólo el efecto de las nanoAu. Todos los embriones se monitorearon cada 12 horas, los embriones muertos fueron retirados de inmediato de la incubadora, ningún cadáver fue analizado para ASS debido a que en algunos casos ya presentaban estado de necrosis.
Tabla 1 Efecto de NanoAu de 20 nm sobre el desarrollo en embrión de pollo.
|
GRUPO CONTROL n = 30 100 μl bufer de fosfatos |
GRUPO EXPERIMENTAL n = 30 100 μl nanoAu de 20 nm |
|
|---|---|---|
| Embriones muertos durante el experimento (22-36HH) | 2 | 17 |
| Corazones con análisis secuencial segmentario (36HH) | 28 | 13 |
| Embriones con defectos cardiacos | 0 | 4 |
| Corazones con doble salida del ventrículo derecho y comunicación interventricular | 0 | 3 |
| Corazones con comunicación interventricular | 0 | 1 |
Fuente: Elaboración de los autores.
A fin de censar cambios morfológicos durante el desarrollo cardiaco por exposición de nanoAu, disecamos los corazones embrionarios de ambos grupos en estadio 36HH. Mediante microscopio estereoscópico medimos en primera instancia las relaciones de la silueta cardiaca, encontramos en el grupo experimental, cuatro piezas anatómicas con distorsión del ángulo de inclinación del tronco de la arteria pulmonar, así como modificación del ápice cardiaco, indicio de posible cardiopatía congénita (Figuras 1a, b y c). En uno de los corazones encontramos también, evidente translocación de las grandes arterias así como presencia del segmento atrial fuera de su situación anatómica (Figura 1c).
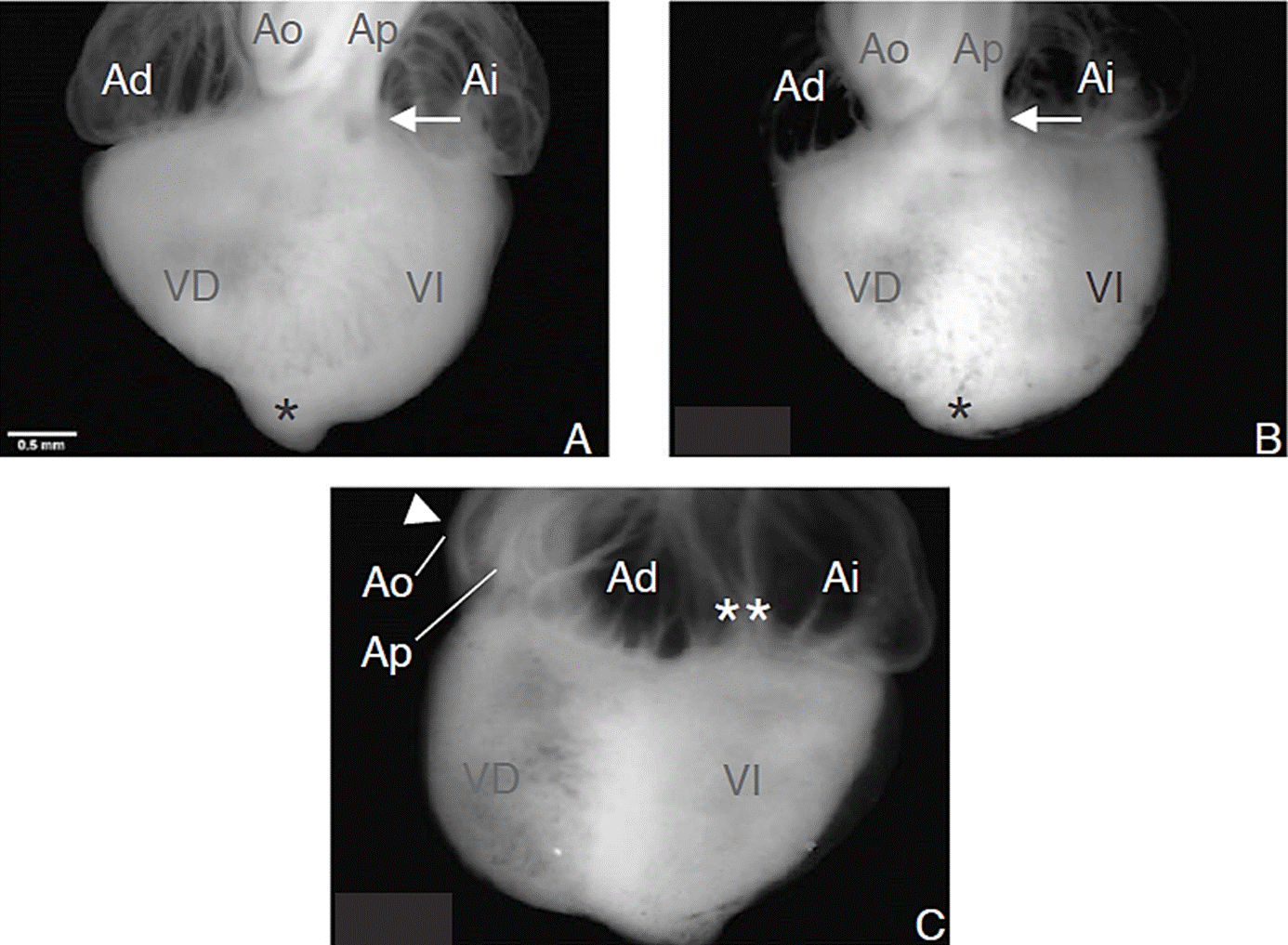
AP = arteria pulmonar. Ao = aorta. Ad = atrio derecho. Ai = atrio izquierdo. VD = ventrículo derecho. VI = ventrículo izquierdo.
Fuente: Imágenes obtenidas por los autores.
Figura 1 Análisis de la silueta cardiaca. (A) Corazón representativo del grupo control, anatomía normal n = 28. (B) Corazón con distorsión del ángulo característico de la arteria pulmonar (flecha), con distorsión del ápice (*), comparar con A. (C) Translocación de los grandes vasos (cabeza de flecha) y segmento atrial en posición anterior con drenaje hacia el VI, (**).
A fin de evidenciar el efecto teratogénico de las nanoAu en el corazón, realizamos microcirugía la pared libre del VD en todos los corazones del experimento. Utilizamos el ASS y confirmamos cuatro corazones con cardiopatía congénita inducida en el grupo experimental, incidencia del 30.77%. En tres de ellos DsVD acompañada de CiV, en el corazón restante sólo encontramos CiV (Tabla 1). Algunas características de los corazones malformados fueron: A) Relación del segmento arterial: en dos corazones el tronco de la arteria pulmonar se encontró anterior a la aorta, característica de las relaciones normales entre grandes arterias (comparar Figura 2a con 2d); otro con las grandes arterias “lado a lado” (Figuras 2b y c) y, en el tercer corazón, las arterias no se encontraban en su ubicación anatómica; sin embargo, con la arteria pulmonar anterior a la aorta (Figuras 1c y 2d). B) Relación atrio-ventricular: tres de los corazones malformados mostraron concordancia atrio-ventricular, es decir, los atrios conectaron con sus correspondientes ventrículos, en un corazón se encontró que ambos atrios drenaban sólo al VI (Figuras 1c y 2d). C) Tabique interventricular: en cuatro corazones se evidenció CiV, defecto septal del tabique interventricular, consecuente con cortocircuito sanguíneo (Figura 2b). D) Tracto de salida ventricular: en tres corazones los pisos valvulares de las grandes arterias (pulmonar y aorta) emergieron exclusivamente del VD (Figuras 2b, c y d); en los tres corazones con DsVD no fue posible distinguir la cresta supraventricular. Respecto al grupo control, en los 28 corazones analizados se encontraron las relaciones anatómicas del corazón normal, con tasa de cardiopatías congénitas del 0% (Figuras 1a y 2a). Los defectos antes descritos afectan mayoritariamente los tractos de salida ventriculares así como el tronco de las grandes arterias, patologías que en conjunto se conocen como cardiopatías congénitas troncoconales. Es posible que las nanoAu eleven las especies reactivas de oxígeno en células que intervienen en dos procesos morfogenéticos de la cardiogénesis: la migración desde la cresta neural hacia el corazón en desarrollo o interfieran en el patrón apoptótico normal del cono-tronco. Finalmente, hacemos énfasis en las virtudes del modelo de embrión de pollo, que permite la manipulación directa del embrión, en nuestro caso, la exposición de nanoAu dentro de la cavidad pericárdica, nuestro modelo es ampliamente aceptado para interpretar el desarrollo normal y patológico en humanos (Harvey 1847; Stalberg y DeHaan 1969; de la Cruz et al., 1989, 1991; Kirby et al., 1983; Watanabe et al., 2001; Schroeder 2003; Webb et al., 2003; Fisher et al., 2007; Red-Horse et al., 2010).
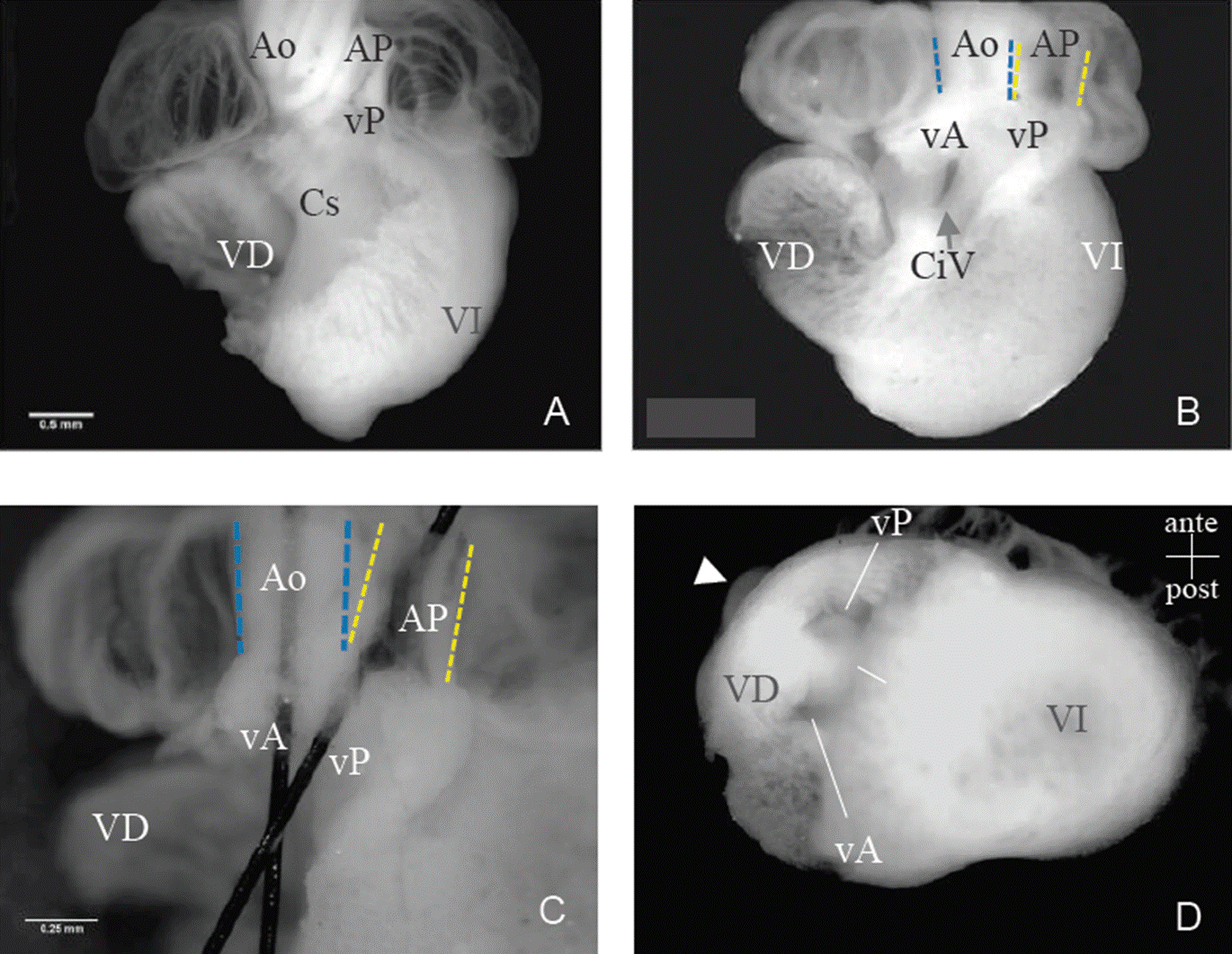
Fuente: Imágenes obtenidas por los autores.
Figura 2 Análisis anatómico interno del ventrículo derecho. (A) Corazón representativo del grupo control, con anatomía normal n = 28. La válvula pulmonar se aloja en el VD, la cresta supraventricular divide los tractos de salida ventriculares. (B) Corazón representativo del grupo experimental con DsVD n = 3, acompañada de CiVn = 4. (C) Magnificación del segmento arterial de la imagen B, se insertaron filamentos por los troncos arteriales para evidenciar la DsVD del tipo grandes arterias “lado a lado”. (D) Corazón con DsVD “arteria pulmonar anterior y aorta posterior”, los pisos valvulares emergen exclusivamente del VD, se observan parcialmente las grandes arterias (cabeza de flecha), vista inferior. Abreviaturas: Cs = cresta supraventricular; vA = válvula aórtica; vP = válvula pulmonar; VD = ventrículo derecho; VI = válvula pulmonar; ante = anterior; post = posterior.
Conclusiones
Los resultados del presente trabajo muestran que las nanoAu de 20 nm pueden ser causa de la interrupción del desarrollo embrionario, pudiendo incrementar la incidencia de cardiopatías congénitas principalmente la “doble salida del ventrículo derecho” así como defectos septales del tabique interventricular por exposición directa con el corazón embrionario del pollo. Pensamos que es necesaria más investigación profunda que contribuya a regular la disponibilidad de productos con nanoAu para el consumo humano.











 nueva página del texto (beta)
nueva página del texto (beta)


