Introducción
A pesar de las diferencias entre los antígenos eritrocitarios reflejadas en los sistemas de grupos sanguíneos, la sangre es el tejido humano que se comparte más fácilmente, tal es el caso de las transfusiones, que salvan miles de vidas anuales. Una transfusión es la transferencia de sangre entera o sus componentes (sólo eritrocitos o plasma) en el torrente sanguíneo. Si bien los componentes normales de las membranas plasmáticas eritrocitarias del donador pueden causar respuestas antígeno-anticuerpo nocivas en el receptor y aunado a ello se tiene como problemas su limitada disponibilidad y vida corta de almacenamiento (estimada en 15 días en refrigeración, la cual puede ser extendida a 42 días empleando agentes anticoagulantes), así como la posibilidad de transmisión de enfermedades infecciosas y posibles incompatibilidades, la demanda de este fluido en caso de cirugías de rutina y traumatológicas, desastres naturales, problemas sociales y guerras, lo hace un fluido biológico de alta importancia (Gaucher et al., 2006).
¿Célula artificial y sangre artificial?
La transfusión de sangre es una necesidad, especialmente en los casos de emergencia (Tabla 1) en los que se presenta choque hipovolémico, consistente en la pérdida mayor a un 20% del volumen normal de sangre o en traumas penetrantes que conllevan a la pérdida aguda de sangre externa secundaria. El tratamiento médico inicial para el choque hipovolémico tiene como finalidad el arreglo de tres áreas principales: maximizar el suministro de oxígeno, restaurar el flujo sanguíneo y la restitución de líquidos. Sin embargo, la escasa disponibilidad o la no existencia de volúmenes suficientes de sangre para atender la demanda de este fluido fisiológico ha llevado a países como Estados Unidos de Norteamérica, Japón y China o a regiones del mundo como Europa, a obtener “sustitutos de sangre u oxígeno terapéutico” con distinto nivel de desarrollo tecnológico (Figuras 1 y 2). Así, existen terapias alternativas que pueden sustituir la transfusión en casos clínicos en los que la sangre no está disponible en el banco de sangre o ésta es insuficiente (Gaucher, et al., 2006). No obstante lo anterior, aunque el desarrollo de esos tres tipos de sustitutos de sangre ha sido un activo campo de interés durante dos o tres decenios, estos sistemas no son todavía adecuados para reemplazar la sangre debido, entre otros factores, a su limitado tiempo de retención en la circulación, a la producción de un efecto vasoconstrictor no deseado y a la incertidumbre sobre la efectividad del transporte de oxígeno.
Tabla 1 Unidades de sangre requeridas por paciente en diferentes situaciones.
| SITUACIONES
QUE INVOLUCRAN EL EMPLEO DE SANGRE |
UNIDADES REQUERIDAS POR PACIENTE |
|---|---|
| Accidente automovilístico |
|
| Cirugía de corazón |
|
| Trasplante de órganos |
|
| Trasplante de médula ósea |
|
Fuente: <http://www.google.com/patents/EP2560625A2>, 14/01/2014; 21:37.

Fuente: Esquema adaptado de: <http://science.howstuffworks.com/innovation/everyday-innovations/artificial-blood4.htm>, 14/01/2014; 22:33.
Figura 2 Dos prototipos de células artificiales: un acarreador de oxígeno (HBOC) y el perfluorocarbono (PFC), ambos son más pequeños que el glóbulo rojo (GR).
Los sustitutos de sangre artificial poseen varias ventajas sobre las transfusiones donde participan donadores, entre ellas están: a) la sangre artificial puede ser diseñada sin poseer ningún grupo antigénico en su superficie, b) puede garantizarse su esterilidad, eliminando la posibilidad de la transmisión de una infección y evitando las pruebas cruzadas de los grupos sanguíneos, y, c) facilidad de almacenamiento prolongado.
Para el desarrollo de sangre artificial se toma en consideración la función principal de la sangre: la transportación de oxígeno a los tejidos por medio del eritrocito (Chang, 2009). Se han sugerido dos estrategias para el desarrollo de acarreadores de oxígeno, es decir, el enfoque biomimético y el enfoque abiótico. El primer enfoque imita la naturaleza en la forma de transportar el oxígeno a los tejidos, mientras que el segundo enfoque utiliza productos químicos sintéticos para lograr el mismo resultado (Figura 3) (Kjellstrom, 2003; Smith, et al., 2004; Ness y Cushing, 2007).

Fuente: Imagen tomada de Ness, P.M., Cushing M.M. (2007). Oxygen therapeutics. Archives of Pathology & Laboratory Medicine, 131: 734-41.
Figura 3 Sustitutos de células rojas.
Los efectos colaterales de las soluciones de hemoglobina (Hb) son: vasoactividad, nefrotoxicidad, interferencia con el sistema fagocitario mononuclear, oxidación durante su almacenamiento, antigenicidad, pobre acarreo de oxígeno, liberación de histamina y depósitos de hierro. Debido a esto, no es posible administrar a la hemoglobina en su forma nativa, de ahí que sea necesario modificarla (Tabla 2). El origen de las células artificiales está relacionado con los acarreadores de oxígeno en la forma de polihemoglobinas y hemoglobinas conjugadas (Radillo-González y cols. 2004).
Tabla 2 Soluciones de hemoglobina modificada.
| 1. Hemoglobina bovina polimerizada |
| 2. Hemoglobina humana recombinante |
| 3. Hemoglobina transgénica |
| 4. Hemoglobina microencapsulada |
| 5. Soluciones perfluoroquímicas |
Aunque una célula completamente artificial equiparable al glóbulo rojo (GR) es todavía un sueño, el desarrollo de membranas lipídicas, poliméricas biodegradables y nanopartículas, son un paso hacia esa posibilidad. Se observa que los sustitutos sanguíneos consisten en entidades cada vez más complicadas, por ejemplo, acarreadores de oxígeno, acarreadores de oxígeno con antioxidantes y sustitutos de glóbulos rojos (Tabla 3), (Schumacher y Ashenden, 2004; Napolitano, 2009; Eastman y Minei, 2009; Alayash, 2004; Lowe et al., 2003).
Tabla 3 Células artificiales.
| Acarreadores de oxígeno artificial (PEGylation) |
Ness, P.M. et al. 2007 | Conjugados de albúmina-Heme |
Eastman, A. y Minel JP, 2009 |
| Hemoglobina/Heme | Cheng, D.C. et al., 2004 | Hb transgénico/ recombinante |
Dieryck, W. et al., 1997 |
| Hb polimerizado (glutaraldehído) |
Kaneda, S. et al., 2009 | Hbs anélidos (lombriz de tierra) |
Hao Zhu et al., 1996 |
| Hb conjugada (PEG) | Winslow R.M., 2003 | Perfluorocarbonos (PFC) | Lowe, K.C., 2002 |
| Vesículas de Hb | Sakai, H. et al., 2006 | Polimerosomas Dendrímeros |
Tanner, P. et al., 2011 y Ruth D. et al., 2005 |
| HBOCS (Ácido poliláctico-catalasa) |
D’Agnillo, F. y Chang, T.M.S., 1998 |
Fuente: La tabla fue desarrollada con base en la consulta que se hizo de los artículos. Es propia de los autores.
La primera célula artificial fue diseñada en 1957 en forma de célula roja y el uso clínico de células artificiales ha sido variado: como adsorbente para hemoperfusión, en forma rutinaria en procesos de intoxicación accidental o suicidas, cuando la diálisis no está disponible (Tabla 4). Otras áreas de aplicación son en las que las células contienen enzimas para tratamientos enzimáticos, islotes para el tratamiento de la diabetes, hepatocitos para la insuficiencia hepática, sistemas de suministro de medicamentos y hormonas (Chang, 2006). En las últimas décadas el interés por la biotecnología, la biología molecular, la nanotecnología y la medicina regeneradora ha estimulado aún más el desarrollo de células artificiales en otros ámbitos, (Discher y Ahmed 2006; Meng et al., 2005; Teramura et al., 2003; Arifin y Palmer, 2003; Arifin, 2005).
Tabla 4 Productos desarrollados a base de hemoglobina (Hb) y fase de investigación clínica en que se encuentran a diciembre de 2013.
| PRODUCTO | DERIVADO | FASE DE INVESTIGACIÓN | INDICACIÓN |
|---|---|---|---|
| Polyheme (Northfield Labs) |
Hb humana | III | Trauma/cirugía |
| Hemopure (Biopure) | Hb bovina | III | Cirugía/hemodilución |
| Hemolink (Hemosol) | Hb humana | III | Cirugía/hemodilución |
| Sangart | Hb humana pegilada | I | Cirugía/hemodilución |
| HemAssist (Baxter) | Hb humana | Terminado | Shock hemorrágico |
| Optro (Somatogen) | Hb recombinante | Terminado | Cirugía/hemodilución |
| Oxygent (Alliance) | Perfluobron | III | Cirugía/hemodilución |
Fuente: <http://www.cancernetwoork.com./rewiew-article/blood-substitutes-how-close-solution/page/0/2>, 15/01/2014, 12:45 pm.
Los tamaños de las células artificiales ahora oscilan entre las macrodimensiones, microdimensiones, dimensiones nanométricas y las dimensiones moleculares (Figura 4), (Chang, 2005).

Fuente: Imagen tomada de Chang, T.M.S. (2005). Therapeutic applications of polymeric artificial cells. Nature Rewiews/Drug Discovery. March Vol. 4 (221-235).
Figura 4 Células artificiales en otros ámbitos.
Las que están en dimensiones macro son adecuadas para la bioencapsulación de células, microrganismos y biorreactantes; aquellas en dimensiones de micra son adecuadas para la encapsulación de enzimas, péptidos, vacunas, fármacos y otros materiales. Las células artificiales que están en las nanodimensiones se han empleado para sustitutos de sangre y vehículos para enzimas, péptidos y fármacos, entre otras aplicaciones. Las células de dimensiones moleculares se utilizan como sustitutos de sangre y enzimas reticuladas (Ming, 2004; Sharma et al., 2011; Napolitano, 2009). La modificación química de la hemoglobina (Figura 5), mantiene la estabilidad en el torrente sanguíneo y también permite la entrega de oxígeno a los tejidos. Hasta la fecha hay cuatro fuentes potenciales de hemoglobina (Tabla 5).

Fuente: Imagen tomada de Napolitano L.M. (2009) Hemoglobin-based oxygen carriers: First, second or third generation? Human or bovine? Where are we now? Critical Care Clinics, 25: 279-301.
Figura 5 Modificación química de la hemoglobina.
Tabla 5 Fuentes potenciales de hemoglobina.
| ORIGEN | EXPLICACIÓN | VENTAJAS | DESVENTAJAS |
|---|---|---|---|
| Sangre humana |
Implica la extracción. | Recurso barato. | No hay suficiente número de donadores. |
| Sangre de vaca | Utiliza Hb de la sangre de vaca. | Recurso barato, reducción de las modificaciones químicas Hb. |
Efecto a largo plazo desconocido en el sistema inmune humano. |
| Microrganismo | Producción a partir de bacterias, hongos y plantas genéticamente modificadas. |
Una fuente de Hb puro, libre de virus y otro componente de sangre. |
Altos costos de producción a gran escala. |
| Animales transgénicos |
Animales capaces de producir Hb cuando maduran. |
Grandes volúmenes. | Posibles objeciones éticas al uso de animales. |
Fuente: Ming, 2004; Sharma, et al. 2011.
Perfluorocarbonos (PFCS)
Los PFCS son “aceites” sintéticos hechos solamente por átomos de carbono y flúor. Han sido desarrollados como materiales aislantes inactivos, en el Proyecto Manhattan durante la segunda guerra mundial. Los PFCs son estables y no reaccionan con tejidos vivos, pero poseen una gran capacidad para acarrear gases incluyendo el oxígeno, el dióxido de carbono y el nitrógeno. La temperatura de ebullición de los diversos PFCs difiere entre unos y otros. Pueden ser líquidos a temperatura ambiente y ser gaseosos a temperatura del cuerpo (<http://espanol.alertdiver.com/Perfluorocarbonos#sthash.tmStmwOs.dpuf>, 15/01/2014, 12:48 pm).
Los perfluorocarbonos son líquidos sintéticos que disuelven grandes volúmenes de oxígeno y también tienen la capacidad de transporte de dióxido de carbono (CO2).
Estos químicos líquidos primero se hicieron famosos en los años 70, cuando los científicos dirigidos por los profesores Lelan C. Clark y Frank Gollan (1966) mostraron que un ratón podía sobrevivir por hasta 10 minutos (Figura 6).

Fuente: Imagen tomada de: <http://www.taringa.net/posts/ciencia-educacion/12990955/Liquidos-respirables-Perfluorocarbono-oxigenado.html>, 15/01/2014, 12:38 pm.
Figura 6 Ratón sumergido en una solución de PFC.
Muchos científicos pensaron que el PFC líquido es la respuesta al desarrollo de un sustituto de sangre eficaz. Esta creencia es compatible con un número de las características favorables asociados al perfluorocarbono (Tabla 6).
Tabla 6 Ventajas y desventajas de los perfluorocarbonos.
| CARACTERÍSTICAS DEL PERFLUOROCARBONO | VENTAJAS | DESVENTAJAS |
|---|---|---|
| Alta solubilidad del oxígeno. | PFC disuelve altos volúmenes de O2 y CO2. Se extraen fácilmente por los tejidos del cuerpo. | Antes de la administración, PFC, éstos deben estar preparados como emulsiones, el perfluorocarbono no se mezcla con plasma sanguíneo. |
| Síntesis de recurso no biológico. | No es transmisor de enfermedades. | Para disolver las cantidades adecuadas de oxígeno en PFC, se requiere que a los pacientes se les administre del 70-100% de oxígeno a través de una máscara de respirar durante la cirugía. |
| Altamente estable. | Altamente estable durante el almacenamiento. PFC no requiere la modificación química, porque no muestra desglose metabólico en el cuerpo. | En los ensayos clínicos en humanos se ha observado el desarrollo de síntomas gripales en algunos pacientes. |
| Químicamente inerte. | PFC no sufre reacción bioquímica en el cuerpo y puede eliminarse del cuerpo a través de los pulmones en exhalación. | |
| Fácil de esterilizar. | Estructura estable, puede soportar altas temperaturas, lo cual permite la esterilización. | |
| Bajo costo. | PFC puede ser producido en calidad de grado médico en una escala grande, comercial. |
Fuente: Cabrales, P. (2006).
Polimerosomas
De las células artificiales mencionadas, las vesículas poliméricas (polimerosomas) son las que en años recientes han tenido una mayor atención, después del primer informe hecho en 1990 por Eisenberg, Bates y Discher (Goliath, 2005). Desde entonces, los bloques de copolímero anfipáticos, dendrímeros y derivados de fulerenos han sido clasificados como formadores de vesículas (Förster y Borchert, 2005) y, a su vez, representan una opción como vehículos de liberación de fármacos (Pata y Dan, 2003).
El empleo de bloques de copolímero para la generación de vesículas poliméricas es una nueva estrategia para el desarrollo de la encapsulación. Dependiendo de la longitud y la naturaleza química del copolímero, el polimerosoma resultante puede ser más robusto que el liposoma comparable a su tamaño (Figura 7). El grosor de la membrana se controla por la variación en el grado de polimerización de los bloques de las moléculas individuales mientras que la fluidez y la permeabilidad de la membrana puede ser ajustada por el cambio de la temperatura de transición vítrea (Tg) del bloque hidrofóbico (Lorenceau et al., 2005).

Fuente: Imagen tomada de Förster, S. y Borchert, K. (2005). Encyclopedia of Polymer Science and Technology. John Wiley & Sons.
Figura 7 Estructura típica de una vesícula lipídica y una vesícula polimérica.
El polimerosoma puede ser formado a partir de bloques de un copolímero usando disolventes orgánicos, acuosos o una mezcla de ambos (Discher et al., 2001). La formación se lleva a cabo en dos pasos, el primero consiste de una bicapa anfipática y el segundo la formación de la vesícula (Figura 8) (Förster y Borchert, 2005).
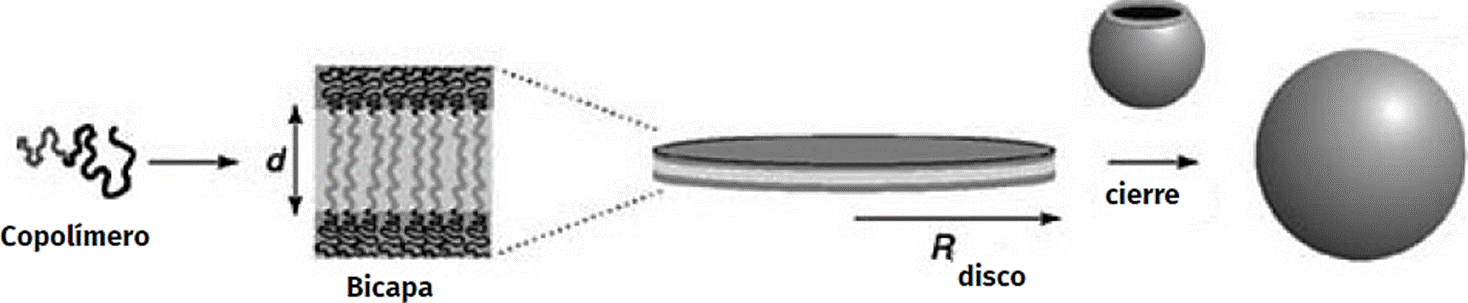
Fuente: Imagen tomada de Förster, S. y Borchert, K. (2005) Encyclopedia of Polymer Science and Technology. John Wiley & Sons.
Figura 8 Esquema estructural de una bicapa anfipática de copolímero y la formación de la vesícula.
Los polimerosomas pueden poseer diversas formas, como se muestra en la Figura 9. Esto va depender de las condiciones del proceso de preparación: composición del copolímero, la naturaleza del disolvente y la temperatura del sistema (Soo y Eisenberg, 2004)

Fuente: Imagen tomada de Soo, P.L. y Eisenberg, A. Preparation of block copolymer vesicle in solution. Journal of Polymer Science: Part B: Polymer Physics. 42: 923-938, 2004.
Figura 9 Micrografías de diferentes tipos de vesículas: a) vesículas pequeñas y uniformes; b) vesículas grandes y polidispersas; c) vesículas atrapadas; d) vesículas de vacío concéntrico; e) cebollas, y, f) vesículas con tubos en la pared.
En la Tabla 7 se muestra en línea de tiempo la evolución en el desarrollo de las células artificiales y sus aplicaciones. Los datos desde 1957 a 2006, corresponden a lo publicado por Chang (2007) y del 2007 al 2012, pertenecen a la investigación que realizaron los autores del presente artículo para conocer el estado del arte hasta nuestros días.
Tabla 7 Conceptos y aplicaciones de las células artificiales poliméricas.
| AÑO | DESARROLLO |
|---|---|
| 1957 Chang | Primera célula artificial polimérica conteniendo hemoglobina y enzimas (método de extrusión). |
| 1964 Chang (Science) | Célula artificial polimérica conteniendo enzimas y hemoglobinas (coacervación interfacial, polímero conjugado con proteína). |
| Nanobiotecnología; entrecruzamiento de proteína (PolyHb) y conjugado de Hb. Método de extrusión por gota para encapsular células intactas para terapia celular. | |
| 1965 Bangham et al. | Microesferas de cristal líquido (liposoma) como modelo de membrana. |
|
1965, |
Tamiz molecular por cromatografía para la separación de células artificiales. |
|
1965, Chang Chang et al. |
Células artificiales con multicomponentes intracelulares. Microesferas con proteína. |
| 1966 Chang | Células artificiales con materiales magnéticos y material biológico. |
| Célula artificial con membrana ultrafina conteniendo adsorbente para hemoperfusión. | |
| 1966 Clark y Gollan | Fluorocarbono como acarreador de oxígeno. |
| 1967 Chang et al. | Célula artificial con membrana de complejo polisacárido para biocompatibilidad. |
| 1968 Chang y Poznansky (Nature) | Implante enzimático que contiene células artificiales para el empleo en terapia enzimática. (Deficiencia congénita de catalasa en ratones acatalacémicos). |
| 1968 Bunn y Jandl | Entrecruzamiento de moléculas de hemoglobina. |
| 1968 Geyer et al. | Efectividad del fluorocarbono en transfusión estudio animal. |
| Célula artificial con membrana lípido-polímero o lípido entrecruzado con polímero con un transportador cíclico. | |
| 1970 - 1975 Chang et. al. | Primer uso clínico de células artificiales en pacientes para hemoperfusión. |
| 1971a Chang (Nature) | Célula artificial con implante enzimático para el tratamiento de linfosarcoma en ratón. Reticulado de hemoglobina con glutaraldehído (polihemoglobina). |
| 1971b Chang | Nanobiotecnología: entrecruzamiento de hemoglobina con glutaraldehído en PolyHb. Sustituto sanguíneo en pacientes. |
| 1972a Chang | Primera monografía de célula artificial. |
| 1972b Chang (Lancet) | Hemoperfusión de células artificiales en paciente con grado IV de coma hepático, recobra la conciencia. |
| 1973 Gregoriadis | Primer uso de liposomas para encapsular enzimas y fármacos. Empleo de liberación controlada. |
| 1975h Chang | Discusión del empleo de células artificiales en vacunas. |
| 1976 Tam, Blumenstein y Wong | Solución de Dextran con hemoglobina conjugada. |
| 1976 Bonhard et al. | Desarrollo de glutaraldehído entrecruzado Poly Hb y su empleo como sustituto sanguíneo. |
| 1977-1985 Chang con Campbell, Cousineau, Ilan, Grunwald, Wahl, Yu etc. | Células artificiales con sistema de multienzimas con co-factor de reciclamiento par reacciones enzimáticas de varias pasos. |
| 1978 Naito y Yokoyama | Desarrollo de perfluorodecalin como sustituto sanguíneo. |
| 1980 Lim y Sun (Science) | Alginato-polilicina-alginato encapsulado en una célula artificial. |
| 1980 Rosenthal y Chang | Célula artificial con membrana de complejo lípido-polímero con Na+, K+, ATPasa. |
| 1980 Djordjevich y Miller | Membrana lipídica encapsulando Hb. |
| 1985 Mitsuno, Ohyanagi | Tratamiento clínico de perfluorodecalin como sustituto sanguíneo. |
| 1986 Yuan y Chang | Célula artificial con microsomas y cytosol. |
| 1986 Bourget y Chang | Presentación oral de célula artificial con enzimas para modificación del metabolismo (feniquetonuria en rata). |
| 1986 Sipehia, Bannard y Chang | Célula artificial con membrana que excluye a pequeñas moléculas hidrofílicas pero permea a moléculas grandes lipofílicas. |
| 1989 Chang, Bourget y Lister | Célula artificial para la remoción selectiva de aminoácidos no deseados en el organismo. |
| Desarrollo y prueba in vivo de un complejo sintético -hem en liposoma y albúmina recombinante como sustituto sanguíneo. | |
| Uso clínico de una forma farmacéutica oral de célula artificial con enzima en pacientes con la enfermedad Lesch-Nyhan. | |
| 1988 Moss et al. | Tratamiento clínico con glutaraldehído entrecruzado Poly Hb. |
| 1990 Hoffman | Hemoglobina humana recombinada. |
| 1994 Yu y Chang | Membrana nanoartificial polimérica biodegradable de glóbulo rojo. |
| 1994 Soon-Shiong et al. | Trasplante de islotes encapsulados en una célula artificial en pacientes con diabetes tipo 1. Reportado como insulino dependiente. |
| 1996 Prakash y Chang (Nature Med.) | Célula artificial oral con células genéticamente modificadas en modelo de rata urémica. |
| 1996 Aebischer, Lysagth et al. (Nature Med) | Fibra de polímero poroso para la encapsulación de células modificadas genéticamente para pacientes con esclerosis. |
| 1998 D’Agnillo y Chang (Nature Biotech) | Nanobiotecnología para hemoglobina entrecruzada, catalasa y superóxido dismutasa para la formación de PolyHb-CAT-SOD soluble. |
| 1998 Tsuchida | Vesícula lípidicas con Hb desarrollo y prueba en animales. |
| 1999 Philips et al. | Membrana lípidicas-PEG con Hb, incremento del tiempo de recirculación. |
| 2000 Liu y Chang | Co-encapsulación de hepatocitos y células madre adulta. |
| 2001 Lörh et al. (Lancet) | Pruebas clínicas con células artificiales con mediadores celulares para el tratamiento de carcinoma pancreático inoperable. |
| 2002 Gould et al. | Capacidad del soporte de vida de la polihemoglobina humana en cirugía. |
| 2002 Sprung et al. | El uso de polihemoglobina bovina en pacientes quirúrgicos: resultados de un ensayo multicéntrico ciego y aleatorio. |
| 2003 Chang, Powanda, Yu | Membrana PEG-PLA con hemoglobina y enzimas de glóbulo rojo en nanodimensiones. |
| 2004 Bloch et al., Aebischer | Estudio clínico fase 1 para terapia de la enfermedad de Huntington empleando células modificadas genéticamente para la secreción del factor neurotrófico. |
| 2004 Yu y Chang (Melanoma Res J.) | Nanobiotecnológica de PolyHb-tyrosinasa en el crecimiento del melanoma en un modelo de rata. |
| 2006 Liu y Chang (J. Liver Trans) | Célula artificial con encapsulación células regeneradoras del hígado en ratas con el 90% del hígado extirpado quirúrgicamente. |
| 2007 Yu y Roberts | Empleo de células artificiales para la selección de restricción de endonucleasas. |
| 2007 Abe, H. et al. | Efecto de vesículas de hemoglobina en reacción anafiláctica en un modelo de rata. |
| 2007 Sakai, H. et al. | Reporte de la observación por un año de ratas Wistar después de una infusión intravenosa de vesículas de hemoglobina. |
| 2007 Tsai y Wong | Patente 7,307,150,2007 conjugado de hemoglobina-dextran como sustituto sanguíneo. |
| 2007 Discher, D. et al. | Aplicación emergente de polimerosomas en el tratamiento de un tumor. |
| 2008 Chiellini, F. et al. | Polímeros micro/nanoestructurados para aplicación biomédica y farmacéutica. |
| 2009 Katz, JS. et al. | Estabilización de la membrana en polimerosomas biodegradables con poli(caprolactona-b-etilenglicol). |
| 2010 Katz, JS. et al. | Nueva ruta de síntesis para el copolímero (PCL-b-PEG) para el desarrollo de una membrana funcionalizada en un polimerosoma biodegradable. |
| 2010 Rameez, S. et al. | Elaboración de polimerosomas con hemoglobina por el método de extrusión a gran escala. |
| 2010 Cho, HK. et al. | Nanopartículas poliméricas, micelas y polimerosomas de bloques de copolímero anfifílicas. |
| 2010 Sakai, H. et al. | Vesículas de hemoglobina que imita a los glóbulos rojos. |
| 2011 Mai´l´té, S. et al. | Coloide de gelatina con Hb empleado como fluido preoperatorio para el acarreo de oxígeno. |
| 2011 Tanner, P. et al. | Polimerosomas que imitan a las células biológicas que pueden emplearse en la liberación controlada de fármacos y biofármacos. |
| 2011 Kim, SH. et al. | Polimerosomas múltiples para la liberación programada de múltiples componentes. |
| 2011 Kamat, NP. et al. | Ingeniería de polimerosomas para el desarrollo de protocélulas. |
| 2011 Perro, A. et al. | Generación de polimerosomas complejos por el método de doble emulsión con el empleo de microfluidos. |
| 2011 Meng, F. et al. | Polimerosomas de la nano a la microescala para el control de la liberación de fármacos y vesículas robustas para virus e imitación de células. |
| 2012 Li, S. et al. | Polimerosomas con membranas ionizables para liberación rápida de proteínas intracelular. |
| 2012 Liu, GY. et al. | Polimerosomas como acarreadores de moléculas zwitterionic (PC@QDs). |
| 2012 Mai´l´té, S. et al. | Polimerosomas “gelly” en su interior con imitación de orgánulos y citoplasma. |
| 2012 Sakai, H. et al. | HBOC con hemoglobina de cerdo. |
| 2012 Taguchi, K. et al. | Evaluación farmacocinética después de una infusión de vesículas de hemoglobina en monos cynomolgus durante 40 días. |
| 2012 Li, D. et al. | Esferas de hemoglobina como portadores de oxígeno. |
| 2012 Liu, M. et al. | Liposoma encapsulando hemoglobina/nanopartículas de sílice como acarreador de oxígeno. |
| 2012 Rameez, S. et al. | Encapsulación de hemoglobina dentro de liposomas con superficie conjugada con poli (etilenglicol) para regular la vasodilatación ocasionada por el óxido nítrico. |
| 2012 Hamadi, M. et al. | Copolímero: eficientes acarreadores de nanopartículas para la terapia génica y vectorización de fármacos. |
En el ámbito de la tecnología, el desarrollo de sustitutos sanguíneos en el mundo científico sigue avanzando en la búsqueda de una alternativa eficaz para los procedimientos de transfusión (generación de glóbulos rojos artificiales), y para tratamiento de enfermedades antineoplásicas con la finalidad de buscar la mejora en la calidad de vida de la población.











 nueva página del texto (beta)
nueva página del texto (beta)



