Introducción
Para poder comprender bien los conceptos de nanociencia, nanotecnología, nanobiología y nanomedicina y poder dar una definición de los mismos, es conveniente establecer primero cuáles son las principales diferencias entre ciencia y tecnología. De una manera general, podemos decir que la ciencia es el trabajo que se realiza en un laboratorio de investigación, aplicando el método científico, en búsqueda de respuestas para determinadas preguntas. Los resultados obtenidos de estas investigaciones, se traducen en trabajos científicos que se publican en revistas especializadas internacionales. Estos trabajos, son previamente analizados por otros científicos especialistas en el tema en cuestión. La tecnología parte de los conocimientos básicos establecidos por la ciencia, para construir un dispositivo o un aparato que tenga una utilidad determinada. El conocimiento necesario para generar el nuevo dispositivo o aparato, generalmente da origen a una patente (mecanismo utilizado para proteger la invención y los derechos de los inventores). La creación de tecnología, proporciona a los científicos nuevas herramientas para contestar nuevas preguntas y avanzar en la ciencia, que a su vez generará nueva tecnología. Por lo tanto, podríamos decir que ciencia y tecnología son las dos caras de una misma moneda.
El prefijo “nano” significa la mil millonésima parte de algo. En el caso de un nanómetro, significa la mil millonésima parte de un metro, es decir 10-9m. Dado que muchas de las propiedades físicas y químicas de la materia se modifican en tamaños comprendidos entre 0.1 y 100 nanómetros, éste sería el mundo “nano” estrictamente hablando.
En el año 1959, varios años antes de recibir el Premio Nóbel de Física, el Dr. Richard Feynman pronunció en el Instituto de Tecnología de California una conferencia titulada “Hay mucho espacio al fondo” (There is plenty of room at the bottom). En esta conferencia, el Dr. Feynman puso los pilares de lo que luego sería conocido como nanotecnología. En su charla, Feynman expuso sus ideas de cómo manipular, controlar y fabricar objetos de muy pequeñas dimensiones. Decía Feynman en su discurso: “Los principios de la física, tal como yo los veo, no niegan la posibilidad de manipular las cosas átomo por átomo. Al no violar ninguna ley, no hay motivo para que no pueda hacerse”. “En el mundo de lo muy, muy pequeño, muchas cosas nuevas podrán suceder, porque los átomos se comportan de manera distinta a como lo hacen los objetos a mayor escala, pues deben satisfacer las leyes de la mecánica cuántica”. Y continúa... “A nivel atómico, aparecen nuevos tipos de fuerza, nuevas posibilidades, nuevos efectos”. Ésta es una de las ideas básicas de la nanotecnología, que consiste en un cambio de estrategia a la hora de fabricar estructuras: el paso de una tradición de arriba hacia abajo top-down a un futuro de abajo hacia arriba bottom-up, manipulando la materia a nivel atómico.
Podemos dar ahora una definición entendible del concepto nanotecnología: es el estudio, síntesis y manipulación de materiales y sistemas funcionales a través del control de la materia a escala nanométrica; tiene como objetivo la fabricación de materiales, objetos y dispositivos tecnológicos a esa escala. Por otra parte, la nanociencia estudia la materia a escala de estructuras moleculares y atómicas, utilizando las herramientas de la física, química, biología y ciencia de los materiales. De esta forma busca responder preguntas básicas sobre el comportamiento de estructuras a esa escala.
Muchos componentes biológicos como el ADN, las membranas celulares, las proteínas, y las estructuras biológicas como los ribosomas o los complejos de poros nucleares tienen tamaño nanométrico. Como todas las células eucariotas están formadas por estos componentes comunes, podemos decir que en la biología hay “vida en el nanomundo”.
Una razón para estudiar la biología a nanoescala, es poder observar propiedades que no se ven en escalas micro o macro. Por ejemplo, medir propiedades físicas de proteínas individuales nos puede dar información sobre su estructura y función. Esta información sin duda nos ayudará a entender cómo los diferentes componentes de un sistema biológico trabajan juntos.
La nanobiología, podría ser definida como el estudio del material biológico a escala nanométrica. Sin embargo, los biólogos moleculares han estado trabajando con nanobiomoléculas desde hace varias décadas. Por lo tanto, estrictamente hablando, se considera nanobiología la disciplina que utiliza productos y conocimiento que surgen de la nanotecnología y los aplica a la investigación en biología. Sería la fusión de la investigación biológica con la nanotecnología, así como la nanomedicina se puede definir como el uso de nanotecnología en el campo médico. (Por consulta de publicaciones recientes ver Balogh, 2010; Kroll, 2012, Jain, 2012.).
A continuación daremos algunos ejemplos sobre el trabajo de investigación que estamos desarrollando en nuestro laboratorio, en el Instituto de Investigaciones Biológicas Clemente Estable. El primer ejemplo, corresponde a las investigaciones que hemos realizado con nanobiomoléculas. El eje de estas investigaciones es el rol del ion Ca2+, su transporte y la regulación de eventos trascendentes como la síntesis proteica en terminales neuronales presinápticos o la regulación de la síntesis de ARN. El segundo ejemplo, corresponde a las investigaciones en curso donde utilizamos nanopolímeros artificiales llamados dendrímeros, donde estudiamos sus posibles aplicaciones como transportadores de drogas o agentes de imagenología en diferentes sistemas biológicos. Por último, nos vamos a referir al microscopio de fuerza atómica y las investigaciones que estamos realizando en el área de las ciencias biológicas y biomédicas. Dado que en los últimos dos ejemplos estamos incluyendo en nuestras investigaciones productos surgidos de la nanotecnología, podemos decir que son investigaciones genuinas en nanobiología y nanomedicina.
Trabajos de investigación
Señalización celular y nanobiomoléculas
Nuestro laboratorio se dedica al estudio de las señales celulares. La transducción de señales es el conjunto de procesos o etapas que ocurren de forma concatenada, por el cual una célula convierte una determinada señal o estímulo exterior, en otra señal o respuesta específica. El proceso de transmisión de señal afecta a una secuencia de reacciones bioquímicas dentro de la célula. Esto se lleva a cabo a través de proteínas o enzimas unidas a otras sustancias llamadas segundos mensajeros. Los cambios en la concentración citosólica de Ca2+ han mostrado ser un sistema de señalización muy versátil. Este sistema regula varios procesos celulares diferentes como la motilidad, secreción y la proliferación celular, entre otros. Los cambios en la concentración intracelular de Ca2+ son detectados por las células como una señal con un significado que debe ser decodificado. Esta decodificación de la información contenida en las señales de Ca2+ es mediada por proteínas capaces de unir Ca2+ (sensoras de Ca2+) que transmiten esta información al blanco final. Como forma de garantizar la función de señalización del Ca2+, las células cuentan con varios sistemas de transporte de dicho ion, que regulan su homeostasis en forma muy precisa (Sotelo y Benech, 1997). Uno de estos sistemas de transporte, son las llamadas bombas de Ca2+ (Ca2+Mg2+-ATPasas). Estas bombas son proteínas y por lo tanto nanoestructuras biológicas.
Trabajando con este transportador hemos obtenido aportes relevantes. Encontramos evidencias de que en ciertas condiciones experimentales, la bomba de Ca2+ puede comportarse como un canal de Ca2+ (Benech et al., 1991, 1995; García-Teijeiro et al., 1999). Caracterizamos el ciclo de reacciones de la Ca2+ ATPasa del sistema tubular denso de plaquetas humanas y mostramos que la estequiometría de esta SERCA (Sarco Endoplasmic Reticulum Calcium ATPase) es diferente a la SERCA de retículo sarcoplásmico de músculo esquelético de conejo (Benech et al., 1995). También mostramos la capacidad de ciertas drogas de desacoplar la enzima y promover un aumento en el eflujo de Ca2+ pero sin síntesis de ATP (García-Teijeiro et al., 1999).
Por otra parte, en colaboración con el Dr. J. R. Sotelo, hemos trabajado en aspectos metabólicos del sistema nervioso, especialmente en la síntesis proteica en el territorio axonal, sináptico y su regulación. En los, organismos eucariotas la síntesis de proteínas extra mitocondriales ocurre en nanoestructuras biológicas denominadas ribosomas. Éste es un tema de investigación muy interesante e importante, ya que en los últimos años han aumentado las evidencias de la existencia de ribosomas y polisomas activos en el dominio axonal y presináptico. De acuerdo con el dogma establecido en las células nerviosas todas las proteínas son sintetizadas en el soma de la neurona y luego transportadas por transporte axonal, al axón y al terminal nervioso (véase Ochs, 1982). Sin embargo, varios grupos de investigación (Dr. E. Koenig, Universidad de Buffalo, USA; Dr. A. Giuditta, Universidad de Nápoles, Italia; Dr. Jaime Álvarez, Universidad Católica de Chile), incluyendo el nuestro, han presentado evidencias muy convincentes que apoyan la existencia de un Sistema Local de Síntesis de Proteínas en axones y terminales nerviosas. En este sentido, hemos contribuido con varias publicaciones utilizando diversas técnicas como auto radiografía a nivel de microscopía óptica, inmunocitoquímica a nivel óptico y electrónico, inmunoprecipitación, Northern blot, RT-PCR, inmunoblot, etc. (Sotelo y Benech, 1997; Sotelo et al., 1999; Sotelo-Silveira et al., 2000; Calliari et al., 2002). (Véase también Koenig y Giuditta, 1999 y Álvarez et al., 2000).
Con respecto al terminal nervioso, al inicio de la década de los 90, se reportó que la fracción sinaptosomal obtenida del lóbulo óptico del calamar fue capaz de sintetizar proteínas extra-mitocondriales (Crispino et al., 1993). Esta fracción fue caracterizada por técnicas bioquímicas y de auto radiografía a nivel de microscopía electrónica. Se encontró que la fracción corresponde al componente presináptico de las neuronas fotorreceptoras del lóbulo óptico del calamar, el cual contiene polisomas activos (Crispino et al., 1997). La caracterización de la existencia de síntesis local de proteínas a nivel axonal y del terminal nervioso, nos llevó a estudiar posibles mecanismos de regulación y uno de los candidatos obvios era el Ca2+. En este sentido, en colaboración con el Dr. A. Giuditta comenzamos a estudiar la modulación del sistema local de síntesis proteica en los sinaptosomas preparados del lóbulo óptico del calamar. Observamos que este proceso estaba muy próximo de su máximo, a la concentración basal de Ca2+ citosólico y era marcadamente inhibida cuando la concentración de este ión era disminuida o aumentada (Benech et al., 1994, 1996, 1997, 1999). La posibilidad de que el Ca2+ module la síntesis local de proteínas sinaptosomal, fue confirmada midiendo la concentración de Ca2+ en un único sinaptosoma (Figura 1), previamente cargado con Fura-2-acetoximetil éster (FURA2 AM). Estos experimentos fueron realizados en colaboración con el Dr. E. Brown del Laboratorio de Neurobiología de la Estación Zoológica de Nápoles, Italia. En su estado de reposo, la concentración de Ca2+ fue de 80 nM (n=10). La adición de cafeína, tapsigargina y KCl, aumentaron la concentración de Ca2+ a 300 nM. Por otra parte, el quelante de Ca2+ BAPTA AM disminuyó la concentración citosólica de dicho ion a menos de 100 nM (Benech et al., 2000). El conjunto de estos resultados sugiere que el rango de sensibilidad de modulación de la síntesis proteica local está en una “ventana” de Ca2+ entre 80 y 300 nM. Estos resultados sugieren que la nanomaquinaria de síntesis proteica eucariota (ribosomas) está presente a nivel presináptico. Los resultados también sugieren, que variaciones en la concentración del Ca2+ citosólico en el terminal presináptico, producto de la actividad neuronal, pueden contribuir a la modulación de la síntesis local de proteínas con importancia para procesos plásticos neuronales como la memoria o el aprendizaje. Por último, los resultados también sugieren la existencia de poblaciones de ARNm específicas a nivel del terminal nervioso, aspecto que llevó a interesarnos en el proceso de síntesis de ARN a nivel del núcleo celular y su regulación.

Figura 1 A: Microscopía láser confocal de un sinaptosoma típico obtenido del lóbulo óptico del calamar en agua artificial de mar (imagen de transmisión). B: Imagen confocal de fluorescencia del mismo sinaptosoma incubado previamente con Fluo-3. La señal de fluorescencia fue fijada al máximo con propósitos ilustrativos. Barra de escala, 2µm.
En los últimos años, el papel del Ca2+ como segundo mensajero se ha expandido a una gran variedad de eventos, desde mecanismos celulares de transducción ya clásicos, como lo es el acoplamiento excitación-contracción en las células musculares, a fenómenos cognitivos tan complejos como el aprendizaje y la memoria. En este contexto, el núcleo celular se ha convertido en uno de los focos principales de investigación. En particular, cómo las señales de Ca2+ que se generan en el citosol pueden afectar fenómenos nucleares. Asimismo, de un tiempo a esta parte, se ha comenzado a concebir al núcleo como un organelo capaz de generar y mantener su propia homeostasis de Ca2+ con relativa independencia de las variaciones en el Ca2+ citosólico (Hardingham et al., 1997; Itano et al., 2003; Echeverría et al., 2003). En esta línea de investigación, estamos estudiando la señalización a nivel nuclear por Ca2+ y el proceso de transcripción (Figuras 2 y 3). Estamos utilizando como paradigma experimental núcleos aislados de hígado de rata y células en cultivo (cultivo primario de células miometriales humanas y de neuronas). Hemos encontrado la existencia de por lo menos 2 componentes de Ca2+ que afectan la síntesis de ARN: a) concentración de Ca2+ en el nucleoplasma en sí misma; b) calcio acumulado en el envoltorio nuclear en forma dependiente de la bomba de calcio SERCA presente en dicho envoltorio (Benech et al. 2002, 2003 y 2005; Escande et al., 2007 a, b y c]. Hemos encontrado también, que la liberación de Ca2+ desde el envoltorio nuclear en respuesta a IP3 fue capaz de promover la fosforilación del factor de transcripción CREB y que un aumento del Ca2+ nuclear a 500 nM, promovió la activación de la transcripción del ARNm de PGC1-á (Escande, tesis de maestría, 2007). Esta proteína es un co-activador de la trascripción y en conjunto con CREB estimula la expresión de los mensajeros de PEPCK1 y G-6-Pasa, contribuyendo de esta forma a la regulación de la gluconeogénesis en hígado.

Imágenes microscopía confocal (C-E). Núcleos aislados fueron cargados con fluo-3, AM y tratados como descrito en (Benech et al, 2005). (C) 1ìM Ca2+libre y 1mM ATP tiempo cero; (D) ìM Ca2+ libre y 1mM ATP a los15 minutos; (E) 1ìM Ca2+libre y 1mM ATP a los 15 minutos, pero con 5ìM thapsigargin. Barra de escala: 5ìm. Reproducido con permiso de Elsevier Ltd.
Figure 2 Carga de Ca2+ dependiente de ATP y sensibilidad a thapsigargin e ionomicina. Nucleaos aislados fueron incubados en un medio de reacción conteniendo: 1mM ATP, 20 ìM GTP, CTP, UTP, 80 mM KCl, 3mM NaCl, 5mM MgCl2, 50 mM Tris-HCl, pH 7.4, 5 mM oxalato de potasio y 1 ìM Ca2+ libre suplementado con 45Ca2+ (0.5 ìCi/ml). La concentración de Ca2+ libre fue calculada de las constantes de asociación aparentes Ca-EGTA de acuerdo con Schwartzenbach, usando un programa de computación como descrito por Fabiato & Fabiato, 1979. (A) Carga de calcio condición control (1ìM Ca2+ libre y 1mM ATP) (?), control más 10 ìM thapsigargin, TG ( ), o control más 2 ìM Ionomycin (¦, o 1ìM Ca2+ libre sin ATP (?). (B) Movilización del 45Ca2+ por EGTA. Se dejaron a los nucleaos aislados cargar 45Ca2+ por 15 min y luego se adiciono 0.5mM EGTA al medio de reacción.
En conjunto, estos resultados sugieren que el núcleo celular es capaz de generar y mantener su propia homeostasis de Ca2+. Variaciones en la homeostasis de Ca2+nuclear originadas en el propio núcleo celular, podría estar modulando procesos tan importantes como la transcripción.
Aplicaciones de los dendrímeros a la nanobiología y nanomedicina
Dendrímeros y músculo liso
Los dendrímeros son una clase única de vehículos nanoestructurados para la entrega de drogas y material genético a blancos intracelulares (Kolhe et al., 2003; Perumal et al., 2008). Como agentes de entrega de drogas, los dendrímeros presentan ventajas como la monodispersión y la multivalencia (Perumal et al., 2008; Cho et al., 2008). Se caracterizan por poseer un núcleo central y un gran número de grupos superficiales. Esto hace que moléculas pequeñas como drogas, enzimas o agentes de imagenología, puedan ser encapsulados o conjugados a los dendrímeros (Tassano et al., 2011; Hamoudeh et al., 2008). Estos polímeros han mostrado ser capaces de producir altos niveles intracelulares de droga y por lo tanto tienen un gran potencial terapéutico [He et al., 2011; Perumal et al., 2008). Asimismo, han demostrado un gran potencial como agentes de diagnóstico (Perumal et al., 2008). Su interacción con las membranas celulares y su internalización celular parecen depender del tamaño, generación y grupos funcionales de superficie (Perumal et al., 2008). En los últimos años, se han realizado varios estudios para evaluar los dendrímeros como transportadores de droga por vía oral [Sadekar y Ghandehari, 2012]. Por otra parte, ha sido observado que los dendrímeros PAMAM de la generación 4 redujeron los niveles de glucosa en sangre en ratas diabéticas [Karolczak , K. et al., 2012] y que dendrímeros modificados PAMAM-OH inhibieron la actividad de la Na+/K+ ATPasa y Ca2+ ATPasa de eritrocitos humanos (Ciolkowski et al., 2011).
La interacción de los dendrímeros con las membranas celulares y la internalización celular parecen depender del tamaño, generación y grupos funcionales de superficie (Perumal et al. 2008). Particularmente, los grupos funcionales superficiales pueden producir una densidad de cargas altamente localizada, que puede tener una influencia importante en la interacción del dendrímero con la membrana celular y su internalización celular.
Nuestro grupo de investigación está estudiando las posibles aplicaciones de los dendrímeros en enfermedades que involucran al músculo liso (como el parto prematuro) y el cáncer.
El parto prematuro es la causa predominante de morbilidad y mortalidad en recién nacidos. Los nanomateriales actualmente en estudio pueden resultar útiles en cuanto al desarrollo de nuevas terapias para tratar los problemas fisiopatológicos de la contracción del músculo liso miometrial (que conllevan al parto prematuro). Para el desarrollo de estas terapias, el conocimiento de los mecanismos de captación celular de los distintos nanomateriales empleados por diferentes tipos celulares, se vuelve primordial. En este sentido, nuestro grupo está estudiando los mecanismos de captación de un nanoconjugado en cultivos primarios de células miometriales humanas (CMH). El nanoconjugado, G4-FITC, fue obtenido al marcar dendrímeros de poliamidoamina (PAMAM) de la generación 4 (G4) con fluoresceína isotiocianato (FITC).
El nanoconjugado obtenido fue caracterizado usando HPLC, NMR y microscopía de fuerza atómica. La concentración de nanoconjugado empleada en los experimentos (7 µg/ml), mostró no afectar significativamente la viabilidad de las CMH hasta las 48 h. El análisis por microscopia láser confocal de CMH incubadas con G4-FITC mostró señal de fluorescencia a nivel perinuclear a partir de las 5 h o más (24, 36 y 48 h) de incubación. A las 24 h, G4-FITC co-localizó parcialmente con “Lysotracker” (Figura 4), un compuesto fluorescente capaz de marcar organelos acídicos en células vivas (lisosomas). Por otra parte, utilizando diferentes tipos de inhibidores de endocitosis y citometría de flujo, logramos identificar el mecanismo de ingreso del nanoconjugado a las CMH. De acuerdo con nuestros resultados, en CMH en cultivo, el G4-FITC estaría siendo captado por medio de endocitosis dependiente de clatrina. Esta conclusión, se basa en el hecho de que la clorpromazina (inhibidor de la endocitosis mediada por clatrina), inhibió la captación de transferrina (control positivo de endocitosis mediada por clatrina) y G4-FITC de forma significativa. La filipina (inhibidor de la endocitosis mediada por caveolina), sin embargo, no mostró tener un efecto inhibitorio significativo en la captación de BODIPY-LacCer (control positivo de endocitosis mediada por caveolina) ni de G4-FITC. Es interesante destacar, que en CMH, nunca detectamos señal de fluorescencia del nanoconjugado caracterizado (G4-FITC) a nivel del núcleo celular. Sin embargo, cuando electroporamos CMH en presencia de G4-FITC, detectamos fluorescencia a nivel de algunos núcleos de CMH. Comprobamos experimentalmente que núcleos aislados de CMH incubados con G4-FITC presentaron señal de fluorescencia (Figura 5). Esta serie de resultados sugieren que los G4-FITC en CMH estarían siendo internalizados por endocitosis dependiente de clatrina, con localización lisosomal a las 24 h. Por otra parte, los resultados también sugieren que la electroporación modifica la distribución intracelular del G4-FITC en este tipo celular, pudiendo convertirse en una tecnología interesante para electrotransferir drogas al citosol o al núcleo de células de músculo liso (Oddone, N. et al., 2013).
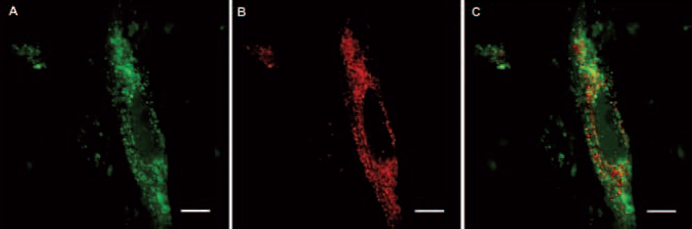
Figura 4 Co-localización parcial de G4-FITC y Lysotracker. Las HMC fueron incubadas por 24 h con G4-FITC y luego 1 h con Lysotracker. Las imágenes se obtuvieron por LCM. G4-FITC (A), Lysotracker (B), Merge (C). Magnificación: 180 x, las barras de escala indicando un tamaño de 10 µm. La longitud de onda de excitación fue de 488 nm y 543 nm para FITC y Lysotracker, respectivamente. Las imágenes fueron superpuestas mediante el software del sistema LCM para observar co-localización.

Figura 5 El G4-FITC ingresa en núcleos aislados de HMC e hígado de rata. Los núcleos aislados fueron incubados por 1 h con G4-FITC y observados por LCM. Núcleos aislados de HMC: G4-FITC (A), DAPI (B), Merge (C). Núcleos aislados de hígado de rata: G4-FITC (D). Magnificación: 120 x. Las barras de escala indican un tamaño de 10 µm (imágenes a, b, y c). Magnificación: 100 x. Las barras de escala indican un tamaño de 20 µm (imagen d).
Dendrímeros y cáncer
El efecto EPR (efecto del incremento de la permeabilidad y retención) se basa en las características fisiopatológicas únicas de los tumores sólidos, las cuales otorgan una ventaja al uso de nanopartículas como vehículos de agentes terapéuticos. Este efecto, surge como consecuencia de la angiogénesis extensa que resulta en la hiper-vascularización, drenaje linfático limitado y aumento de la permeabilidad a los lípidos y macromoléculas. Estas características, ayudan a asegurar el suministro adecuado de nutrientes para satisfacer las necesidades metabólicas de los tumores de crecimiento rápido (Heuser et al., 1986; Maeda et al., 2000).
El abordaje experimental que emplea nanopartículas tradicionales polidispersas, como por ejemplo liposomas y polímeros convencionales, mostró serias complicaciones. Afortunadamente este problema (la capacidad de ajustar tamaños exactos y uniformes) puede ser abordado con éxito empleando dendrímeros, ya que es posible la selección de una entidad de tamaño exacto (Choi y Baker, 2005). La capacidad de construir poblaciones monodispersas de dendrímeros en el rango de tamaño necesario para aprovechar el efecto EPR, es un paso alentador hacia la explotación de las propiedades tumorales como estrategia de captación pasiva de los dendrímeros. En un trabajo reciente de nuestro grupo (Tassano et al., 2011), se logró marcar los dendrímeros PAMAM G4-FITC con el intermediario [99mTc(CO)3(H2O)3]+ con una pureza radioquímica de ~90%. Desarrollamos un método de análisis por HPLC usando columnas C18 y encontramos que el compuesto fue estable por 24 horas. En ratones con melanoma inducido, observamos que el patrón de biodistribución del conjugado fue similar al encontrado en ratones normales. Sin embargo, a la hora post-inyección, observamos una alta captación del conjugado por parte del tumor. La captación tumoral, fue 4-10 veces mayor que la captación observada por la musculatura circundante, lo que permitió un buen contraste y la obtención de buenas imágenes centellográficas (Figura 6). La elevada captación por parte del tumor puede ser explicada por el efecto EPR descrito anteriormente. El análisis de las imágenes por microscopía confocal, mostraron que el 99mTc(CO)3-dendrímero-FITC fue internalizado por las células del hígado y del tumor, con señal fluorescente detectada a nivel del citoplasma celular (Figura 7). Los estudios biológicos mostraron el potencial del compuesto desarrollado en la obtención de imágenes moleculares oncológicas (Tassano et al., 2011). Por otra parte, nuestro grupo estudió la biodistribución de 99mTc(CO)3-dendrímero en otro modelo de tumor murino. Dicho estudio fue realizado en ratones Balb-c con tumor mamario inducido con células 4T1. La biodistribución empleando 99mTc (CO) 3-dendrimero en ratón con tumor mamario fue similar a la observada en ratones normales, con una captación significativa, 1 h post-inyección. Los resultados están expresados en % actividad/g a los tiempos 1 h y 3 h, respectivamente. Se observó acumulación hepática (21.9 ± 3.4, 16.4 ± 3.3), renal (27.9 ± 10.2, 12.8 ± 0.9) y tumoral (1.39 ± 0.2, 0.77 ± 0.1). A nivel del tumor, el % actividad/g fue de 3-4 veces mayor que en el músculo circundante donde el % actividad/g fue: 0.4 ± 0.05 y 0.3 ± 0.2 a los tiempos 1 h y 3 h, respectivamente.
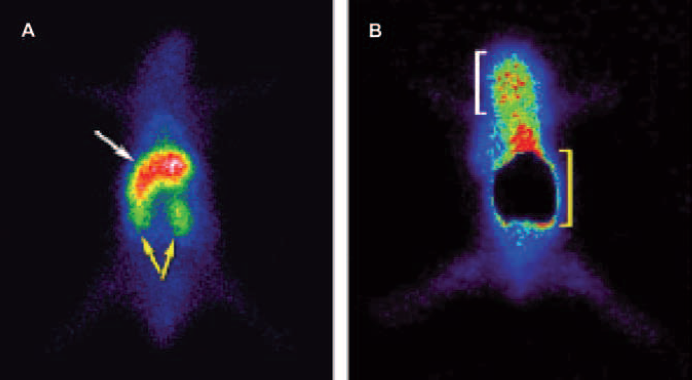
Figura 6 Imagen centellográfica de ratón normal (A) y ratón portador de melanoma (B) inyectados con 99mTc (CO)3-dendrímero-FITC, 1 h post-inyección. (A) Las flechas blancas y amarillas muestran el hígado y los riñones, respectivamente. (B) En blanco se muestra la región donde se localiza el tumor. En amarillo se muestra la región abdominal (hígado y riñones) sobre la cual se colocó una máscara de de manera que no interfiera con la imagen de la región del tumor.
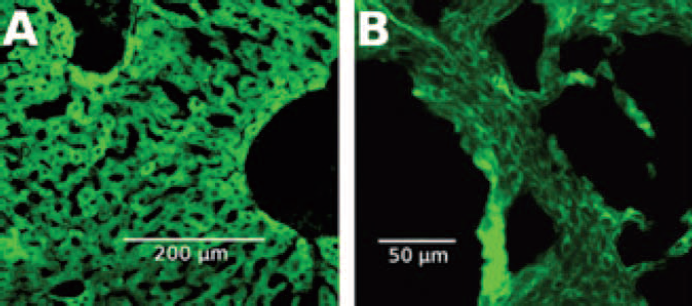
Figura 7 Imágenes de microscopía láser confocal: secciones de hígado (A) y tumor (B) provenientes de ratones portadores de melanoma inyectados con 99mTc (CO)3-dendrímero-FITC, 24 h post-inyección
En este modelo, también se inyectó dendrímero-FITC en forma intravenosa. Se evaluó la captación por las células del tumor a las 24 h post-inyección por microscopía láser confocal. Se observó señal de fluorescencia en el citosol de las células tumorales.
Microscopía de fuerza atómica en ciencias biológicas y biomédicas
La microscopía de fuerza atómica (MFA) va emergiendo como una herramienta muy poderosa en la investigación en general y particularmente aplicada a las ciencias biológicas y biomédicas. La MFA permite el análisis topográfico y mecánico de todo tipo de materiales (conductores y no conductores) a escala nanométrica. El MFA de nuestro instituto tiene acoplado un microscopio óptico invertido de epifluorescencia, el cual posibilita la combinación de imágenes topográficas con el marcaje de células y tejidos utilizando colorantes, sondas o anticuerpos específicos. Permite el análisis topográfico y mecánico a escala nanométrica de material biológico vivo.
Las posibilidades para la investigación en el área biológica y biomédica son múltiples permitiendo:
Por revisión reciente ver Whited, A. M & Park, P. S.-H., 2013.
Utilizando MFA, estamos obteniendo imágenes de alta resolución estudiando el proceso de internalización celular de nanocompuestos como dendrimeros y SPIONs (Superparamagnetic iron oxide nanoparticles) en diferentes cultivos de líneas celulares o cultivos primarios como las CMH mencionadas anteriormente (Figura 8).

Figura 8 Imágenes de microscopía de fuerza atómica de CMH incubada con G4-FITC y fijada con PFA 3%. (A) Imagen de altura CMH. (B) Imagen de deflexión CMH. (C) Imagen de deflexión de región de CMH donde se observan acúmulos de G4-FITC sobre la misma. Las barras de escala indican un tamaño de 15 µm (A y B). La barra de escala indica un tamaño de 1 µm (C).
También estamos estudiando por AFM las propiedades materiales de cardiomiocitos vivos obtenidos de ratones control o diabéticos. La prevalencia de la diabetes mellitus (DM) está creciendo rápidamente. Ha sido estimado que el número de personas adultas afectadas por la diabetes a nivel global aumentará de 171 millones en el 2000 a 300 millones en el 2030 (Wild et al., 2000). La DM es un factor de riesgo bien reconocido por desarrollar insuficiencia cardíaca. De hecho, el Framingham heart study ha mostrado que la frecuencia de insuficiencia cardíaca es 2 veces mayor en hombres diabéticos y 5 veces mayor en mujeres diabéticas en comparación con sujetos controles de la misma edad (Kannel y McGee, 1979). Por lo tanto, complicaciones cardiovasculares son la causa principal de morbilidad y mortalidad relacionada con la diabetes (Garcia et al., 1974).
La DM es responsable de diversas complicaciones cardiovasculares como aumento en la arteriosclerosis en las grandes arterias y el corazón, lo que aumenta el riesgo de infarto de miocardio (Boudina y Abel 2007). En modelos animales de diabetes, varias alteraciones funcionales y estructurales del corazón han sido documentadas tanto en diabetes tipo I como tipo II. En diabetes tipo I, la mayoría de los estudios se han realizado en animales en los cuales la diabetes se induce por administración de estreptozotocina (droga que elimina las células beta del páncreas) (Joffe II et al., 1999; Nielsen et al., 2002; Boudina y Abel, 2007). Nuestro grupo de investigación está trabajando con ratones CD1, a los cuales se les induce diabetes tipo I por inyección intraperitoneal de la droga antes mencionada. Hemos constatado un aumento en la muerte de ratones diabéticos en comparación con ratones control de la misma edad. Como mencionado anteriormente, el MFA permite medir y conocer las propiedades materiales dinámicas visco-elásticas de las células vivas. Las medidas de elastografía que se realizan por MFA, permiten mapear la distribución espacial de las propiedades mecánicas de la célula. Estas propiedades mecánicas son reflejo de la estructura celular. A través de las medidas obtenidas, sería posible detectar cambios promovidos por varias enfermedades a nivel de célula única. Estos cambios han sido observados en varios tipos celulares y enfermedades diferentes (Somer y Meiselman, 1993; Hansma y Hoh, 1994; Wu et al., 2000; Alexopoulos et al., 2003; Shelby et al., 2003; Costa, 2004; Perrault et al., 2004). Los resultados preliminares obtenidos con cardiomiocitos vivos aislados de corazones de ratones diabéticos o de ratones control mostraron que el módulo elástico aparente medido por MFA resultó un 100% mayor en los cardiomiocitos diabéticos. Estos resultados sugieren que los cardiomiocitos de los ratones diabéticos son más duros que los provenientes de ratones control. Los resultados sugieren que la diabetes, estaría modificando las propiedades mecánicas de los cardiomiocitos, aspecto que abordaremos próximamente.
Conclusión
La base de datos actual de clasificación de toxicidad de una sustancia se basa en el hecho de que una vez probada la toxicidad de la misma, todas las sustancias similares serán clasificadas como tóxicas. Este mismo razonamiento aplica para sustancias no tóxicas. Sin embargo, esta lógica no puede ser aplicada en el caso de sustancias formuladas a nanoescala, pues aquí intervienen otro tipo de elementos tales como tamaño, área de superficie, morfología de las partículas, composición química, reactividad, entre otros aspectos.
Hoy contamos con numerosos sistemas nanoestructurados nuevos con múltiples aplicaciones potenciales en el área biomédica. Es necesario, además de la caracterización físicoquímica de estos materiales (tamaño de partículas, potencial zeta, solubilidad, estabilidad, etc.), estudiar su interacción con los sistemas biológicos. Asimismo, conocer la capacidad de estos sistemas nanoestructurados de ingresar en las células, su mecanismo de ingreso, su posible metabolización y su interacción con nanobiomoléculas. Y, desde luego, conocer también si puede provocar daño a nivel celular o del organismo y caracterizar el tipo de daño. Un conocimiento detallado de la interacción de los sistemas nanoestructurados con los sistemas biológicos nos conducirá al desarrollo de sistemas nanoestructurados biocompatibles. Este conocimiento permitirá desarrollar nuevas terapias para el tratamiento de enfermedades como parto prematuro, cáncer, enfermedades neurodegenarativas, diabetes, por mencionar algunas.











 nueva página del texto (beta)
nueva página del texto (beta)




