Uno de los objetivos centrales de la nanociencia es construir pequeñas estructuras para el diseño de materiales avanzados, nanodispositivos de alto rendimiento y miniaturización de dispositivos electrónicos. Las nanopartículas inorgánicas son particularmente atractivas como piezas de construcción para tales propósitos, debido a sus propiedades ópticas, electrónicas, magnéticas y catalíticas únicas (Daniel y Astruc, 2004; Grieve et al., 2000; Lu et al., 2007; Medintz et al., 2005; Pérez-Juste et al., 2005; Shipway et al., 2000), muchas de las cuales pueden ser moduladas simplemente cambiando su tamaño, forma, o la funcionalización de la superficie de la nanopartícula, sin cambiar la composición del material. Hasta ahora se han realizado avances significativos utilizando estrategias de química húmeda, para sintetizar nanopartículas de alta calidad de una gran variedad de materiales inorgánicos, incluyendo oro, plata, óxido de hierro y semiconductores (Daniel y Astruc, 2004; Grieve et al., 2000; Lu et al., 2007; Medintz et al., 2005; Pérez-Juste et al., 2005; Shipway et al., 2000). La manipulación de las condiciones de síntesis permite el control racional de la morfología de las partículas y provee los medios para adaptar las propiedades de los materiales durante el proceso de síntesis. Otro aspecto fundamental de la síntesis de nanopartículas es su estabilización, de tal manera que pueda mantenerse su tamaño y su forma en función del tiempo.
Debido a sus propiedades físicas y químicas únicas, las nanopartículas son con frecuencia descritas como átomos artificiales (Alivisatos, 1996; Banin et al., 1999; Collier et al., 1997). Los avances en los procesos de síntesis han permitido el control preciso sobre los parámetros estructurales que gobiernan la formación de las nanopartículas lo que ha permitido adaptar las propiedades de estos átomos artificiales de acuerdo con su uso específico. La síntesis y el ensamblado modular de nanopartículas permite explotar sus propiedades únicas, lo que puede llevar a nuevas aplicaciones en catálisis, electrónica, fotónica, magnetismo así como sensado químico y biológico.
Los métodos de síntesis de nanopartículas suelen agruparse en dos categorías, las aproximaciones «de arriba hacia abajo» y las «de abajo hacia arriba» (Rao et al., 2004; Schmid, 2004). La primera consiste en la división de sólidos másicos en porciones más pequeñas. Este enfoque puede involucrar la molienda o el desgaste, métodos químicos, y la volatilización de un sólido seguido por la condensación de los componentes volatilizados. La segunda aproximación, «de abajo hacia arriba», consiste en la fabricación de nanopartículas a través de la condensación de átomos o entidades moleculares en una fase gaseosa o en solución. Este último enfoque es mucho más popular en la síntesis de nanopartículas. Las nanopartículas pueden ser soportadas o no. El soporte da estabilidad a las nanopartículas, además de que les puede conferir propiedades específicas (Wachs, 2001).
Existen varios métodos que utilizan la aproximación «de arriba hacia abajo», los más representativos son (Rao et al., 2004; Schmid, 2004): a) La evaporación térmica, que consiste en el calentamiento hasta la evaporación del material que se pretende depositar. Se lleva a cabo en una cámara de vacío en la que se condensa el vapor sobre una lámina fría requiriendo en todo momento un control preciso de las condiciones de crecimiento para no producir una modificación de la morfología de la capa depositada. b) El depósito químico en fase vapor (CVD, por sus siglas en inglés) que consiste en la descomposición de uno o varios compuestos volátiles, en el interior de una cámara de vacío (reactor), en o cerca de la superficie de un sólido para dar lugar a la formación de un material en forma de capa delgada o de nanopartículas. c) La preparación de clusters gaseosos, que utiliza un láser pulsado de alta potencia para producir vapores atómicos metálicos que son acarreados en un gas inerte y posteriormente son depositados en un óxido monocristalino u otro sustrato, bajo condiciones de ultra-alto vacío. d) La implantación de iones, que consiste en que los iones de un material pueden ser implantados en un sólido, cambiando por tanto las propiedades físicas y químicas de este último, ya que el ion implantado puede ser de un elemento distinto al que lo compone, también se pueden causar cambios estructurales en el sólido implantado, puesto que la estructura cristalina del objetivo puede ser dañada. El equipamiento necesario para la implantación de iones suele consistir en una fuente de iones que produce los iones del elemento deseado, un acelerador donde dichos iones son electrostáticamente acelerados hasta alcanzar una alta energía, y una cámara donde los iones impactan contra el objetivo. Cada ion suele ser un átomo aislado, y de esta manera la cantidad de material que se implanta en el objetivo es en realidad la integral respecto del tiempo de la corriente de ion. Esta cantidad es conocida como dosis. Las corrientes suministradas suelen ser muy pequeñas (microamperios), y por esto la dosis que puede ser implantada en un tiempo razonable es también pequeña. Por todo esto, la implantación de iones encuentra aplicación en los casos en que el cambio químico necesario es pequeño. Las energías típicas de ion se encuentran en el rango de 10 a 500 keV. La energía de los iones junto con la especie de ion y la composición del objetivo determinan la profundidad de penetración de los iones en el sólido. e) La molienda de partículas de tamaño macro o micrométrico, por medio de molinos de alta eficiencia; las partículas resultantes son clasificadas por medios físicos, recuperándose las de tamaño nanométrico. Dado que la molienda enérgica y continua de los materiales iniciales puede inferir cambios energéticos en los sólidos, debido a la acumulación de defectos en situación de no-equilibrio, lo que puede causar una disminución de las energías de activación, activando los sólidos para llevar a cabo reacciones químicas en estado sólido. La activación mecanoquímica de sólidos cristalinos puede producir también alteraciones y cambios tanto texturales como estructurales, que pueden resultar de gran interés en el desarrollo de materiales (Boldyrev, 2006; Imamura et al., 1984). La mecanosíntesis por reacción entre metales y óxidos ha sido estudiada en algunos sistemas con el objeto de obtener materiales compuestos nanoestructurados (Schmid, 2004; Takacs, 1993). En la Figura 1, se presentan imágenes HRTEM de nanopartículas de Fe3O4 y de nanopartículas de ZnO@Fe3O4 sintetizadas por mecanosíntesis.

Fuente: A. Vázquez Olmos et al., trabajo en preparación.
Figura 1 Micrografías obtenidas por HR-TEM de nanopartículas de Fe3O4 (izquierda) y de nanopartículas de ZnO@Fe3O4 (derecha) sintetizadas por mecanosíntesis.
Como puede constatarse en lo aquí descrito, varios de los métodos que utilizan la aproximación «de arriba hacia abajo», salvo la molienda, requieren de instrumentación compleja y complicada, lo cual los hace costosos, por tanto, muchas veces se prefieren los métodos que utilizan la aproximación «de abajo hacia arriba».
Existen diversos métodos que utilizan la aproximación de “abajo hacia arriba” para la síntesis de nanopartículas, los más empleados son aquellos que utilizan procedimientos químicos. Por lo general, inician con la reducción de los iones metálicos a átomos metálicos, seguido por la agregación controlada de estos átomos. El método químico es el más conveniente para la obtención de nanopartículas uniformes y pequeñas. Los métodos más representativos de esta aproximación son:
a) El método coloidal
Los coloides son partículas individuales, que son más grandes que las dimensiones atómicas, pero lo suficientemente pequeño como para exhibir movimiento browniano. Si las partículas son lo suficientemente grandes, entonces su comportamiento dinámico en suspensión en función del tiempo se regirá por las fuerzas de la gravedad y se dará el fenómeno de sedimentación, si son lo suficientemente pequeños para ser coloides, entonces su movimiento irregular en suspensión puede ser atribuido a bombardeos colectivos de una multitud de moléculas térmicamente agitadas en una suspensión líquida. Este rango de tamaño de partículas en una solución coloidal suele oscilar en el rango de nanómetros, por ello el método coloidal es un método eficiente de producción de nanopartículas (de-Jong, 2009; Schmid, 2004). Este método consiste en disolver una sal del precursor metálico o del óxido a preparar, un reductor y un estabilizante en una fase continua o dispersante (un líquido en este caso). Este último puede jugar el papel de reductor, de estabilizante o ambos. En principio el tamaño promedio, la distribución de tamaños y la forma o morfología de las nanopartículas pueden ser controlados variando la concentración de los reactantes, del reductor y del estabilizante así como la naturaleza del medio dispersante. Por este método se pueden formar dispersiones estables por periodos de tiempo muy largos, por ejemplo, Michel Faraday, en 1857, creó dispersiones coloidales de oro, que hoy en día aún permanecen estables (Faraday, 1957). A principios de los años cincuenta del siglo pasado, Turkevitch reportó el primer método estándar y reproducible para la preparación de coloides metálicos (partículas de oro de 20 nm por medio de la reducción de [AuCl4 -] con citrato de sodio). Adicionalmente fue el primero en proponer un mecanismo paso a paso de la formación de nanoclusters basado en la nucleación y crecimiento (Turkevich et al., 1951; Turkevich y Kim, 1970).
En la Figura 2, se muestran micrografías obtenidas por TEM y HR-TEM de nanovaras de Mn3O4 sintetizadas por el método coloidal, obtenidas en el Grupo de Materiales y Nanotecnología del CCADET-UNAM (Vázquez-Olmos et al., 2005). El depósito de coloides sobre soportes (por ejemplo, sobre óxidos) es posible, aunque la mayoría de las veces hay incremento del tamaño de las partículas cuando es necesario remover el estabilizante por medio de un tratamiento térmico.

Tomado de Vázquez-Olmos et al., 2005), con autorización de los autores.
Figura 2 Micrografías obtenidas por TEM y HR-TEM de nanovaras de Mn3O4 obtenidas por el método coloidal. En el extremo derecho se presenta su correspondiente patrón de difracción de electrones.
b) Reducción fotoquímica y radioquímica
La síntesis de nanopartículas metálicas modificando el sistema químico por medio de altas energías se asocia con la generación de reductores fuertes altamente activos como electrones, radicales y especies excitadas.
La reducción fotoquímica (fotolisis) y la radicación-química (radiólisis) difieren en el nivel de energía utilizado. La síntesis fotoquímica está caracterizada por energías por debajo de 60 eV, mientras que la radiólisis utiliza energías de 103-104 eV. Los métodos de reducción fotoquímica y radioquímica tienen la ventajas sobre el método de reducción química. Debido a la ausencia de impurezas formadas cuando se usan reductores químicos, estos métodos producen nanopartículas de alta pureza. Además, la reducción fotoquímica y radioquímica permiten producir nanopartículas en condiciones de estado sólido y a bajas temperaturas.
La reducción fotoquímica en solución se emplea frecuentemente para sinterizar partículas de metales nobles. Estas partículas se obtienen a partir de las correspondientes sales en agua, alcohol o solventes orgánicos. En estos medios, bajo la acción de la luz, se forman las siguientes especies activas:
En el caso de reacción con alcoholes, un átomo de hidrógeno y un radical hidroxilo producen un radical alcohol:
Un electrón solvatado interacciona con, por ejemplo, un átomo de plata, reduciendo el metal (Sergeev, 2006):
Se ha descrito también la síntesis de nanopartículas de plata en nanoemulsiones por reducción utilizando radiólisis (Revina et al., 1999), obteniéndose distribuciones de partícula muy estrechas. Debido a su disponibilidad y reproducibilidad, la reducción por radiación-química para sintetizar nanopartículas está teniendo una gran aceptación. En la fase líquida, las etapas asociadas con la distribución espacial de los productos intermediarios juegan un papel esencial en la producción de nanopartículas metálicas. En contraste con la fotólisis, la distribución de los intermediarios generados durante el proceso de síntesis es más uniforme, lo que permite obtener partículas con distribuciones de tamaño más estrechas.
El método de radiólisis pulsada permite la síntesis de partículas metálicas activas con estados de oxidación inusuales (Ershov, 1997). La reacción con un electrón hidratado eaq - que tiene un alto potencial de reducción, procede de la siguiente manera:
La presencia de un electrón unitario en el orbital exterior de un átomo o de un ion metálico determina su alta reactividad química. En el transcurso de la reducción por radiación-química, inicialmente se forman átomos o pequeños clusters metálicos, los cuales son transformados en nanopartículas, para estabilizarlos se pueden agregar aditivos similares a los usados en la reducción química para formar coloides.
c) Irradiación con microondas
La técnica de irradiación con microondas produce nanopartículas con una muy baja dispersión de tamaño, aunque no siempre se logre un control preciso en la morfología, como pasa en la mayoría de las técnicas de “abajo hacia arriba”. Las microondas actúan como campos eléctricos de alta frecuencia, capaces de calentar cualquier material conteniendo cargas eléctricas como las moléculas polares en un disolvente o iones conductores en un sólido. Los solventes polares se calientan y sus componentes moleculares se ven obligados a girar con el campo y pierden energía en colisiones. Las muestras conductoras y semiconductoras se calientan cuando los iones y los electrones contenidos en ellas forman una corriente eléctrica y la energía se pierde debido a la resistencia eléctrica del material. En los últimos años, el proceso de calentamiento asistido por microondas se ha utilizado como una alternativa atractiva para la síntesis de materiales a escala nanométrica, dado que es un método rápido, uniforme y efectivo, que permite incrementar las cinéticas de reacción en uno o dos órdenes de magnitud.
Nanopartículas coloidales de Pt, Ru, Ag y Pd estabilizados por polímeros han sido preparadas por calentamiento con microondas, a partir de las sales precursoras del metal disueltas en soluciones de etilenglicol (Zhu et al., 2004).
Por otra parte, el calentamiento por microondas de las muestras líquidas permite la disminución de las fluctuaciones de temperatura en el medio de reacción, proporcionando, así, un entorno más homogéneo para la nucleación y el crecimiento de las partículas metálicas (Patel et al., 2005; Zhu et al., 2004).
d) Utilización de dendrímeros
La síntesis de nanopartículas también se ha llevado a cabo usando micelas, emulsiones y dendrímeros como nanorreactores que permiten la síntesis de partículas de forma y tamaño definidos. Esto se logra alterando la naturaleza de los dendrímeros. Los dendrímeros son moléculas altamente ramificadas, las que incluyen un núcleo central, unidades intermediarias repetitivas y grupos funcionales terminales (Muzafarov y Rebrov, 2000). Los dendrímeros representan nuevos tipos de macromoléculas que combinan el alto peso molecular y baja viscosidad de sus soluciones con su forma molecular tridimensional y la presencia de una estructura espacial. El tamaño de los dendrímeros varía de 2 a 15 nm y representan nanorreactores naturales. Los dendrímeros con un número pequeño de unidades intermediarias existen en forma “abierta” mientras que los que involucran muchas unidades forman estructuras esféricas tridimensionales. Los grupos terminales de los dendrímeros pueden ser modificados con grupos hidróxidos, carboxilos, hidroxicarboxilos, entre otros.
Los dendrímeros de diferentes generaciones con varios grupos funcionales terminales han probado ser templetes adecuados para la síntesis de nanopartículas monometálicas y bimetálicas. Diferentes poly(amidoaminas) han sido muy populares como dendrímeros para la síntesis de nanopartículas. Con estos dendrímeros se han sinterizado nanopartículas de oro de 1-3 nm (Kim et al., 2004; Zheng y Dickson, 2002). Otros trabajos, por ejemplo, han informado que este método es útil para la síntesis de nanopartículas de platino y paladio con tamaños de partícula entre 1 y 2 nm incorporadas en dendrímeros poly(amidoaminas) funcionalizadas con grupos amino. Los dendrímeros han también sido activamente utilizados para la síntesis de nanopartícul as bimetálicas (Sergeev, 2006).
e) Síntesis solvotermal
Con el nombre general de síntesis solvotermal se agrupan una serie de técnicas en las que un precursor metálico disuelto en un líquido, en un recipiente cerrado, es calentado por encima de su punto de ebullición, lo que genera una presión superior a la atmosférica (normalmente moderada). El líquido habitual es el agua, y de ahí el nombre de “síntesis hidrotermal”; sin embargo, cada vez se van utilizando con mayor frecuencia otros medios líquidos: disolventes orgánicos, amoniaco líquido, hidracina, etc., y tenemos entonces la síntesis solvotermal. En este tipo de técnicas normalmente los tiempos de reacción son largos (comparados con otros métodos químicos).
La síntesis hidrotermal se refiere a reacciones heterogéneas en medio acuoso por encima de 100 °C y 1 bar. Una característica distintiva de la síntesis hidrotermal es que los reactivos que difícilmente se disuelven en agua pasan a la disolución por acción del propio disolvente o de mineralizadores. El objetivo de esta técnica es lograr una mejor disolución de los componentes de un sistema y así se logran disolver o hacer reaccionar especies muy poco solubles en condiciones habituales (p. ej., la sílice, aluminosilicatos, titanatos, sulfuros) (Xie y Shang, 2007). En este sentido cabe señalar que el agua, calentada a 600 °C (lo que obviamente requiere presión que evite su paso al estado de vapor) experimenta una disociación (H3O+, OH-) mucho mayor que lo habitual a presión ordinaria: llega a ser de 10-6 en lugar de 10-14, lo que quiere decir que en estas condiciones, el agua, como anfótero que es, se comportará a la vez como un ácido y una base bastante fuertes, capaz por tanto de ataques ácido-base mucho más agresivos. Por otra parte, pueden añadirse distintas especies conocidas como “mineralizadores”, tanto básicos (carbonatos, hidróxidos) como ácidos (nítrico, clorhídrico, sales amónicas) oxidantes o reductores, complejantes, etc., que potenciarán la capacidad de disolución del agua en una u otra dirección. Además, el agua en estas condiciones suele actuar como agente reductor (liberando oxígeno), por lo que cabe esperar también variaciones en el estado de oxidación de los elementos implicados en la síntesis. No menos importante es la adición de especies utilizables como “plantilla” con el fin de nuclear el producto en su entorno y generar así cavidades o porosidad “a la medida” y, en este sentido, cationes orgánicos, con geometría definidas como el terametilamonio (TMA) y otros, están siendo utilizados con gran éxito en la síntesis de nuevas especies nanométricas (Xie y Shang, 2007).
f) Método sol-gel
El método sol-gel es un proceso químico en fase húmeda ampliamente utilizado en la ciencia de los materiales. Este método se utiliza principalmente para la fabricación de nanomateriales (normalmente un óxido metálico). Se parte de una solución química o sol que actúa como precursor de una red integrada ya sea de partículas discretas o de una red de polímeros. Los precursores típicos del proceso sol-gel son los alcóxidos metálicos y los cloruros metálicos, que sufren varias reacciones de hidrólisis y policondensación para formar una dispersión coloidal, que luego de una polimerización lenta forma un gel. En general, los alcóxidos son muy sensibles a la humedad (se descomponen muy fácilmente ante la presencia de ésta), es por ello que la hidrólisis para la formación del gel es llevada a cabo usando alcoholes como un solvente común para los diferentes líquidos inmiscibles. Un gel polimérico es una red macromolecular infinita, la cual está hinchada por solvente. Un gel puede ser creado cuando la concentración de la especie dispersa aumenta. El solvente es atrapado en la red de partículas y así la red polimérica impide que el líquido se separe, mientras el líquido previene que el sólido colapse en una masa compacta. La deshidratación parcial de un gel produce un residuo sólido elástico que se conoce como xerogel. Finalmente, este material es completamente deshidratado y eventualmente tratado térmicamente en flujo de gas para obtener el material nanoestructurado final (de-Jong, 2009).
El método sol-gel ha sido usado en los últimos años para preparar una amplia variedad de materiales nanoestructurados. El método es atractivo porque involucra procesos a baja temperatura. También la alta pureza y homogeneidad son atribuibles a su forma de preparación en sistemas multicomponente (de-Jong, 2009). La Figura 3 muestra imágenes de microscopía electrónica de barrido de pequeñas esferas de óxido de silicio sintetizadas por el método sol-gel.

Fuente: Cortesía del Dr. José Ocotlán Flores del Grupo de Materiales y Nanotecnología del CCADET-UNAM.
Figura 3 Imágenes de microscopía electrónica de barrido de pequeñas esferas de óxido de silicio sintetizadas por el método sol-gel.
Las dispersiones de nanopartículas son termodinámicamente metaestables, debido a su muy alta área superficial, lo que representa una contribución positiva a la entalpía libre del sistema. Si las energías de activación no son lo suficientemente altas, se produce una evolución de la dispersión de nanopartículas causando un aumento en el tamaño de las nanopartículas por un proceso de maduración de Ostwald (Ostwald ripening). Por lo tanto, las nanopartículas altamente dispersas están estabilizadas sólo cinéticamente y no pueden producirse en condiciones que superen un cierto umbral, por lo que se prefieren los métodos de la llamada «química suave». Un método que se utiliza comúnmente para estabilizar las nanopartículas es depositarlas en un soporte, generalmente un óxido metálico, para impedir su sinterización, re-cristalización y agregación. Este tipo de materiales nanoestructurados soportados son de gran utilidad en áreas como la catálisis, aplicaciones ópticas, médicas, entre otras. Los métodos clásicos de depósito de nanopartículas en óxidos metálicos son:
La impregnación, que consiste en el llenado de los poros del soporte con una solución del precursor metálico (normalmente una sal) en el que el volumen puede ser el necesario para llenar el volumen de poros o bien un exceso de volumen que luego de un periodo de maduración es removido por evaporación, de tal forma que el precursor metálico y su contraion permanecen sobre la superficie del soporte. Éste es un método sencillo y barato, por tanto, es el método clásico de preparación de catalizadores a nivel industrial; sin embargo, con la desventaja de que se tiene muy poco control de la manera en que interacciona el precursor metálico con el soporte, además de que no se logra una eliminación eficiente del contraión del precursor metálico. Una vez que se logra la interacción de los precursores metálicos con el soporte, el material obtenido se somete a tratamientos térmicos en mezclas de gases reductoras u oxidantes, para obtener las nanopartículas depositadas en el soporte (Bond et al., 2006; Zanella et al., 2002).
Adsorción iónica, en este método se puede utilizar tanto la adsorción de aniones como de cationes. Los cationes pueden ser adsorbidos a través de interacción electrostática con los grupos superficiales del soporte cargados negativamente (O-), esto se logra cuando el pH de la solución en la que está suspendido el soporte es superior al punto isoléctrico del soporte (PIE). Las especies aniónicas pueden ser adsorbidas en los grupos superficiales del soporte cargados positivamente (OH2 +), cuando el pH de la solución es inferior al PIE (Bond et al., 2006; Zanella et al., 2005; Zanella et al., 2002). Las superficies de óxidos o hidróxidos pueden ser protonadas o deprotonadas dependiendo del pH de la solución. El valor en el cual la carga eléctrica total de la superficie es cero es el punto de carga cero, que tiene el mismo valor en pH que el PIE.
Depósito-Precipitación (DP), que consiste en el depósito de un óxido hidratado o de un hidróxido sobre la superficie de un soporte, como resultado de un aumento gradual y homogéneo del pH de la solución en la que el soporte es suspendido. Los agentes basificantes típicos son los hidróxidos, como el NaOH, o el KOH, los carbonatos o las bases de retardo como la urea (Zanella et al., 2005; Zanella et al., 2002). El precipitado puede ser nucleado por la superficie del soporte, y cuando se lleva a cabo correctamente toda la fase activa es ligada al soporte sin que permanezca flotando en la solución. Este método así como las adsorciones iónicas presentan la ventaja sobre la impregnación de que la mayor parte de los contraiones del precursor metálico pueden eliminarse de manera eficiente por medio de lavados repetidos de las muestras luego del depósito del precursor metálico. Como en los métodos anteriores, la obtención de las nanopartículas depositadas se logra luego de un tratamiento térmico del precursor metálico en interacción con el soporte, en atmósferas de gases reductoras u oxidantes, dependiendo de las propiedades químicas de la especie depositada y el estado de oxidación deseado del material depositado. El tamaño y la morfología de partículas soportadas es altamente dependiente de los parámetros utilizados durante la síntesis (temperatura de depósito, tiempo de contacto, pH, tipo de gas y temperatura utilizados durante el tratamiento térmico), del soporte utilizado (características electrónicas, morfológicas, defectos superficiales, etc.), y del precursor metálico (Zanella et al., 2005; Zanella et al., 2002). Las Figuras 4 y 5 muestran ejemplos de catalizadores compuestos por nanopartículas de oro soportadas en óxido de titanio preparadas por el método de depósito precipitación, utilizando urea como base de retardo. En la Figura 4 se muestran el catalizador en polvo, una imagen de microscopía electrónica del mismo, la distribución de tamaños de partícula obtenidos y una imagen de HRTEM de una nanopartícula de oro. En la Figura 5 se muestran imágenes de microscopía electrónica de transmisión de nanopartículas de oro soportadas en cristales de óxido de titanio.
Depósito de coloides. En principio el tamaño promedio y la distribución del tamaño de partícula pueden ser controlados seleccionando adecuadamente las condiciones de síntesis. La ventaja de usar una ruta coloidal para preparar materiales metálicos soportados radica en el hecho de que las condiciones de preparación pueden ser manipuladas para obtener partículas con una distribución de tamaños estrecha en torno al tamaño deseado, inclusive por este método puede ser controlada la forma de las partículas. Existen reportados en la literatura una buena cantidad de métodos para la síntesis de coloides metálicos, en los que se han utilizado una gran cantidad de reductores como el citrato de sodio, tiocianato de sodio, poli(etilen-imina), cloruro de tetrakis[hidroximetil]fosfonio y borohidruro de sodio (Bond et al., 2006; Dyson y Mingos, 1999; Turkevich et al., 1951). Como se mencionó arriba también pueden utilizarse estabilizantes. Las nanopartículas metálicas pueden ser inmovilizadas en el soporte sumergiéndolo en la suspensión coloidal, seguido por un proceso de lavado y secado. En una preparación exitosa las partículas una vez soportadas no deberían ser significativamente más grandes que las obtenidas en el sol; para lograr lo anterior se requiere mantener un delicado balance entre varios parámetros tales como la naturaleza y concentración del estabilizante, la relación metal/estabilizante y, por supuesto, la naturaleza del soporte (Bond et al., 2006). En principio, el depósito de partículas coloidales no es un problema (Grunwaldt y Baiker, 1999; Martra et al., 2003) a menos que sea necesario remover el estabilizante por tratamiento térmico.
Depósito fotoquímico. Se basa en que ciertos cationes metálicos con potenciales redox apropiados pueden ser depositados en el soporte y reducidos por fotoelectrones creados por la iluminación de semiconductores, tales como óxidos de zinc, tungsteno y titanio. El mecanismo de fotorreducción ha sido ampliamente estudiado (Fernandez et al., 1995). En este método se pueden utilizar también estabilizantes orgánicos, para evitar el crecimiento desmedido de las partículas tales como PVA y PVP (Li, McCann, Gratt, y Xia, 2004). Los soportes que no tienen un bandgap adecuado (Fe2O3 y SnO2) normalmente no son adecuados para ser utilizados como soportes en este método (Li et al., 2004). La desventaja de este método es que su eficacia es muy sensible a las características tanto del bulto como de la superficie del soporte. La mayor ventaja es que no es necesario tratar térmicamente las muestras ya que luego de la preparación, el metal se encuentra reducido por la irradiación con UV.
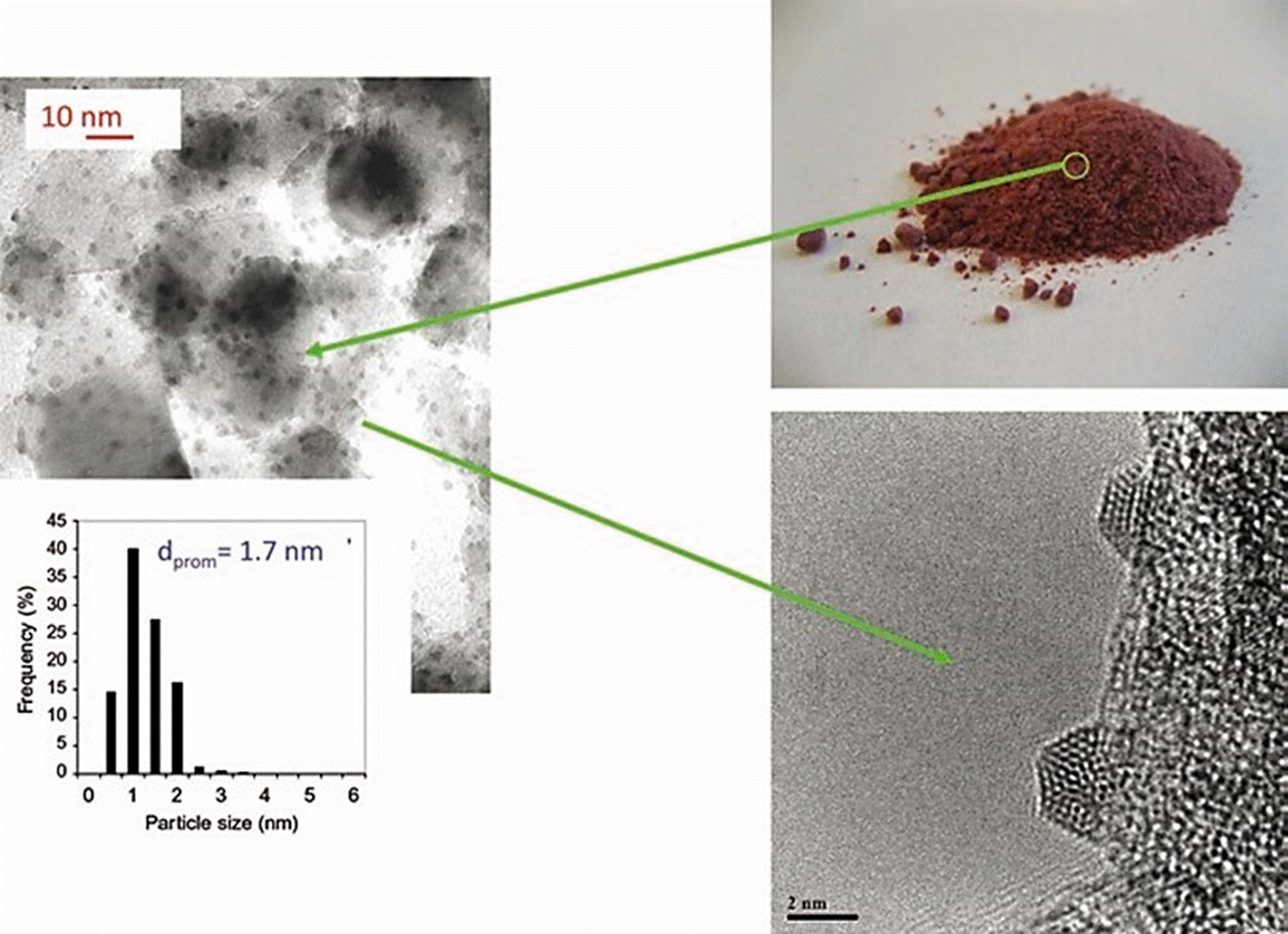
Se muestra el catalizador en polvo, una imagen de microscopía electrónica del mismo, la distribución de tamaños de partícula obtenidos y una imagen de HRTEM de una nanopartícula de oro.
Figura 4 Catalizador consistente en nanopartículas de oro soportadas en óxido de titanio preparadas por el método de depósito-precipitación, utilizando urea como base de retardo.











 nueva página del texto (beta)
nueva página del texto (beta)



