¿Qué es un fármaco?
Un fármaco es una sustancia química capaz de prevenir, controlar, tratar, curar o modificar, procesos fisiológicos no deseados. Existen diferentes tipos de fármacos, entre los más comunes se encuentran algunos compuestos orgánicos, derivados de ácidos nucleícos y derivados de tipo carbohidrato (Hoffman, 2011).
Existen distintos factores que pueden mermar la disponibilidad de los fármacos en el sitio requerido, entre ellos, la degradación (debida a los ácidos estomacales o al sistema inmunológico), la interacción con el medio biológico e incluso la penetración intracelular (Peer et al., 2007). En algunos casos los fármacos pueden dañar orgános sanos, por ejemplo los fármacos que se utilizan en el tratamiento contra el cáncer tienen como objetivo matar las células cancerosas sin eliminar las sanas. Las células cancerosas se multiplican a un ritmo mayor que las sanas (de 2 a 4 veces más rápido). Sin embargo, los fármacos no son capaces de reconocer las células sanas que también se dividen con rapidez; por ejemplo, las de la médula ósea, los folículos pilosos y el recubrimiento del tracto digestivo. Esta falta de reconocimiento de las células tiene como consecuencia los efectos secundarios de los tratamientos contra el cáncer, como anemia, pérdida del cabello y alteraciones gastrointestinales (Ackerman, 2008).
Los fármacos que se utilizan en el tratamiento contra el VIH generan toxicidad hepática, debido a que las enzimas metabolizan o descomponen el fármaco en sustancias químicas activas (metabolitos) que generalmente son tóxicos. Si una sustancia inhibe las enzimas, el procesamiento de los fármacos es lento y los niveles de medicamento en el cuerpo aumentan, intensificando la toxicidad y los efectos secundarios. Si la sustancia estimula la producción de las enzimas, se acelera el metabolismo de los fármacos y éstos se eliminan rápidamente, haciendo que las concentraciones del medicamento caigan hasta niveles ineficaces. Si se metabolizan múltiples fármacos a través de una vía compartida, puede producirse un bloqueo del metabolismo, ya que todos los fármacos compiten por las mismas enzimas.
No sólo los fármacos contra el VIH generan toxicidad hepática, el paracetamol es un fármaco dañino para el hígado a partir de ciertas dosis, es uno de los principales causantes de insuficiencia hepática aguda, siendo responsable de más de 50 mil visitas a urgencias médicas (Highleyman, 2003).
Para que los farmacos puedan cumplir con sus funcioneds (prevenir, controlar, tratar, curar o modificar) es necesario que no se modifequen las propiedades fisicoquímicas de las moléculas que los forman, que los factores externos con los que interactúa en el organismo no cambien la naturaleza del farmáco y, finalmente, que no decrezca la concentración cuando se absorben.
Vias de administración
Existen diferentes vías de administración de un fármaco, como son: oral, intravenosa, intramuscular, subcutánea, sublingual, rectal, ocular, nasal, inhalación, tópica o trasdérmica. El suministro oral es la vía más conveniente, segura y menos costosa, sin embargo, fármacos como la insulina, que se utiliza en pacientes con diabetes, no pueden ser suministrados mediante esta vía, debido a que se digieren y se eliminan sin adsorberse (MMIMH). Cuando un fármaco es suministrado vía oral, comienza a absorberse en el tracto gastrointestinal, pasando por el tubo digestivo hasta el esófago, donde se fragmenta en pequeñas partículas. Posteriormente llega hasta el estómago donde comienza la absorción, la cual se lleva a cabo principalmente en el intestino, una vez absorbido a nivel de la circulación sanguínea, el fármaco se propaga a través del cuerpo y penetra diferentes tejidos (Figura 1).

Figura 1 Esquema que representa los órganos por los que circula un fármaco cuando es suministrdo por vía oral [3]. 1. Paso al tubo digestivo por el esófago, 2. Disolución del medicamento en pequeñas partículas, 3. Absorción, que puede tener lugar a nivel del estómago, pero que se lleva a cabo principalmente en el intestino.
¿Cómo optimizar la administración de un fármaco?
Los efectos secundarios, la toxicidad, la concentración y la degradación son características de los fármacos que pueden controlarse con el uso de nanomateriales “inteligentes”. En este caso los nanomateriales inteligentes serán aquellos que cumplan con algunas de las siguientes funciones: trasladar el fármaco sin ninguna modificación hasta el lugar del organismo donde se requiera, liberar la sustancia química de forma controlada, no generar residuos químicos tóxicos, ser biocompatibles, incrementar la vida útil del fármaco, tener baja velocidad de degradación, eliminarse completamente del organismo una vez liberado todo el fármaco y tener tamaño nanométrico (10-9 m).
En la literatura científica internacional existen trabajos de investigación dedicados al diseño, síntesis y caracterización de materiales con dichas propiedades. Entre los nanomateriales inteligentes más estudiados se encuentran las nanopartículas poliméricas, los polímeros conjugados, los liposomas, las micelas, las dendritas, los nanotubos de carbono y las nanoesferas o nanocajas (poliméricas o metálicas) (Figura 2) (Peer et al., 2007).
Nanomateriales inteligentes
Las nanopartículas poliméricas son materiales comúnmente utilizados como portadores de fármacos. Entre las primeras investigaciones sobre el uso de polímeros para la dosificación de fármacos anticancerígenos destaca la que se realizó en el año 1979, por el grupo de Couvreur y col. (Duncan, 2006), donde utilizaron nanopartículas de polialquilcianoacrilato. Los polímeros multifuncionales siguen desarrollándose, ya sea como polímeros conjugados o como portadores poliméricos (Figura 2). En el año 2006, Duncan y col. (Satchi-Fainaro et al., 2006; Couvreur et al., 1979) realizaron trabajos sobre el uso de polímeros químicamente conjugados con fármacos, para el tratamiento de varios tipos de tumores cancerígenos. Sin embargo, estos materiales presentan una distribución de tamaño de partícula poco homogénea, y algunos tienen grupos funcionales en la superficie de las partículas, como carboxilos o hidroxilos, que pueden ser altamente reactivos y generar modificaciones químicas desfavorables para aplicaciones biológicas (Guo et al., 2007) .
Para controlar el tamaño de partícula se diseñaron nanoesferas poliméricas, las cuales constituyen un grupo de materiales que tienen como característica, además del tamaño nanométrico, una forma que facilita su absorción (Hassan et al., 2007). Esta protección polimérica del fármaco, permite que la liberación esté controlada por la velocidad de degradación del polímero, la cuál puede prolongarse hasta por 24 horas; también permite que el fármaco no se absorba antes de llegar al lugar afectado. El tamaño y la forma del material proporcionan una mejor difusión. Muchos fármacos que se ingieren vía oral utilizan este tipo de polímeros para protegerlos de los ácidos estomacales. Las nanoesferas de PLGA (ácido poli-láctico glicólico), con diámetro de 90 a 150 nm, pueden almacenar hasta 45% en peso de fármaco y logran eficiencias de 95% (Gref et al., 1994). Las nanoesferas también pueden estar constituidas por cascarones metálicos que contienen el fármaco, aunque estos materiales no tienen ventajas sobre otros tipos de portadores debido a que la mayoría no son materiales biodegradabes y no tienen un tamaño suficientemente pequeño para eliminarse (Peer et al., 2007).
Por otra parte, los liposomas son coloides (1000 nm, aproximadamente) de portadores que se forman espontáneamente cuando algunos lípidos son hidratados en medio acuoso (Sharma et al., 1997). Los liposomas están compuestos por materiales biocompatibles y biodegradables, que consisten en un componente acuoso, atrapado en bicapas de lípidos que pueden ser naturales o sintéticos. Los fármacos pueden retenerse en la parte acuosa de los liposomas, o bien en las intercapas que los forman. Hasta el momento se han logrado encapsular vacunas, esteroides, agentes anticoagulantes, fármacos antimicrobianos, material genético, entre otros (Gregoriadis, 1993).
Otro material que ha sido evaluado en la retención y dosificación de fármacos son las micelas que están formadas por moléculas hidrofóbicas ensambladas, capaces de solubilizar sustancias lipofílicas, y se encuentran rodeadas por extremos hidrofílicos estabilizados por una interface (Figura 3). Las propiedades fisicoquímicas de las micelas como: tamaño, carga y funcionalización de la superficie, son controladas en función del método de preparación (Francis et al., 2004).
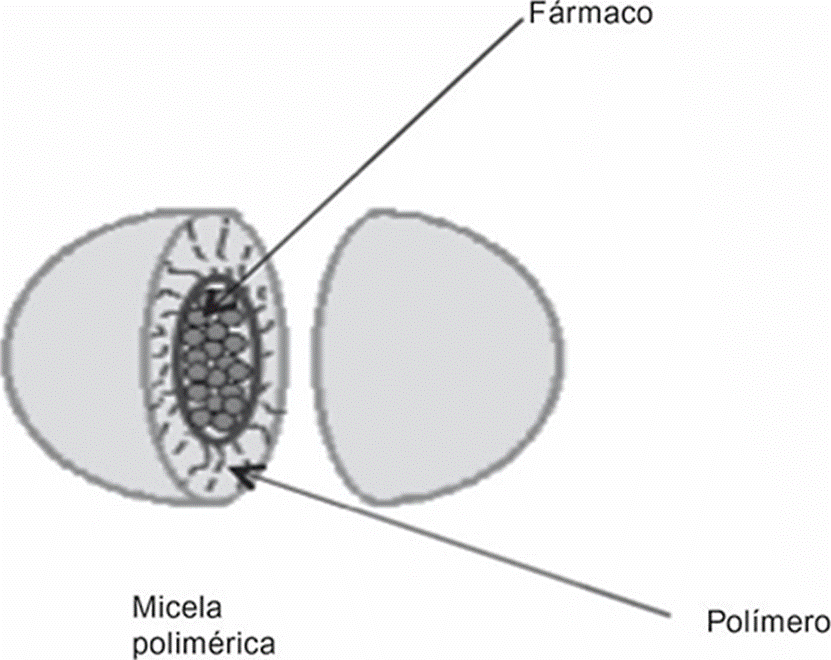
Figura 3 Representación esquemática de de una micela polimérica, donde el polímero tiene características anfifílicas y un fármaco lipofílico.
Los liposomas y las micelas son materiales que portan diferentes tipos de fármacos, pero no resuelven los problemas de dosificación controlada, pues son materiales que pueden circular rápidamente por el torrente sanguíneo cuando se aplican por vía intravenosa, y bajo ciertas condiciones liberan el fármaco antes de llegar al lugar indicado (Peer et al., 2007). La combinación de fosfolípidos y polímeros se ha utilizado para lograr la liberación de dos fármacos, combinando sus propiedades para lograr un material bifuncional, que reduce la toxicidad y evita la metástasis (propagación de un foco canceroso en un órgano distinto de aquel en que se inició); sin embargo, es un material costoso (Sengupta et al., 2005).
Las dendritas, por su parte, son macromoléculas globulares altamente ramificadas, que tienen un núcleo central, y son capaces de enlazar fármacos, grupos funcionales específicos (que puedan dirigir o solubilizar el compuesto químico) y anticuerpos (Figura 4). La complejidad química de las dendritas permite que estos materiales puedan retener mayor cantidad de fármaco y se pueda controlar la cinética de liberación (Gillies et al., 2005). Sin embargo, en comparación con otros materiales que se utilizan como dosificadores de fármacos, las dendritas se sintetizan en varias etapas y son altamente costosas, lo que impide la producción a gran escala (Peer et al., 2007).
Las nanopartículas metálicas, son materiales que pueden ser dispersados y funcionalizados para introducir fármacos. Por ejemplo, las nanopartículas de oro se utilizan en terapias fototérmicas en tratamiento contra el cáncer de mama (Chen et al., 2005). Estas nanopartículas pueden estructurarse en forma de cascarones con diámetros entre 100 y 200 nm, o en forma de cajas con tamaño menor a 50 nm. Aunque es otra opción en el uso de materiales inteligentes, el uso de partículas metálicas tienen varias desventajas debido a que no son biodegradables, no son lo suficientemente pequeñas para liberarse fácilmente y pueden acumularse en diferentes órganos del cuerpo causando toxicidad a largo plazo.
Los nanotubos de carbono están constituidos por átomos de carbono dispuestos en una red hexagonal cilíndrica, de forma que su estructura es la misma que se obtendría si se enrollara sobre sí misma una lámina de grafito. Sus extremos pueden estar abiertos o cerrados por media esfera de fulereno (Figura 5) (Sinha, 2005). La característica principal de estos materiales es que muestran una relación longitud/diámetro muy elevada: su diámetro es del orden de los nanómetros y su longitud puede variar desde una micras hasta varios centímetros (Rivas-Martínez et al., 2007). Los nanotubos de carbono pueden utilizarse en el encapsulamiento de medicamentos debido a que no modifican las características fisicoquímicas del fármaco y son resistentes a la degradación durante el tránsito por el interior del cuerpo. El carbono que los forma es una sustancia biocompatible, que puede descomponerse y excretarse después de liberar el fármaco. Además, hay estudios que demuestran que el reducido tamaño de los nanotubos los capacita para penetrar en el interior de las células, requisito necesario para esta aplicación. Sin embargo, la dosificación utilizando nanotubos de carbono, no puede ser controlada debido a que no existe una conexión química con el fármaco (Klingeler et al., 2011; Rivas-Martínez et al., 2007; Sinha, 2005).
Nuevas opciones en la dosificación controlada de fármacos
Recientemente se han desarrollado nuevos materiales híbridos cuyas características fisicoquímicas pueden ser aprovechadas en la dosificación controlada de fármacos. Estos materiales son llamados MOF (Metal Organic Framework) y están constituidos por un centro metálico que puede ser Co, Fe, Al, Cr, V, Ga, Cu, Ni, Sc, entre otros; y un ligando orgánico aniónico que conecta los centros metálicos, que comúnmente son carboxilatos, imidazoles o fosfonatos (Horcajada et al., 2010 y 2006; Taylor-Pashow et al., 2009). La Figura 6 muestra el esquema de una MOF, donde los octaedros representan los centros metálicos de hierro, los cuales están unidos por carboxilatos orgánicos con diferente estructura. Cada uno de los ligandos genera un material con tamaño de poro que puede ir desde 0.6 hasta 2.4 nm. Se elige como centro metálico al hierro, debido a que para encapsular un fármaco es necesario que el metal sea inocuo al organismo para que no se acumule, y este metal tiene una naturaleza no tóxica y es biocompatible. La elección del ligando orgánico está en función del tamaño del fármaco. La combinación del metal con el ligando permite la formación de nanopartículas homogéneas que pueden ser fácilmente suministradas al organismo (Horcajada et al., 2006).
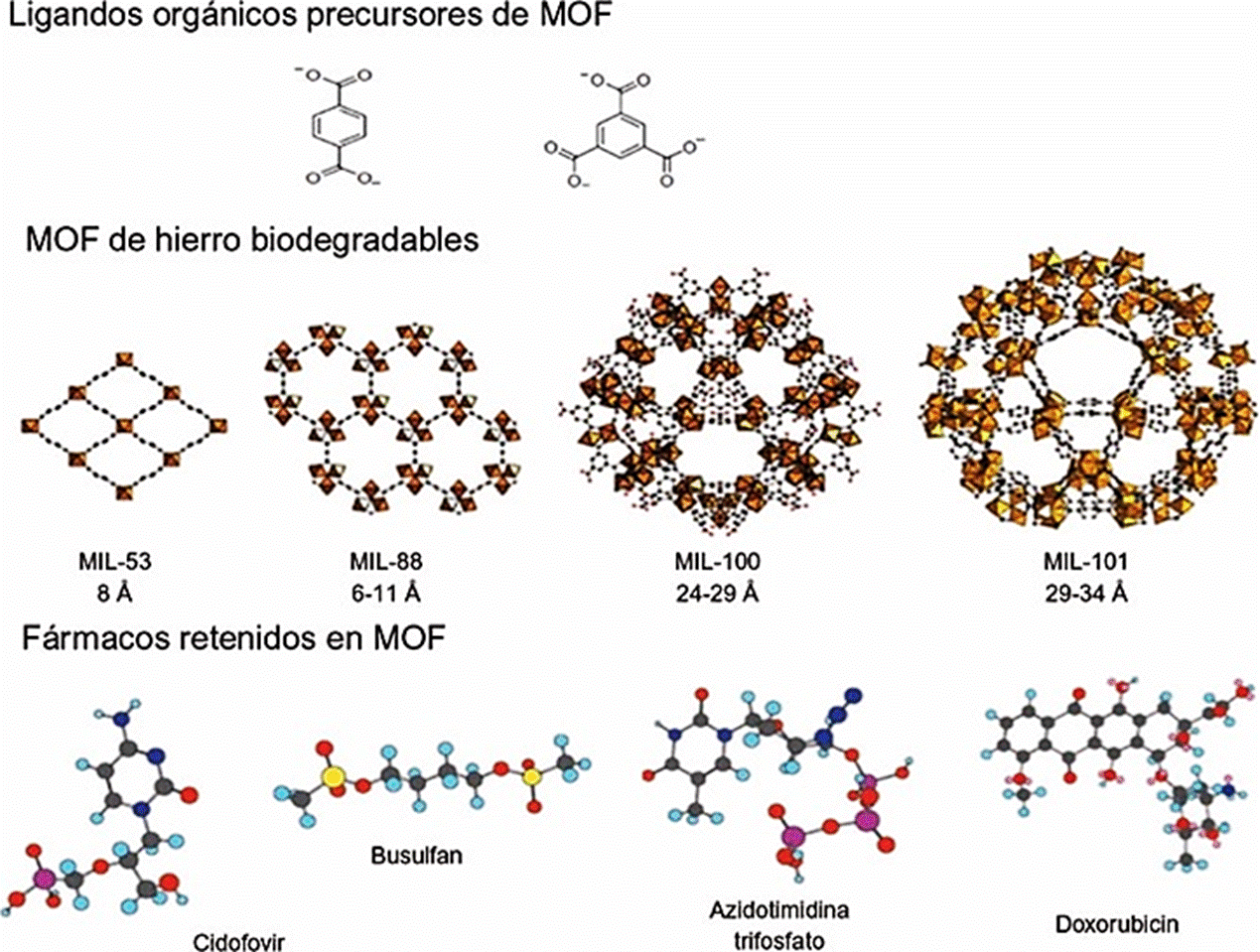
Figura 6 Redes metal orgánicas de hierro utilizadas en la dosificación de fármacos. En la parte superior se representan los carboxilatos utilizados para la síntesis de las MIL (Metal organic framework sintetizadas en el Institut Lavoisier); enseguida se muestran las estructuras de las MOF, donde los octaedros representan los centros metálicos de hierro; finalmente, se presentan las estructuras de algunos fármacos que pueden retenerse en los poros de cada MOF.
La síntesis de las MOF es sencilla en comparación con otros materiales que se utilizan como dosificadores. Comúnmente se requieren condiciones solvotérmicas con solventes que puede ser agua y etanol, y temperaturas inferiores a 100º C. También puede utilizarse la síntesis asistida por ultrasonido o microondas, las cuales disminuyen el tiempo de síntesis y aumentan la homogeneización del tamaño de las partículas. En el ámbito biomédico estos materiales funcionan como esponjas que atrapan a las moléculas de fármaco con diferentes características (polaridad, tamaño o grupo funcional), con una simple inmersión del sólido en la solución adecuada del fármaco (Horcajada et al., 2010).
Conclusiones
Desde 1960, cuando se sintetizaron por primera vez los polímeros para dosificar fármacos, han surgido numerosos trabajos con aportaciones importantes en el desarrollo de nuevos materiales para controlar los efectos nocivos de los fármacos. En la actualidad, más del 90% de los trabajos está enfocado en nanomateriales, por ser éstos los que presentan mayor control en la liberación y mejor distribución cuando son introducidos por alguna vía al organismo. Sin embargo, no existe todavía un material que cumpla con todas las especificaciones que se requieren para transporte y dosificación adecuada de fármacos. Por lo cual, la línea de investigación de nanomateriales capaces de controlar la liberación, de llegar al lugar afectado, de degradarse una vez liberado todo el fármaco y de no tener que metabolizarse por órganos como el hígado (que terminan muy afectados), sigue dando paso al desarrollo de nuevos materiales. En este sentido las MOF se presentan como otra opción en el control de fármacos, debido a que constituyen un grupo de materiales cuyas propiedades pueden ser modificadas. El diseño de las MOF depende del centro metálico y el ligando orgánico, los cualés aportan características fisicoquímicas acordes al fármaco que se desee encapsular. La síntesis sencilla, el bajo costo, la facilidad con la que se modulan sus propiedades y la posibilidad de funcionalizarlos (para encapsular anticuerpos u otras moléculas que puedan atacar diferentes problemas) son ventajas que podrían superar a los materiales existentes.











 nova página do texto(beta)
nova página do texto(beta)





