Nanotecnología y nano-objetos
La nanotecnología es definida por la National Nanotechnology Initiative (NNI) [1] como “El desarrollo de investigación y tecnología a nivel atómico, molecular o macromolecular en la escala de tamaño de aproximadamente 1- 100 nanómetros (nm) (donde 1 nm es 10-9 metros) para la creación y uso de estructuras, aparatos y sistemas con nuevas propiedades y funciones debidas a su tamaño, así como la capacidad de controlar o manipular material a escala atómica”, en tanto que la Royal Society & Royal Academy of Engineering. Nanosciencie and Nanotechnologies, en su documento Opportunities and Uncertainties, indica más brevemente que la nanotecnología es “la capacidad de manipular efectos físicos, típicamente fenómenos cuánticos, que ocurren en nano-objetos”.1 Los nanobjetos, por otro lado, han sido recientemente definidos como toda estructura que presente una, dos o tres dimensiones en la escala de tamaños entre 1 y 100 nm.2
Nano-Objetos + Medicina = Nanomedicina
Como se ilustra en la Figura 1 no existe límite en la naturaleza del material de partida empleado en la preparación de nano-objetos. Sin embargo, es importante señalar que una vez en contacto con tejidos biológicos, las nuevas propiedades de los nanoobjetos no necesariamente se acotarán a la manifestación de fenómenos cuánticos. De hecho, en presencia de células, la relevancia de sus nuevas propiedades no se manifestará como fenómenos cuánticos, sino mediante su reconocimiento y captura por mecanismos de fagocitosis y pinocitosis celulares. Asimismo, los nano-objetos exhibirán capacidad para cruzar barreras anatómicas y fenomenológicas, como el tracto gastrointestinal, las mucosas en general, la piel y la barrera hematoencefálica. En otras palabras, una vez en contacto con seres vivos, tejidos ex vivo o cultivos celulares, los nano-objetos pueden funcionar como herramientas capaces de ejecutar acciones programadas en forma controlada. Por ello, en su definición más breve, la nanomedicina sería la aplicación de nano-objetos a la medicina. Las siguientes plataformas tecnológicas conforman la nanomedicina: en primer lugar (por tamaño de mercado, número de publicaciones y patentes a nivel mundial), la de diseño y aplicación de nanosistemas de entrega de drogas (nanosed)), siendo la nanotecnología farmacéutica el conjunto de tecnologías que permite fabricar nano-objetos capaces de ejecutar alguna de las acciones propias del área de la tecnología farmacéutica. Las restantes plataformas son aquellas relativas al diseño de nanosistemas de imágenes, de nuevos materiales, aparatos y sistemas, y de aspectos vinculados con la clínica, la nanotoxicología (es decir, el estudio de los efectos tóxicos causados por nano-objetos (Figura 2)) y regulación de prácticas de manufactura y aplicación.
La definición física de la nanotecnología limita el tamaño de los nano-objetos a la cota superior de los 100 nm. Sin embargo, en un contexto biológico, las nuevas propiedades arriba mencionadas pueden mantenerse hasta por lo menos los 200-300 nm. La definición de nano-objeto, por otro lado, excluye las moléculas convencionales, cuya estructura no está manipulada en la nanoescala para conseguir nuevas propiedades dependientes de su dimensión.
¿Nano-objetos y farmacia?
Definidos de esta forma, los nano-objetos parecerían ser sofisticados productos de la físicoquímica, alejados de toda pertinencia farmacéutica. Pero la conexión entre nano-objetos, farmacia y el concepto de medicamento, emerge al vislumbrar que las nuevas propiedades de los nano-objetos (capacidad de ingreso a células por mecanismos fago/pinocíticos y de cruce de barreras) (Figura 3), podrían aprovecharse para transportar y entregar drogas que hubieran sido incorporadas a su estructura. De hecho, varios tipos de nanomedicinas ya existen como productos aprobados por autoridades regulatorias y han ingresado al mercado farmacéutico mundial (Figura 4).
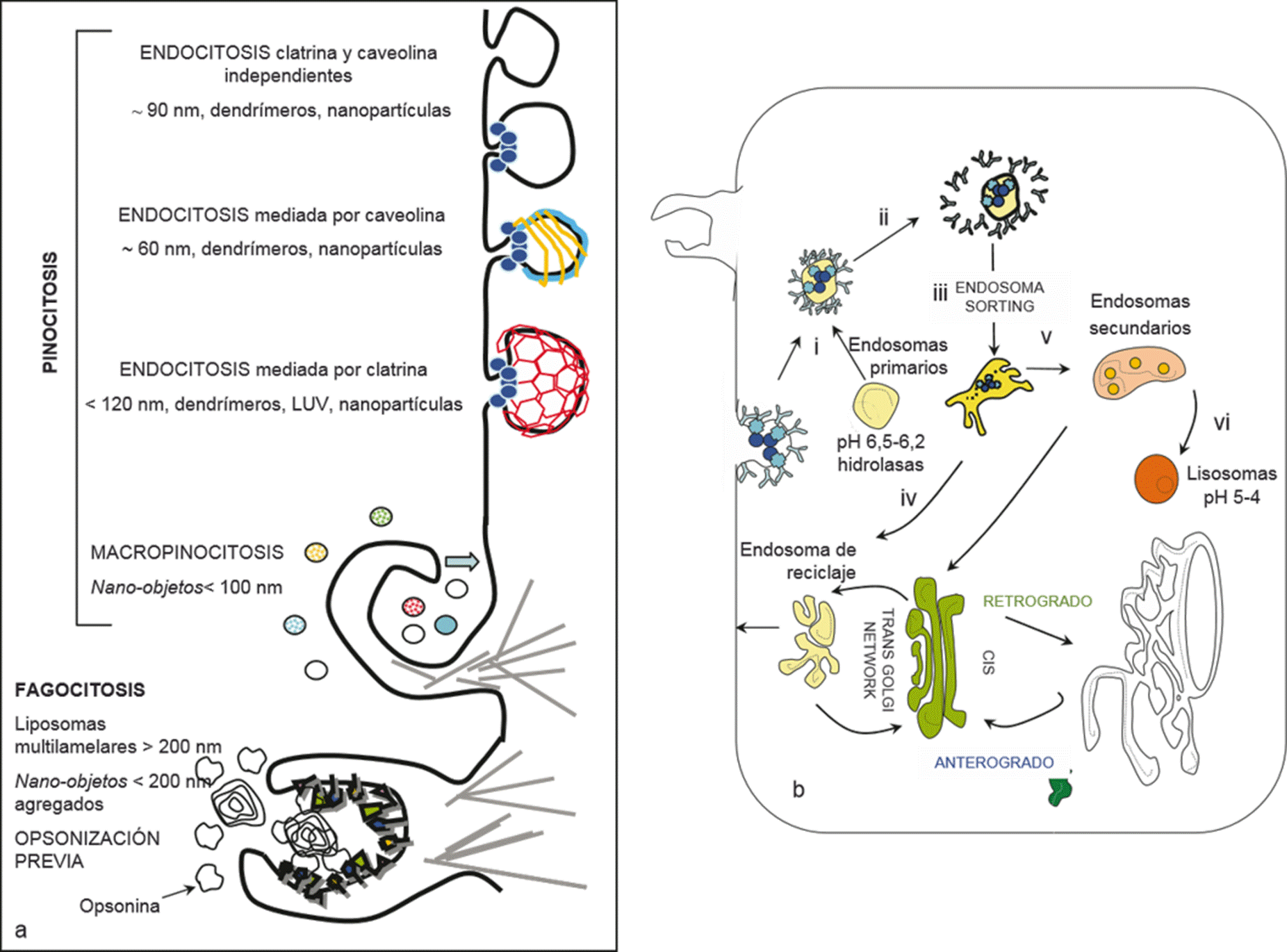
Figura 3 a) Modalidades de captura celular de nano-objetos. b) rutas intracelulares seguidas luego de la captura pinocítica de nano-objetos/nano-sed.

a) Ruta endovenosa (i.v): Los nano-objetos/nano-sed se inyectan directamente en circulación sanguínea sistémica (nanoobjetos rígidos o sólidos deben tener diámetro menor de 3 x 104 nm para evitar bloqueo del lecho capilar pulmonar).
b) Ruta subcutánea (s.c), intramuscular (i.m) e intraperitoneal (i.p): los nano-objetos/nano-sed se inyectan en el espacio intersticial/extracelular. El sistema linfático elimina los excesos de fluidos y de material particulado del espacio intersticial. Únicamente pequeñas moléculas (< 16 kilo daltons, KDa) ingresan al compartimiento vascular a través de los poros de la pared de los capilares sanguíneos, en tanto que moléculas más pesadas únicamente son transportadas por el sistema linfático. Los nano-objetos pequeños (< 100 nm) ingresan a los capilares linfáticos y únicamente la pequeña proporción que no es capturada por los macrófagos de los nódulos linfáticos, drena a la circulación sistémica. Los nano-objetos de mayor tamaño permanecen en el espacio extracelular y aquellos hechos de matrices biodegradables actúan como reservorios de liberación sostenida de la droga transportada; cuando su tamaño desciende por debajo de los 7-8 x 103 nm por biodegradación, pueden ser capturados por fagocitosis.
c) Ruta oral : Los nano-objetos/nano-sed administrados por esta ruta están diseñados para proteger a la droga transportada de la acción de la acidez, lipasas, proteasas y sales biliares. Una vez en el intestino delgado, los nano-objetos idealmente deberían adherirse a la capa de mucus (mucoadhesión). Los nano-objetos/nano-sed mucoadhesivos pueden actuar como reservorios para la liberación de drogas, que a su vez ingresarían a los enterocitos. Usualmente los nano-objetos no son capturados por enterocitos, pero sí por las células M de las placas de Peyer; en este ultimo caso, los nano-objetos son transcitados y entregados a la circulación linfática.
d) Ruta tópica: excluyendo los liposomas ultradeformables y nano-objetos de diámetro menor a 5 nm, ningún otro nano-objeto, independientemente de su tamaño o forma, puede atravesar la seca superficie del estrato corneo (stratum corneum, sc). Esta barrera decrece considerablemente al perderse las capas celulares del sc.
e) La inflamación local está relacionada con incremento de permeabilidad de la vasculatura. En este caso, los nano-objetos en circulación sanguínea pueden extravasar para llegar a las células de la zona inflamada.
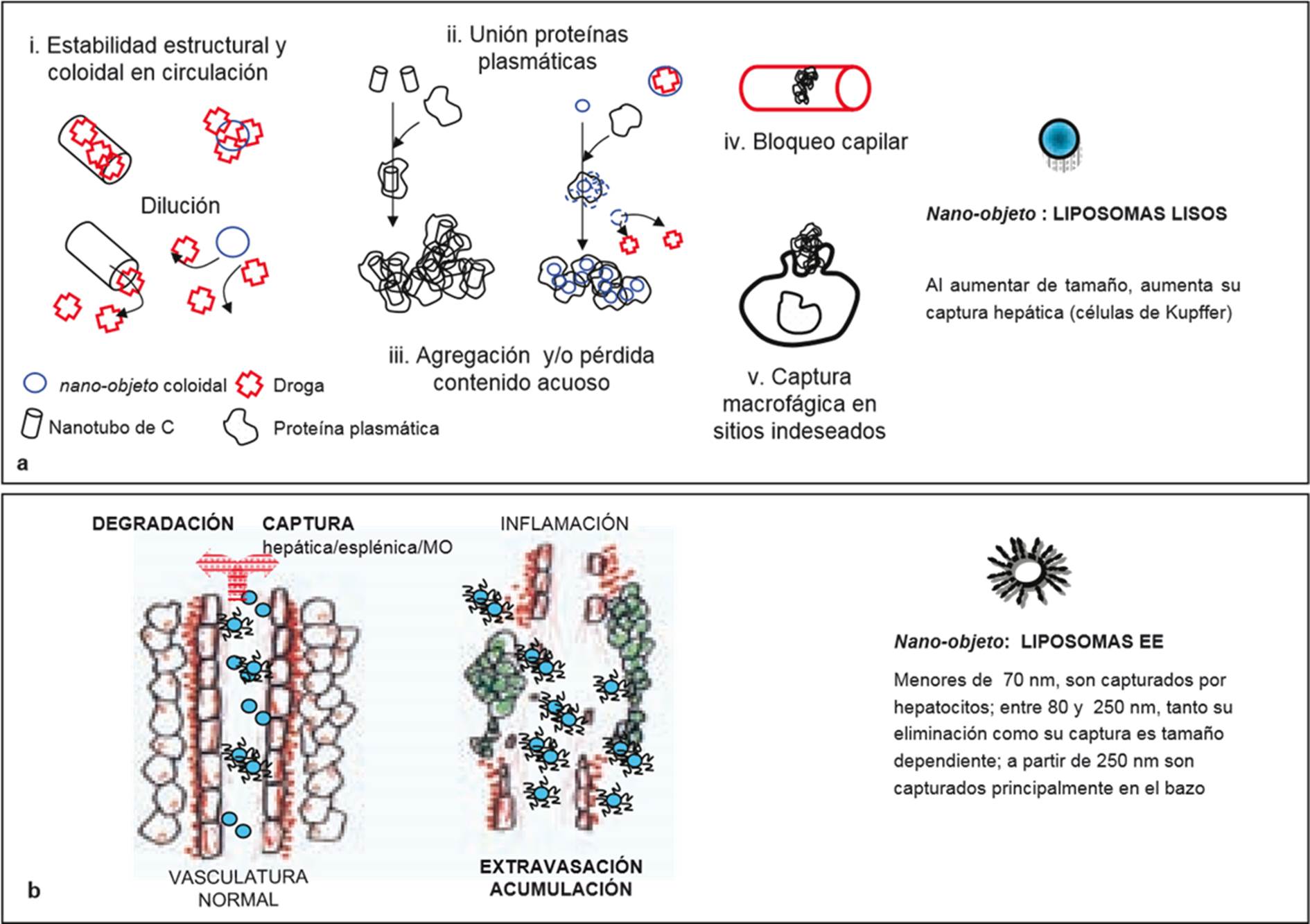
f) Nano-objetos en circulación sanguínea: el endotelio continuo contiene poros que permiten la extravasación de pequeñas moléculas (2-3 nm diámetro); el endotelio fenestrado de los riñones permite la eliminación urinaria de pequeños (< 5 nm) partículas deformables, dependiendo de su balance hidrofílico/hidrofobito y carga eléctrica. La mayor parte de los nanoobjetos poseen diámetros mayores a 5 nm y permanecen confinadas en circulación sanguínea, no pudiendo extravasar a tejidos periféricos. Mientras circulan en sangre, los nano-objetos son recubiertos por proteínas plasmáticas como la lipoproteina hdl, que se adsorbe a la superficie de liposomas causando la desestabilización de su bicapa y eventual pérdida de drogas hidrosolubles transportadas en su interior. La absorción de proteínas conocidas como opsoninas en la superficie de un nano-objeto promueve el reconocimiento y posterior eliminación de circulación sanguínea por parte de las células accesibles del sistema retículo endotelial. El grado de opsonización varía de acuerdo con la naturaleza de la superficie del nano-objeto, y con su tamaño. Los nano-objetos opsonizados son eliminados en órganos con vasculatura de endotelio fenestrado, fundamentalmente por parte de las células de Kupffer en la luz de los sinusoides hepáticos, seguido por los macrófagos de bazo y en menor extensión, dependiendo de su tamaño, por macrófagos pulmonares y de médula ósea. Los nano-objetos diseñados para evitar la opsonización son eliminados mas lentamente de circulación. En esta situación, los nano-objetos tienen mayores chances de extravasar a tejidos periféricos en sitios donde existe incremento de permeabilidad vascular -con destrucción local de membrana basal del endotelio continuo- causada por inflamación. (Modificado de Drug delivery sistems against leishmaniasis? Still an open question. Eder L. Romero and María José Morilla. Expert Opinion on Drug Delivery. 5 (7): 805-823, 2008).
Figura 4 Rutas de administración de nano-objetos/nano-sed y barreras anatómicas
En realidad, la estrategia de incorporar drogas a estructuras que funcionan como vehículos, con objeto de incrementar la selectividad de su entrega a sitios blanco, no es nueva. La idea data de 1977, cuando el grupo de Ward [2] incorporó antimoniales pentavalentes en liposomas (vesículas formadas por bicapas lipídicas que encierran un espacio acuoso interno, conformadas por lípidos anfipáticos, usualmente esteres de glicerol con ácidos grasos y ácido fosfórico, de simetría generalmente cilíndrica cuya cabeza polar se orienta hacia el medio acuoso y las colas lipídicas hacia el interior hidrofóbico de la bicapa (Figura 5a, a1, a2, b) -notar diferencia con micelas, que son asociaciones de moléculas también anfipáticas pero de simetría cónica, que se hallan en equilibrio termodinámico con su entorno y que en medios acuosos orientan sus cabezas polares hacia el exterior acuoso y sus colas hacia el core hidrofóbico que no contiene agua (Figura 5c,d)) para tratar leishmaniasis visceral-. Se halló que una vez incorporados en liposomas, farmacocinética y biodistribución de los antimoniales cambiaba rotundamente respecto de la droga libre. Esta observación incentivó a muchos otros grupos de investigación, principalmente europeos, a abordar la preparación de liposomas de distinta estructura y tamaño, generalmente conteniendo drogas de bajo peso molecular poco hidrosolubles o muy tóxicas, con el objeto de modificar su farmacocinética y farmacodinamia y así conseguir mejorar los efectos terapéuticos de dichas drogas. Es sabido que para ejercer su acción en forma óptima, las drogas deben llegar en tiempo y forma al sitio blanco; la ausencia de selectividad y las concentraciones por debajo de las terapéuticas disminuyen su efectividad. Teóricamente, la entrega correcta de drogas debería superar los impedimentos interpuestos por barreras epiteliales, flujo turbulento, enzimas, pH, membranas celulares o de organoides. De acuerdo con la química medicinal, la factibilidad del cruce de estas barreras, dependería estrictamente de la estructura química de la droga. Pero ahora, la ambiciosa intención de la incorporación de drogas en liposomas era posibilitar el transporte de las mismas a través de barreras y conseguir su entrega selectiva, sin introducir modificaciones en su estructura. Los espectaculares cambios en performance terapéutica de los antimoniales liposomales respecto de los antimoniales libres permitieron el surgimiento de un nuevo paradigma: el que una vez incorporada a liposomas, farmacocinética y biodistribución de una droga deja de depender de su propia estructura, para depender del tamaño, carga neta, composición lipídica y estructura superficial del liposoma.
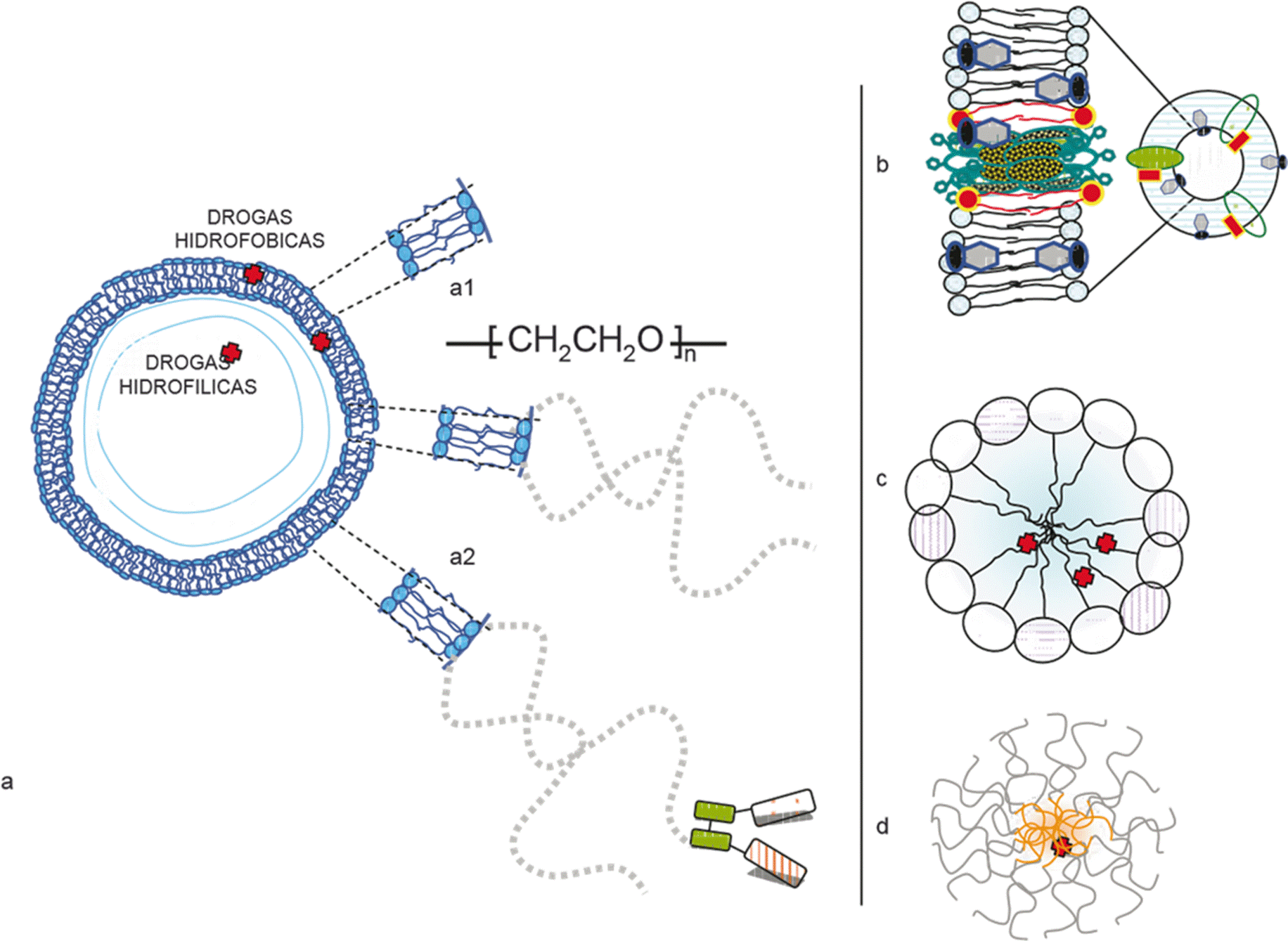
a) Nano-objeto tipo liposoma unilamelar, detalle de bicapa lipídica formada por fosfolipidos (moléculas anfipaticas). a1) Detalle de bicapa lipídica con protección estérica (5 % mol: mol polietilenglicol 2000, proporciona una cobertura de 50 Å; dibujo no a escala): direccionalización o targeting pasivo. a2) Detalle de bicapa lipídica con protección estérica unida a la fracción Fab de anticuerpo monoclonal: targeting activo.
b) Estructura de Ambisome ®. Liposoma del tipo SUV (small unilamellar vesicle), que contiene HSPC (fosfatidilcolina de soja hidrogenada), fosfatidilglicerol, colesterol. Octámero de Anfotericina B transmembrana.
c) Micela convencional (formada por lisofosfolípidos, o surfactantes iónicos o no iónicos).
d) Micela polimérica (formada por asociación de copolímeros en bloque, como poloxámeros).
Figura 5 Nano-objetos tridimensionales más comunes usados como nano-sed
Es importante reconocer que los estudios preclínicos y clínicos de diferentes tipos de liposomas a los que se incorporaron drogas con fines terapéuticos al cabo de más de 20 años ha generado una sólida base de conocimientos que en la actualidad nos permite predecir, con cierta seguridad, la relación entre estructura y tamaño liposomal con la vía de administración, farmacocinética, biodistribución y hasta el tránsito intracelular de la droga entregada.
Los liposomas también Son nano-objetos y por ende, los nano-sed más antiguos
Diez años atrás, los liposomas eran clasificados como suspensiones coloidales, haciendo referencia a partículas en suspensión con tamaños entre 1 y 1000 nm, al igual que las suspensiones de micelas y de proteínas, aerosoles y geles. Sin embargo, durante el mismo periodo, el número creciente de investigaciones emergentes de la gigantesca arena nanotecnológica llevó a muchos investigadores a deslindar relación entre liposomas y los hipervariados, multiestructurales “sistemas nanoparticulados” (nanopartículas poliméricas, metálicas, lipídicas o de óxidos metálicos, nanotubos y nanofibras, dendrímeros, nanocristales) que, en definitiva, no son otra cosa que nanoobjetos. Desde principios del año 2000 hasta la fecha han surgido más de 5 mil artículos de investigación -a tasa exponencial- que emplean sistemas nanoparticulados para controlar la entrega de drogas. En muchos de ellos, lamentablemente, se ignoraron valiosos conceptos elementales obtenidos a lo largo de dos décadas de estudios sobre liposomas. Vale la pena mencionar que su administración endovenosa permitió revelar fenómenos universales, a repetirse toda vez que cualquier estructura particulada entra en contacto con proteínas y células de la sangre. Por ejemplo, las bases biofísicas de la opsonización, y la relación entre radio de la estructura, potencial Z, módulo de elasticidad, tensión superficial/ protección estérica y patrón y monto de adsorción de proteínas plasmáticas, con la farmacocinética y biodistribución del liposoma, pueden extenderse a cualquier tipo de nanopartícula. La posibilidad de direccionamiento (targeting) pasivo, que permite la acumulación de liposomas protegidos estéricamente en las vecindades de sitios con aumento de permeabilidad vascular y disminución de drenaje linfático, también es factible para cualquier sistema nanoparticulado. Las incógnitas /dificultades estratégicas del targeting activo y del control del tráfico intracelular, por otro lado, permanecen vigentes no sólo para los liposomas, sino también -y era de esperarse- para cualquier sistema nanoparticulado.
Vemos entonces que por su tamaño, generalmente menor de 150 nm, porque su estructura puede ser manipulada en la nanoescala y por permitir controlar farmacocinética y biodistribución de drogas, los liposomas deberían ser considerados como los más estudiados del tsunami de nano-objetos aplicado a la entrega de drogas. Y, efectivamente, los liposomas han sido recientemente clasificados como nano-objetos de tipo nanoparticulado (con tres dimensiones en la nanoescala), junto con dendrímeros y quantum dots. Los nanotubos y nanofibras serían nano-objetos de tipo bastón, con dos dimensiones en la nanoescala. Lo único que separa a los liposomas de los nano-objetos recientemente descritos es su fructífero pasado y presente, algo conocido por parte de la tecnología farmacéutica convencional, pero desconocido para la mayoría de los científicos sumados a la ruta transversal de la nanotecnología y que abordan el empleo de nanopartículas como sistemas de entrega de drogas.
Nano-sed administrados por vía endovenosa:
La mayoría de los nano-objetos actualmente en el mercado se administran por vía endovenosa, las proteínas del plasma se asocian a la superficie de los nano-sed, lo que causa su destrucción, agregación y/o eliminación de la circulación. Esto reduce el tiempo de permanencia de los nanosed en circulación y en consecuencia sus efectos terapéuticos (Figura 6a). Cuando los nano-sed son liposomas, nanopartículas poliméricas o nanotubos de carbono, la asociación con las proteínas plasmáticas puede evitarse recubriéndolos con una sustancia llamada polietilen glicol. Esta protección se conoce como estabilización estérica (EE), y permite que un nano-sed de hasta 200 nm de tamaño permanezca en circulación por largo tiempo, independientemente de su concentración, estructura y de la carga eléctrica de su superficie. La prolongación del tiempo de circulación aumenta las oportunidades de que los nano-sed abandonen la circulación en sitios donde la permeabilidad de los vasos sanguíneos está alterada y es mayor que la normal. En estas condiciones dan con sitios que unen alta permeabilidad vascular a un escaso drenaje linfático y a una elevada presión intersticial, como sucede en los tumores sólidos o en zonas inflamadas. La acumulación según este mecanismo se conoce como direccionamiento (targeting) pasivo (Figura 6 b).
Ejemplos de nano-sed con capaces de atravesar barreras anatómicas: dendrímeros y liposomas ultradeformables
Los dendrímeros (D) son nano-objetos poliméricos de entre 2 y 10 nm de tamaño, con ramificaciones en número y posición estrictamente controladas. Ni los más pequeños ni los mayores son aptos para incorporar drogas en su interior y actuar como nano-sed. En cambio, los de tamaño intermedio tienen una estructura semirrígida, que los hace capaces de retener drogas (Figura 7a) y les confiere extremo interés farmacéutico. Los D pueden atravesar las paredes que tapizan los vasos sanguíneos cuando éstas están intactas. También acceden libremente al citoplasma. Para esto, los que tienen carga positiva se adsorben sobre la membrana celular formando hoyos transitorios a través de los cuales penetran al citoplasma mientras que los otros son captados por pinocitosis y luego de ingresar a las células llegan al citoplasma porque provocan la ruptura de la membrana que los envuelve.
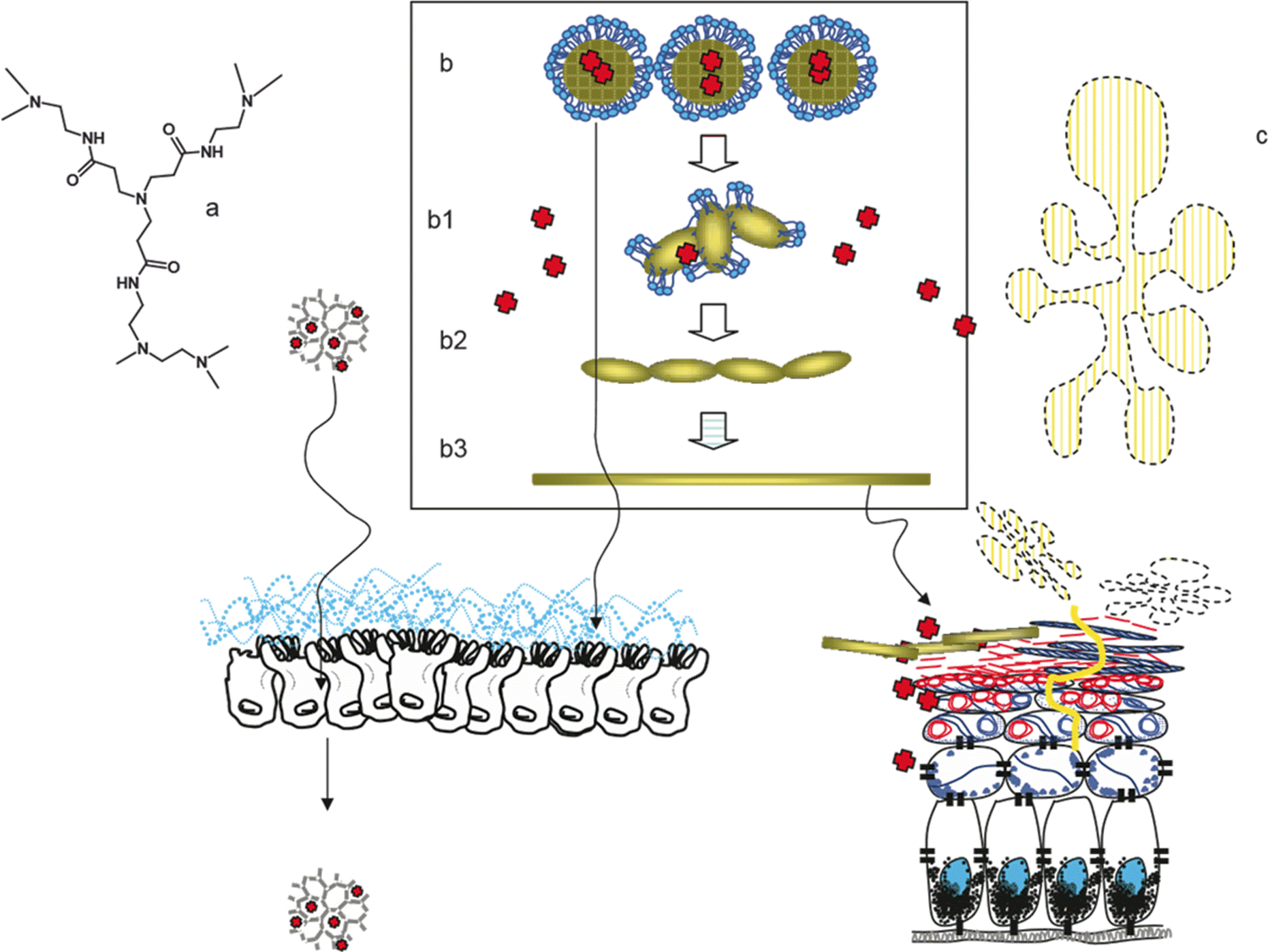
a) Dendrímeros: nano-objetos poliméricos de distribución de tamaño monodispersa con elevada relación área/volumen y diámetro entre 2-8 nm. Los dendrímeros de poliamidoamina (PAMAM) de generaciones (G) 2.5 a G 3.5 pueden incrementar el pasaje para celular a través de la mucosa gastrointestinal, al secuestrar el Ca+2 de modo de inducir la apertura de las uniones estrechas. El mecanismo de complejación sería equivalente al ocurrido con nano-partículas del polímero quitosán. Los dendrimeros PAMAM son hidrosolubles y actúan como micelas unimoleculares para formar complejos con drogas hidrofóbicas incorporadas a sus bolsillos hidrofóbicos internos. Su elevada estabilidad estructural permite su administración por la vía oral. A diferencia de otros tipos de partículas poliméricas, los dendrímeros no presentan problemas de escalado, presencia de productos de contaminación y heterogeneidad de tamaño.
b) Nanopartículas lipídicas sólidas y nanopartículas lipídicas nano estructuradas (LSN y NLN): nano-objetos de core hidrofóbico de cristalinidad variable, estabilizado por una superficie anfipática. Las drogas son retenidas en el interior del core cristalino. c1) frente a un estímulo como luz, deshidratación, calor, el core transiciona espontáneamente a una mayor cristalinidad, liberando la droga; el surfactante se pierde. c2) y c3) las nanopartículas forman un gel oclusivo, que impide la pérdida de humedad una vez aplicado sobre la piel. LSN y NLN pueden administrarse por vía tópica y oral.
c) Liposomas ultradeformables (LUD): nano-objetos vesiculares capaces de experimentar locomoción espontánea y penetración a través de capas profundas por el interior de nano canales acuosos del estrato córneo (sc). LUD no se fusionan ni coalescen sobre la superficie del sc y penetran sin ser destruidos. UDL pueden transportar eficientemente drogas hidrofílicas de bajo o alto peso molecular a través de lesiones superficiales engrosadas, que representan una barrera adicional a la absorción por vía tópica.
Figura 7
Por otro lado, el estrato córneo formado por restos de células que cubre la superficie de la piel es la principal barrera para el acceso a las capas más profundas de la epidermis. Ésta es la causa del fracaso de muchos tratamientos basados en el depósito del medicamento. En algunos casos sucede lo opuesto y las sustancias atraviesan la piel e ingresan en la circulación sistémica. Cuando esto sucede, la aplicación tópica de sustancias puede producir efectos colaterales dañinos. Los liposomas ultradeformables -liposomas UD- (Figura 7 c), impulsados por gradientes de humedad, son capaces de atravesar canales en la membrana cuyo diámetro es varias veces menor al que tendrían estos nanosed si no pudiesen cambiar fácilmente de forma. Este tipo de nanosed permite superar la barrera que interpone un estrato córneo intacto.
La principal plataforma nanomédica es la de los nano-sed
El principal campo de conocimiento de la nanomedicina es el de diseño de nano-sed, abarcando el 76 % de artículos publicados en el mundo académico, seguido por el 11 % para diagnóstico in vitro, 6 % para biomateriales y 4 % para sistemas de imágenes. Cerca de un 60 % de las patentes mundiales en nanomedicina también corres ponden al campo del drug delivery (http://scientific.thomson.com/products/sci). La industria farmacéutica muestra especial interés en las nanosuspensiones, que permiten incrementar la solubilidad de pequeñas moléculas terapéuticas (alrededor del 40 % de las moléculas en el pipeline pertenecen a esta clase), permitiendo su administración por vía oral para producir elevada biodisponibilidad. Existen ya cinco productos en el mercado, producidos por Elan Drug Delivery (una compañía con sede en Dublín, Irlanda), en alianza con Merck & Co, ParPharmaceutical Companies, Wyeth Pharmaceuticals, Abbot, y SkyePharma. [3,4].
Los países desarrollados se están organizando para abordar los desafíos metodológicos y conceptuales relativos al diseño de nano-sed
Tratamientos más veloces, más eficaces y menos tóxicos, son las ventajas derivadas de la aplicación de la nanomedicina a los nichos terapéuticos que causan mayor carga social y sufrimiento del paciente. Esto se traduce en ganancias económicas proyectadas a nivel global, en el orden de los billones de euros para la próxima década, únicamente en referencia a nanosed. La European Comission ha emitido una serie de documentos, resumidos en el denominado “Bases para una agenda estratégica de investigación” (SRA) en nanomedicina”, lanzada a fines de 2006. En esta propuesta, han participado tanto empresarios como investigadores de todos los países de la Comunidad Económica Europea. Los documentos fueron dos; el primero fue un vision paper - “Bases para una agenda estratégica de investigación en nanomedicina”, emitido en septiembre de 2005 y abarcando hasta el año 2020. Poco más tarde, en noviembre de 2006, se amplió la participación a unas 150 organizaciones miembro de toda Europa y se emitió la “Agenda estratégica de investigación en nanomedicina de la Plataforma Tecnológica Europea” (5). Existe, además, un tercer documento, el Forward Look report emitido por la European Science Foundation (ESF, www.esf.Org)3 - en conjunto con el European Medical Research Council (EMRC). En Estados Unidos, bajo la coordinación de varias agencias gubernamentales -entre ellas la Nacional Science Foundation (NSF)- bajo el Nanoscale Science, Engineering and Technology (NSET) (un subcomité del National Science and Technology Council (NSTC)), se creó, en 2001, la National Nanotechnology Initiative (NNI). La NNI organiza desde las agencias que la conforman, una estrategia de financiamiento en cinco modalidades: 1) inversión en investigación fundamental en ciencia e ingenierías; 2) financiación de investigaciones puntuales, bajo la denominación de “grandes retos” en: materiales nanoestructurados, manufactura en la nanoescala, instrumentos en la nanoescala y metrología, detección y protección de material químico-biológico-radiológico-explosivo; nanoelectrónicos, nanofotónicos, nanomagnéticos, aplicaciones médicas, robóticas y mejoramiento medioambiental; 3) apoyo para el desarrollo de centros de investigación (ubicados en laboratorios nacionales); 4) fondos para emplazamiento de infraestructura estratégica de I+D en nanotecnología y, 5) investigaciones de aspectos sociales y programas de educación [6].
Estados Unidos plantea un ambicioso esquema de investigación, fuertemente sostenido por empresas, basado en una fase inicial de investigación básica, y no definen profundización alguna sobre nano-sed. Claramente, Estados Unidos y Europa enfocan el desarrollo en nanomedicina en forma completamente diferente. Europa no se centra en la creación de nuevos centros de investigación de excelencia, sino que identifica una serie de problemas clave de la salud basándose en parámetros como tasa de mortalidad, nivel de sufrimiento que la enfermedad impone al paciente, prevalencia e impacto que la nanomedicina puede tener en el diagnóstico temprano para evitar la enfermedad. De acuerdo con la SRA, la investigación nanomédica debe iniciarse y estimularse en aquellas áreas de la salud donde el beneficio para el paciente es máximo, y enfocarse en enfermedades de máximo impacto socio económico. Siguiendo los lineamientos del reporte de WHO sobre “Priority medicines for Europe and the World” de noviembre de 2004, las enfermedades identificadas como prioritarias y que producen la mayor carga social son las cardiovasculares (principal causa de muerte en Europa, siendo infarto de miocardio y stroke la mitad de las muertes en Europa); cáncer (segunda causa de muerte en el mundo occidental). Debido al envejecimiento progresivo de la población, y a mejoras en las terapias cardiovasculares, se visualiza al cáncer como la principal causa de muerte en las décadas futuras. Se incluyen las enfermedades músculo esqueléticas e inflamatorias como la artritis reumatoide, porque tienen un efecto devastador en la calidad de vida y requieren constante medicación. Enfermedades como las neurodegenerativas (Alzheimer o Parkinson) también están relacionadas con la edad, y reducen la calidad de vida además de conllevar una enorme carga social. La diabetes es otro ejemplo de enfermedad que requiere constante medicación y monitoreo y cuya incidencia se espera que aumente. En último lugar se identifican las infecciones globales tanto virales como bacterianas que no tienen tratamiento adecuado. También son considerados de relevancia la emergencia de resistencia en infecciosas y de enfermedades como HIV/AIDS y SARS.
Con base en potencialidades conocidas y expectativas de grado de avance, y en términos de aceptación por autoridades de salud y entrada en pruebas clínicas, la SRA ha seleccionado tecnologías clave cuyo desarrollo debería estimularse. Así, se comenzó por identificar nanobjetos de tipo estratégico: micelas, liposomas, dendrímeros, cristales líquidos, nanopartículas (nanoesferas-nanocápsulas amorfas o cristalinas), hidrogeles, polímeros para impresión molecular, conjugados poliméricos, implantes formados in situ, para rutas de administración peroral fundamentalmente, y en posterior término parenteral, transdermal, trans tejido/local implante. Los nano-objetos de máxima relevancia serían aquellos que permitieran controlar no sólo la farmacocinética sino también la entrega selectiva de cantidades masivas de droga, especialmente de drogas muy activas. Se establecieron como prioritarios los nanosed basados en nanoobjetos preparados en base a materiales biodegradables, biocompatibles, no tóxicos y nano-objetos de estructura y arquitectura controlada, tales como polímeros biomiméticos, dendrímeros terapéuticos y nanotubos. Se establecieron como prioritarias las tecnologías de autoensamblaje y aquellas responsables de generar nano-objetos con nuevas funciones: direccionamiento activo, entrega por comando, nanoaparatos para entrega inteligente/sistemas gatillados por estímulos biológicos, sistemas de entrega autorregulados y nuevos nano-objetos poliméricos para la entrega de péptidos/proteínas terapéuticas, así como sistemas que permitan el control de tráfico intracelular. Se enfatizó la necesidad de contar con esquemas universales de formulación, que pudieran emplearse para envío iv, im, o peroral. La escala temporal propuesta por Europa va desde 2005 hasta 2020, dejando para los últimos cinco años la aplicación de nano-objetos nanoparticulados a ingeniería de tejidos, los sistemas de direccionamiento de genes y a células, la teranóstica (diagnóstico + terapia) empleando nano-objetos, y los nano-objetos + microchips multirreservorios, en ese orden.
A diferencia de su ambicioso equivalente incluido en la Nacional Nanotechnology Initiative (NNI) de los Estados Unidos, la Agenda Estratégica propuesta por la EC sería un buen modelo a seguir por nuestros países latinoamericanos, porque se basa en una mirada local hacia problemas propios, que ofrece soluciones potenciales en un plazo de tiempo no mayor a diez años.
¿Por qué la irrupción de las empresas biotecnológicas en farmacia necesita de la nanotecnología?
La química medicinal y la química combinatoria buscan nuevos targets para fabricar drogas “a medida”. Este enfoque, sin embargo, únicamente es válido para moléculas de bajo peso molecular, y para el screening de macromoléculas de origen natural como proteínas, ácidos nucléicos con actividad biológica propia. Considerando que entre 2002 y 2003 la Food and Drug Administration (FDA) aprobó tantos productos biotecnológicos (como anticuerpos monoclonales, hormonas, enzimas y ácidos nucléicos) y sistemas de entrega, como nuevas moléculas de bajo peso molecular, el reporte 2006 PhRMA “Biotechnology medicines in development” identifica 418 nuevas medicinas biotecnológicas para más de 100 enfermedades, incluyendo cáncer, infecciosas, autoimmunes, AIDS/HIV y condiciones relacionadas, actualmente en pruebas clínicas o bajo revisión de la FDA. Sin embargo, el potencial terapéutico de estas macromoléculas, así como su aplicación clínica, está impedido por las numerosas barreras anatómicas y fenomenológicas interpuestas a su entrega.
Por ejemplo, tanto durante manufactura, almacenamiento y transito in vivo, es de extrema importancia mantener las estructuras secundarias, terciarias y cuaternarias de las proteínas. Las mismas están mediadas por interacciones débiles y son fácilmente destruidas por variaciones de pH, fuerza iónica, temperatura, alta presión, solventes no acuosos, iones metálicos, detergentes, adsorción superficial, agitación y fuerzas de fricción. La mayoría de estos factores está presente en procesos de manufactura, incluyendo esterilización y liofilización. La desestabilización de las proteínas reduce su actividad biológica, incrementa su inmunogenicidad y puede conducir a su agregación. Su estructura vulnerable a enzimas proteolíticas es responsable de su corta vida media en el sitio de administración. Su gran tamaño impide que se difundan a través de barreras epiteliales, a menos que existan transportadores específicos. La vía de administración mas común para proteínas es la iv, que usualmente no es bien tolerada por los pacientes. Aunque el clearance de las proteínas inyectadas iv puede ir desde los pocos minutos hasta los varios días, la mayoría de las proteínas también tienen cortas vidas medias en circulación. Además, puede ocurrir distribución indeseada y por ende requerirse dosis mayores y más frecuentes para conseguir eficacia terapéutica, que en su conjunto puede causar efectos tóxicos. Las vías sc e im también se usan para administrar biofarmacéuticos. Luego de la administración sc, la biodisponibilidad puede ser tanto 100 % como mucho menor, dependiendo del peso molecular, sitio de inyección, actividad muscular y condiciones patológicas. Proteínas por debajo de 16.000 Da son directamente absorbidas vía capilares sanguíneos locales, en tanto aquellas más pesadas pueden difundir a través de la pared endotelial sanguínea para entrar a los capilares sanguíneos en los sitios de inyección, o pueden ingresar al sistema linfático para volcarse a la sangre desde el conducto torácico. El transporte linfático es un proceso lento y la permanencia prolongada de proteínas en el sitio de inyección las expone a degradación enzimática. Por estas razones, la efectividad de proteínas o péptidos terapéuticos dependerá de un régimen de administración frecuente, que es incómodo para el paciente, a la vez que costoso. Por ello, la posibilidad de emplear vías no parenterales, como la tópica o mucosa, para la entrega de proteínas terapéuticas, es de extremo interés para la industria farmacéutica. Por ejemplo, la penetración de nanoobjetos a través del estrato córneo, permitiría entregar macromoléculas a capas profundas de la epidermis o superficiales de la dermis, sin llegadar a sangre, o sin afectar a aquellos estratos celulares que mantienen la viabilidad de la piel. La posibilidad de emplear nano-objetos muco adhesivos y con capacidad de protección estructural frente al entorno hostil del tracto gastrointestinal, permitiría la entrega de proteínas por vía oral, que serían capturadas por las células M de las Placas de Peyer o por enterocitos. De esta forma, aun en pequeñas cantidades llegarían intactas al sistema linfático o a la sangre, respectivamente; estas estrategias son particularmente prometedoras para macromoléculas de muy alta actividad específica. Abordajes similares servirían para el cruce de las barreras mucosas respiratorias y urogenitales.
Finalmente, a menos que se cuente con un sistema adecuado de entrega, el movimiento de macromoléculas por simple difusión por el interior celular es prácticamente imposible. Las macromoléculas deben transitar en el interior de vesículas endo o fagocíticas, que las direccionarían sobre los organoides blanco. La captura celular de nano-objetos que contengan proteínas incorporadas a su estructura permite que las proteínas ingresen a diferentes rutas de tráfico vesicular. Ejemplo de ello, en las terapias de remplazo enzimático, donde el organoide blanco que necesita incorporar enzimas faltantes a su interior son los lisosomas o las mitocondrias, o el núcleo en caso de terapia génica con plásmidos.
La nanomedicina debe ser traslacional
Respondiendo a las necesidades globales de colaboración y cooperación, la Sociedad Internacional de Nanomedicina (International Society for Nanomedicine, ISNM) se presentará en el seno de la 2da Conferencia clinam (www.clinam.org) el día 26 de abril de 2009. La ISNM ya cuenta con estatutos, lineamientos iniciales y estrategia de acciones a corto plazo, vertidos por sus dos principales socios fundadores, la European Society for Nanomedicine y la American Society for Nanomedicine (ASNM) y será la principal referente de las capacidades académicas, empresariales y de organizaciones políticas a escala mundial para conseguir la llegada a la clínica de las estrategias terapéuticas y de diagnóstico nanomédicas. Representantes de todos los continentes harán una presentación de cinco minutos exhibiendo sus programas nacionales en nanomedicina. De cara a esta realidad, debemos ser conscientes que llegado el año 2009 nuestros países latinoamericanos ni siquiera cuentan con plataformas nanomédicas que mostrar, dado que la masa crítica de investigadores y emprendedores abocados a desarrollar este tipo de estrategias todavía está por reunirse. El futuro ya fue ampliamente discutido en el primer mundo; hemos tenido la oportunidad de escuchar los argumentos en juego y deberíamos comenzar a hacer lo propio desde nuestro lugar en el sur.











 nueva página del texto (beta)
nueva página del texto (beta)