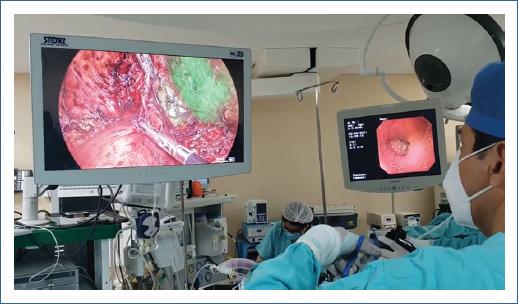
Introducción
La primera ocasión en que se describió el uso de la endoscopia intraoperatoria fue en 1973, cuando Espiner et al.1 utilizaron la colonoscopia transquirúrgica con la finalidad de localizar todos los pólipos del colon y recto durante una resección abierta mediante colotomía. La primera vez que se reportó un control endoscópico transoperatorio en una anastomosis del tracto digestivo fue en 1994, cuando Wittgrove et al.2 presentaron una cohorte de cinco pacientes en quienes se realizó cirugía de bypass gástrico con reconstrucción en Y de Roux (BGRY). Hasta la fecha existen múltiples estudios en los que se emplea el control endoscópico transoperatorio en cirugías que involucran anastomosis digestivas, la mayoría de ellas anastomosis mecánicas y en casi todos los casos con resultados alentadores.
Desde hace poco más de 20 años ha cobrado gran relevancia el control endoscópico intraoperatorio (CEIO) en las anastomosis digestivas (colorrectales, gastro-yeyuno, esófago-yeyuno, bypass gástrico, etc.), debido al incremento en el uso de técnicas mínimamente invasivas y dispositivos mecánicos de grapeo, así como la aparición de nueva evidencia que demuestra la posibilidad de disminuir las complicaciones postoperatorias con el uso de esta. Por ejemplo, al documentar una fuga tras realizar la prueba neumática o con la visualización directa de la línea de grapeo, favoreciendo la reparación inmediata, ya sea mediante la colocación de puntos de reforzamiento o, incluso, el desmantelamiento y elaboración de una nueva anastomosis3,4. Otro de los aspectos que ha beneficiado el uso de la endoscopia transoperatoria en cirugías que involucren anastomosis es el de identificar mediante visión directa una hemorragia a nivel de la línea de grapeo5, una complicación temprana que ocurre en el 0.6-4% de los pacientes sometidos a RYGBP6,7 y hasta en el 0.5-1.8% de los pacientes en quienes se realizan anastomosis colorrectales8, favoreciendo la resolución de la hemorragia en el mismo tiempo quirúrgico sin tener repercusión en el pronóstico de la anastomosis.
A pesar de las ventajas demostradas en el uso de la endoscopia transoperatoria, en un principio y aun en la actualidad, algunos cirujanos se han mostrado temerosos por la integridad de la línea de grapeo de una anastomosis recién elaborada al ser sometida a un incremento de la presión durante el estudio endoscópico, sin embargo esta posibilidad ha sido evaluada en diversos estudios, por ejemplo el de Kryzauskas et al.9, quienes demostraron que se requiere en promedio 48.58 mmHg para vencer una línea de grapeo al realizar una prueba neumática; mientras que en una revisión endoscópica convencional mediante panendoscopia la presión intraluminal promedio en el esófago es de 8.9 (3.0-20.7) mmHg y en el estómago de 10.0 (3.0-17.9) mmHg10, y en una colonoscopia se ha documentado una máxima de 8.5 ± 0.5 mmHg11, sin superar en ningún caso los 15 mmHg, independientemente del sitio donde se encuentre la punta del colonoscopio. También en este último estudio se evidenció que existe una correlación entre la duración de la endoscopia y el incremento de la presión intraluminal, factor que favorece al estudio transoperatorio que es generalmente corto.
Bypass gástrico con reconstrucción en Y de Roux
Esta cirugía fue una de las primeras en las que se introdujo el control endoscópico de la anastomosis, aunque, como lo describen Wittgrove et al., quizás aparece como un objetivo secundario, pues la cirugía comenzó a realizarse por vía laparoscópica y era un desafío sostener el anvil para colocarlo dentro del pouch gástrico y realizar la anastomosis mecánica con la engrapadora circular, por lo que se introdujo una guía metálica transabdominal por uno de los puertos, el cual era encontrado por el endoscopista a manera de rendezvous, favoreciendo que al elaborar la gastro-yeyuno anastomosis se pudiera desarrollar una revisión endoscópica al tiempo que el endoscopista realizaba la prueba neumática (de fuga aérea) con la anastomosis sumergida en solución, buscando identificar burbujas que evidenciaran una fuga en la línea de grapeo, con este pequeño grupo se empleó la endoscopia como parte de un procedimiento y no como un método para verificar la integridad de la anastomosis.
En el mismo tenor pero muchos años después, Valenzuela et al.12 presentaron un trabajo de 100 pacientes a quienes se realizó BGRY, a 50 de ellos se les hizo un CEIO y 50 estuvieron en el grupo control, identificando en el primer grupo una tasa estadísticamente significativa de menor fuga anastomótica (0 vs. 8%; p = 0.0412), así como una menor necesidad de reintervenciones (0 vs. 8%; p = 0.0412), con apenas un tiempo quirúrgico mayor en el control endoscópico (194.10 vs. 159 min; p < 0.001) y menor estancia hospitalaria (2.44 vs. 3.46 días; p = 0.025). En el trabajo de Sekar et al.13, que comprende 340 pacientes a los que se realizó BGRY, la evaluación endoscópica de la gastro-yeyuno anastomosis (GJ) resultó en la detección de 56 fugas intraoperatorias (16.4%), mejorando así la evolución de los pacientes a quienes se realizó endoscopia intraoperatoria.
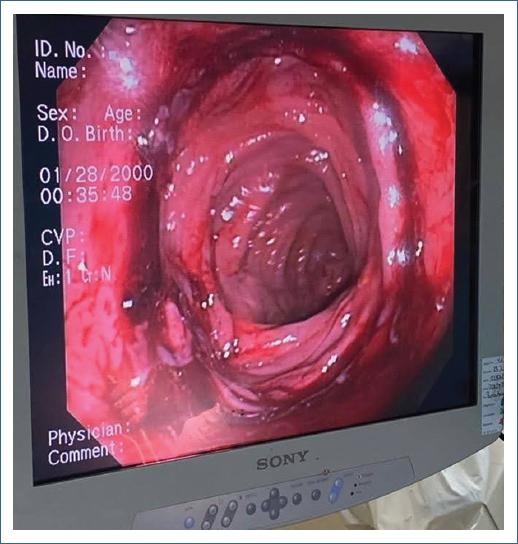
Respecto a la prevención de la hemorragia en los BGRY, se ha notado una mayor incidencia en cirugía laparoscópica (1-4%) que en cirugía abierta (< 1%)7,14-16. A pesar de que existen cuatro posibles sitios de hemorragia (pouch gástrico, anastomosis gastro-yeyuno, yeyuno-yeyuno anastomosis y el estómago excluido), en la mayoría de las ocasiones el sangrado se localiza en la línea de grapas de la anastomosis esófago-yeyuno, lo que la hace un sitio asequible para un manejo endoscópico (Fig. 1)17.
Esófago-yeyuno anastomosis
La anastomosis esófago-yeyuno con reconstrucción en Y de Roux (RYEJ) ha mostrado los mejores resultados en la evolución de los pacientes con cáncer gástrico, por lo que se ha considerado como la técnica de elección en el manejo quirúrgico de esta patología18. Sin embargo, la fuga anastomótica después de una gastrectomía total por cáncer gástrico no es infrecuente, con una incidencia que oscila entre el 0.5 y el 11%19-22. A pesar de ello no existe información tan amplia sobre CEIO en este tipo de cirugías como la hay en cirugía bariátrica o colorrectal (Fig. 2). Uno de los trabajos más grandes en RYEJ es el de Nishikawa et al.23, en el cual se realizó una revisión endoscópica transoperatoria de la anastomosis esófago-yeyuno en 48 pacientes, de los cuales el 4.2% desarrollaron fuga anastomótica postoperatoria, en ambos encontrando alteraciones a nivel de la línea de grapeo, mientras que en el 6.3% de los pacientes con CEIO se identificaron fallas inadvertidas en las anastomosis esófago-yeyuno.
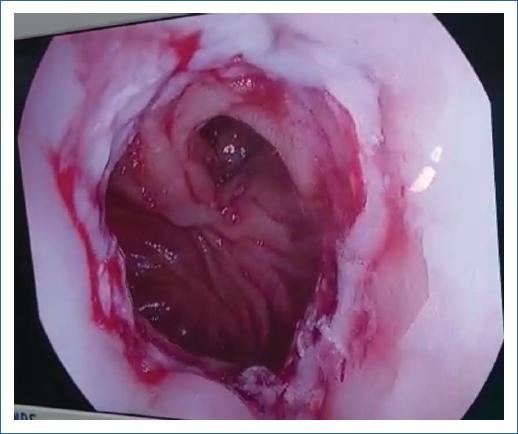
Figura 2 Revisión endoscópica intraoperatoria de la esófago-yeyuno anastomosis mecánica con reconstrucción en Y de Roux durante una gastrectomía total por cáncer gástrico.
El estudio de Lieto et al.5 sobre RYEJ por cáncer gástrico, que también incluye anastomosis colorrectales, documentó que de los 118 pacientes a quienes se realizó anastomosis digestivas con revisión endoscópica intraoperatoria, 5 (4.3%) presentaron hemorragia en la línea de grapeo, la cual fue controlada en dos de los casos con compresión prolongada, en dos casos con sutura directa y en el último caso, que tenía otros defectos en la integridad de la anastomosis, se desmanteló y se elaboró una nueva.
Anastomosis colorrectales
En este tipo de anastomosis es donde se tienen mejor documentados los beneficios de realizar un control endoscópico transoperatorio (Fig. 3)24-26. Un ejemplo es el trabajo de Li et al.27, que contempla una cohorte de 244 pacientes sometidos a resección de colon con anastomosis distal, de los cuales a 107 se les realizó colonoscopia intraoperatoria de rutina (CIOR), mientras que a los 137 restantes se les realizó la colonoscopia solo bajo consideraciones específicas (CIOCE) determinadas por el cirujano, obteniendo en el segundo grupo un incremento de 5.7 veces la incidencia de complicaciones anastomóticas (0.9 frente a 5.1%), asimismo cinco pacientes (3.6%) tuvieron sangrado en la línea de grapeo en el grupo CIOCE frente a un paciente (0.9%) en el grupo con CIOR (p = 0.234). Dos pacientes (1.5%) en el grupo CIOCE experimentaron fugas anastomóticas postoperatorias, mientras que ningún paciente del grupo CIOR tuvo fugas (p = 0.51). A pesar de tratarse de una muestra pequeña, se identificó un beneficio en realizar una revisión endoscópica de forma sistemática a todos los pacientes en quienes se realiza una anastomosis colorrectal. En este mismo estudio se identificaron seis pacientes con hemorragia en la línea de grapeo, logrando en todos la hemostasia con la colocación de sutura directa, sin repercusiones en el estado de la anastomosis.
Yang et al.28 presentaron un trabajo con una cohorte más numerosa, en el cual evaluaron el impacto de la colonoscopia intraoperatoria (CIO) como método de prueba contra fugas en la resección anterior baja por cáncer de recto. Se incluyeron un total de 1,266 pacientes, de los cuales 215 se sometieron tanto a CIO como a prueba de fuga aérea en cirugía de cáncer de recto. La CIO se realizó después de elaborada la anastomosis, para visualizar la línea de grapeo con prueba de fuga aérea insuflando el neorrecto. La comparación de la tasa de fuga anastomótica mostró una diferencia significativa entre los grupos (grupo CIO sin fugas intraoperatorias frente a grupo sin CIO sin fugas intraoperatorias, 4.3 frente a 11.7%; p = 0.007), mientras que la incidencia de ileostomía profiláctica de descompresión debido a una fuga aérea positiva fue significativamente mayor en el grupo CIO que en el grupo sin CIO (10 vs. 2 casos, p = 0.036).
Finalmente, en 2020, Krzauskas et al.29 podrían haber esclarecido esta controversia, al menos en las anastomosis colorrectales, al realizar un metaanálisis en el cual incluyeron 12 estudios con 3,787 pacientes, a los cuales realizaron prueba de fuga aérea aislada, CIO con prueba de fuga aérea y CIO con fuga aérea e instilación de solución salina teñida de azul. Este metaanálisis comprende dos estudios controlados y aleatorizados, los cuales reportaron una prueba de endoscopia intraoperatoria positiva en el 23-25% de los pacientes y sus tasas finales de fuga anastomótica en el grupo con CIO fueron del 4 y 10%, contra el 14 y 20% en los grupos control.
Por otro lado, los estudios observacionales incluidos en el metaanálisis reportaron una tasa de pruebas de fuga aérea positivas que varió del 1.2 al 18.8%, con tasas de fuga anastomótica en el grupo de estudio del 0-10%, contra el 1.5-12.1% en el grupo control.
Uno de los estudios más numerosos incluido en el metaanálisis fue realizado por Allaix et al.30, con una cohorte de 398 pacientes, en el cual se reporta un cambio del plan quirúrgico en el 5% de los pacientes a quienes se realizó CIO debido a pruebas de fuga aérea positivas, de estos pacientes, al 70% se les realizó un estoma de protección y al 30% restantes se les realizó un refuerzo de la anastomosis, logrando el 0% de fugas anastomóticas, convirtiéndolo en un estudio de peso para el resultado del metaanálisis.
Finalmente, el análisis agrupado con un valor de odds ratio total de 0.52 (intervalo de confianza del 95%: 0.34-0.82) reveló que las tres pruebas intraoperatorias utilizadas para evaluar la integridad de la anastomosis se asociaron con una tasa de fuga anastomótica más baja, con una diferencia estadísticamente significativa (p < 0.001), sin heterogeneidad significativa entre los estudios (χ2: 9.49; grados de libertad: 11; p = 0.58; I2: 0) (Tabla 1).
Tabla 1 Evaluación mediante colonoscopia intraoperatoria de las anastomosis de recto
| Evaluación mediante colonoscopia intraoperatoria de las anastomosis de recto | ||||
|---|---|---|---|---|
| Estudio | n | Anormalidades identificadas durante la endoscopia | Tasa de fuga después de la CIO (%) | Cambios en la cirugía tras la EIO* |
| Kamal et al., 2015[26] | 415 | 17 | 9 (2.1%) | 2 |
| Li et al., 2009[27] | 107 | 11 | 0 (0.0%) | 5 |
| Yang et al., 2017[28] | 215 | 10 | 10 (4.6%) | 10 |
| Lieto et al., 20114† | 56 | 8 | 2 (3.6%) | NA |
*Ileostomía derivativa, hemostasia endoscópica, colocación de puntos hemostáticos o de reforzamiento.
†Se tomó en cuenta únicamente el brazo de anastomosis de colon del estudio.
CIO: colonoscopia intraoperatoria; EIO: endoscopia intraoperatoria.
Conclusiones
El CEIO como método para revisión de las anastomosis digestivas era un paso inminente durante el desarrollo de la endoscopia, pues es un recurso invaluable para la visualización directa de la línea de grapeo con la finalidad de verificar la integridad, descartar hemorragia o la prueba neumática desde el interior de la anastomosis. Aunque de manera inicial el temor de los cirujanos era que al incrementar la presión intraluminal en el tracto digestivo tras realizar una anastomosis se pudiese condicionar una disrupción en la línea de grapeo, se ha demostrado en modelos experimentales que se requiere más del doble de la presión media máxima infundida durante un estudio endoscópico transoperatorio para que se vea afectada la línea de grapeo, ya sea que se trate de un grapeo sencillo o al usar un doble grapeo. A pesar de su amplia difusión y buenos resultados, la revisión endoscópica continúa siendo un recurso un tanto subjetivo en la evaluación de la integridad mecánica de una anastomosis, por lo que en vías de mejorarlo, algunos buscan estandarizar los parámetros que evaluar, parámetros que en la actualidad todavía quedan a criterio del cirujano.











 nueva página del texto (beta)
nueva página del texto (beta)