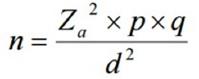Introducción
El reflujo biliar, también conocido como reflujo duodeno gástrico (RDG) se define como la presencia de contenido biliar dentro del estómago, siendo capaz de producir síntomas digestivos altos y una gastritis química o también llamada biliar o alcalina1. El diagnostico de reflujo biliar se debe realizar con prueba de Ph-metría e impedancia, medición de ácidos biliares y diferenciar del reflujo no acido, la observación de lago biliar en el estudio endoscópico es sugestivo de esta patología2,3. Estos pacientes son capaces de desencadenar mutaciones en la replicación celular hacia el desarrollo de una metaplasia y displasia, pudiendo llegar hasta un cáncer gástrico4. Si bien no está demostrado que la presencia de Helicobacter pylori en pacientes con reflujo biliar es un factor para el aumento de este tipo de reflujo, está demostrado que la presencia de Helicobacter pylori es un factor riesgo para progresión a metaplasia y displasia independientemente de la presencia o no de reflujo biliar, por lo que es un factor que debe tenerse en cuenta5, pacientes sometidos a intervenciones quirúrgicas tales como colecistectomía se reporta hasta un 40% de reflujo biliar y más del 70% en otras intervenciones quirúrgicos tales como Bilroth I por lo que debe ser un hallazgo esperado en estos pacientes6.
La metaplasia es un cambio en la identidad celular, y este proceso puede ser regulado por factores de transcripción que inician y / o mantienen la identidad celular, tal vez en concreto con la reprogramación epigenética, se han estudiado la metaplasia intestinal completa ó Tipo I que consta de células caliciformes secretoras de sialomucina y células absortivas no secretoras, la metaplasia intestinal incompleta (Tipo IIa, IIbó III). La tipo IIa consta de pocas células absortivas, células columnares secretoras de sialomucina ácida y neutra, células caliciformes secretoras principalmente de sialomucina y ocasionalmente sulfomucina y la Tipo IIb ó III presenta células columnares secretoras principalmente de sulfomucina y células caliciformes secretoras de sialomucina y sulfomucina7. Universalmente, la metaplasia es un precursor de la displasia de bajo grado, que puede culminar en displasia de alto grado y carcinoma, siendo el cáncer gástrico ocupando la tercera causas de mortalidad global en subtipos de cáncer, la metaplasia sin displasia presenta una progresión anual a cáncer gástrico del 0.25% (siendo la metaplasia tipo IIa y III la que presenta mayor riesgo), la metaplasia con displasia leve a moderada un .6% y un 6% con displasia severa por lo cual la detección clínica mejorada y la vigilancia de la metaplasia podrían conducir a una mejor prevención o detección temprana de la displasia y el cáncer8,9.
Le endoscopia con biopsia es el método de elección para detección de metaplasia y se realiza el muestreo por protocolo de Sydney10 si no hay sospecha visible o biopsias dirigidas en caso de lesiones sospechosas (depósitos blanquecinos de placas delgadas)11, con el avance de la tecnología la cromo endoscopia con magnificación presenta altas tasas de certeza sin embargo esta técnica requiere experiencia y no está disponible en todos los centros endoscópicos por lo cual no se la ha dado tanto peso, la detección con luz blanca presenta una sensibilidad que varía del 23% al 40% y un especificidad cercana al 30%, por lo cual la imagen en banda (Cromo endoscopia digital) ha sido de gran utilidad reportando una sensibilidad diagnostica cercana al 70% así como especificidad entere 65-70%, la mayoría de estudios realizados es con tecnología (NBI)12-14. El ácido acético es un ácido débil que rompe los puentes de disulfuro de las glicoproteínas causando una desnaturalización reversible de las proteínas intracelulares citoplasmáticas, permitiendo definir mejor la arquitectura de lesiones en la mucosa adyacente, reportando una sensibilidad diagnostica de metaplasia por encima de 80% en combinación con cromoendoscopia digital y especificidad cercana al 70%, lo que la vuelve una técnica muy útil para estos casos15-17.
Objetivos
Primario
– Comparar la utilidad diagnostica de la aplicación de ácido acético + cromoendoscopia digital (I-scan) vs el solo uso de cromoendoscopia digital (I-scan) para detección de metaplasia intestinal gástrica en pacientes con gastropatía biliar
Criterios de exclusión
1. Pacientes que recibieron tratamiento para la erradicación del Helicobacter pylori, previo al estudio endoscópico
2. Cirugías por las técnicas Billroth I o II o pancreático – duodenectomía
3. Pacientes con neoplasia esofágica, gástrica o duodenal.
4. Pacientes con complicaciones como hemorragia, perforación, etcétera, en el momento del diagnóstico endoscópico.
***No se Realizó Ph-metría como impedancia para determinar reflujo no acido, ni bili test para corroboración de gastropatía biliar, se tomó en cuenta la visualización de lago biliar adherente al momento de realización del estudio endoscópico como herramienta diagnostica.
Metodología
Se trata de un estudio prospectivo, aleatorizado y analítico, se realiza el estudio de forma aleatoria de acuerdo a secuencia de orden en donde se formaron dos grupos comparativos en el primero se empleó cromoendoscopia digital con sistema (I-scan) y OE (Optical enhancement) en pacientes que cumplieran los criterios de inclusión, en búsqueda de metaplasia gástrica y el otro grupo con aplicación de ácido acético diluido al 2.5% y aplicado con aspersor directo a la mucosa y sistema de cromoendoscopia digital con sistema (I-scan) y OE (Optical enhancement).
Se tomaron muestra dirigidas en caso de sospecha de metaplasia y protocolo de Sydney en caso de no sospechar metaplasia intestinal gástrica
Se recabaron resultados de patología y se contrastarán resultados en base a diagnósticos reportados.
Se utilizó un procesador de PENTAX PK – i7010 y un gastroscopio EG29 – i10 con canal de trabajo de 3.2 mm
– Se calculó tamaño de muestra para tamaño muestral conocido en base a estudios de validez con mayor número de pacientes con un IC del 95% un margen de error del 5% y heterogenicidad del 50%.
Resultando en 231 pacientes de forma aproximada.
Se empleó el programa spss versión 25. previa organización de datos en Excel se usaron tablas de contingencia con pruebas cruzadas para determinar sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo, así como certeza diagnóstica basados en los resultados de patología y diagnósticos descritos en ambos brazos (dicha validación con test de Fisher y chi cuadrado con validez (p=.05, IC 95%).
Se determinó prueba de normalidad a muestra poblacional para USO de estadística paramétrica o no paramétrica para análisis univariado y ser realizo análisis multivariado en variables con estadística significativa y se describieron características generales de la población.
El estudio se llevó a cabo de octubre 2019 a marzo 2020.
Resultados
En nuestras características de población total no obtuvimos diferencias en cuanto a genero p=.34, se identificó metaplasia intestinal gástrica en 91(39%) p=.042, tuvimos un alto índice de detección de H. pylori 160(70%) p=.001, y de los pacientes con diagnóstico de metaplasia el 74% (67) presentaban H pylori, lo cual nos estableció un OR 1.42 en pacientes con gastropatía biliar y un OR 4.3 en pacientes con H pylori y gastropatía biliar, al realizar la comparación de nuestros grupos para utilidad diagnostica se observó una sensibilidad, especificidad, Valor predictivo positivo y negativo de 69.7%, 70.2%, 68.2% y 67.7% respectivamente para el grupo de los pacientes en los que solamente empelamos tecnología I-SCAN (136 pacientes) y una sensibilidad, especificidad, Valor predictivo positivo y negativo de 88.2%, 70.2%, 74.6%,86.4% para el grupo de los pacientes en los que se empleó ácido acético y tecnología I- SCAN (95 pacientes)se obtuvo una certeza diagnostica de 72% vs 90.3 % p=.001 cuando se comparó ambos grupos. (Ver tablas 1 y 2 y grafico 1).
Tabla 1 Características de población, *Numero y porcentaje **Media y desviación estándar (Años)*** Corroborado por patología **** Análisis multivariado como factor de riesgo + número de pacientes del total de metaplasia).
| Variables | N = 231 | OR (IC95%)**** |
|---|---|---|
| Genero* | Masculino 103 (45%) | |
| Femenino 128 (55%) | ||
| P = .34 | ---- | |
| Edad** | 59 ± 10.4 | |
| Metaplasia Gastrica*** | Presente 91 (39%) | |
| Ausente 140 (61%) | ||
| P = .042 | 1.42 (1.1-2.4) | |
| Metaplasia Gástrica | Displasia 22 (24%) | |
| Sin Displasia 69 (76%) | ||
| P= .023 | ---- | |
| Helicobacter P pylori. | Presente 161 (70%) | |
| Ausente 70 (30%) | ||
| P = .001 | 4.3(2.23-7.9) | |
| H pylori + Metaplasia + | 67 (74%) | |
| P =-001 | ||
| 136 (59%) | ||
| Grupo I-scan | 95 (41%) | |
| Grupo I-SCAN + AA |
Tabla 2 Utilidad diagnostica en detección de metaplasia gástrica en ambos grupos *(Metaplasia Gástrica Intestinal), **(Valor predictivo positivo, y valor predictivo negativo) *** (Ácido acético al 2.5 % + I – SCAN)
| MGI* | Sensibilidad | Especificidad | VPP** | VPN** | Certeza Dx. |
|---|---|---|---|---|---|
| I-SCAN | 69.7% | 70.2% | 68.2% | 67.7% | 72%(44/61) |
| AA+ I-SCAN*** | 88.2% | 70.2% | 74.6% | 86.4% | 90.3%(28/31) |
| Valor de p | P=.001 | P=.32 | P=.42 | P=.001 | P=.001 |
Discusión
En nuestros resultados observamos que la presencia de gastropatía biliar al momento de realizar una endoscopia puede ser un factor de riesgo, para desarrollo de metaplasia intestinal tal y como se refieren estudios previos, y el presentar Helicobacter pylori concomitante puede aumentar el riesgo de presentar metaplasia, estas aseveraciones no pueden ser del todo definidas por que nuestro diagnóstico de gastropatía biliar solo es por sospecha al momento del estudio endoscópico (lago biliar visible) y no concluyente con prueba de Ph-metría y bilitest, además de que el Helicobacter pylori es uno de los principales factores de riesgo para metaplasia gástrica por si solo sin necesidad de presencia de reflujo biliar, sin embargo es altamente sugestivo18. En nuestros dos grupos si encontramos una diferencia en cuanto a certeza diagnostica del 90.2% vs 72% lo que es similar a lo reportado en algunas publicaciones tales como Sha j Wang, et al.19, nuestra sensibilidad, valor predictivo y positivo en nuestro grupo en el que se empleó ácido acético + I - SCAN por lo que el uso de ácido acético al ser una reacción reversible por completo debería empezar a emplearse como un uso más rutinario en combinación con la cromo endoscopia digital, además de que dichos resultados pueden ser resultado no solo de una mejor calidad de visualización diagnostica del observador sino también de la capacidad para dirigir mejor las biopsias con esta técnica, si bien hay algunas publicaciones donde el NBI presenta certeza diagnostica del 95% en metaplasia intestinal gástrica20, las publicaciones suelen reportar diversos resultados por lo que influye mucho el tiempo del observador y la experiencia del centro hospitalario y el endoscopista, además de que con tecnología I- SCAN hay menos literatura publicada.
Conclusión
La técnica combinada de cromoendoscopia + ácido acético parece mostrar resultados superiores como prueba de detección de metaplasia respecto a la cromo endoscopia digital, lo cual impactaría directamente en el diagnóstico precoz de una lesión premaligna y si tenemos un factor condicionante como gastropatía biliar el uso de esta técnica combinada debería emplearse.











 nova página do texto(beta)
nova página do texto(beta)