Introducción
La esofagogastroduodenoscopia (EGD) es el estándar diagnóstico para la evaluación de la mucosa del tubo digestivo superior1,2. Una limpieza adecuada de la mucosa a este nivel es indispensable para la adecuada evaluación y diagnóstico3,4. Las estrategias más frecuentemente utilizadas para la limpieza de tubo digestivo superior incluyen: lavado con aspiración con agua durante el procedimiento y premedicación con agentes antiespumantes y mucolíticos previo al procedimiento4-6. Hasta el momento no se ha estandarizado la forma de administrar la premedicación, así como tampoco la manera de evaluarla4,7,8. En los estudios reportados se utilizan diferentes tipos de medicamentos, combinaciones y diluciones; así como diferentes escalas y puntajes para valorar su efectividad3,4,7-9. Los medicamentos más frecuentemente utilizados son simeticona con o sin N-acetilcisteína (NAC)4,7,10. La simeticona es un agente antiespumante que no se absorbe a la circulación sistémica, no tiene interacciones medicamentosas y tiene un adecuado perfil de bioseguridad5,9,11. La dosis recomendada de simeticona es de 66.6 a 133.3 mg y la cantidad de líquido habitualmente administrada y tolerada es de 100 ml 20 a 30 minutos antes del estudio8,12,13. El uso de simeticona contra placebo ha demostrado superioridad para mejorar la visibilidad de la mucosa y al compararla combinada con NAC la mayoría de los estudios no han demostrado diferencias significativas1,3,6,9,10,14. El Consenso Asiático para diagnóstico de neoplasias en EGD y la Sociedad Británica de Gastroenterología recomiendan utilizar premedicación con simeticona sola o combinada previo a la EGD y sugieren que se debe reportar la visibilidad de la mucosa utilizando alguna escala publicada15,16. A pesar de la evidencia sobre la utilidad y seguridad de la premedicación, el uso de líquidos vía oral previo a la EGD continúa siendo una preocupación recurrente para los anestesiólogos que administran la sedación para el procedimiento ya que podría asociarse a riesgo de broncoaspiración3,7,9,17.
El objetivo de nuestro trabajo fue evaluar si el uso de 100 mg de simeticona en 50 ml de agua no es inferior a la dosis recomendada de 100 mg en 100 ml para mejorar la visibilidad global de la mucosa. Como objetivos secundarios se compararon la visibilidad de la mucosa gástrica, la visibilidad de la mucosa por área, diferencias en tiempo del procedimiento y eventos adversos.
Material y métodos
Se realizó un ensayo clínico de no inferioridad, unicéntrico, prospectivo, aleatorizado, cegado al investigador el cual incluyó a todos los pacientes hombres y mujeres, ≥ 18 años que acudieron a EGD diagnóstica en la Unidad de Endoscopía del Instituto Nacional de Cancerología de México (INCan) de septiembre del 2019 a febrero del 2020. Los criterios de exclusión fueron: neoplasia del tubo digestivo superior, anatomía alterada por cirugía previa, estenosis de tubo digestivo alto, mujeres embarazadas o lactando, alergia conocida a la simeticona, disfagia o intolerancia a la vía oral y contraindicación para el procedimiento endoscópico o para la sedación. Se eliminaron todos los pacientes con endoscopía incompleta por cualquier causa. Se entregó consentimiento informado del procedimiento endoscópico especificando la premedicación y riesgos del procedimiento a todos los pacientes que se invitó a participar.
Selección de pacientes y premedicación con simeticona
Todos los pacientes candidatos para el estudio que aceptaron participar fueron divididos mediante una lista de números aleatorios en dos grupos de premedicación. En el grupo A se les pidió que tomaran vía oral 100 mg de simeticona en 100 ml de agua y en el grupo B 100 mg de simeticona en 50 ml de agua. La premedicación se les dio a los pacientes 20-30 minutos antes de realizar el estudio con supervisión del equipo de enfermería en el área de preparación, posteriormente se canalizaron con solución intravenosa y se trasladaron a la sala de endoscopia. Se registraron la edad, género e indicación de la EGD de todos los pacientes que aceptaron participar.
Realización de EGD
Después de recibir anestesia local en la hipofaringe con lidocaína al 10% en spray, monitoreo continuo de signos vitales, administración de O2 por mascarilla nasal y sedación profunda con propofol ± fentanilo por el servicio de anestesiología se introdujo un video endoscopio de alta definición GIF-190 con procesador Exera III (Olympus, Tokio, Japón) hasta duodeno. Después de aspirar el contenido líquido del tubo digestivo superior se evaluó la visibilidad de la mucosa en 6 sitios distintos: 1) esófago distal, 2) fondo, 3) cuerpo proximal, 4) cuerpo distal, 5) antro y 6) duodeno y se fotodocumentó cada una de estas regiones. Los endoscopistas pudieron lavar libremente con agua las áreas que consideraron con limpieza inadecuada con jeringas de 60 ml. Se grabaron el total de la duración del estudio y las fotografías tomadas durante el mismo.
De cada procedimiento se registró: la indicación del estudio, uso de dispositivos adicionales (como cap), los diagnósticos endoscópicos y la toma de biopsias.
Posterior a la realización del estudio todos los pacientes se trasladaron al área de recuperación para vigilancia y valorar efectos adversos por un periodo de 2 a 4 horas bajo supervisión del equipo de enfermería y una vez recuperados de la sedación se egresaron de la unidad. El diagnóstico endoscópico se le entregó a cada paciente de manera verbal al momento de su egreso del servicio de endoscopia y se registró en el expediente electrónico. En caso de haberse tomado biopsias los resultados se entregaron por los servicios responsables de los pacientes en un periodo de 7 días aproximadamente.
Todos los procedimientos se realizaron por endoscopistas en entrenamiento bajo supervisión de endoscopistas expertos los cuales estaban cegados a la dosis de simeticona administrada.
Todas las complicaciones presentadas durante o después del procedimiento endoscópico (en la sala de recuperación) fueron registradas.
Evaluación de la limpieza de la mucosa digestiva superior
Después de la realización de los estudios endoscópicos los videos e imágenes registradas fueron revisados por un médico endoscopista investigador cegado a la premedicación utilizada para calificar la visibilidad de la mucosa. La escala utilizada fue la de Basford et al7simethicone and N-acetylcysteine (NAC, la cual no considera la cantidad de agua irrigada y evalúa la visibilidad de la mucosa con puntajes de 1 a 4 (ver figura 1). Los puntajes de visibilidad de la mucosa utilizados fueron los siguientes:
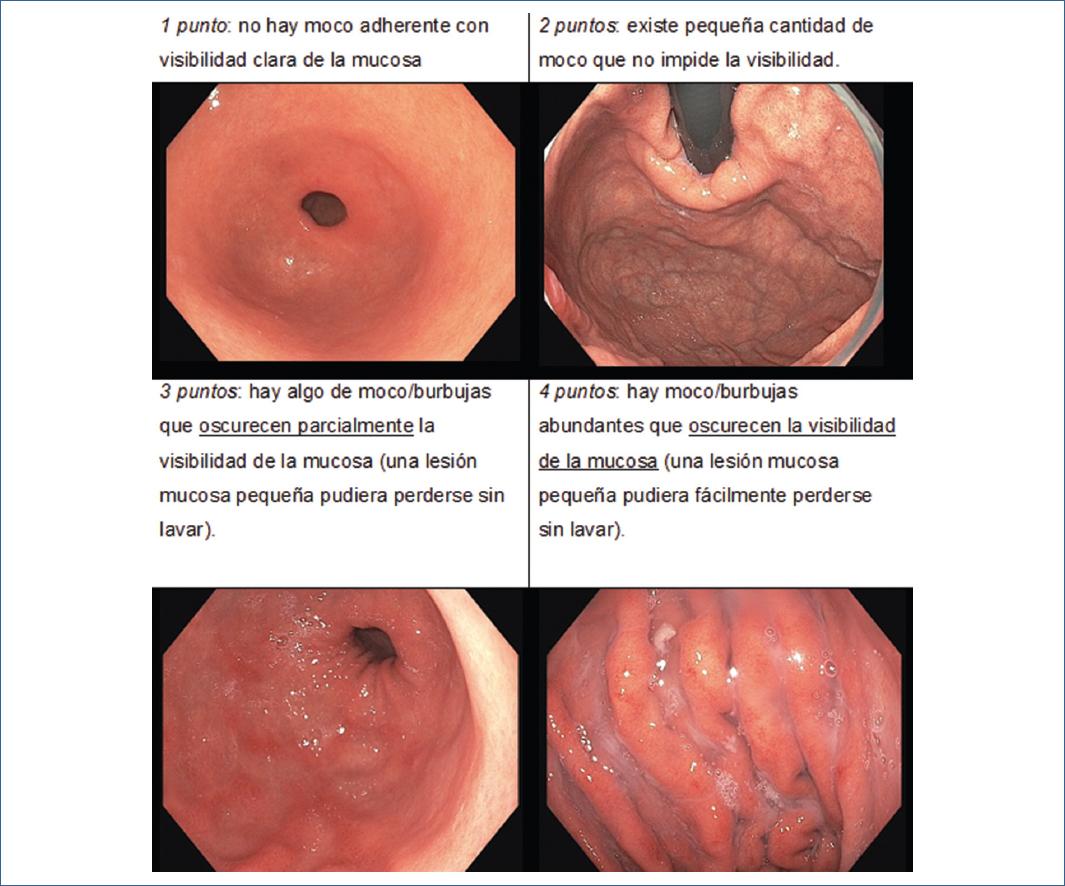
Figura 1 Escala de visibilidad de la mucosa. Elvas L, Areia M, Brito D, et al. Premedication with simethicone and N-acetylcysteine in improving visibility during upper endoscopy: A double-blind randomized trial. Endoscopy. 2017;49(2):139-145. doi:10.1055/s-0042-119034
- Puntaje total de visibilidad de la mucosa (PTVM): Puntaje obtenido de la suma de todas las áreas examinadas, el cual podía ser mínimo de 6 puntos y máximo de 24 puntos.
- Puntaje de visibilidad de la mucosa gástrica (PVMG): Puntaje obtenido de la suma de las áreas gástricas examinadas (fondo, cuerpo proximal, cuerpo distal y antro), el cual podía ser de mínimo de 4 puntos y máximo 16 puntos, considerándose una limpieza gástrica adecuada si era menor de 7 puntos.
- Puntaje de visibilidad de la mucosa de cada área: Puntaje de visibilidad de la mucosa obtenido de cada área, el cual podía ser de 1 punto y máximo 4 puntos.
Independientemente del puntaje reportado a menor valor mejor limpieza de la mucosa.
Cálculo de muestra y análisis estadístico
En base a los resultados de estudios previos similares se consideró una desviación estándar esperada de 214; para el cálculo del margen de no inferioridad se tomó como la diferencia de la simeticona contra placebo el límite inferior del IC 95% reportado en el meta-análisis de Li, et al6, que fue de -4.65 (M1) y se estableció como límite de no inferioridad el 20% de esta diferencia (M2), resultando una diferencia máxima clínicamente aceptable entre ambos grupos de -0.93. Se utilizó un nivel de significancia unilateral de 0.05, un poder estadístico del 80% y se agregó un 10% de pérdidas de seguimiento, obteniendo 64 pacientes por grupo; esto permite determinar con una certeza del 80% que el tratamiento experimental no será inferior al estándar si el límite inferior del IC 95% unilateral es superior a -0.93.
Las variables categorías fueron descritas en porcentajes y proporciones y las variables continuas fueron descritas en medias y desviaciones estándar. Se utilizó la prueba de Chi2 para comparar variables categóricas y la prueba T de Student para muestras independientes para comparar variables continuas. Se consideró un valor de p ≤0.05 como estadísticamente significativo y un intervalo de confianza del 95%. Se utilizó el programa Minitab 2017 ® para el análisis de datos.
Resultados
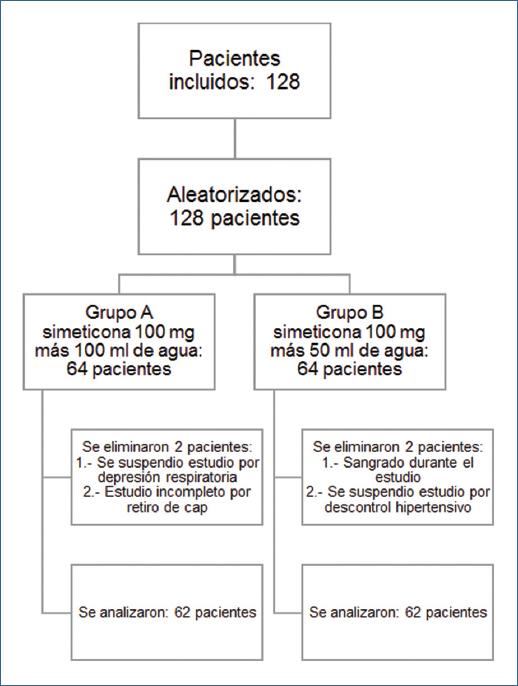
Se incluyeron y aleatorizaron un total de 128 pacientes, 64 pacientes en cada grupo de premedicación en un periodo de 6 meses. Se eliminaron cuatro pacientes: dos en el grupo A (uno por suspensión de la EGD por depresión respiratoria secundario a la sedación y otro porque se cayó de forma accidental un cap en duodeno que se extrajo endoscópicamente sin realizar la fotodocumentación de las áreas); y dos en el grupo B (uno se suspendió el estudio por descontrol hipertensivo y otro por presentar sangrado por gastropatía portal hipertensiva severa durante el procedimiento que se autolimitó e impidió la evaluación de la mucosa). Por lo tanto, se incluyeron en el análisis de datos un total de 124 pacientes, 62 pacientes en el grupo A y 62 pacientes en el grupo B (Figura 2). No se encontraron diferencias estadísticas entre los grupos en cuando a edad y sexo tal como se muestra en la tabla 1.
Tabla 1 Características demográficas
| Grupo de estudio | Grupo A | Grupo B | Valor p |
|---|---|---|---|
| No. Pacientes: n | |||
| 124 | 62 | 62 | |
| Edad (años): media ±DE | 55.39 ±16.72 | 56.98 ±15.18 | 0.289 |
| Sexo: n (%) | |||
| Mujeres: 89 (71.77%) | 44 (70.97%) | 47(75.80%) | 0.421 |
| Hombres: 35 (28.22%) | 18 (29.03%) | 17(27.42%) |
La indicación más frecuente para realizar la EGD fue dispepsia (n=30, 24.19%), seguida de estudio de extensión (n=18, 14.52%), diagnóstico/vigilancia de varices esofágicas (n=14, 11.29%), vigilancia de algún síndrome genético familiar (síndrome de poliposis adenomatosa familiar, síndrome de Lynch o tamizaje por familiar con cáncer gástrico hereditario) (n=14, 11.29%), enfermedad por reflujo gastroesofágico (n=10, 8.06%), anemia en estudio (n=10, 8.06%), búsqueda de sarcoma de Kaposi (n=9, 7.26%), vigilancia polipectomía (n=8, 6.45%), búsqueda de tumor primario (n=6, 4.83%), enfermedad acido-péptica (n=4, 3.23%) y diarrea crónica (n=1, 0.81%).
La visibilidad de la mucosa global fue peor en el grupo B que en el grupo A con una media de PTVM de 9.65 (DE ± 3.17) vs 8.26 (DE ± 2.03) respectivamente (con una diferencia de medias de -1.39, p=0.003). Encontrando inferioridad en el grupo B cuando se comparó la limpieza global con el grupo A (límite inferior del IC 95% unilateral de -2.335).
En cuanto a la visibilidad de la mucosa gástrica el grupo B demostró peores resultados, obteniendo una media de PVMG de 6.71 (DE ± 2.43) comparado con una media de PVMG de 5.76 (DE ± 1.66) en el grupo A (con una diferencia de medias de -0.95, p=0.006), siendo también inferior la premedicación del grupo B para este objetivo (límite inferior IC 95% unilateral de -1.691). Al clasificar la limpieza gástrica en adecuada e inadecuada, también fue menor el porcentaje de estudios con limpieza adecuada en el grupo B (58.06 % vs 77.42%, p=0.011) (Tabla 2).
Tabla 2 Puntajes de visibilidad de la mucosa total, gástrica y por área
| Grupo de estudio | Grupo A | Grupo B | p (IC 95%) |
|---|---|---|---|
| Esófago distal: media ± DE | 1.39 ±0.55 | 1.66 ±0.81 | 0.015 (-0.521, -0.027) |
| Fondo gástrico: media ± DE | 1.55 ±0.72 | 1.89 ±0.96 | 0.014 (-0.640, -0.037) |
| Cuerpo proximal: media ± DE | 1.87 ±0.82 | 2.07 ±0.97 | 0.117 (-0.513, 0.126) |
| Cuerpo distal: media ± DE | 1.21 ±0.45 | 1.42 ±0.71 | 0.027 (-0.422, 0.003) |
| Antro: media ± DE | 1.13 ±0.34 | 1.34 ±0.57 | 0.008 (-0.377, -0.425) |
| Duodeno: media ± DE | 1.11 ±0.32 | 1.27±0.58 | 0.028 (-0.328, 0.005) |
| PVMG: media ± DE | 5.76 ±1.66 | 6.71 ±2.43 | 0.006 (-1.691, -0.212) |
| PTVM: media ± DE | 8.26 ±2.03 | 9.65 ±3.17 | 0.003 (-2.335, -0.043) |
| Duración del estudio (min/seg): media ± DE | 10:09 ±04:35 | 08:57 ±03:50 | 0.060 (-0.001,0.002) |
| Limpieza gástrica adecuada: n (%) | 48 (77.42%) | 36 (58.06%) | 0.011 (0.185, 0.881) |
Al analizar los puntajes de visibilidad de la mucosa gástrica por área, el grupo B obtuvo peores puntajes en todos los segmentos excepto en el cuerpo proximal (Tabla 2).
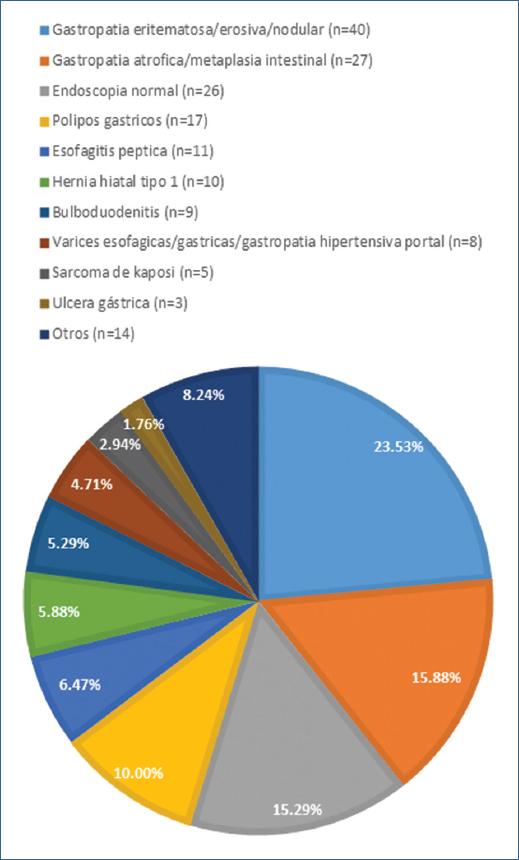
En cuando a los diagnósticos endoscópicos estos se presentaron en más de un paciente y fueron los siguientes: gastropatía eritematosa/erosiva/nodular (n=40, 23.53%), gastropatía atrófica/probable metaplasia intestinal (n=27, 15.88%), endoscopia normal (n=26, 15.29%), pólipos gástricos (n=17, 10.00%), esofagitis péptica (n=11, 6.47%), hernia hiatal tipo 1 (n=10, 5.88%), bulboduodenitis erosiva/inespecífica (n=9, 5.29%), varices esofágicas/gástricas/gastropatía hipertensiva portal (n=8, 4.71%), sarcoma de Kaposi (n=5, 2.94%), ulcera gástrica (n=3, 1.76%) y otros (n=14, 8.24%) (Grafica 1).
De las EGD realizadas en el 53.23% (n=66) fueron con cap, 33 pacientes en el grupo A y 33 pacientes en el grupo B. En la mayoría de los procedimientos se tomaron biopsias para estudio histopatológico (n=78, 62.9%) sin diferencias significativas entre ambos grupos (p=0.305). Tampoco se encontró diferencia estadísticamente significativa en cuanto a la duración de la EGD (p=0.060) y no se reportaron eventos adversos relacionados con la premedicación en ninguno de los grupos.
Discusión
La limpieza de la mucosa de tubo digestivo superior es determinante para una adecuada evaluación de la mucosa del tubo digestivo. Como se sugiere en algunos consensos y posicionamientos en calidad de endoscopia superior15-16 el uso de agentes mucolíticos y antiespumantes como la simeticona previo al procedimiento endoscópico es una estrategia adecuada para mejorar dicha limpieza. En nuestro trabajo encontramos que la premedicación con 100 mg de simeticona en 50 ml de agua fue inferior para mejorar la visibilidad de la mucosa global y gástrica cuando se comparó con 100 mg de simeticona en 100 ml de agua, nuestros resultados no mostraron eventos adversos en ninguno de los dos grupos ni diferencias en cuanto a tiempo de procedimiento ni toma de biopsias. Además, cuando se evaluó la limpieza por áreas del estómago el área de peor visualización de la mucosa gástrica fue el cuerpo proximal. Chang y colaboradores encontraron que con NAC el cuerpo gástrico también presentó peor limpieza gástrica10 por lo que pareciera que el cuerpo del estómago se debe revisar de manera intencionada con mayor detalle.
Consideramos que a pesar de ser un estudio aleatorizado y controlado nuestro trabajo tiene algunas limitaciones, estas incluyen que los procedimientos se realizaron por endoscopistas en entrenamiento, la evaluación de la limpieza gástrica se realizó por un solo investigador y no se cuantificó el agua utilizada para lavar la mucosa. También vale la pena mencionar que nuestro Hospital es un hospital oncológico de tercer nivel y que a pesar de que se excluyeron pacientes con cáncer en tubo digestivo superior estos pacientes podrían padecer otras condiciones que afectaran el vaciamiento y la limpieza gástrica.
Por no ser parte de los objetivos del trabajo no se reportaron los diagnósticos histopatológicos por lo que no se pudieron evaluar las lesiones premalignas.
A pesar de sus limitaciones, este trabajo tiene relevancia ya que es de los pocos que evalúa la cantidad de agua en la que se diluye la simeticona para evaluación de limpieza de tubo digestivo alto global, gástrica y por área del estómago en EGD diagnósticas en población mexicana. Además utilizamos una escala que no incluye la cantidad de agua irrigada y evitamos el uso de simeticona en el frasco de agua y bomba de irrigación lo que mantiene los canales de irrigación del endoscopio limpios18.
Por otro lado, se podría pensar que el uso de dispositivos como cap modificaría la visión endoscópica y por lo tanto la evaluación de la limpieza de la mucosa. En nuestro trabajo la mitad de los procedimientos se realizaron con cap, siendo el mismo número de endoscopias por cada grupo, por lo que consideramos que este factor no afectó los resultados de los puntajes de limpieza gástrica.
De acuerdo a nuestros resultados parecería que la cantidad de agua en la que se diluye el agente antiespumante está relacionada con la mejoría de la limpieza y que utilizar 50 o 100 ml de agua no se relacionó con la presencia de eventos adversos ni con aumento en el tiempo del procedimiento o con la toma de biopsias.
En conclusión, el uso de premedicación con 50 ml de agua y 100 mg de simeticona fue inferior para obtener una adecuada limpieza de la mucosa de tubo digestivo superior cuando se comparó con un volumen de 100 ml de agua y 100 mg de simeticona sin cambios en cuanto a eventos adversos, duración del procedimiento ni en la toma de biopsias.











 nueva página del texto (beta)
nueva página del texto (beta)