Introducción
Desde la primera descripción de acalasia en 1964 de Sir Thomas Willis, se han identificado las causas de la misma1. Acalasia deriva del griego Khalasis, que se traduce “sin relajación”. Una definición histórica de acalasia es la incapacidad del esfínter esofágico inferior para relajarse en ausencia de peristalsis2. La acalasia se caracteriza por relajación del esfínter esofágico inferior alterada, ausencia de contracciones peristálticas propagadas normalmente, en ausencia de anomalías estructurales que lo expliquen3.
Se han definido 3 subtipos de acalasia, con distintas implicaciones pronósticas y terapéuticas4,5. La acalasia tipo 1 se define como un IRP mayor a 15mmHg y 100% peristalsis fallida. Acalasia tipo 2 se define como un IRP mayor de 15 mmHg, no peristalsis normal y panpresurización esofágica en al menos 20% de los tragos; y acalasia tipo 3 como un IRP mayor de 15mmHg, no peristalsis normal y contracciones rápidas o prematuras (espásticas) en al menos 20% de los tragos6,7.
La máxima progresión de acalasia del cardias conlleva una dilatación masiva del esófago con desviación de su eje y tortuosidad, resultando en esófago sigmoideo o tortuoso. Por lo anterior comentado, la acalasia en etapa terminal se define como la acalasia que cursa con un esófago sigmoideo y corresponde a 5%-10% de los casos8.
La etiología de la acalasia es desconocida y existen publicaciones que intentan elucidar el defecto neurológico en acalasia mediante los hallazgos histopatológicos típicos (fibrosis, ausencia de células ganglionares y grados variables de inflamación); sin embargo, las descripciones morfológicas de la enfermedad son limitadas y todos los datos existentes hasta hace algunos años se obtuvieron de especímenes de esofagectomía de pacientes no respondedores a cirugía9. Actualmente es posible la realización de biopsias de la capa muscular esofágica mediante b-POEM, técnica donde se obtiene tejido de la capa muscular esofágica una vez realizada la fase de miotomía10.
El presente trabajo tiene como objetivo determinar si existe relación entre el estadio de la enfermedad y los hallazgos histopatológicos en pacientes con acalasia tratados por miotomía peroral endoscópica (POEM).
Epidemiología de la acalasia
La acalasia tiene una incidencia que varía de 0.3 a 1.63 por 100mil adultos al año. (1). Debido a la cronicidad de acalasia, la prevalencia estimada de acalasia es 9 a 10 por 100mil habitantes. En Estados Unidos, los rangos de hospitalización para acalasia dependen de la edad del paciente, variando de 0.25/100mil habitantes menores de 18 años a 37/100mil habitantes mayores de 85 años11. A pesar de que la incidencia es baja, la cronicidad de la acalasia afecta significativamente la calidad de vida, la productividad laboral y el estatus funcional comparados con la población general12.
La acalasia en etapa terminal corresponde a 5% de los casos y lamentablemente, incluso después del tratamiento, 10% progresará hacia esta etapa13, donde los pacientes pueden cursar con aspiración recurrente, estasis esofágica que llevan a ulceración, hemorragia, fistulización o perforación del cuerpo esofágico, llegando a cáncer en algunos casos14.
Etiología y patogenia de acalasia y su progresión entre subtipos
Estudios histológicos han mostrado que las neuronas mientéricas están disminuidas o ausentes en especímenes obtenidos de resección esofágica de pacientes con acalasia9.15. La causa de una reducción inicial de las neuronas inhibitorias en acalasia es desconocida: puede ser un proceso autoinmune provocado por una infección viral indolente (Ej. herpes o sarampión), en conjunto con un hospedador genéticamente susceptible16. La teoría de la autoinmunidad se apoya en que los pacientes con acalasia son más propensos a presentar enfermedades autoinmunes concomitantes y en que la prevalencia de autoanticuerpos neurales séricos es más alta que en la población general17.
El hecho de que el virus herpes simple es un virus neurotrópico con predilección por epitelio escamoso puede explicar porque se afectan casi exclusivamente el esfínter esofágico inferior y músculo esofágico. La reacción inmune aberrante contra los ganglios mientéricos se basa en la infiltración de linfocitos T citotóxicos en los ganglios mientéricos18. Estas células T poseen un repertorio de receptores y son activados de forma conjunta con los antígenos del virus herpes 119. Adicionalmente la respuesta inmune celular, los anticuerpos antineurales puede contribuir y son especialmente detectados en pacientes con un genotipo HLA específico, aquel que contiene los alelos DQA1*0103 y DQB1*060320.
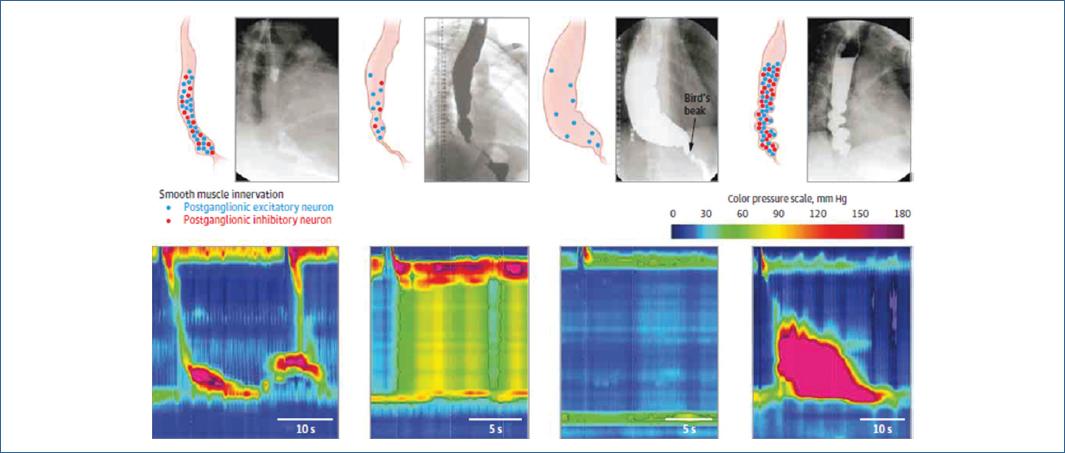
Al final, la consecuencia de la inflamación del plexo mientérico es la disfunción de las neuronas postganglionares en el esófago distal, incluyendo el esfínter esofágico inferior21,22, que resulta en desequilibrio entre el control inhibitorio y excitatorio del esfínter y el esófago esofágico inferior. Los estímulos colinérgicos desenfrenados pueden detener la relajación del esfínter esofágico inferior, hipercontractilidad del esófago distal y contracciones rápidamente propagadas en el esófago distal. La pérdida de estas neuronas resulta en las contracciones en banda aisladas del esófago y el esfínter esofágico inferior con la estimulación nerviosa y explica la ausencia de la peristalsis y de relajación del esfínter esofágico inferior en la manometría de los pacientes con acalasia23.
Con la introducción de la manometría de alta resolución, se han identificado 3 diferentes subtipos de acalasia basados en los patrones de presión del cuerpo esofágico: tipo I se caracteriza por relajación del esfínter esofágico inferior y 100% de peristalsis fallida; en el tipo II existe presurización del esófago en más del 20% de los tragos y finalmente en el tipo III existen contracciones prematuras, espásticas, en el 20% de los tragos24,25. También se desconoce el mecanismo asociado a cada tipo de Acalasia: Goldblum, et al.26 reportaron que 3 de 3 especímenes tomados de pacientes con acalasia tipo 3 tenían inflamación mientérica, pero número de células ganglionares normal (20-22 células por sección). Los 8 pacientes restantes (con acalasia tipo 1) tenían disminución o ausencia del número de células ganglionares. Lo anterior llevó a los investigadores a proponer que la acalasia tipo III pudiera corresponder a la fase más temprana de la acalasia, con preservación de la respuesta motora del cuerpo esofágico, progresando en fases posteriores a la acalasia tipo I26. Sin embargo, existen varios argumentos en contra de esta hipótesis, el más obvio es que uno de estos pacientes tenía síntomas de acalasia por 15 años sin progresión franca previa al tratamiento. De forma similar, cuando los pacientes con acalasia tipo III acorde a la clasificación de Chicago, se incluyeron en el estudio de acalasia europeo, todos persistieron con espasmo esofágico en el seguimiento27. Por lo tanto, aunque se requieren estudios prospectivos para contestar esta pregunta de forma definitiva, no existe información publicada, ni la mayor experiencia clínica, que sugiera la progresión de acalasia tipo III a tipo I o II1. Si no es representativo de una etapa temprana de la enfermedad, los pacientes representan una entidad clínica distinta, caracterizado por una respuesta inmune de menor impacto en la función neuronal, la cual no causa apoptosis28. Apoyando esta hipótesis, el cultivo de fondo gástrico humano resecado de pacientes con acalasia muestra disminución de la expresión de óxido nítrico sintetasa y sensibilidad colinérgica incrementada, sin afectar el número de neuronas29. Las liberación de citocinas (IL-8) de forma local puede inducir desequilibrio entre la función postganglionar excitatorio e inhibitoria en pacientes con acalasia tipo III. En contraste, la acalasia tipo I y II resulta de un ataque inmune citotóxico que conlleva apoptosis neuronal del plexo mientérico sin selectividad de tipos neuronales del plexo mientérico1. Mas bien, la variabilidad entre los pacientes es reflejo de la rapidez con la que esto ocurre. Goldblum, et al. reportaron que los pacientes sin infiltrado del plexo mientérico tenían duración menor de los síntomas y pérdida severa de fibras nerviosas al compararlos con los pacientes con infiltrado inflamatorio. Estos hallazgos sugieren que el tipo de respuesta inmune y la intensidad del ataque citotóxico mediado por linfocitos T, son las determinantes más relevantes de la presentación clínica de esta enfermedad. Algunos reportes muestran que la peristalsis regresa, hasta cierto punto, después del tratamiento en pacientes con tipo II, pudiendo esperar que el regreso a la peristalsis en estos pacientes tipo II indica que algunas neuronas están presentes y recuperan función normal posterior al retiro de la obstrucción en el esfínter esofágico inferior y que con el paso del tiempo, estas neuronas desaparecerán, dando lugar a la acalasia tipo I30.
Basados en todo lo mencionado previamente, se llega a la hipótesis de que dependiendo del fondo inmunogenético, la exposición previa al virus de herpes simple 1 o similares y la respuesta inmune asociado, los pacientes se pueden presentar, de forma alterna, con inflamación crónica en ausencia de pérdida neuronal (acalasia tipo 3) o con una respuesta inmune citotóxica que progresa a pérdida de neuronas entéricas (acalasia tipo 1 y 2). El tiempo de la progresión puede conducir finalmente a agangliosis y fibrosis en los pacientes, dependiendo la intensidad y el mantenimiento de la respuesta inmune inicial, y la localización de la respuesta inflamatoria puede determinar las anormalidades manométricas características31. (Figura 1).
Diagnóstico de acalasia
El diagnóstico de acalasia se realiza demostrando alteración en la relajación del esfínter esofágico inferior y ausencia de peristalsis, no asociados a estenosis, tumor, compresión extrínseca, aparatos implantados o procesos infiltrativos32 con el uso apropiado de paraclínicos33. Llegar al diagnóstico de acalasia puede ser complicado, y muchos pacientes tienen síntomas por muchos años antes del diagnóstico correcto y el tratamiento debido a la sobreposición de síntomas con la enfermedad por reflujo gastroesofágico como pirosis, dolor torácico y regurgitación. En contraste, cuando los pacientes se presentan con disfagia, se opta por descartar obstrucción mecánica de forma prioritaria con endoscopía alta o estudios de imagen y posteriormente un trastorno de motilidad esofágica2.
Endoscopia superior
La endoscopia superior con biopsias de la mucosa se debe realizar en la mayoría de los pacientes que debutan con disfagia. Esto descartará esofagitis por enfermedad por reflujo gastroesofágico, esofagitis eosinofílica, lesiones estructurales (estenosis, membranas o anillos) y cáncer esofágico o pseudoacalasia. Los hallazgos endoscópicos de un trastorno de motilidad incluyen esófago dilatado o tortuoso, impactación de alimento o lagos de líquido estancado en el esófago y la resistencia a la intubación de la unión esófago-gástrica, candidosis atribuible a la estasis esofágica y en ausencia de inmunosupresión. Sin embargo, ningún hallazgo endoscópico permite el diagnóstico de certeza de acalasia2,33.
Esofagograma
La apariencia clásica de pico de pájaro o punta de lápiz es una imagen característica y bien conocida en la medicina. Otros estudios radiográficos que sugieren trastorno de la motilidad esofágica incluyen dilatación esofágica, llenado esofágico por el contraste, apariencia de sacacorchos y aperistalsis33.
Manometría esofágica de alta resolución
En la década de 1990, Ray Clouse y sus colegas dieron nacimiento a la manometría de alta resolución al disminuir el espacio entre los sensores ubicados a lo largo del catéter de presión de la manometría convencional de 5 cm a 1 cm, aumentando el número de sensores 36 en total, los cuales se encuentran a una distancia entre ellos menor de 2 cm (5, 34). Esto permite evaluar la presión intraluminal a través de toda la extensión del esófago y en los esfínteres (Figura 2)1. El estándar de oro para el diagnóstico de trastornos motores es la clasificación de Chicago v3.05.
Se han definido 3 subtipos de acalasia, con implicaciones pronósticas y terapéuticas4,5: Acalasia tipo 1: IRP > 15mmHg y 100% peristalsis fallida. Acalasia tipo 2: IRP >15 mmHg, no peristalsis normal y panpresurización esofágica ≥20% de tragos y acalasia tipo 3: IRP >15mmHg, no peristalsis normal y contracciones espásticas en ≥20% de los tragos (Figura 3). Si no se cumplen los criterios para acalasia, se debe determinar si el trastorno motor es del tipo no acalasia, en este sentido, se puede considerar a los pacientes con obstrucción de la unión esófago gástrica como portadores de acalasia, al representar un estadio temprano24,25. En los casos en los que existe duda se deben evaluar con ultrasonido endoscópico para descartar causas mecánicas de obstrucción al tracto de salida de la unión esófago gástrica6,7.
Estadios de acalasia: acalasia no terminal y acalasia en etapa terminal
La máxima progresión de acalasia del cardias corresponde a la acalasia en etapa terminal y se define actualmente como un paciente con acalasia que tiene un esófago sigmoideo en los estudios de imagen. La progresión de la enfermedad en ausencia de cualquier tratamiento lleva a la dilatación masiva del esófago con desviación de su eje y tortuosidad resultando en esófago sigmoideo o tortuoso o esófago de etapa terminal, corresponde a 5% de los casos. Incluso después del tratamiento, 10% progresará hacia la etapa terminal de la acalasia8,13, donde los pacientes pueden cursar con aspiración recurrente, estasis esofágica que llevan a ulceración, hemorragia, fistulización o perforación del cuerpo esofágico, llegando a cáncer en algunos casos14.
La definición de esófago sigmoideo no es consistente en la literatura. Un esófago sigmoideo se define como aquel que tiene >6cm de diámetro con desviación de su eje35,36. Posteriormente se clasificó a la acalasia sigmoidea en 2 tipos basados en la tomografía: a) Sigmoideo tipo 1: El esófago se encuentra significativamente dilatado y tortuoso con una única luz. B) Sigmoideo tipo 2: El esófago está muy dilatado y tortuoso con doble lumen en la tomografía simple14.
Braghetto I. et al en 2002 describieron una clasificación acorde al grado de alteración anatómico-radiológica del esófago en pacientes con acalasia, gradando a la enfermedad en 4 estadios (Figura 4)37:
– Tipo I Precoz: trastorno motor, sintomático, sin dilatación esofágica.
– Tipo II No avanzado: con dilatación <10 cm (8 cm para otros autores revisados)
– Tipo III Avanzado: con dilatación >10 cm
– Tipo IV Avanzado: con dilatación más de 10 cm y de tipo megaesófago sigmoideo.
Sin embargo, la clasificación de Braghetto I. y colaboradores no ha sido validada en estudios prospectivos. Otra clasificación que se basa en la morfología esofágica por esofagograma es la clasificación japonesa. Esta clasificación fue descrita inicialmente en 1983 y validada recientemente por Kato Ryo y colaboradores (2019); esta distingue 3 tipos de esófago: recto (St), sigmoideo (Sg) y sigmoideo avanzado (aSg) acorde al ángulo que se forma en la interacción de 2 líneas rectas trazadas paralelas al eje mayor del esófago y el eje mayor de la parte esofágica posterior a angulación (figura 5). Se reclutaron 59 pacientes con acalasia tratados con cirugía (St n=34, Sg = 21, aSg = 4), para el análisis juntaron los pacientes en 2 grupos acorde a su morfología (sigmoideo y sigmoideo avanzado vs. no sigmoideos). Durante el seguimiento se evaluó la presencia de disfagia, resistencia al paso del endoscopio a nivel de la unión esófago-gástrica, cambios en el peso corporal y manometría esofágica. Reportaron que existe diferencia entre los meses con síntomas antes de la cirugía (St 39 (24-64) meses vs. Sg 120 (48-240) meses, p <0.01), pérdida de peso corporal (St 5 (0-8)kg vs. Sg 0 (0-2) kg, p= 0.02); sin diferencias en el diámetro transverso en el esofagograma ( St 42 (36-49) mm vs. 44 (39-50) mm, p= 0.63) ni en el IRP postoperatorio ( St n=21, IRP 10 (8-13) mmHg vs. Sg n= 8 (8-14) mmHg p= 0.86). Aunque encontraron información interesante en cuanto a la evolución de acalasia, no encontraron diferencias en el pronóstico. Sin embargo, este estudio tiene 2 limitaciones importantes: la evaluación de los síntomas no se realizó con el puntaje de Eckardt y no se realizó esofagograma cronometrado en el seguimiento38.
Histopatología y progresión entre los subtipos de acalasia
Existen muchas publicaciones que intentan elucidar el defecto neurológico en acalasia pero las descripciones de los cambios histológicos de la enfermedad son limitadas. Todos los datos existentes hasta hace algunos años se obtuvieron de especímenes de esofagectomía de pacientes con enfermedad terminal que no respondieron a cirugía9.
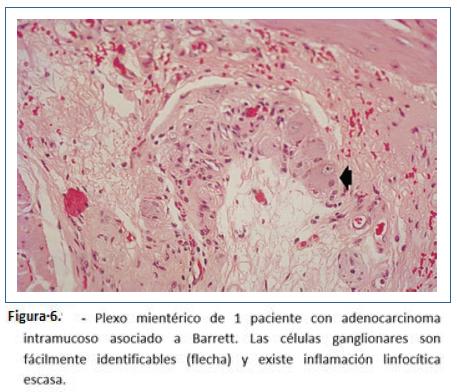
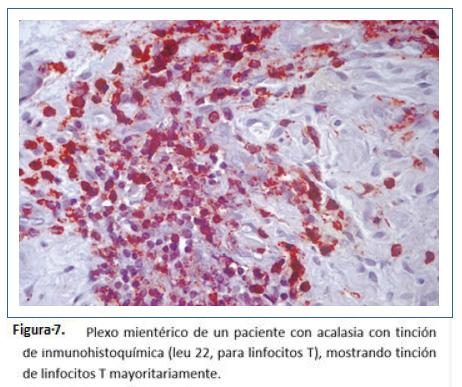
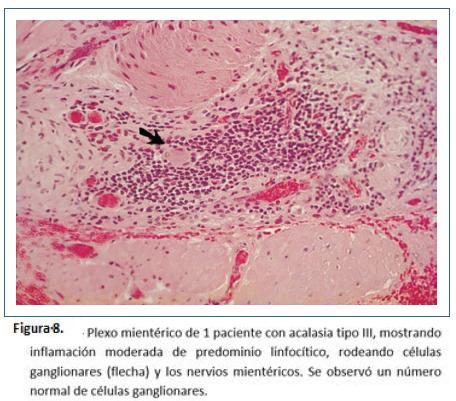
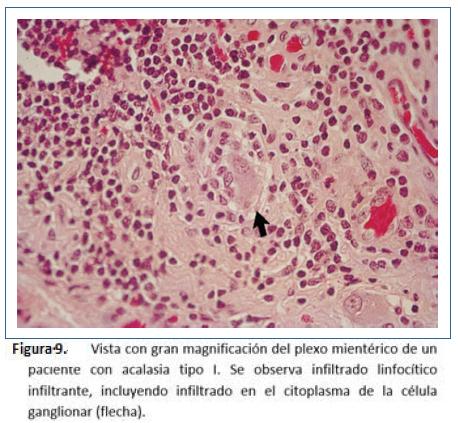
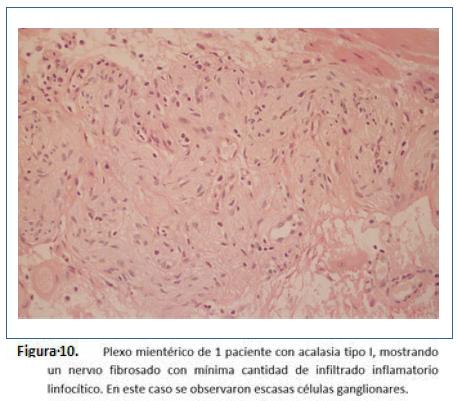
Goldblum y colaboradores en 1994 evaluaron 42 especímenes de resección esofágica por acalasia terminal. La gran mayoría de los hallazgos fueron: Depleción o ausencia total de nervios mientéricos, destrucción difusa de nervios mioentéricos o inflamación crónica mientérica variable. Sin embargo, no pudieron determinar si la inflamación causó la destrucción o es un fenómeno secundario y concluyeron que se puede aprender poco de la evolución natural de acalasia con los especímenes en etapa terminal39. Por lo anterior, realizaron otro estudio teniendo en cuenta que la esofagomiotomía incluye fibras musculares, plexo mientérico y se realiza en pacientes que no tienen acalasia terminal. Este estudio realizado entre 1993 y 1995 en la Cleveland clinic incluyeron 2 grupos: pacientes tratados con acalasia tratados por esofagomiotomía quirúrgica (n=11) vs grupo control pacientes con adenocarcinoma esofágico tratados con esofagectomía (n= 8). Durante la cardiomiotomía se realizaron cortes de miotomía de 5 mm de ancho de la muscular propia, de forma bilateral, del borde libre de la esofagectomía y de inmediato se realizó fijación en fijador de Holland y se tiñeron con hematoxilina y eosina y tricrómico de Masson; en el análisis histopatológico se buscaron: 1) presencia o ausencia de células ganglionares y número de ganglios. 2) presencia o ausencia de ganglionitis (infiltrado linfocítico dentro del citoplasma de células ganglionares). 3) presencia o ausencia de neuritis mesentérica (inflamación dentro o alrededor de nervios mientéricos: leve, moderada o severa) y 4) presencia o ausencia de fibrosis neural mientérica evaluado como leve, moderada o severa con tinción de tricrómico de Masson. En los hallazgos de patología: los 8 casos de adenocarcinoma mostraron inflamación leve o ausencia de inflamación sin infiltrado linfocitario y alrededor de 29 células ganglionares por sección (rango 19-42) y 0.7-0.9 células por campo de alto poder (figura 6). En el grupo de acalasia se observó disminución de células ganglionares en 5 pacientes (1-9 células por sección) y ausencia de células ganglionares en 2 pacientes. Todos los pacientes mostraron algún grado de inflamación mientérica (infiltrado del plexo mientérico por linfocitos n=8, por eosinófilos n= 6, por células plasmáticas y mastocitos n=2, ganglionitis n= 2) y fibrosis n= 3, destacando que los 3 pacientes con ausencia de fibrosis en nervios mientéricos tienen acalasia vigorosa (Figuras 7 a 11). De estos casos, uno de ellos corresponde a una enfermera de 49 años de edad que desarrolló acalasia rápidamente progresiva con disfagia y pérdida de peso, transcurriendo 2 meses y medio desde el inicio de síntomas a la esofagectomía. Entre sus hallazgos patológicos se encuentran un número normal de células ganglionares, inflamación mientérica compuesta de linfocitos y escasos eosinófilos, ausencia de fibrosis neural mientérica; entonces, basados en este caso concluyeron que tal vez, la inflamación mientérica, predominantemente en la forma de linfocitos T, es la característica más temprana de acalasia. Además, describieron un espectro de cambios histopatológicos que ocurren en acalasia: inflamación mientérica con lesión y pérdida subsecuente de células ganglionares, con lesión y fibrosis de nervios mientéricos, independientes de la duración de la enfermedad y que no existe relación demográfica con la presión del EEI y que en acalasia vigorosa existe un número normal de células ganglionares9.
En un estudio retrospectivo de Sodikoff J. y colaboradores, en el cual examinaron biopsias de la capa muscular propia obtenidas de 43 pacientes con acalasia sometidos a esofagectomía laparoscópica (tipo I n=20, tipo II n=20, tipo III n=03), reportaron pérdida ganglionar total en 74%, inflamación en 17%, fibrosis en 11% y atrofia muscular en 2%. Se observó mayor pérdida ganglionar total en los pacientes con acalasia tipo I respecto a pacientes con acalasia tipo III (Tipo I n=19/20 vs tipo II n= 13/20, p= 0.44) y concluyeron que la acalasia tipo I es resultado de la progresión desde la acalasia tipo II o III y que los trastornos motores constituyen un grupo heterogéneo que tienen en común la obstrucción al tracto de salida. Las limitantes de este estudio es que es retrospectivo y que tiene un número pequeño de pacientes con acalasia tipo III40.
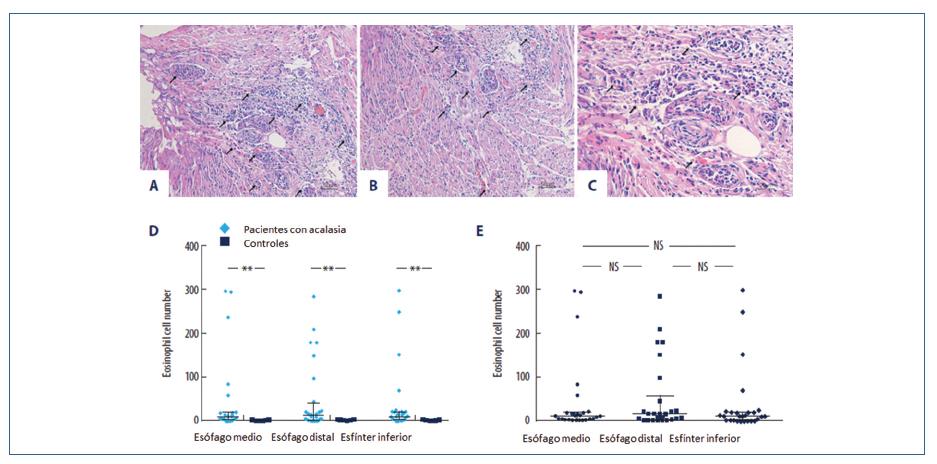
El papel de los eosinófilos en acalasia es poco claro. Tottrup y colaboradores estudiaron 9 especímenes de esofagectomía de pacientes con acalasia, encontraron infiltración por eosinófilos dentro de la muscular propia y el plexo mientérico en todos sus pacientes41.
Zhao y colaboradores realizaron un estudio en el Departamento de Gastroenterología y Hepatología, Tianjin, P.R. China, publicado el 19 de abril de 2018, donde evaluaron la presencia de eosinófilos en el músculo esofágico de pacientes con acalasia. El estudio incluyó pacientes recientemente diagnosticados con acalasia (n=28, mujeres 16, hombres 12, tipo I n= 12, tipo II n=14 y tipo III n=2); se les realizó biopsia de la capa muscular y de la capa mucosa del esófago medio, distal y en el esfínter esofágico inferior durante la miotomía peroral endoscópica y el grupo control fueron pacientes sometidos a esofagectomía debido a adenocarcinoma esofágico (n= 9, Hombres 4, mujeres 5). Se les dio seguimiento a 1 año a los pacientes con acalasia y se les realizó nuevamente biopsias. Encontraron aumento en el número de eosinófilos en el grupo de pacientes con acalasia (figura 12), expresión de activación de eosinófilos en 85.7% de los pacientes con acalasia y ninguno en el caso de pacientes control. No hubo diferencias significativas entre el índice de Eckardt prePOEM y la distribución de eosinófilos en la capa muscular de pacientes con acalasia ni diferencias entre Eckardt entre grupos. El grado de inflamación esofágica, incluyendo el número de eosinófios, fue similar entre los subtipos I y II de acalasia, sin embargo solo hubo 2 pacientes con acalasia tipo III en este estudio. Concluyeron que la acalasia es un trastorno multifactorial y heterogéneo, considerando la acalasia con infiltrado eosinofílico como un potencial subtipo de esofagitis eosinofílica; sin embargo se requieren más estudios controlados, multicéntricos y grandes para caracterizar la etiología y patogenia de la acalasia, así como los factores que pueden influir en la respuesta a tratamientos con la miotomía peroral endoscópica42.
Toma de biopsias en acalasia en la actualidad
La toma de biopsias endoscópicas en acalasia mediante endoscopia superior convencional tiene rendimiento diagnóstico muy bajo ya que la afección en esta enfermedad no es mucosa. Sin embargo, con la endoscopia del tercer espacio es posible realizar toma de biopsias de las capas más profundas, mejorando el rendimiento diagnóstico. En un estudio realizado por Hiroki Sato y colaboradores en Japón (2016), se evaluaron 10 casos de pacientes con sospecha de trastorno eosinofílico esofágico, con el objetivo de clasificar estos trastornos. De estos 10 casos, en 4 casos no se obtuvieron eosinófilos en el epitelio, sin embargo, la manometría reveló trastorno hipercontráctil asociado, por lo que se sometió a POEM y durante el mismo se realizaron biopsias endoscópicas peroral de músculo esofágico (b-POEM), demostrando la eficacia de esta técnica al revelar infiltrado eosinofílico en la capa muscular no documentado en las biopsias tomadas mediante endoscopia convencional y concluyeron que la miotomía peroral endoscópica es un método menos invasivo para realizar biopsias de la capa muscular, permitiendo caracterizar un nuevo trastorno eosinofílico conocido como miositis eosinofílica esofágica10.
De acuerdo a lo ya comentado, existen diferencias entre los estudios para demostrar de forma consiste alteraciones histopatológicas entre los diferentes subtipos de acalasia y sobre todo si existen diferencias en cuanto al tiempo de presentación de la enfermedad desde el inicio de los síntomas, por esta razón, b- POEM representa una alternativa segura y efectiva que nos permite evaluar la histología de la capa muscular en pacientes con acalasia en diferentes estadios de la enfermedad y por lo tanto, esto nos ayudará a determinar si existe una vía común de evolución de estos pacientes o si son una sola entidad con diferentes etapas compartidas que finalmente terminarán en un daño específico común.
Justificación
La acalasia se caracteriza por relajación del esfínter esofágico inferior alterada y ausencia de contracciones peristálticas propagadas normalmente en ausencia de anomalías estructurales que lo expliquen. La etiología es desconocida pero se reconoce el daño neuronal crónico que ocasiona obstrucción al tracto de salida esofágico. La afección principal se encuentra en la capa muscular pero existe poca información acerca de los hallazgos histopatológicos de pacientes con acalasia ya que las biopsias endoscópicas convencionales no son profundas y no aportan información para la etiopatogenia de esta enfermedad. Algunos estudios demuestran distintos grados de fibrosis, inflamación y agangliosis a este nivel; sin embargo, estos trabajos han sido realizados en especímenes de esofagectomía, lo cual ha representado un sesgo al incluir solo pacientes con enfermedad en estadio avanzado.
Actualmente, gracias al desarrollo de la miotomía peroral endoscópica como tratamiento de acalasia, ahora es posible realizar biopsias de la capa muscular directamente durante el procedimiento y evaluar las biopsias en pacientes con acalasia en diferentes estadios, permitiendo determinar si existe una relación entre ambos y acorde al subtipo de acalasia, con el objetivo de mejorar el conocimiento de la enfermedad y con ello mejorar los tratamientos ofrecidos a este grupo de pacientes.
Planteamiento del problema
La acalasia esofágica es una enfermedad poco prevalente en el mundo, sin embargo, se considera que tiene mecanismos de etiopatogenia que podría compartir con otras enfermedades de origen autoinmune y actualmente se tienen pocos datos acerca de las características histológicas que se presentan en este grupo de pacientes, lo cual genera en la clínica pocas oportunidades para ofrecer un diagnóstico y tratamiento adecuados, ya que se entiende poco sobre esta enfermedad. Es por ello, que la obtención de información histológica por medio de un método de mínima invasión como b- POEM, permite evaluar su relación con las diferentes etapas de la enfermedad y determinar mejor la fisiopatología de este grupo de pacientes, lo cual nos brindará mejor información con respecto al diagnóstico potencialmente oportuno y la capacidad de poder ofrecer mejores tratamientos a este grupo de pacientes.
Pregunta de investigación
¿Cuál es la relación entre el estadio de acalasia y los hallazgos histopatológicos en pacientes postratados por POEM?
Hipótesis
H1.- Existe una relación directamente proporcional entre el estadio de la enfermedad y los cambios histopatológicos en pacientes con acalasia tratados por POEM.
H0.- No existen una relación entre el estadio de la acalasia y los cambios histopatológicos observados en pacientes tratados por POEM.
Objetivos
Objetivo general
Determinar si existe una relación entre el estadio de la enfermedad y los hallazgos histopatológicos en pacientes con acalasia tratados por POEM.
Objetivos específicos
Determinar si existen diferencia entre los hallazgos histopatológicos en biopsias de la capa muscular a nivel del esófago, unión esófago gástrica (UEG) y estómago acorde al estadio de la acalasia en pacientes tratados por el método POEM.
Determinar si existen diferencias histopatológicas intragrupo (diferencias entre estadios de la enfermedad por grupo)
Determinar si existen diferencias histopatológicas intergrupo (diferencias histológicas entre subtipos de acalasia)
Determinar si existen factores asociados al estadio de la acalasia.
Material y métodos
Tipo de estudio: Estudio de cohorte prospectiva.
Pacientes, material y métodos:
Universo del estudio:
Pacientes con el diagnóstico de Acalasia (de acuerdo a lo definido en el consenso de Chicago V3), tratados con miotomía peroral endoscópica y que se encuentren en seguimiento en el Departamento de Endoscopia Gastrointestinal del Hospital de Especialidades del Centro Médico Nacional s. XXI, entre enero 2017 y enero 2020.
Lugar de desarrollo
El estudio se realizó en el servicio de endoscopia gastrointestinal del Hospital de Especialidades UMAE CMN s XXI, en los pacientes con Acalasia sin tratamiento endoscópico o quirúrgico previo, que fueron tratados con miotomía peroral endoscópica, a quienes se les realizó biopsia de capa muscular de la unión esófago-gástrica durante la miotomía endoscópica.
Criterios de inclusión
– Hombres y mujeres mayores de 18 años.
– Pacientes con diagnóstico manométrico de acalasia acorde a Chicago V3, sin tratamiento endoscópico o quirúrgico previos.
– Pacientes que aceptan realización de miotomía peroral endoscópica (POEM).
– Pacientes que aceptan realización de biopsias de la capa muscular esofágica durante el procedimiento.
Criterios de exclusión
Cálculo de tamaño de muestra
Por la baja incidencia de la enfermedad se decide tamaño de muestra por conveniencia, con la siguiente fórmula:
Variables y escalas de medición
Se documentaron las características clínicas de los pacientes que incluyen: Edad, género, síntoma principal: disfagia, dolor torácico, regurgitación. Subtipo de acalasia: tipo 1, 2 o 3. Estadio de la enfermedad: esófago recto o sigmoideo. Variables manométricas: Presión basal del esfínter esofágico inferior, presión de relajación integral, presión máxima de relajación del esfínter esofágico inferior, porcentaje de ondas peristálticas fallidas, porcentaje de ondas con panpresurización y porcentaje de ondas prematuras. Variables histopatológicas: Número de células ganglionares, sitio con infiltrado inflamatorio: capa muscular, plexo mientérico: periganglionar (ganglionitis) o perineural (neuritis), número de linfocitos, número de eosinófilos y grado de fibrosis: leve, moderada o severa. Ver tabla 1.
Definición de variables
Variable independiente: edad, género, estadio de la acalasia, subtipo de acalasia.
Variable dependiente: histopatología de la enfermedad que incluye grado de inflamación, fibrosis, ausencia de células ganglionares (aganglionosis), eosinofilia y atrofia. Disfagia, dolor torácico, regurgitación. Presión basal del esfínter esofágico inferior, presión de relajación integrado, presión máxima de relajación del esfínter esofágico inferior, porcentaje de ondas peristálticas fallidas, porcentaje de ondas con panpresurización, porcentaje de ondas prematuras, porcentaje de ondas rápidas, porcentaje de ondas débiles y porcentaje de ondas retrógradas. Variables histopatológicas: Número de células ganglionares, sitio con infiltrado inflamatorio: capa muscular, plexo mientérico: periganglionar (ganglionitis) o perineural (neuritis), número de linfocitos, número de eosinófilos y grado de fibrosis: leve, moderada o severa.
Métodos de recolección de datos
Se registraron los parámetros clínicos, radiológicos, manométricos e histológicos de todos los pacientes con diagnóstico de Acalasia tratados con miotomía peroral endoscópica del Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez” del Centro Médico Nacional siglo XXI en una base de datos electrónica y se contó con un expediente médico por cada paciente, los cuales solo fueron manejados por el personal médico incluido en el protocolo, todo esto además de su expediente normal del hospital. Se recolectaron todos los datos de la evaluación pre-POEM y durante el procedimiento, así como los hallazgos endoscópicos, de la manometría, del esofagograma y los reportes histopatológicos.
Descripción general del estudio. Métodos
-
Evaluación pre-POEM: El diagnóstico de acalasia incluyó: Cuestionario de síntomas utilizando el puntaje de Eckardt; endoscopía superior, esofagograma cronometrado y manometría esofágica de alta resolución (MAR), tomografía abdomino-pélvica o ultrasonido endoscópico en los casos de sospecha de pseudoacalasia, para confirmar y clasificar la enfermedad utilizando los criterios de Chicago version 3.0.
Para la evaluación del estadio de la enfermedad, consideramos a los pacientes con acalasia terminal si presentan esófago sigmoideo acorde a la clasificación japonesa mediante la morfología observada en el esofagograma pre-POEM y además se documentó el tiempo de evolución desde el inicio de síntomas hasta el momento en que acude por atención médica27.
POEM: El procedimiento se realizó de acuerdo a la descripción original de la técnica por Inoue y colaboradores que incluye la revisión, incisión, tunelización, miotomía total de la unión esófago-gástrica y 2-3cms de la porción gástrica y cierre con clips. Para el procedimiento se utilizaron endoscopios marca Fujinon EG-590WR o EG-600WR, a los cuales se les añadió un pequeño capuchón de plástico durante el procedimiento. Se realizó con CO2 y en la sala de endoscopía convencional bajo anestesia general. Se documentaron las características del procedimiento y la existencia de potenciales eventos secundarios.
Toma de biopsias B-POEM: Previo al cierre endoscópico se realizó la toma de biopsias utilizando una pinza estándar (Boston Scientific, USA): 2 biopsias de estómago, 2 de la unión EG y 2 de esófago distal en los últimos 5cms de la unión EG sobre la capa circular interna (Figura 13). Esas muestras de tejido se colocaron en formol y fueron enviadas al laboratorio de Patología donde se procesaron, fijaron y tiñeron con hematoxilina y eosina para visualizar sitio y tipo de infiltrado inflamatorio, células ganglionares y tricrómico de masón para evaluar grado de fibrosis al visualizarla al endoscopio por un patólogo experto.
Los datos se recabaron mediante hojas de cálculo del programa Excel (Microsoft 2016) y los datos se analizarán con el programa estadístico SPSS versión 22.
Análisis de datos
Se consideró un universo de pacientes con acalasia sin tratamiento endoscópico o quirúrgico previos, tratados con miotomía peroral endoscópica, a quienes se les realizó biopsia de unión esófago-gástrica durante el procedimiento y que se encuentran en seguimiento en el Departamento de Endoscopia Gastrointestinal del Centro Médico Nacional Siglo XXI, con una heterogeneidad del 50%, con un margen de error del 10% y con nivel de confianza del 95%.
Las variables cuantitativas con distribución normal se expresaron con media y desviación estándar, aquellas con libre distribución con mediana (rangos intercuartílicos), las variables nominales con porcentaje.
Las variables cuantitativas de distribución normal se analizan con la prueba estadística para demostrar diferencia entre tres grupos (ANOVA). Las variables cualitativas dicotómicas se analizan con X2. Para expresar las variables demográficas se utilizó estadística descriptiva.
Se analizó la asociación entre el estadio de la acalasia y su correlación con los hallazgos histopatológicos como objetivo primario y además se analizó la relación entre los resultados histopatológicos, tipo de acalasia y características demográficas. Se utilizó el programa de análisis estadístico Excel 2019, perteneciente a la gamma de Microsoft Office para Windows y el programa de análisis estadístico SPSS v. 22 de IBM.
Consideraciones éticas
El protocolo fue evaluado por el comité local de investigación del hospital y está sujeto a las normas específicas para este tipo de estudios: reglamento de la Ley General de Salud en materia de investigación para la Salud y con la Declaración de Helsinki, así como a las normas e instructivos institucionales en materia de investigación científica. Antes de iniciar el protocolo, este fue aprobado por el Comité Local o Nacional de investigación y posteriormente se registró en la página cliialtrials.com, una vez que se obtuvo el registro institucional. Todos los pacientes y sus representantes legalmente autorizados proporcionaron el consentimiento informado por escrito con las firmas correspondientes previa explicación amplia en que consiste el procedimiento, así como también de los riesgos y beneficios. Esto se realizó por parte de un médico residente que no tiene ninguna relación con el estudio presente y que estuvo encargado de realizar esta explicación en un ambiente adecuado para este fin. Una vez resueltas todas las potenciales dudas acerca de la participación en el estudio, se procedió a la firma del mismo (Anexo 1).
Es importante mencionar que todos los medicamentos utilizados están incluidos en el cuadro básico del IMSS; los accesorios y el equipo utilizado forman parte de los servicios integrales que tiene el instituto para otorgar atención a nuestros derechohabientes en la realización de los diferentes estudios endoscópicos.
La miotomía peroral endoscópica ha demostrado su eficacia y seguridad en otros estudios, con tasas de éxito similares a las de la miotomía de Heller. Durante la miotomía peroral endoscópica se realizó toma de biopsias de la capa muscular a nivel gástrico, de unión esófago-gástrica y de esófago para caracterizar los hallazgos histológicos en búsqueda de relación entre el estadio de acalasia anatómico patológico y los subtipos de acalasia. Lo anterior con la finalidad de generar conocimiento que pueda ayudar a futuras investigaciones de la etiología de acalasia, hasta ahora desconocida, para poder diseñar un tratamiento etiológico definitivo y no condiciona mayor riesgo que en el paciente que se somete a miotomía peroral endoscópica y no se le realizan biopsias de la capa muscular esofágica. De esta manera se considera un beneficio mucho mayor que el riesgo del procedimiento. Sin embargo, de acuerdo al artículo 17 de la Ley General de salud se considera como una investigación con un riesgo mayor al mínimo por el tipo de procedimiento a realizar con un balance positivo a favor del beneficio con respecto al riesgo del mismo y además se contó con válvula de seguridad ante cualquier eventualidad o complicaciones durante el procedimiento: los pacientes fueron tratados en nuestro hospital, para esto existió un contacto directo con los servicios de admisión continua, gastroenterología, medicina interna, cirugía general, terapia intensiva o cualquier otro servicio necesario en caso de presentarse algún tipo de complicación. Cabe mencionar, que este procedimiento ha demostrado ser seguro y eficaz, con una tasa de riesgos mínima, sin embargo, nosotros al realizar la toma de biopsias durante la miotomía peroral endoscópica, dejamos hospitalizado al paciente para su evaluación integral posprocedimento 48 a 96hrs como mínimo previo egreso. Sin embargo, en caso de presentarse algún evento adverso posterior, los pacientes tuvieron contacto con los investigadores y pudieron acudir a cualquier hora al servicio de admisión continua del hospital donde estará el servicio de gastroenterología las 24hrs enterado de los participantes en este estudio y se brindó la atención necesaria.
Se cuidó la confidencialidad de los participantes para el manejo de los datos en informes, tesis y/o publicaciones que deriven de este proyecto de investigación. Para la protección de identidad, cada paciente se identificó por su número de afiliación y una numeración consecutiva según la fecha de ingreso al estudio. El manejo de los datos fue de uso exclusivo por los investigadores participantes, por lo cual aseguramos que los resultados obtenidos del estudio son estrictamente confidenciales y de uso exclusivamente académico.
Si el paciente no acepta participar en nuestro protocolo se otorgó la misma atención que normalmente se realiza en estos casos por parte del instituto y se brindaron las herramientas médicas o quirúrgicas necesarias para su tratamiento sin ningún tipo de coerción o limitación para ello por parte de los investigadores.
Al final del procedimiento toda esta información estará de forma pública en el portal de clinicaltrials.com y en cualquier momento que el paciente lo solicite tiene la posibilidad de que le informemos acerca de los resultados del protocolo de investigación que estamos realizando.
El presente estudio se apegó a lo establecido en:
– REGLAMENTO de la Ley General de Salud en Materia de Investigación para la Salud.
Recursos, financiamiento y factibilidad
Recursos humanos
MÉDICOS
– Dr. Oscar Víctor Hernández Mondragón: Jefe de Servicio del departamento de Endoscopia Gastrointestinal, Médico gastroenterólogo y especialista en endoscopía especializada, así como en modelos biológicos, adscrito al servicio de endoscopia del Hospital de Especialidades UMAE CMN Siglo XXI.
– Dra. Marina González Martínez. Médico gastroenterólogo y especialista en Fisiología gastrointestinal adscrita al servicio de endoscopía del Servicio de Endoscopía del Hospital de Especialidades UMAE CMN Siglo XXI
– Dr. Omar Michel Solórzano Pineda, Médico especialista en Cirugía general, cirugía laparoscópica avanzada y Endoscopia Gastrointestinal adscrito al servicio de endoscopía del Servicio de Endoscopía del Hospital de Especialidades UMAE CMN Siglo XXI
– Dr. Enrique Alejandro Blanco Lemus, Médico especialista en Patología adscrito al servicio de Patología del Hospital de Cardiología del Centro México Nacional s. XXI.
– Dr. Raúl Antonio Zamarripa Mottú: Médico especialista en Gastroenterología cursando adiestramiento endoscópico gastrointestinal adscrito al servicio de endoscopia del Hospital de Especialidades UMAE CMN Siglo XXI.
Recursos físicos
Instalaciones del servicio de endoscopia del Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez”, Centro Médico Nacional Siglo XXI, unidad de Endoscopia.
Pacientes
Todos los pacientes incluidos son derechohabientes del IMSS y que acudieron de cualquiera de los 3 niveles de atención, con diagnóstico de acalasia y que se encuentren en evaluación y tratamiento por parte de los servicios de cirugía general, gastroenterología o medicina interna bajo tratamiento con mitomía peroral endoscópica. Se realizó una apertura de expediente en nuestra unidad para su atención integral.
Recursos Materiales
Papelería diversa
Sistema de trabajo y equipos del servicio de endoscopía. El equipo de endoscopia es un equipo otorgado por parte de los servicios integrales con los que cuenta el hospital por lo cual no hubo necesidad de solicitar otro tipo de equipamiento especial.
Se utilizó una computadora que forma parte del servicio de endoscopia y donde se integraron las bases de datos de los pacientes de este protocolo.
Máquina de anestesia y monitoreo continuo durante el procedimiento: electrocardiograma, tensión arterial no invasiva, oximetría de pulso, por el servicio de Anestesiología.
Recursos financieros
Se emplearon los servicios integrales contratados por el instituto para la realización de las miotomías endoscópicas y para el procesamiento y análisis de biopsias obtenidas. Estos se emplean de manera cotidiana para la realización de los estudios complementarios y de seguimiento de los pacientes en la unidad. Por lo anterior no se destinaron recursos financieros especiales para el estudio.
Factibilidad
El estudio es factible en nuestra unidad debido a que somos un centro de referencia, contamos con todos los recursos necesarios para llevar acabo cualquier tipo de procedimiento con los cuidados necesarios y el control adecuado para cualquier procedimiento terapéutico. Además, observamos un promedio de 5 pacientes mensuales por esta patología lo cual hace que la factibilidad del procedimiento sea correcta.
Resultados
Se reclutaron un total de 42 pacientes con diagnóstico de Acalasia que fueron tratados con miotomía peroral endoscópica en el departamento de Endoscopia Gastrointestinal del Hospital de Especialidades del Centro Médico Nacional Siglo XXI del 01 de enero de 2017 al 01 de Enero de 2020, que cumplieron los criterios de inclusión. De estos, se eliminaron 4 pacientes debido a que no fue posible tomar las biopsias durante el procedimiento como se observa en la figura 14. Se incluyeron 38 pacientes (15 mujeres y 23 hombres), edad 52 ± 15años. El tipo de acalasia más frecuente es el tipo 2 en 74% (n=28), la presión basal del esfínter esofágico inferior fue de 34.66 ± 13.17mmHg, el IRP de 32 ± 11.4mmHg/s y un puntaje de Eckardt de 7 (6-9) puntos. El síntoma principal fue disfagia en 80% (n=30) y el tiempo desde el inicio de síntomas hasta diagnóstico de acalasia de 24 (10.5-64.5) meses. Las características basales de la población se resumen en la tabla 2.
En cuanto a la morfología esofágica: el diámetro esofágico fue de 4 ± 1.37 cm y el estadio radiográfico acorde a la clasificación japonesa más frecuente fue recto en 84% (n=32), con acalasia terminal en 16% (n=6, sigmoideo 5, sigmoideo avanzado 1) de los casos.
El hallazgo histopatológico respecto al estadio de acalasia (tabla 3) más frecuente es la ausencia de células ganglionares (agangliosis) en los 3 niveles donde se obtuvieron las biopsias, sin significancia estadística e independientemente si el paciente tiene esófago recto o sigmoideo (porción esofágica: recto n=26 (81.25%) vs. sigmoideo n=6 (100%), p = 0.84, porción unión esófago-gástrica: recto n= 29 (90.62%) vs. sigmoideo n= 6 (100%), p= 0.22 y porción gástrica: recto n= 30 (93.75%) vs. sigmoideo n= 6 (100%), p= 0.68). Otros hallazgos encontrados fueron 4 casos aislados de fibrosis (porción esofágica: recto n=1 (3.28%), porción unión esófago-gástrica (recto n=1 (3.28%) vs. sigmoideo n= 1 (16.6%), p = 0.29) y porción gástrica (recto n=1 (3.28%)) y 3 casos con algún grado de inflamación (esófago recto porción esofágica n= 1(3.28%), porción gástrica: recto n=1 (3.28%) vs. sigmoideo n=1 (16.6%), p= 0.29). Hubo 1 paciente con esófago recto que no mostró ninguna alteración en las biopsias nivel de UEG.
En cuanto a los hallazgos histopatológicos y el tipo de acalasia (tabla 4), el hallazgo más frecuente fue nuevamente la ausencia de células ganglionares en los 3 niveles pero sin significancia estadística entre los tipos de acalasia (porción esofágica: Tipo I n= 6 (100%) vs. tipo II 27 (96.4%) vs. tipo III n=4 (100%), p= 0.83), UEG: Tipo I n=5 (83.3%) vs. Tipo II n= 27 (96.4%) vs. tipo III n=4 (100%), p= 0.22) y gástricas: Tipo I n= 6 (100%) vs Tipo II n= 29 (92.8%) vs Tipo III n= 4 (100%), p=0.68). Otros hallazgos menos frecuentes pero interesantes y que solo ocurren en pacientes con acalasia tipo II son: fibrosis (porción esofágica n= 1 (3.5%), UEG n= 2 (7.1%), gástrica n= 1(3.5%)) e inflamación (porción gástrica n= 2 (7.1%). Hubo 2 pacientes que no mostraron alteración histológico a nivel de porción UEG (tipo I n=1 y tipo II n= 1).
Investigando si existen factores asociados a estadio de la enfermedad se compararon las características basales de los pacientes con la morfología esofágica (tabla 5), encontrando menor presión basal del EII en los pacientes con esófago sigmoideo con significancia estadística (todos 34.66 ± 13.17 mmHg, esófago recto 37.2 ± 12.5 mmHg vs esófago sigmoideo 21.0 ± 6.32 mmHg, p= 0.004). No se observa significancia estadística al comprar estadio de acalasia con género (p= 0.219), edad (p= 0.807), tipo de acalasia (p=NS), IRP (p=0.33), puntaje de Eckardt (p=0.469), síntoma principal (p=NS), tiempo desde inicio de síntomas hasta diagnóstico (p=0.83) y diámetro esofágico (p=0.52).
Al comparar las características basales de los pacientes con el tipo de acalasia (tabla 6) se observa que existe diferencia intergrupo en el IRP, siendo menor en los pacientes con acalasia tipo 1 (Tipo I 20.21 ± 8.48 vs. Tipo II 34.65 ± 10.94 vs. Tipo III 31.65 ± 8.37, p= 0.01) y en el diámetro esofágico que es menor en el grupo de acalasia tipo 1 ( Tipo I 3.16 ± 1.50cm vs. Tipo II 4.24 ± 1.19cm vs. Tipo III 3.8 ± 0.81cm, p= 0.02). No se observa significancia estadística al comparar tipo de acalasia con género (p= 0.32), edad (p=0.06), síntoma principal (p=0.67), tiempo desde inicio de síntomas hasta diagnóstico de acalasia (p=0.27) y estadio de acalasia (p=0.7).
Discusión
Nuestro trabajo de investigación es uno de los pocos estudios realizados en esófagos humanos in situ, ya que analizamos los hallazgos de sujetos con diferentes estadios de acalasia y con todos los tipos de la misma, a quienes se les realizó biopsias durante la miotomía peroral endoscópica. Nuestro objetivo primario fue determinar si existe relación entre los hallazgos histopatológicos en biopsias de la capa muscular respecto al estadio de la enfermedad y demostramos que ningún hallazgo histológico es característico de la acalasia en estadio terminal ni guarda relación con el tipo de acalasia a diferencia de lo reportado previamente en la literatura.
El amplio espectro de cambios histopatológicos que ocurren en acalasia reportados en la literatura (inflamación mientérica con lesión, pérdida subsecuente de células ganglionares, con lesión y fibrosis de nervios mientéricos)9 ha llevado a proponer que la acalasia puede ser una enfermedad progresiva, catalogando a la acalasia tipo III como la fase más temprana y la acalasia tipo II y tipo I como las fases más tardías19,24,40. La máxima progresión de acalasia del cardias corresponde a la acalasia en etapa terminal, definida como aquella acalasia que cursa con un esófago sigmoideo (>6cm de diámetro con desviación de su eje)8,13,35,36. La clasificación japonesa distingue 3 tipos de esófago: recto (St), sigmoideo (Sg) y sigmoideo avanzado (aSg) basado en la morfología esofágica en el esofagograma baritado38 y fue la que utilizamos para definir a los pacientes con acalasia terminal y analizar su relación con los hallazgos histológicos.
Goldblum y colaboradores realizaron un estudio donde compararon los hallazgos de pacientes con acalasia en etapa temprana (n=11, acalasia clásica n=8, acalasia vigorosa n=3) tratados con esofagomiotomía quirúrgica y reportaron que el número de células ganglionares es inversamente proporcional con el grado de fibrosis neural mientérica (p<0.001) basados en que 100% (8/8) de sus pacientes con acalasia clásica tenían disminución o ausencia del número de células ganglionares y 100% (3 /3) de pacientes con acalasia vigorosa tenían inflamación mientérica y número de células ganglionares normal9. En nuestro estudio diferimos de esta conclusión ya que encontramos agangliosis en la mayoría de los pacientes con acalasia, sin evidencia de que predomine la fibrosis en acalasia terminal ni en acalasia tipo I y tampoco encontramos predominio de inflamación en la acalasia no terminal ni en acalasia tipo III. Esto puede estar relacionado con la diferencia tamaño de muestra de ambos estudios (nosotros n=38 vs. Goldblum y cols. n=11) y a la clasificación manométrica actual de acalasia, ya que se utilizó manometría convencional en el estudio mencionado y en el presente estudio utilizamos manometría de alta resolución y nos basamos en la clasificación de Chicago V3. En otro estudio publicado más recientemente por Sodikoff J. y colaboradores donde se examinaron biopsias de pacientes con acalasia tratados con esofagectomía laparoscópica (n= 43: tipo I n=20, tipo II n=20, tipo III n=03), observaron mayor pérdida ganglionar total en los pacientes con acalasia tipo I (Tipo I n=19/20 vs tipo II n= 13/20, p= 0.44) y concluyeron que la acalasia tipo I es resultado de la progresión desde la acalasia tipo II o III40. Este estudio retrospectivo tiene un número pequeño de pacientes con acalasia tipo III y no analizaron al subgrupo de pacientes con acalasia terminal, lo que puede explicar las diferencias entre su conclusión y los hallazgos de nuestro estudio.
Dentro de nuestro estudio también analizamos la relación que existe entre las características basales de los pacientes evaluados, el estadio y el tipo de acalasia. Encontramos que la presión basal del esfínter esofágico inferior es menor en los pacientes con esófago sigmoideo respecto a pacientes con esófago recto, que el IRP es menor en pacientes con acalasia tipo I y el diámetro esofágico es mayor en acalasia tipo II; sin embargo, desconocemos la importancia clínica de estos hallazgos y es necesario continuar con el seguimiento de estos pacientes para elucidar su posible impacto en la historia natural de la enfermedad. Por otro lado, no encontramos significancia estadística respecto a género, edad, puntaje en escala de Eckardt, síntoma principal, tiempo desde inicio de síntomas hasta diagnóstico de acalasia ni diámetro esofágico, por lo que no pudimos establecer factores asociados al estadio de acalasia; a diferencia de lo reportado por Kato Ryo y colaboradores en su estudio, donde analizaron pacientes con acalasia tratados con cirugía (n= 59: St n=34, Sg = 21, aSg =4) en 2 grupos acorde a su morfología (sigmoideo y sigmoideo avanzado vs. no sigmoideos). Encontraron diferencias estadísticamente significativas entre la edad (St 38 (26,46) años vs Sg 56 (39-68) años, p <0.01), los meses con síntomas antes de la cirugía (St 39 (24-64) meses vs. Sg 120 (48-240) meses, p <0.01), pérdida de peso corporal (St 5 (0-8)kg vs. Sg 0 (0-2) kg, p= 0.02); sin diferencias en el diámetro transverso en el esofagograma ( St 42 (36-49) mm vs. 44 (39-50) mm, p= 0.63) ni en el IRP postoperatorio ( St n=21, IRP 10 (8-13) mmHg vs. Sg n= 8 (8-14) mmHg p= 0.86) (38). Sin embargo, este estudio tiene la importante limitación de que la evaluación de los síntomas no se realizó con el puntaje de Eckardt que podría explicar las diferencias entre sus hallazgos y los nuestros acorde a los síntomas.
Aunque nuestro estudio tiene un tamaño de muestra pequeño, creemos que es debido a la baja prevalencia de la enfermedad a nivel mundial y debido a que el estudio se desarrolla en un centro de referencia nacional con experiencia en endoscopia terapéutica endoluminal (tercer espacio), pudiera reflejar la prevalencia de la enfermedad en nuestro país. Este trabajo contribuye a corroborar y reforzar el conocimiento que se tiene en la literatura mundial.
Una limitante de nuestro estudio es que fue realizado en un único centro, esperamos que en un futuro se puedan ampliar los hallazgos encontrados mediante la realización de un estudio multicéntrico.
Conclusiones
Los pacientes con acalasia tienen amplio espectro de cambios histopatológicos (agangliosis, fibrosis, grados variables de inflamación) en la capa muscular de la unión esófago-gástrica; no obstante, no existe relación entre estos hallazgos, el estadio ni el tipo de acalasia.
A pesar de que el esófago sigmoideo se asocia a menor presión basal del esfínter esofágico inferior respecto a pacientes con esófago recto (recto 37.2 ± 12.5 mmHg vs. sigmoideo 21.0 ± 6.32, p= 0.004) y la acalasia tipo I se asocia a IRP menor y diámetro mayor respecto a acalasia tipo 2 y 3, se necesitan más estudios para elucidar el posible impacto que tienen estos hallazgos en la historia natural de la acalasia.











 nova página do texto(beta)
nova página do texto(beta)