Introducción
En enero de 2020, la Organización Mundial de la Salud (OMS) declaró la enfermedad por coronavirus 2019 (COVID-19) como emergencia de salud pública y el 11 de marzo como un estado de pandemia1.
En junio del 2020 se sobrepasaron los 6,000,000 de casos, con al menos 375,000 fallecidos, lo que refleja la gravedad del impacto mundial2.
El conocimiento sobre el coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2), el cual provoca la enfermedad, es limitado debido a su reciente aparición, sin embargo se ha establecido que es altamente transmisible, cada portador puede infectar al menos tres personas más, por lo que se recomienda el distanciamiento social como forma de prevención1,3.
El SARS-CoV-2 se puede adquirir por contacto directo o de forma indirecta por contacto con superficies y objetos1,4.
La pandemia ha traído retos que los sistemas de salud han tenido que enfrentar, entre ellos destacan el riesgo de infección en trabajadores de la salud, escasez de equipos de protección personal (EPP) y saturación de camas en las unidades de cuidados intensivos, entre otros, que han expuesto carencias a nivel mundial4,5.
La mayoría de los países implementaron medidas de confinamiento para enlentecer el pico de incidencia de COVID-19, evitando así la sobrecarga de los servicios de salud; en el caso de la endoscopia, la mayoría de las sociedades suspendieron procedimientos electivos para evitar la propagación del virus, atendiendo exclusivamente emergencias y casos oncológicos5-7.
En EE.UU. la suspensión de endoscopia retrasaría el diagnóstico de más de 2,800 casos de cáncer colorrectal y 22,000 pólipos con displasia de alto grado, aumentando la tasa de mortalidad a seis meses en un 6.5%. Considerando que hay más de 600,000 portadores de cirrosis, se estima que más de 1,500 presentarán un sangrado variceal8.
Ante la falta de evidencia, la mayoría de las sociedades basan recomendaciones en opiniones de experto, donde incluyen la implementación de tamizaje por COVID-19 previo al estudio y con base en los resultados modificar el uso de EPP, o diferir en casos positivos6-8.
Repici, et al. evaluaron la incidencia de COVID-19 en pacientes y personal de salud con uso adecuado de EPP, concluyendo que el riesgo de infección es bajo9.
El presente estudio tiene como objetivo conocer la perspectiva de los endoscopistas respecto al reinicio de endoscopia electiva en tiempos de COVID-19.
Pruebas de detección de SARS-CoV-2
Léase: La confirmación diagnóstica de SARS-CoV-2 es mediante detección de ARN viral por reacción en cadena de la polimerasa en tiempo real (RT-PCR)10-13. Otros métodos de detección se basan en la tecnología CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)-Cas14 o en amplificación isotérmica, pero su uso no es tan extendido15.
La muestra de elección es el hisopado nasofaríngeo, aunque los protocolos pueden adaptarse a otras muestras como lavados broncoalveolares16. Algunos estudios han utilizado saliva como muestra, ya que es de fácil obtención y permite detectar ARN viral por más tiempo17,18. Sin embargo, otros estudios sugieren lo contrario al evaluar una población extrahospitalaria15. Además, los métodos de obtención de la saliva no son homogéneos, lo cual podría explicar las diferencias encontradas. La utilización de esta muestra deberá estandarizarse antes de aplicarse de forma sistemática19.
La alternativa diagnóstica es la detección sérica de anticuerpos IgM e IgG. Se han desarrollado inmunoensayos enzimáticos, que permiten la detección y cuantificación relativa20-22. También se han desarrollado pruebas rápidas, basadas en técnicas de inmunoprecipitación de flujo lateral que brindan resultados cualitativos de presencia o ausencia de anticuerpos, que incluso pueden utilizar sangre total sin la fase previa de separación del suero23.
Existen gran cantidad de pruebas rápidas, con diferente sensibilidad y especificidad, sin embargo requieren validarse en cada población frente a las técnicas de detección de ARN viral y anticuerpos por ensayos cuantitativos antes de ser utilizadas. Algunos estudios revelan gran heterogeneidad entre ellas, además reportan variaciones dependientes de la interpretación del lector y de la etapa de la infección en la cual se aplican, lo que limita su uso24,25.
Aplicación de pruebas como criterio para reinicio de las endoscopias electivas
Con los métodos disponibles, la detección del ARN viral puede iniciar desde el día siguiente al inicio de los síntomas, siendo significativa la probabilidad a partir del día 3 y alcanzando su pico al cumplirse una semana. A partir de ese momento, la detección de ARN viral va disminuyendo, a menos que el paciente empeore su condición, ya que en una presentación clínica severa puede mantenerse por varias semanas26.
Por otro lado, los anticuerpos son detectables al iniciar la segunda semana desde el inicio de los síntomas27,28. En promedio, el rango de positivización de la IgM está entre los días 5 y 10 a partir de la presentación clínica, mientras que para la IgG el rango varía entre los días 13 y 2122. Guo, et al. demostraron positivización de IgM con un intervalo del día 3 al 6, mientras que la IgG presentó positivización entre los días 10 y 1821,22. Este trabajo se realizó en pacientes con síntomas severos, lo cual podría explicar la aparición más temprana.
La selección de la prueba depende del momento de la infección, la presentación clínica y el propósito de esta; de tal manera que la detección de ARN viral es útil como confirmación diagnóstica de infección aguda y como criterio para dar de alta a un paciente sintomático, mientras que la detección de anticuerpos es útil para comprobar infección reciente o pasada, entre otros, sin embargo ninguna prueba puede garantizar ausencia de infección en estadios muy tempranos, en los que la persona infectada ya cuenta con potencial para transmitir el virus (Fig. 1)14,15,25.

Figura 1 Variación estimada en el tiempo en las pruebas de diagnóstico para la detección de COVID-19 respecto al inicio de los síntomas. Los intervalos de tiempo estimados se basan en datos publicados en diferentes reportes, por lo cual son aproximaciones (adaptada de Ben-Assa, et al., 202016 y Wölfel, et al., 202027).RT-PCR: reacción en cadena de la polimerasa en tiempo real; IgM: inmunoglobulina M; IgG: inmunoglobulina G.
Metodología
Se realizó una encuesta (Tabla 1) en forma consensuada por parte de expertos en endoscopia con preguntas enfocadas al desarrollo de la endoscopia durante la pandemia, así como de disponibilidad de EPP y del uso de pruebas de tamizaje de SARS-CoV-2 previo a la endoscopia durante el mes de mayo 2020, la cual fue distribuida vía e-mail, mensajería instantánea y por contacto directo, obteniendo respuesta de 168 endoscopistas latinoamericanos, que la completaron en forma voluntaria y completa. Se formularon ocho preguntas, que se distribuyeron de la siguiente forma: tres sobre información del endoscopista y situación actual con respecto a la pandemia, dos acerca del uso de pruebas de tamizaje, dos sobre la disponibilidad de EPP y una acerca del reinicio de la actividad endoscópica. Con base en las preguntas se tabularon datos mediante Excel, obteniendo frecuencias simples, las cuales fueron analizadas mediante cruce de variables.
Tabla 1 Cuestionario respecto a reinicio de endoscopia en tiempos de COVID-19
| Cuestionario respecto a reinicio de endoscopia en tiempos de COVID-19 |
|---|
| 1. ¿Su práctica endoscópica la realiza en el sector: privado y/o público? |
| 2. ¿En qué país de Latinoamérica desarrolla su actividad médica? |
| 3. ¿En su país realizan pruebas de detección o tamizaje en pacientes asintomáticos (PCR o anticuerpos) previo a la endoscopia digestiva? |
| 4. ¿Considera adecuado realizar test diagnósticos de COVID -19 (PCR o anticuerpos) en pacientes asintomáticos antes de la endoscopia digestiva? |
| 5. ¿La unidad de endoscopia donde usted trabaja, cuenta con el equipo completo de protección (EPP) para atender un paciente con diagnóstico positivo de COVID-19? |
| 6. Con respecto a la pregunta anterior, el suministro de equipo de protección (EPP) de su unidad de endoscopia tiene una reserva: ¿para menos de 7 días, de 7 a 28 días, o más de 28 días? |
| 7. En relación con la COVID-19 en su comunidad (área de atracción), ¿en cuál etapa se encuentran? |
| 8. ¿Considera adecuado reiniciar gradualmente las actividades endoscópicas electivas en la unidad de endoscopia donde usted trabaja? |
COVID-19: enfermedad por coronavirus 2019; PCR: reacción en cadena de la polimerasa; EPP: equipo de protección personal.
Los resultados de la encuesta fueron manejados únicamente por los investigadores, esto con el fin de mantener la información recogida con total confidencialidad y anonimato.
Resultados
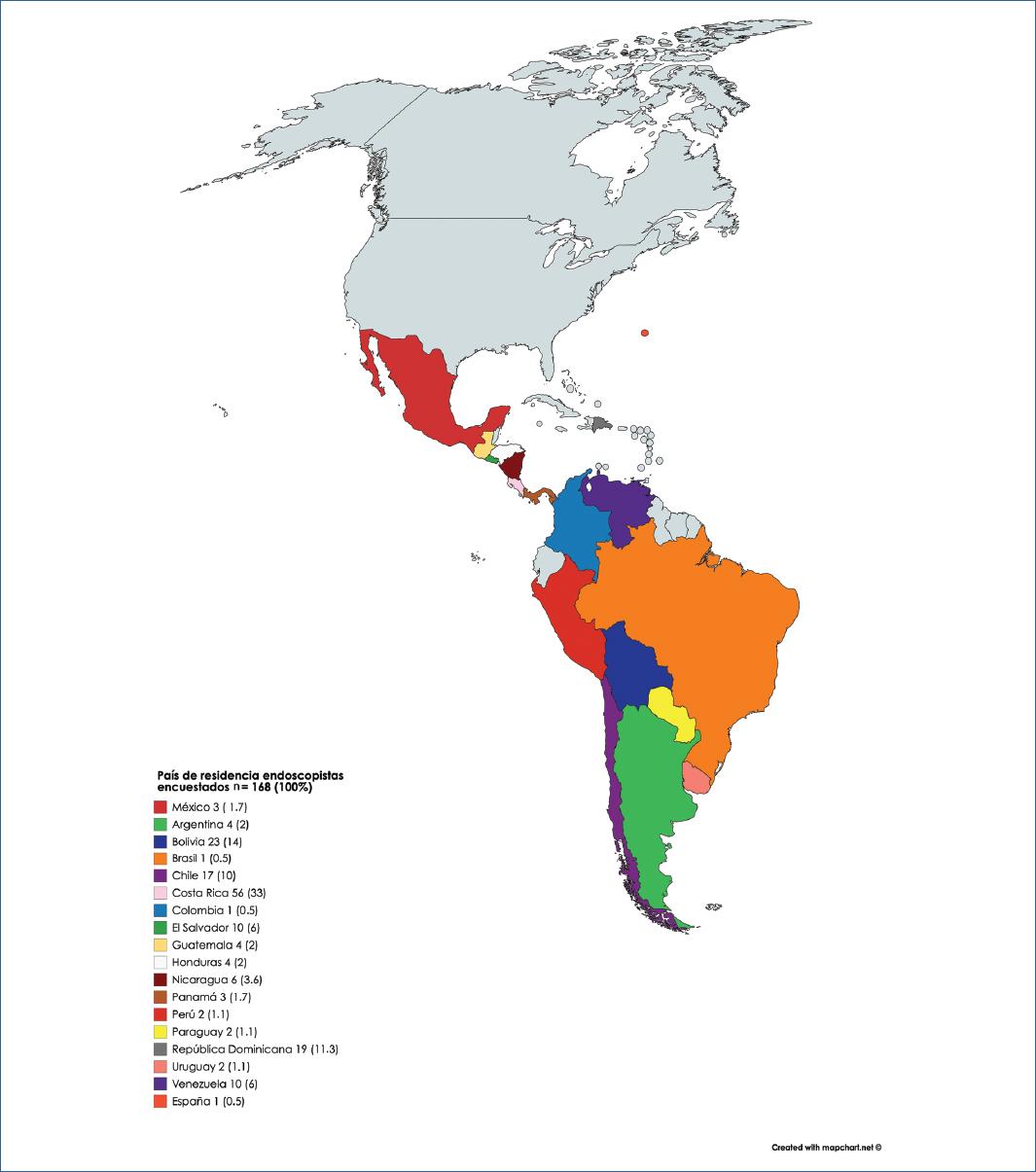
La encuesta se llevó a cabo durante el mes de mayo 2020 por un periodo de dos semanas, donde se registraron 168 participantes de 18 países, la mayoría latinoamericanos. Una tercera parte de los encuestados provenían de Costa Rica y en segundo lugar de Bolivia, con 14% de participantes (Fig. 2).
El 48% (n = 80) realizan la práctica de endoscopia digestiva tanto en el ámbito público como en el privado, mientras el 40% (n =67) únicamente ejerce a nivel privado. De acuerdo con el comportamiento epidemiológico, el 35% (n = 59) están en áreas de atracción, con rápido aumento de casos nuevos de COVID-19, representados mayoritariamente por Bolivia (23%, n = 14) y República Dominicana (20%, n = 12). Solamente el 4% (n = 8) realizan estudios endoscópicos en zonas sin casos nuevos por al menos dos semanas consecutivas, representado en un 50% de los casos por Venezuela (Tabla 2).
Tabla 2 Distribución simple de resultados de encuesta practicada a los endoscopistas
| Variable encuestada | n = 168 (%) |
|---|---|
| Tipo de práctica | |
| Privado Publico | 67 (40) |
| Publico | 21 (12.5) |
| Público y privado | 80 (47.5) |
| Tamizaje a pacientes asintomáticos | |
| No | 148 (88) |
| Sí | 20 (11) |
| Posición acerca de realización de estudio en pacientes asintomáticos | |
| No | 43 (25.5) |
| Sí | 125 (74.5) |
| Presencia de EPP en UE | |
| No | 37 (22) |
| Sí | 131 (78) |
| Tiempo de reservas de EPP | |
| 12 semanas o más | 12 (7) |
| De 4 a 8 semanas | 38 (22.6) |
| Menor a 4 semanas | 59 (35.2) |
| Menor a 7 días | 59 (35.2) |
| Etapa epidemiológica | |
| Aumento exponencial en nuevos casos | 45 (27) |
| No hay nuevos casos (por al menos 2 semanas) | 8 (5) |
| Rápido aumento de casos nuevos | 59(35.2) |
| Tendencia a la baja en nuevos casos | 56 (32.8) |
| Posición acerca de reinicio de actividades electivas en UE | |
| No | 38 (23) |
| Sí | 130 (77) |
UE: Unidad de Endoscopia; EPP: equipo de protección.
El 88% (n = 148) de los encuestados no realizan tamizaje a pacientes asintomáticos previo a una endoscopia, sin embargo el 70% (n = 127) lo consideran útil; la distribución de profesionales que llevan a cabo esta prueba se observa en la tabla 3. En cuanto al EPP completo, el 80% (n = 131) afirmaron contar con este, pero un 35% (n = 59) tienen una reserva para menos de siete días de actividad; pese a esto, un 77% (n = 130) consideran apropiado reiniciar los estudios electivos (Fig. 3).
Tabla 3 Endoscopistas encuestados que realizan pruebas de detección previo a endoscopia según país de origen
| Endoscopistas encuestados que realizan pruebas de detección previo a endoscopia según país de origen | n = 20 (%) |
|---|---|
| Bolivia | 2 (10) |
| Chile | 2 (10) |
| Costa Rica | 4(20) |
| España | 1(5) |
| Honduras | 1(5) |
| Panamá | 1(5) |
| República Dominicana | 5 (25) |
| Perú | 1(5) |
| Uruguay | 1 (5) |
| Venezuela | 2(10) |
| Total | 20 (100) |
La disponibilidad de EPP es mayor (46%, n = 61) en aquellos que ejercen tanto a nivel privado como público, mientras el 11% (n = 15) de aquellos dedicados al sector público cuentan también con el mismo recurso. Si se realiza el análisis por país, aproximadamente el 77% (n = 130) de las unidades de endoscopia del territorio latinoamericano cuentan con EPP completo (Fig. 4).

Figura 4 Resultados mediante gráfico de barras de la encuesta electrónica por país de residencia realizada a los 168 endoscopistas. A: endoscopistas según distribución en medicina pública, privada o mixta. B: tamizaje de pacientes asintomáticos previo al procedimiento. C: uso y reservas de EPP. D: reinicio de actividades electivas en la UE y etapa epidemiológica del país, respectivamente.UE: Unidad de Endoscopia; EPP: equipo de protección.
El 94% (n = 53) de endoscopistas costarricenses estuvieron de acuerdo con reiniciar la endoscopia electiva, representando el 40% de latinoamericanos con esta posición, mientras que una postura negativa es más frecuente en médicos bolivianos (Fig. 4).
Discusión
El presente estudio tiene como objetivo conocer la percepción subjetiva de endoscopistas en distintos países de Latinoamérica respecto al reinicio de endoscopia electiva en tiempos de COVID-19, y la influencia que genera la disponibilidad de EPP y pruebas de tamizaje en ella.
Desde el inicio de la pandemia distintas medidas de aislamiento surgen en respuesta a lo observado en países donde, una vez iniciado el contagio, el contacto de personas de forma habitual llevó a una rápida transmisión comunitaria del virus, con la posterior saturación del sistema hospitalario1,2. Es inevitable una disminución drástica en la realización de procedimientos, lo cual tiene un impacto en detección y tratamiento de diversas patologías del tracto gastrointestinal. Conforme avanzan las semanas, es imperativo desarrollar lineamientos para reiniciar procedimientos electivos6,7.
Forbes, et al. analizan medidas instauradas por centros de salud mediante una encuesta que permite analizar el impacto generado por estas en la atención de pacientes, en el entrenamiento en endoscopia y el uso de EPP8. Además, sugieren que el rendimiento de pruebas de tamizaje es bajo y al no modificar la recomendación de uso completo de EPP podría omitirse en escenarios de recursos limitados7.
La encuesta realizada tomó la opinión de 168 endoscopistas de 18 países distintos, donde el 77% consideraron apropiado reiniciar las actividades endoscópicas electivas. Un aspecto clave para apoyar el reinicio es la disponibilidad de EPP, donde un 80% de los entrevistados afirman contar con él; sin embargo, el 35% consideran tener reservas necesarias solamente para siete días (Fig. 3).
Durante situaciones de escasez de respiradores, la sociedad americana de enfermedades infecciosas favorece reutilizarlos mediante técnicas de desinfección como el uso de peróxido de hidrógeno vaporizado, irradiación germicida ultravioleta o calor seco a 70-80 grados. La reutilización debería considerarse incluso en ausencia de escasez, en forma preventiva. Otra recomendación es agregar un protector facial o una mascarilla quirúrgica como cubierta para el respirador, de modo que se logre prolongar su uso29,30.
Otra variable importante es la fase de transmisión en que se encuentra cada país, donde el 61% de los encuestados laboran en áreas con rápido aumento de casos nuevos, por lo que el reinicio de las actividades debe realizarse bajo estrictos protocolos de funcionamiento, con el fin de minimizar la posibilidad de infección. Es importante considerar que los resultados obtenidos no se pueden extrapolar a Latinoamérica, ya que se trató de una muestra a conveniencia, con una subrepresentación de países con alta densidad demográfica como México y Brasil.
La Sociedad de Endoscopia Digestiva de Asia-Pacífico emitió recomendaciones acerca del reinicio de endoscopia electiva, considerando número y curva epidémica de casos de COVID-19, disponibilidad de EPP y volumen acumulado de casos electivos pospuestos31. Según lo recomendado, mientras un país se encuentre en fase de crecimiento exponencial de casos o cuente con reservas de EPP menores a 1 mes debería abstenerse de realizar procedimientos electivos, mientras que si se encuentra en una etapa con tendencia a la baja o cuenta con reservas para 4-8 semanas, podría reiniciarse con el 50% de la actividad. Cuando no se detecten casos nuevos por al menos dos semanas y se cuente con al menos 12 semanas de reserva de EPP, se debería reiniciar con el 100% de la capacidad31,32.
Se ha planteado el tamizaje por COVID-19 72 horas previo al estudio electivo, sin embargo se debe considerar la posibilidad de infección entre el momento de realización de la prueba y el procedimiento endoscópico6.
El 77% de los encuestados consideran importante realizar pruebas de detección previo a la endoscopia, sin embargo lo anterior debe considerarse con cautela, ya que todas las pruebas presentan limitaciones en detección de pacientes potencialmente infecciosos en etapas tempranas de la enfermedad27.
El panorama se complica con portadores asintomáticos, especialmente en el ámbito comunitario, ya que el periodo de detección se desconoce, debido a que no existe un punto de partida correspondiente al inicio de los síntomas. Otro desafío son los casos muy leves con carga viral muy baja33. Este hecho cobra mayor relevancia al tomar en cuenta que las personas pueden excretar partículas virales viables e infecciosas desde 1-4 días antes del inicio del cuadro clínico27-34; por otro lado, los anticuerpos tienen un periodo de positivización mayor, por lo que su utilidad para descartar infección aguda es menor34,35. Por ende, una prueba negativa no garantiza que el paciente no es infeccioso y no exime al personal de salud de utilizar EPP completo.
Conclusión
El presente estudio presenta limitaciones importantes al ser de tipo descriptivo, observacional y carente de un análisis estadístico específico basado en su encuesta, además es dependiente del momento epidemiológico de cada uno de los encuestados. Por otro lado, la mayor fortaleza del estudio corresponde a brindar una valoración subjetiva de los endoscopistas latinoamericanos donde se logra determinar que los encuestados con mayor disponibilidad de EPP, así como pruebas de tamizaje, presentan mayor disposición para reiniciar procedimientos electivos, como sucede con un 77% de los encuestados. Además se realiza una revisión de la utilidad real de las pruebas en forma de tamizaje demostrando importantes carencias que pueden tener impacto y limitar su uso de forma sistemática.
Es importante destacar que debido a la rápida evolución de la pandemia COVID-19 es probable que las recomendaciones pronto requieran actualizarse.











 nueva página del texto (beta)
nueva página del texto (beta)