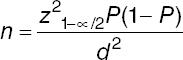Marco teórico
Introducción
El cáncer esofágico es la octavo tipo de tumor maligno más frecuente a nivel mundial, y la sexta causa de mortalidad por cáncer en el mundo. Histológicamente hay dos tipos principales: adenocarcinoma y cáncer esofágico de células escamosas (CECE) (1). Hay una importante variabilidad geográfica en la incidencia de cancer de esófago, se estima que 80% ocurre en países en vías de desarrollo. La tasa de supervivencia es en general pobres, derivado en parte del diagnóstico en etapas tardías, el inicio de disfagia está asociado a enfermedad avanzada y a una supervivencia menor de 15% a 5 años (2).
Factores de riesgo y poblaciones en riesgo para Cáncer Esofágico de Células escamosas
Común a la patogénesis de otros tipos de neoplasia, el desarrollo de CECE es resultado de una serie de factores no modificables (genética) y modificables (ambientales).
A nivel mundial, la incidencia de CECE es más del dos veces más alta en hombres que en mujeres. En muchos países, incluyendo los que presentan una incidencia relativamente baja (incluye algunos países desarrollados), alcohol y tabaco son los factores de riesgo principales. Los efectos combinados de alcohol y tabaco son sinérgicos y están bien documentados, en un estudio italiano se documentó un Odds Ratio (OR) de 2.6 (95% IC 4-29) para pacientes no fumadores con hábito etílico intenso, OR de 8.4 (95% IC 16-41) para pacientes con habito etílico moderado y tabáquico intenso y OR de 21.8 (95% IC 6-15) para aquellos con ambos hábitos intensos. El tabaco no fumado también se ha corroborado como un factor de riesgo para CECE (3).
Los factores dietéticos y nutricionales están implicados y se han estudiado como factores de riesgo para CECE. Los estudios han sugerido que una ingesta baja en frutas y vegetales; así como algunas deficiencias de micronutrientes como Selenio, Zinc y folatos son factores de riesgo para CECE (4, 5, 6).
Algunas exposiciones ambientales específicas ha sido vinculadas a riesgo incrementado de CECE, como la exposición a hidrocarburos aromáticos policíclicos no sólo los provenientes del tabaco, sino del uso de estufas con carbón, la bebida brasileña maté, uso frecuente de tés calientes. Otros factores no bien demostrados: pobre higiene oral, infección por virus de papiloma (7, 8). Se ha implicado también un componente genético en el desarrollo de CECE, sobre todo genes implicados en el metabolismo del alcohol, como aquello relacionado con alcohol deshidrogenasa y aldehído deshidrogenasa (9).
Poblaciones únicas de pacientes con algunas comorbilidades están asociados a una incidencia aumentada de CECE y podrían ser candidatos a programas de tamizaje dirigido. La Tilosis, una condición genética rara caracterizada por hiperqueratosis cutánea, asociada a una mutación en el cromosoma 17, está asociada con un riesgo acumulativo de CECE que se estima de hasta 90%, la NCCN en su versión 2018 recomienda la vigilancia en todos los familiares de pacientes con esta condición a partir de los 20 años (10). La ASGE (American Association of Gastrointestinal Endoscopy) recomienda un programa de tamizaje en los pacientes con esofagitis por caústicos, empezando después de 10-20 años después del evento índice, cada 2 o 3 años (11).
Otras poblaciones en riesgo de desarrollar CECE la constituyen los pacientes con cáncer escamoso diagnosticado en la vía aero-digestiva alta (cabeza y cuello), en los que se ha reportado la presencia de lesiones sincrónicas y metacrónicas en esófago. Los pacientes con acalasia se encuentran de igual forma en riesgo aumentado de CECE, el OR varia de acuerdo a publicaciones, hasta 50 (11).
La relación entre acalasia y cáncer esofágico de células escamosas
Acalasia es una condición relativamente rara con una tasa de incidencia anual de 0.5–1.2 por 1,00,000 individuos. Es un trastorno de la motilidad del esófago, y aunque su etiología no se ha determinado de manera concluyente hay un aumento evidencia de que la acalasia es el resultado de mecanismos autoinmunes. El principal mecanismo fisiopatológico descrito es una disminución en el número de neuronas mientéricas, o su ausencia, causando aperistalsis y relajación deficiente del esfínter esofágico inferior (EEI). Lo más probable es que las neuronas mientéricas desaparezcan debido a ganglionitis crónica de origen inmunitario. Clínicamente, los pacientes desarrollan disfagia como Una consecuencia de la pérdida de peristalsis esofágica y fracaso de la relajación del EEI. La acalasia es una condición relativamente rara, no obstante, presenta complicaciones tangibles como megaesófago, neumonía por aspiración, desnutrición y cáncer de esófago, específicamente carcinoma esofágico de células escamosas (CECE) (12).
Un metaanálisis reciente de 40 estudios (11 978 pacientes) describe una incidencia de CECE de 312.4 casos por 100 000 pacientes/año. La prevalencia fue de 26 casos en 1000 (En sudamerica se describe por efecto de enfermedad de Chagas una prevalencia de 56 casos por 1 000 habitantes); con un incremento absoluto en el riesgo para CECE de 308.1 casos por 100 000 pacientes por año. La edad media de diagnóstico de carcinoma 56.9 años (DE 12.9) para carcinoma escamoso y 68.3 (DE 16.5) para adenocarcinoma. El periodo medio después del inicio de los síntomas de acalasia y el diagnóstico de carcinoma fue de 22.2 años (DE 11.1). El tiempo medio de desarrollo después de miotomía o dilatación fue de 11.5 años (DE 9.5 años). En cuanto a la topofragía: 42% desarollaron el carcinoma en el tercio inferior, 40% en tercio medio y 17% en tercio superior. Supervivencia después del diagnóstico fue de 12.7 meses (DE 4.9), y sólo 4.54% vivieron más de 5 años. El CCE del esófago ocurre no antes de los 5 años del inicio de los síntomas de la enfermedad (13).
Fisio-patología
Múltiples mecanismos fisiopatológicos se han vinculado con el desarrollo de CECE. Una hipótesis es que la estasis alimentaria promueve la producción de ácido láctico y la fermentación debido al sobrecrecimiento bacteriano, esto se “estanca” en el tercio distal del esófago causando inflamación continua, con daño a la mucosa esofágica predisponiendo así a cambios displásicos. Además, la mucosa dañada es más sensible a los carcinógenos contenidos en los alimentos como nitrosaminas, alcohol y tabaco (14). El ácido parece jugar un papel importante también, ya que la aperistalsis elimina una de las principales defensas para el aclaramiento del ácido, esto propicia un aumento en la frecuencia (menor de para CECE) en adenocarcinoma (15, 16).
Con respecto de las alteraciones histológicas y marcadores de displasia, los cambios que se han descrito son cambios hiperplásicos en el epitelio con focos de cambios displásicos. Al hacer inmunohistoquímica para p53, p21, p16 y factor de crecimiento epidérmico, se ha encontrado un patrón limítrofe entre hiperplasia y carcinoma in situ. Esto probablemente implica que la hiperplasia causada por la irritación química que produce la estasis alimentaria, finalmente se transforme en displasia y después a carcinoma.
La biología de las células displásicas escamosas y su historia natural no está bien estudiada. Fue en el estudio de Linxian (Linxian Nutrition Intervention Trial) que inició en 1987 en el que se dio seguimiento inicialmente a 3.5 años, en el que, por primera vez, se documentó que la displasia predice evolución a cáncer, y que a mayor grado de displasia hay mayor riesgo de cáncer: los riesgos relativos (RR) fueron 2.2 (0.7-7.5) para displasia de bajo grado, 15.8 (5.9-42.2) para grado moderado, 72.6 (29.8-176.9) para displasia de alto grado; 22.9 (6.7-78) para displasia no especificada. En un seguimiento a 13.5 años se corroboraron estos hallazgos: 8% de los pacientes con histología normal desarrollaron CECE, 24% de los pacientes que habían sido catalogados como displasia de bajo grado, 50% de los pacientes con displasia moderada y 74% de los pacientes con displasia de alto grado (17).
Los criterios histológicos para la displasia escamosa fueron inicialmente descritos en 1970, modificados 10 años después en base a los resultados de la experiencia China. Requiere de la presencia de atipia nuclear (alargamiento, pleomorfismo, hipercromasia), o pérdida de la polaridad celular, maduración anormal, sin invasión de la células a través de la membrana basal. En la displasia leve las anormalidades están confinadas al tercio inferior del epitelio, en displasia de grado moderado estos cambios se presentan en los 2 tercios inferiores y en la displasia de alto grado abarca la totalidad del epitelio sinónimo de carcinoma in situ) (18).
Tamizaje de displasia escamosa y cáncer esofágico temprano
Ya que el esófago es fácilmente accesible a la endoscopia, el diagnóstico temprano y el tratamiento curativo del cáncer es factible. No obstante, el diagnóstico tardío sigue siendo frecuente dada la sintomatología inespecífica durante la etapa temprana de estos tumores, el inicio de disfagia está asociado a enfermedad avanzada y a una supervivencia menor de 15% a 5 años.
La cromoendoscopia juega un papel importante en el tamizaje del CECE y lesiones precursoras. Hablando de cromoendoscopia con tinciones, el agente de elección es el agente yodado Lugol (19). Se trata de una tinción absortiva que contiene yodo, yodo potásico y agua destilada. La aplicación de Lugol al 0.5-3% resultada en una coloración verde-café, café obscuro o negra de la mucosa con epitelio escamoso normal que dura de 5 a 8 minutos. Este agente yodado se une al glucógeno, una molécula que está presente en todas las células epiteliales escamosas del cuerpo. Las células epiteliales normales adquieren una apariencia café posterior a la administración tópica de Lugol; en contraste, las células atípicas, incluyendo áreas que contengan displasia o cáncer, contienen menos glucógeno, y por tanto menor captación celular del agente yodado, exhibiendo así una característica “no teñida”, con frecuencia llamada área no teñida o no captante, esta se considera significativa cuando mide más de 5 mm. Otras situaciones que pueden presentar hipocaptación de Lugol son inflamación (esofagitis) y epitelio con metaplasia intestinal (esófago de Barret). Y por el contrario, se observan áreas de captación intensa cuando hay acantosis glucogénica, un cambio benigno de la mucosa esofágica (20).
La administración de Lugol en la mucosa esofágica puede presentar complicaciones que se han reportado desde 0 a 3% como dolor retroesternal y sensación urente en faringe; menos frecuente es la presentación de esofagitis o gastropatía erosiva, sin embargo se ha reportado (21, 22).
La práctica del uso de Lugol para detección de displasia/neoplasia no es única para esófago, de hecho, fue inicialmente descrita para cérvix y los primeros reportes de su uso datan de los años 60s, y desde entonces la investigación con esta tinción fue extensiva. Misumi y cols. llevaron a cabo uno de los primeros (y más significativos) reportes con esta técnica en 1990 en la que detectaron 17 lesiones en una cohorte japonesa en la que administraron 20 ml de Lugol al 1.5%, seguido de administración de mucolítico y agua. Encontraron además que la delimitación de las lesiones correlacionaba de forma confiable con el tamaño de la lesión establecido en la evaluación histológica del espécimen (23).
Shiozaki y cols. en 1990 también reportaron un estudio en el que el examen endoscópico inicial fue con endoscopia convencional con luz blanca, seguido de cromoendoscopia con Lugol en 178 pacientes conocidos con cáncer de cabeza y cuello pero sin síntomas esofágicos. Se identificaron lesiones no teñidas en 69 pacientes, y las biopsias de estas lesiones no teñidas identificaron 13 lesiones cancerosas en 9 pacientes (5% de la cohorte) y displasia escamosa en 22 pacientes (12% de la cohorte); el resto de las lesiones no teñidas mostró patología consistente con cambios inflamatorios o paraqueratosis (24).
En 1998 Dawsey y cols. reportaron un estudio en el que a 225 pacientes con displasia o cáncer en esófago diagnosticada por un método no endoscópico (balón esofágico para citología), se les realizó endoscopia con luz blanca convencional, y cromoendoscopia con Lugol 1.2%. La sensibilidad de la endoscopia convencional con luz blanca fue de 62% para detectar displasia de alto grado o cáncer y la sensibilidad de la cromoendoscopia con Lugol al detectar lesiones son teñidas fue de 96%. Todos los casos de cáncer invasivo fueron detectados por endoscopia convencional; sin embargo, 55% de los casos con displasia moderada y 23% de los casos con displasia de alto grado se habrían omitido sin cromoendoscopia con Lugol (25).
En los pacientes con acalasia que no cuentan con una vigilancia, cuando se presenta CECE se detecta en etapas tardías y por tanto con un pronóstico sombrío. Esto está favorecido por el hecho de que los pacientes con acalasia están acostumbrados a un vaciamiento esofágico difícil/retardado, y por tanto sólo reportan empeoramiento de esta sintomatología hasta que el tumor se encuentra en estado avanzado. Poco existe publicado sobre un programa de vigilancia en esta población, buena parte de la información se obtiene de estudios retrospectivos. Uno de los estudios más grandes con 448 pacientes con un seguimiento promedio de 15 años, con endoscopia de luz blanca tradicional, encontró que el 3.3% desarrolló CECE después de una duración media desde el inicio de los síntomas de 13 años, reportaron un HR de 28, no estudiaron ni reportaron la presencia de lesiones precursoras (26).
Ide y cols reportaron una cohorte de 43 pacientes con acalasia en diferentes estadios de evolución, en los que realizaron cromoendoscopia con NBI y con Lugol 1.5%. Encontraron una sensibilidad de 100% para ambos métodos, y una especificidad de 85.7% para NBI y 81% para Lugol, sin embargo no reportaron la presencia de lesiones precursoras, notablemente, no se documentó ninguna reacción adversa a la administración de Lugol (27).
En el estudio prospectivo con cromoendoscopia más grande, recientemente reportado, de un grupo del norte de Europa, en el que se incluyeron 230 pacientes, se encontró al 3% con displasia escamosa o CECE, a una edad media de 68 años. En este estudio se encontró que la endoscopia de luz blanca de alta definición detectó 65% de las lesiones displásicas detectadas por cromoendoscopia con Lugol, mayoría de las lesiones no teñidas detectaron patología benigna: 73% cambios inflamatorios, 5% hiperqueratosis, 1% Esófago de Barrett, 13% ninguna alteración significativa y 8% fuero displasia o CECE. La capacidad diagnóstica de Lugol se obtuvo comparando con la primera endoscopia de tamizaje en la que se tomaron biopsias esofágica aleatorias sin cromoendoscopia en pacientes en los que no se sospecharon lesiones por endoscopia convencional con luz blanca en 44 pacientes, ninguno de ellos presentó displasia; y en el momento de tamizaje con Lugol se detectó a 3 pacientes con displasia; la sensibilidad reportada fue de 100% y especificidad de 62% (28).
Justificación
Los pacientes con acalasia tienen un riesgo incrementado comprobado de presentar CECE, sin embargo, no existen programas definidos de tamizaje, y dada la sintomatología propia de la enfermedad, los pacientes que desarrollan neoplasia generalmente se presentan en un periodo tardío en el que tienen mal pronóstico y pocas probabilidades de tratamiento curativo. Se ha demostrado en estudios realizados en poblaciones de riesgo, que el CECE sigue una secuencia displasia-neoplasia que podemos, hasta cierto punto, anticipar y de esta forma detectar y tratar lesiones tempranas. Por lo que detectar lesiones precursoras, al igual que otros terrenos en endoscopia preventiva (adenomas en colon, mataplasia de Barrett, lesiones tempranas gástricas) podría darnos una pauta para conductas terapéuticas encaminadas a disminuir la mortalidad ligada a esta neoplasia.
Planteamiento del problema
¿Cuál es la prevalencia de displasia en los pacientes con acalasia de más de 5 años de evolución?
Objetivos
Pregunta de investigación
¿Es posible detectar displasia de forma temprana en los pacientes con acalasia, antes de que presenten una lesión neoplásica avanzada?
Material y métodos AT
Diseño del estudio: Prospectivo, transversal.
Pacientes, material y métodos:
Universo del estudio
Pacientes con diagnóstico manométrico de acalasia, cuyos síntomas hayan iniciado hace más de 5 años, evaluados y/o en seguimiento en el Servicio de Endoscopia Gastrointestinal del Hospital de Especialidades de Centro Médico Nacional Siglo XXI, entre Enero y Junio de 2018.
Lugar de desarrollo
El estudio se realizará en el servicio de Endoscopia Gastrointestinal del Hospital de Especialidades de la Unidad Médica de Alta Especialidad del Centro Médico Nacional Siglo XXI.
Muestra
Pacientes con diagnóstico manométrico de acalasia, cuyos síntomas hayan iniciado hace más de 5 años, evaluados y/o en seguimiento en el Servicio de Endoscopia Gastrointestinal del Hospital de Especialidades de Centro Médico Nacional Siglo XXI, entre Enero y Junio de 2018.
Criterios de selección
1. Criterios de inclusión: edad 18 años o más, cumplir criterio diagnóstico para acalasia (Chicago v3.0), sin importar el tratamiento que hayan recibido (farmacológico, dilatación endoscópica, cardiomiotomía quirúrgica o cardiomiotomía endoscópica por boca - POEM), que acepten por escrito su consentimiento para realizar panendoscopia (que se realiza como parte de su seguimiento) con tinción con Lugol al 2%.
2. Criterios de exclusión: pacientes con antecedente de neoplasia esofágica conocida, pacientes con otra condición maligna sólida o hematológico diagnosticada, condición médica que del paciente que contraindique una endoscopia alta, estasis esofágica importante que no pueda ser removida con el endoscopio, detección de lesión ulcerada, infiltrativa o estenótica, presencia de esofagitis erosiva severa.
3. Criterios de Eliminación: pacientes que no firmen el consentimiento informado, pacientes con antecedente de alergia al yodo.
Procedimientos
A todos los pacientes que cumplan con los criterios para diagnóstico de acalasia sin importar el tratamiento que hayan recibido, cuyos síntomas hayan iniciado hace más de 5 años; se les realizará la siguiente evaluación:
1) Historia clínica completa: A todos los pacientes que cumplan con los criterios para diagnóstico de acalasia sin importar el tratamiento que hayan recibido, cuyos síntomas hayan iniciado hace más de 5 años, se registrarán en un formato de historia clínica gastrointestinal, todos los datos epidemiológicos, clínicos, somatometria y exploración física.
2) Esófagogastroduodenoscopia: Será realizada por un médico endoscopista con amplia experiencia en el área. Se empleará un panendoscopio EGW-600 (Fujinon ®), se realizará de forma convencional el procedimiento como parte de su seguimiento; se llevará a cabo la remoción de restos alimentarios en esófago con agua y aspiración; y en seguida se realizará una revisión exhaustiva de la mucosa esofágica con luz blanca convencional, registrando las lesiones potenciales detectadas, describiendo los siguientes elementos: clasificación de París (0-I lesiones elevadas, 0-II lesiones planas, 0-III lesiones deprimidas), su diámetro estimado por la apertura de un fórceps para biopsia de 7 mm, distancia de la arcada dentaria guiado por las marcas del endoscopio (expresada en centímetros) y cara del esófago en la que se encuentre (anterior, posterior, lateral derecha o izquierda) (Anexo I). En seguida se utilizará catéter de aspersión y se instilará de proximal a distal 20 ml de Lugol a 1.5% en las 4 paredes del esófago y en su totalidad, una vez aplicada la tinta, se irrigará de proximal a distal para eliminar el exceso y se realizará nuevo examen detallado de la mucosa esofágica en búsqueda de áreas no teñidas que sean iguales o mayores de 5 mm, estas se registrarán por separado a las obtenidas por luz blanca, con las mismas especificaciones descritas, y se tomarán 2 biopsias con un fórceps para biopsia con mandíbula radia estándar de 2.8 mm (Boston Scientific ®), serán depositadas en un frasco con formol al 40% para su fijación, uno por lesión detectada, y serán analizados por un patólogo experto en tubo digestivo.
Descripción de las variables
Características clínicas de los pacientes: Edad, género, síntomas: disfagia, dolor torácico, regurgitación, pirosis.
Por endoscopia de alta definición con luz blanca: presencia de lesiones sospechosas (cambio en la mucosa) descritas por clasificación de París (0-I lesiones elevadas, 0-II lesiones planas, 0-III lesiones deprimidas), su diámetro estimado (estimado en milímetros), distancia de la arcada dentaria y cara del esófago en la que se encuentre (anterior, posterior, lateral derecha o izquierda); número total de lesiones encontradas.
Tabla 1 variables y escalas de medición
| Variable | Tipo | Escala | Unidad de medición | Equipo |
|---|---|---|---|---|
| Edad | Cuantitativa discreta | Numérica | Años | Evaluador |
| Género | Cualitativa dicotómica | Nominal dicotómica | Femenino Masculino | Evaluador |
| Tiempo desde el inicio de los síntomas. | Cuantitativa discreta | Numérica | Meses | Evaluador |
| Índice tabáquico mayor de 10 paquetes/años | Cualitativa dicotómica | Nominal dicotómica | Si No | Evaluador |
| Etilismo intenso | Cualitativa dicotómica | Nominal dicotómica | Si No | Evaluador |
| Disfagia | Cualitativa dicotómica | Nominal dicotómica | Si No | Evaluador |
| Dolor torácico | Cualitativa dicotómica | Nominal dicotómica | Si No | Evaluador |
| Regurgitación | Cualitativa dicotómica | Nominal dicotómica | Si No | Evaluador |
| Esofagitis por estasis al diagnostico | Cualitativa dicotómica | Nominal dicotómica | Si No | Panendoscopio |
| Diámetro máximo del esófago | Cuantitativa continua | Numérica | Centímetros | Radiología |
| Morfología de la lesión. | Cualitativa ordinal. | Numérica | Paris: 0-Is, 0-Ip, 0-IIa, 0-IIb, 0-IIc, 0-III. | Panendoscopio |
| Diámetro de la lesión | Cuantitativa discreta | Numérica | Milímetros | Panendoscopio |
| Número de lesiones encontradas | Cuantitativo continuo | Numérica | Milímetros de mercurio. | Manometría |
| Reporte histopatológico | Cualitativa ordinal. | Normal, displasia de bajo, moderado y alto grado. | Microscopio (Patólogo). |
Definición de variables:
Por cromoendoscopia con Lugol al 1.5%: presencia de lesiones no teñidas descritas por clasificación de París (0-I lesiones elevadas, 0-II lesiones planas, 0-III lesiones deprimidas), su diámetro estimado (estimado en milímetros), distancia de la arcada dentaria y cara del esófago en la que se encuentre (anterior, posterior, lateral derecha o izquierda); número total de lesiones encontradas.
Edad
Definición conceptual: número de años cumplidos en un sujeto.Definición operacional: Se consideran años cumplidos transcurridos y once meses 29 días después del último año cumplido.
Género
Definición conceptual: categoría a la cual se asigna a un individuo según el sexo al que pertenece.
Definición operacional: se considera género femenino y masculino.
Síntomas
Definición conceptual: La disfagia está definida como la dificultad para la deglución con sensación de atasco de alimento; el dolor torácico definido como dolor retroesternal opresivo; la regurgitación, definida como el paso involuntario del alimento del esófago distal al esófago proximal, hipofaringe o faringe.
Definición operacional: Se registrarán los síntomas que presente el paciente al momento del cuestionario.
Tiempo desde el inicio de los síntomas.
Definición conceptual: tiempo transcurrido desde el inicio de los síntomas de acalasia (disfagia, regurgitaciones frecuentes, dolor torácico) al momento de la evaluación.
Definición operacional: tiempo transcurrido desde el inicio de los síntomas de acalasia al momento de la realización de la endoscopia de tamizaje.
Índice tabáquico
Definición conceptual: número de cigarrillos, dividido entre el número 20 (numero de cigarros que contiene una cajetilla) dividido entre los años que ha fumado.
Definición operacional: número de cigarrillos, dividido entre el número 20 (número de cigarros que contiene una cajetilla) dividido entre los años que ha fumado.
Etilismo intenso
Definición conceptual: ingesta de más de 200 gramos de etanol por semana.
Definición operacional: ingesta de más de 200 gramos de etanol por semana.
Estasis alimentaria en esófago
Definición conceptual: presencia de restos alimentarios en esófago detectados por endoscopia a pesar de ayuno mayor de 8 horas.Definición operacional: presencia de restos alimentarios en esófago detectados por endoscopia a pesar de ayuno mayor de 8 horas.
Morfología de la lesión: Clasificación de París
Definición conceptual: descripción por medio de clasificación de París en: 0-I lesiones planas (0-Ip lesión polipoidea, 0-Is lesión sésil), 0-II lesiones planas (0-IIa plana elevada, 0-IIb plana, 0-IIc con depresión menor de 2 mm), y 0-III lesiones con depresión mayor de 2 mm. Definición operacional: descripción por medio de clasificación de París en: 0-I lesiones planas (0-Ip lesión polipoidea, 0-Is lesión sésil), 0-II lesiones planas (0-IIa plana elevada, 0-IIb plana, 0-IIc con depresión menor de 2 mm), y 0-III lesiones con depresión mayor de 2 mm.
Diámetro de la lesión y número de lesiones encontradas
Definición conceptual: diámetro mayor de la lesión estimado en comparación con un fórceps de 7 mm de diámetro. Número total de lesiones registradas.
Definición operacional: diámetro mayor de la lesión estimado en comparación con un fórceps de 7 mm de diámetro. Número total de lesiones registradas.
Histopatología
Definición conceptual: atipia nuclear (alargamiento, pleomorfismo, hipercromasia), o pérdida de la polaridad celular, maduración anormal, sin invasión de la células a través de la membrana basal. En la displasia leve las anormalidades están confinadas al tercio inferior del epitelio, en displasia de grado moderado estos cambios se presentan en los 2 tercios inferiores y en la displasia de alto grado abarca la totalidad del epitelio.
Definición operacional: atipia nuclear (alargamiento, pleomorfismo, hipercromasia), o pérdida de la polaridad celular, maduración anormal, sin invasión de la células a través de la membrana basal. En la displasia leve las anormalidades están confinadas al tercio inferior del epitelio, en displasia de grado moderado estos cambios se presentan en los 2 tercios inferiores y en la displasia de alto grado abarca la totalidad del epitelio.
Análisis estadístico
Las características demográficas de los sujetos se describirán en términos de promedios (± desviación estándar), mediana (y rango intercuartílico), y porcentajes. Las variables cualitativas con U de Mann-Whitney. Las variables cuantitativas se compararan utilizando pruebas paramétrica o no paramétricas, con base a la distribución de los resultados. La prevalencia se determinará utilizando la fórmula predeterminada. Se utilizará el programa de análisis estadístico SPSS 22. Se considerará una p < 0.05 como estadísticamente significativa
Consideraciones éticas
El protocolo de estudio está realizado bajo los lineamientos de la ley general de salud de México promulgada en 1986 (con reforma del 2014) y con la Declaración de Helsinki de 1975, con modificación en el Congreso de Tokio, Japón en 1983. Toda la información obtenida de los pacientes incluidos, se manejará de forma confidencial. Todo paciente contará con consentimiento informado para la realización de la panendoscopia sin implicar esto algún riesgo extra para los participantes, basándose en el artículo 13 de la Ley General de Salud. En todo momento se respetará la confidencialidad de los participantes en el estudio. El protocolo de estudió se someterá a evaluación por el comité local de ética del Hospital de Especialidades del CMN Siglo XXI.
Recursos humanos
Director de tesis: Dr. Omar Michel Solórzano Pineda.
Asesor: Dr. Oscar Víctor Hernández Modragón.
Investigador: Carlos Mendoza Segura.
La realización del protocolo se realizará en el servicio de endoscopia del Hospital de Especialidades del Centro Médico Nacional Siglo XXI.
Recursos financieros
Se empleará los servicios integrales contratados por el instituto para la realización de panendoscopia. Estos se emplean de manera cotidiana para la realización de los estudios complementarios y de seguimiento de los pacientes en la unidad. Por lo anterior no se destinarán recursos financieros extras especiales para este estudio.
Se destinarán $ 600.000 MX para la adquisición del Lugol necesario para el estudio.
Instalaciones y personal participante
La esofagogastroduodenoscopia y aplicación de Lugol se realizará por un médico en Adiestramiento en Endoscopia Gastrointestinal, con supervisión del Dr. Omar Solórzano Pineda, médico adscrito al servicio de endoscopia del Hospital de Especialidades, Centro Médico Nacional s. XXI.











 nova página do texto(beta)
nova página do texto(beta)