Introducción
La incidencia de hemorragia digestiva baja (HDB) es de 33 por cada 100,000 personas y representa el 1.4% de los eventos de hemorragia digestiva, sin embargo, aunque la proporción de casos es menor comparada con la hemorragia digestiva alta (HDA), tiene una mayor mortalidad y mayor estancia hospitalaria.1 En México no contamos con estadísticas de este padecimiento.
A diferencia de la HDA, en donde se cuentan con escalas para estratificación de riesgo que son mundialmente aceptadas, en HDB se han publicado diversas escalas, algunas diseñadas para choque hipovolémico como el índice de choque2, para severidad de comorbilidades como el índice de Charlson3, otras inicialmente aplicadas en HDA y posteriormente utilizadas en HDB como la escala de Glasgow-Blatchford (GBS)4, Rockall5, y AIMS656, finalmente las escalas diseñadas para HDB como BLEED7, Strate8, NOBLADS9, Oakland10 y SHA2PE11, sin embargo, no existe alguna escala que se adecue a todas las poblaciones.6,12
La escala de SHA2PE es la más recientemente añadida a las escalas de estratificación de riesgo para HDB, publicada en diciembre 2018, fue diseñada en Islandia, basado en 438 pacientes incluidos en el análisis retrospectivo de 3 años con HDB, se incluyen las siguientes variables: presión arterial sistólica < 100mmHg (1 punto), hemoglobina <10.5g/dl (2 punto), de 10.5-12g/dl (1 punto), uso de antiagregantes (1 punto), uso de anticoagulantes (1 punto), frecuencia cardiaca >100 latidos por minuto (1 punto) y sangrado durante su estancia en urgencias (1 punto); los pacientes con ≤1 punto tienen bajo riesgo de requerir intervención hospitalaria, con una sensibilidad 91%, especificidad 75%, valor predictivo positivo 53%, valor predictivo negativo 96% y un área bajo la curva de 0.83.11
En guías de HDB reconocidas internacionalmente, como American Society for Gastrointestinal Endoscopy (ASGE)13 y American College of Gastroenterology (ACG)14, mencionan algunas escalas de estratificación sin recomendar alguna para la práctica clínica, sin embargo, al inicio de este año, se publica en la guía británica, British Society of Gastroenterology (BSG)15, el uso de forma rutinaria de la escala Oakland, la cual fue diseñada y validada en su población.
Es necesario validar en nuestra población estas escalas de estratificación para identificar tempranamente a los pacientes que tienen alto riesgo de necesitar intervenciones en hospital como transfusión, ingreso a unidad de terapia intensiva, tratamiento hemostático ya sea mediante endoscopia, angiografía o cirugía.
Objetivos
Determinar la utilidad de las escalas de estratificación de riesgo en pacientes con HDB para predicción de sangrado severo.
Material y métodos
Estudio retrospectivo, observacional, que incluyó a pacientes que acudieron al servicio de urgencias por HDB en el hospital Médica Sur, en el periodo de Enero del 2016 a Mayo del 2019. Se incluyeron a los pacientes mayores de 18 años, con expediente completo y se excluyeron a quienes tuvieran diagnóstico de cáncer colorrectal previo o enfermedad inflamatoria intestinal ya conocida. Se recolectaron los datos demográficos, características clínicas y estudios de laboratorio a su ingreso a urgencias.
Se consideró como sangrado severo a los pacientes que necesitaron tratamiento por radiología intervencionista (angiografía) ó quirúrgico, requerimiento transfusional (≥2 paquetes globulares), que presentaran resangrado durante su estancia hospitalaria (segunda intervención, ya sea endoscópica, angiográfica ó quirúrgica), ingreso a unidad de terapia intensiva (UTI), mortalidad hospitalaria o que tuvieran reingreso a hospitalización por HDB en los 30 días posteriores a su ingreso índice.
El objetivo primario fue la predicción de sangrado severo de acuerdo a la aplicación en cada uno de los pacientes de las 10 escalas de estratificación de riesgo (índice de choque, Charlson, GBS, AIMS65, Rockall, Strate, BLEED, NOBLADS, Oakland, SHA2PE), los objetivos secundarios fueron la predicción de las escalas para requerimiento de angiografía, cirugía ó transfusión, ingreso a UTI, resangrado, reingreso hospitalario o muerte.
Se utilizó estadística descriptiva empleando pruebas paramétricas y no paramétricas de acuerdo con el tipo de variable estudiada, se usó el área bajo la curva para la predicción de sangrado severo de cada una de las escalas de estratificación. Todos los análisis fueron realizados con el programa estadístico SPSS versión 24, se consideró una diferencia significativa al valor de p <0.05.
Resultados
Durante el periodo de estudios se presentaron a urgencias un total de 181 pacientes con HDB, la edad media es de 62 (±20) años, 64% fueron hombres, el índice de Charlson medio fue de 3 (±2), con uso de antiagregante plaquetario el 19.3% y con anticoagulante el 4.4% (Tabla 1).
Tabla 1 Características demográficas
| Variable | Sangrado no severo n (%) | Sangrado severo n (%) | p |
|---|---|---|---|
| Total | 143 | 38 | |
| Edad media, años (DE) | 60 (±20) | 69 (±19) | 0.018 |
| Hombre | 86 (60.1) | 30 (78.9) | 0.037 |
| Consumo tabaco | 30 (21.0) | 12 (31.6) | 0.196 |
| Diabetes Mellitus | 14 (9.8) | 9 (23.7) | 0.030 |
| Hipertensión arterial sistémica | 54 (36.4) | 15 (39.5) | 0.711 |
| Cirrosis hepática | 2 (1.4) | 1 (2.6) | 0.509 |
| Insuficiencia cardiaca | 7 (4.9) | 3 (7.9) | 0.440 |
| Enfermedad renal crónica | 6 (4.2) | 4 (10.5) | 0.221 |
| Neoplasia | 10 (7.0) | 6 (15.8) | 0.108 |
| Uso antiagregante plaquetario | 22 (15.4) | 13 (34.2) | 0.019 |
| Uso antiacoagulante | 5 (3.5) | 3 (7.9) | 0.367 |
| Uso AINE | 15 (10.5) | 5 (13.2) | 0.575 |
| Índice de Charlson (DE) | 2 (±2) | 4 (±2) | 0.000 |
DE: desviación estándar, AINE: antiinflamatorio no esteroideo.
En su presentación en urgencias, el 3.9% presentó síncope, el 31.5% se acompañó con dolor abdominal, el 3.9% de los pacientes acudió en las primeras 4 horas de inicio del sangrado y tuvieron una media de 13.3 (±2.9) g/dL de hemoglobina (Tabla 2).
Tabla 2 Presentación clínica y estudios de laboratorio en urgencias
| Variable | Sangrado no severo n (%) | Sangrado severo n (%) | p |
|---|---|---|---|
| Total | 143 | 38 | |
| Síncope | 4 (2.8) | 3 (7.9) | 0.162 |
| Evacuaciones diarreicas | 17 (11.9) | 11 (28.9) | 0.020 |
| Dolor abdominal | 46 (32.2) | 11 (28.9) | 0.845 |
| Sangrado en urgencias | 2 (1.4) | 1 (2.6) | 0.509 |
| Frecuencia cardiaca, latido por minuto (DE) | 81 (± 14) | 87 (± 16) | 0.018 |
| Presión arterial sistólica, mmHg (DE) | 131 (± 20) | 127 (± 22) | 0.233 |
| Hemoglobina, g/dL (DE) | 13.9 (± 2.6) | 11.0 (± 3.0) | 0.000 |
| BUN, mg/dL (DE) | 17.0 (± 13.1) | 23.8 (± 14.9) | 0.000 |
| Albúmina, mg/dL (DE) | 3.6 (± 0.5) | 2.9 (± 0.8) | 0.001 |
| INR (DE) | 0.9 (± 0.1) | 1.0 (± 0.2) | 0.088 |
| Tiempo protrombina, seg (DE) | 11.3 (± 3.4) | 11.5 (± 2.1) | 0.102 |
DE: desviación estándar, BUN: nitrógeno ureico en sangre, INR: razón normalizada internacional.
Al 92.2% de los pacientes se realizó colonoscopia durante su estancia hospitalaria, el tiempo medio de presentación en urgencias hasta realización del procedimiento fue de 18 horas (sin diferencia entre los grupos con y sin sangrado severo, p 0.822), el 5.4% tuvo sangrado activo con identificación del sitio de sangrado y el 30.5% con visualización de retos hemáticos sin sitio activo de sangrado. De las causas del sangrado, el 37.7% fue por divertículos y el 22.8% por hemorroides (Tabla 3).
Tabla 3 Etiología de hemorragia digestiva baja
| Etiología | Prevalencia |
|---|---|
| Divertículos | 37.7 |
| Hemorroides | 22.8 |
| Colitis* | 18.0 |
| Neoplasia | 7.2 |
| Lesiones vasculares | 5.4 |
| Padecimiento anorrectal benigno** | 1.2 |
| Sin sitio evidente de sangrado | 7.7 |
*Se incluyeron: colitis isquémica, pseudomembranosa y úlceras de origen infeccioso.
**Con exclusión de hemorroides.
El 21% de los pacientes tuvieron sangrado severo, 23.2% requirió transfusión (14.4% necesitó ≥2 paquetes globulares), 2.8% presentaron resangrado, en 2.2% se realizó angiografía, 10.5% fue ingresado a UTI y 6.1% tuvo reingreso hospitalario. Hubo un incremento significativo de estancia hospitalaria entre los pacientes sin sangrado severo (2 ± 2 días) y con sangrado severo (6 ± 5 días) (p 0.000). Ninguno de los pacientes requirió tratamiento quirúrgico por sangrado ni falleció durante su estancia hospitalaria.
Entre las 10 escalas evaluadas, solo la escala SHA2PE tuvo un área bajo la curva >0.80 para predicción de sangrado severo (Figura 1 y Tabla 4), así como para los desenlaces resangrado, transfusión, angiografía e ingreso a UTI (Tabla 5). Las escalas que tuvieron una mayor sensibilidad para sangrado severo fueron Strate (100%) y BLEED (100%) y la de mayor especificidad para sangrado severo fue el índice de choque con un 98.6% (Figura 2).
Tabla 4 Área bajo la curva de escalas para predicción de severidad en hemorragia digestiva baja
| Área bajo la curva (intervalo de confianza 95%) | |
|---|---|
| Rockall | 0.69 (0.50-0.87) |
| AIMS65 | 0.71 (0.25-0.91) |
| Glasgow Blatchford | 0.68 (0.49-0.86) |
| Charlson | 0.70 (0.52-0.87) |
| NOBLADS | 0.54 (0.33-0.74) |
| Strate | 0.57 (0.37-0.77) |
| BLEED | 0.70 (0.52-0.87) |
| Índice choque | 0.58 (0.36-0.79) |
| Oakland | 0.60 (0.41-0.80) |
| SHA2PE | 0.82 (0.65-0.99) |
Tabla 5 Área bajo la curva de las escalas para cada uno de los desenlaces de severidad en hemorragia digestiva baja
| Escala | Resangrado (IC) | Transfusión (IC) | Angiografía (IC) | Reingreso (IC) | UTI (IC) |
|---|---|---|---|---|---|
| Charlson | 0.63 (0.30-0.95) | 0.67 (0.48-8.61) | 0.62 (0.18-1.00) | 0.63 (0.36-0.91) | 0.67 (0.48-0.86) |
| Rockall | 0.71 (0.45-0.98) | 0.62 (0.41-0.83) | 0.71 (0.34-1.00) | 0.54 (0.19-0.88) | 0.70 (0.51-0.89) |
| NOBLADS | 0.61 (0.28-0.95) | 0.57 (0.36-0.78) | 0.61 (0.14-1.00) | 0.43 (0.75-0.79) | 0.57 (0.36-0.78) |
| Strate | 0.55 (0.16-0.93) | 0.56 (0.35-0.77) | 0.54 (0.16-1.00) | 0.55 (0.23-0.87) | 0.56 (0.35-0.77) |
| BLEED | 0.63 (0.30-0.95) | 0.67 (0.48-0.86) | 0.62 (0.18-1.00) | 0.63 (0.36-0.91) | 0.67 (0.48-0.86) |
| Oakland | 0.61 (0.28-0.95) | 0.57 (0.36-0.78) | 0.61 (0.14-1.00) | 0.62 (0.33-0.90) | 0.57 (0.36-0.78) |
| AIMS65 | 0.86 (0.71-1.00) | 0.66 (0.44-0.88) | 0.85 (0.65-1.00) | 0.51 (0.16-0.86) | 0.66 (0.44-0.88) |
| GBS | 0.66 (0.36-0.96) | 0.64 (0.43-0.84) | 0.66 (0.24-1.00) | 0.67 (0.42-0.92) | 0.64 (0.43-0.84) |
| SHA2PE | 0.85 (0.68-1.00) | 0.80 (0.61-0.98) | 0.83 (0.61-1.00) | 0.67 (0.35-1.00) | 0.80 (0.61-0.98) |
| Índice choque | 0.73 (0.28-1.00) | 0.61 (0.37-0.84) | 0.46 (0.00-1.00) | 0.64 (0.26-1.00) | 0.53 (0.30-0.76) |
IC: intervalo de confianza 95%, UTI: unidad de terapia intensiva, GBS: Glasgow-Blatchford score.

Figura 1 Área bajo la curva de escalas para predicción de severidad en hemorragia digestiva baja.GBS: Glasgow-Blatchford score.
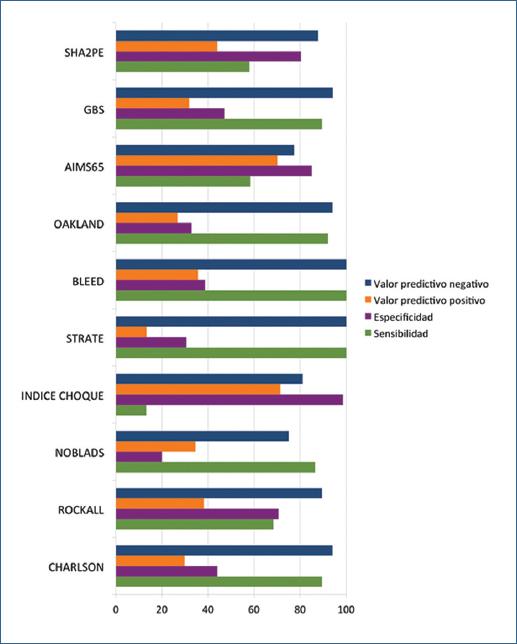
Figura 2 Sensibilidad, especificidad y valores predictivos positivos y negativos para las escalas de estratificación para sangrado severo en hemorragia digestiva baja.GBS: Glasgow-Blatchford score.
Por cada uno de los puntos positivos de la escala SHA2PE, se vio un incremento significativo (p 0.000) en la presencia de sangrado severo en nuestra población: 0 puntos 8.5%, 1 punto 21.6%, 2 puntos 35.7%, 3 puntos 51.6% y 4 puntos 66.7%.
Discusión
Las diversidades entre poblaciones, etiologías y factores de riesgo en pacientes con HDB hace que sea un padecimiento en el que es complicado realizar una predicción de severidad que sea aplicable de forma práctica y cotidiana.
En este trabajo se muestra la utilidad de 10 escalas para identificar correctamente a los pacientes con sangrado severo, de las cuales, solo la escala SHA2PE tiene una adecuada predicción para este desenlace compuesto, además que también predice de forma correcta a los pacientes que requieren transfusión, tratamiento mediante radiología intervencionista, ingreso a unidad de terapia intensiva y los que tuvieron reingreso hospitalario en los 30 días posteriores.
Una ventaja de la escala SHA2PE, además de su adecuada predicción de los desenlaces adversos en HDB, es que tiene una fácil aplicación, en donde se requiere elementos simples de la historia clínica como uso de antiagregantes y anticoagulantes, signos vitales y la cifra de hemoglobina a su ingreso a urgencias.











 nova página do texto(beta)
nova página do texto(beta)


