Introducción
La pancreatitis crónica es una patología compleja observada con frecuencia en gastroenterología, su incidencia anual es de 4 casos por cada 100,000 personas-año y se caracteriza por inflamación crónica y fibrosis del páncreas. Las complicaciones tardías relacionadas con esta entidad incluyen estenosis del conducto pancreático, litiasis pancreática, pseudoquiste pancreático, fístulas y dolor abdominal crónico, en ocasiones es necesario realizar un manejo multidisciplinario y multimodal para el alivio de los síntomas incluyendo endoscopia, radiología intervencionista y cirugía pancreática1.
La terapia endoscópica en pancreatitis crónica va dirigida principalmente al alivio del dolor abdominal y el manejo de complicaciones. El dolor abdominal asociado a pancreatitis crónica puede abarcar desde molestias inespecíficas posprandiales hasta un dolor incapacitante. Se han propuesto diversos mecanismos para explicar el dolor abdominal en pancreatitis crónica, por vía de estímulos nociceptivos de origen visceral, anormalidades estructurales provocadas por la obstrucción del conducto pancreático y el daño neurológico secundario a inflamación y fibrosis, por lo tanto el manejo endoscópico puede dirigirse a diferentes blancos terapéuticos. Los abordajes de tratamiento endoscópico para el dolor de origen pancreático incluyen el bloqueo del plexo celiaco, drenaje endoscópico de pseudoquiste pancreático, descompresión del conducto pancreático y tratamiento de estenosis biliares benignas secundarias a pancreatitis crónica, las cuales se revisarán a continuación2.
Manejo del dolor
Bloqueo del plexo celiaco guiado por ultrasonido endoscópico
El plexo celiaco se localiza anterolateral a la aorta a nivel de L1, se encuentra conformado por diferentes ganglios incluyendo ganglios aórticos, renales y mesentéricos; en él se combinan fibras nerviosas del sistema simpático y parasimpático. Diversos órganos abdominales reciben inervación por vía del plexo celiaco incluyendo el hígado, páncreas, vesícula biliar, estómago, bazo, riñones, intestino delgado y 2/3 del colon proximal. El dolor en pancreatitis crónica puede ser visceral (en el 22%) y no visceral (en el 78%), lo cual explica la diversidad en la respuesta al tratamiento3. El bloqueo del plexo celiaco es un procedimiento de segunda línea para el manejo del dolor en pancreatitis crónica, se realiza guiado por ultrasonido endoscópico (USE), este método ha demostrado ser superior al procedimiento guiado por tomografía computarizada o fluoroscopia4. Se han evaluado estudios acerca de la eficacia del bloqueo del plexo celiaco, los estudios actuales presentan variabilidad en la forma de evaluar la respuesta al tratamiento, en promedio se espera una respuesta del 60-70% con mejoría de los síntomas además de reducir la dependencia al uso de narcóticos, con duración de la respuesta desde 1 semana a 1 mes y pérdida posterior del efecto analgésico; se ha observado una mejor respuesta en pacientes de edad avanzada y aquellos pacientes que responden en la primera sesión de bloqueo del plexo. Mediante USE se localiza la emergencia del tronco celiaco, posteriormente se inyectan anestésicos locales y esteroides que inhiben temporalmente el plexo, reducen la inflamación y mejoran la calidad de vida5. Existen dos técnicas para la administración de los fármacos, la inyección bilateral o unilateral y la inyección directa al ganglio celiaco, sin embargo no se ha encontrado una diferencia significativa entre ellas. Los fármacos utilizados son bupivacaína 20 ml al 25% con 80 mg (4 ml) de triamcinolona6. El procedimiento se encuentra contraindicado en pacientes con inmunocompromiso por el riesgo de infección y en coagulopatía o trombocitopenia, que incrementan el riesgo de hemorragia. Dentro de los eventos adversos se incluye diarrea (1-20%), hipotensión ortostática (1-20%), exacerbación del dolor (en el 9%) a las 48 horas, infección y hemorragia; una complicación infrecuente es la lesión a la arteria de Adamkiewicz, que irriga el segmento medular anterior y puede llevar al síndrome de la arteria espinal anterior7.
Descompresión del conducto pancreático
La obstrucción del conducto pancreático puede presentarse secundario a litiasis pancreática, estenosis del conducto pancreático y/o compresión del conducto pancreático por un pseudotumor o pseudoquiste pancreático. La descompresión del conducto pancreático se lleva a cabo mediante la realización de los siguientes procedimientos: 1) esfinterotomía pancreática, 2) colocación de prótesis pancreática, y 3) extracción de litos en el conducto pancreático.
Esfinterotomía pancreática
Mediante la esfinterotomía pancreática se descomprime el conducto pancreático. Este procedimiento permite el acceso al conducto pancreático para realizar futuros procedimientos terapéuticos, en caso de obstrucción ampular puede considerarse la esfinterotomía pancreática como monoterapia. El procedimiento se puede realizar de dos maneras, canulando la papila mayor mediante el uso de un esfinterotomo, dirigiendo el accesorio y realizando el corte hacia la posición 1 de las manecillas del reloj; la segunda técnica se realiza con aguja cortante, ya sea colocando o no una prótesis plástica pancreática previo al corte8. Un estudio aleatorizado demostró resultados a favor de realizar la esfinterotomía con aguja cortante sobre una prótesis plástica, ya que este método se asoció a una menor tasa de complicaciones, en particular pancreatitis post-Colangiopancreatografía retrógrada endoscópica (CPRE) comparado con la técnica estándar 0 y 29%, sin embargo esta técnica se ha asociado a reestenosis de la esfinterotomía en el 15-30% en algunas series de casos9.
Endoprótesis pancreática
Las prótesis pancreáticas se utilizan para el tratamiento de las estenosis del conducto pancreático, fugas o en caso de litiasis pancreática no resuelta. La respuesta al tratamiento suele ser favorable, sin embargo la respuesta a largo plazo es subóptima. Se utilizan prótesis de 3-5 Fr y en casos en los cuales el conducto pancreático se encuentra dilatado se utilizan prótesis de 7-10 Fr10. En pacientes con estenosis recurrentes se utilizan múltiples prótesis plásticas para dilatar la estenosis. Actualmente existe poca información acerca de cuánto tiempo debe permanecer colocada la prótesis pancreática. Existen diferentes tipos de prótesis plásticas, con variaciones en el calibre y el material. Las prótesis metálicas totalmente cubiertas se han evaluado en el tratamiento de estenosis del conducto pancreático. Una preocupación con este tipo de prótesis es la obstrucción de conductos secundarios debido a la cobertura de la prótesis, la respuesta se ha reportado de hasta el 80-100% con este tipo de prótesis, sin embargo el seguimiento ha sido a corto plazo (5 meses)11,12. En la actualidad la evidencia es a favor de utilizar prótesis plásticas de mayor calibre, basado en un estudio que evaluó la colocación de múltiples prótesis plásticas en el conducto pancreático con un seguimiento de 38 meses, con un 84% de los pacientes encontrándose asintomáticos13.
Extracción de lito y litotricia endoscópica
Los litos en el conducto pancreático pueden provocar obstrucción y aumento de la presión intraductal activando la cascada inflamatoria, lo cual lleva a mayor fibrosis (Ver Figura 1). Existen diversos métodos para la extracción del lito, se puede realizar por vía retrógrada utilizando canastillas de Dormia, balones extractores o fórceps, los factores que se asocian a mayor éxito son litos pequeños, móviles, sin estenosis del conducto pancreático. La extracción de litos > 5 mm puede no ser posible con técnicas estándar, y en casos donde existe un lito impactado, se utilizan la litotricia extracorpórea (LTEC) y la litotricia intraductal.
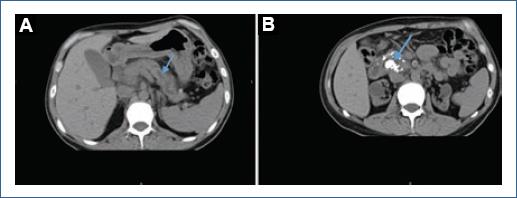
Figura 1 A: tomografía simple de abdomen donde se observa el conducto pancreático dilatado a nivel de cuerpo y cola de páncreas (flecha). B: tomografía computarizada simple de abdomen donde se observan calificaciones a nivel de la cabeza del páncreas (flecha).
La LTEC es otro método útil en litos > 5 mm, litos impactados o aquellos localizados detrás de una zona de estenosis, destruye los litos pancreáticos en el 90% de los casos y se asocia con aclaramiento espontáneo en el 80% sin necesidad de endoscopia, siendo el objetivo una fragmentación < 3 mm14.
La litotricia a través del endoscopio consiste en destruir los litos con catéteres especiales mediante pancreatoscopia. Existen dos tipos de litotricia endoscópica, la electrohidráulica y la litotricia láser, con la posibilidad de mantener visión directa en el conducto pancreático reduciendo complicaciones como hemorragia y perforación. Un estudio reciente evaluó la seguridad y eficacia de la pancreatografía retrógrada endoscópica (PRE) y la pancreatoscopia comparado con PRE, encontrando mayor éxito técnico (98.9 vs. 87.6%) en aquellos pacientes en los que realizó pancreatoscopia permitiendo la extracción efectiva de los litos cuando la técnica estándar no fue posible15.
Drenaje de pseudoquiste pancreático
El pseudoquiste pancreático es una complicación que se desarrolla en el 20-40% de los pacientes con pancreatitis crónica, a diferencia de los pacientes con pancreatitis aguda solo una minoría de estos pseudoquistes resuelven de manera espontánea16.
La terapia endoscópica es el procedimiento de elección para el tratamiento de los pseudoquistes, con resultados comparables con la cirugía, asociados a menor costo, menor estancia hospitalaria y mejoría en la calidad de vida. Las indicaciones de tratamiento incluyen dolor abdominal, saciedad temprana, pérdida de peso, náuseas y vómitos asociados a obstrucción el tracto de salida gástrico, ictericia e infección; también se pueden considerar en pacientes asintomáticos con un pseudoquiste > 5 cm que no resuelve de manera espontánea tras 3-6 meses de seguimiento. Existen dos métodos para realizar el drenaje del pseudoquiste: el drenaje transpapilar y el drenaje transmural, este último idealmente se realiza guiado por USE17. La European Society of Gastrointestinal Endoscopy (ESGE) recomienda el uso de múltiples prótesis plásticas doble cola de cochino para realizar el drenaje con un mínimo de tiempo de 2 meses hasta la resolución del quiste, ya que el retiro prematuro se asocia a recurrencia; el éxito clínico se define como una reducción del 30-50% en el diámetro de la colección en 1 mes, logrando un éxito técnico más del 90%, las complicaciones ocurren en el 13% con mortalidad del 0.3%.
Drenaje transpapilar
Se recomienda cuando la colección se encuentre comunicada con el conducto pancreático principal y el quiste mida < 6 cm de diámetro, manteniendo un drenaje por un periodo de 4-6 semanas para pseudoquistes pequeños localizados en cabeza o cuerpo de páncreas con un éxito del 80%. Se prefiere el uso de prótesis plásticas doble cola de cochino 10 Fr para prevenir la migración de la prótesis18.
Drenaje transmural
En casos donde el pseudoquiste no comunica con el conducto pancreático se puede realizar por endoscopia una cistogastrostomía o cistoduodenostomía. Si se visualiza compresión del pseudoquiste se puede realizar por vía endoscópica, la localización del pseudoquiste debe ser < 1-1.5 cm de distancia de la pared gástrica. El USE se encuentra indicado en casos de hipertensión portal o ausencia de compresión visible por vía endoscópica para evitar complicaciones, el éxito del USE ha sido reportado en el 88-95%. Durante el procedimiento se localiza el sitio de punción y posteriormente se utiliza coagulación y un balón dilatador para crear el trayecto y colocar una prótesis plástica o metálica con un éxito del 95% a los 3 meses17,18. El uso de prótesis metálicas autoexpandibles o prótesis de aposición luminal no ha demostrado superioridad en el drenaje del pseudoquiste, la ventaja que demuestran sobre las prótesis plásticas es que se puede crear un diámetro de drenaje mayor reduciendo el tiempo que lleva para la resolución del pseudoquiste y menor oclusión de la prótesis, las desventajas incluyen la hemorragia y migración de la prótesis19. El uso de prótesis metálicas con sistema antimigración podría evitar esta última complicación20.
Estenosis biliares asociadas a pancreatitis crónica
Las estenosis biliares intrapancreáticas se encuentran en el 3-46% de los pacientes con pancreatitis crónica, esta complicación ocurre secundaria a fibrosis o compresión extrínseca por colecciones líquidas peripancreáticas, y puede llevar a colangitis, litiasis biliar y cirrosis biliar secundaria en el 10% de los casos. Cuando son diagnosticadas es importante descartar la presencia de un proceso neoplásico21. El tratamiento consiste en colocar una endoprótesis biliar plástica o metálica para mantener el drenaje biliar. Se ha demostrado en estudios que este tipo de estenosis pueden ser refractarias al tratamiento, la colocación de una endoprótesis biliar plástica se asocia a altas tasas de falla terapéutica, un estudio no aleatorizado demostró éxito clínico del 24 vs. 92% colocando una prótesis plástica vs. múltiples prótesis plásticas. Por este motivo la recomendación actual es utilizar múltiples prótesis plásticas con recambios cada 3 meses y duración del tratamiento mínimo de 1 año22. En cuanto a las prótesis metálicas un estudio comparó estas prótesis con el uso de prótesis plásticas demostrando no inferioridad. La ESGE recomienda la colocación de una endoprótesis biliar en estenosis sintomáticas, cirrosis biliar secundaria o elevación asintomática de la fosfatasa alcalina > 2-3 veces límite superior normal o elevación de bilirrubina total > 1 mes. Continúa en estudio cuál es la prótesis ideal para el tratamiento de estenosis biliares, la duración y los recambios de prótesis necesarios23.
Conclusiones
En conclusión, los avances tecnológicos y la mejoría en las técnicas endoscópicas han permitido expandir la capacidad de tratamiento en pancreatitis crónica, sin embargo en la actualidad continúa siendo un reto para el gastroenterólogo. El manejo endoscópico permanece como el tratamiento de primera línea en las diversas complicaciones asociadas a la enfermedad, sin embargo es importante recordar que se requiere de un equipo multidisciplinario para el adecuado manejo de este grupo de pacientes.











 nova página do texto(beta)
nova página do texto(beta)


