Introducción y objetivo
La biopsia por aspiración con aguja fina guiada por ultrasonido (USE-BAAF) se ha convertido en un método eficaz para el diagnóstico de tejidos en pacientes con anomalías de una gran variedad órganos. Por esta razón, la USE-BAAF ahora se incorpora a los algoritmos de estudio de pacientes con sospecha de neoplasias de mediastino y abdominales. Por otra parte, el ultrasonido (USE) intervencionista recientemente se ha extendido en todo el mundo, no solo para ampliar un diagnóstico sino también para una intervención terapéutica. Sin embargo, continua controversia en múltiples estudios sobre los diferentes aspectos técnicos de la USE-BAAF en el resultado histopatológico, principalmente la aspiración, tipo de aguja y la presencia de un citopatólogo en el lugar donde se realiza el procedimiento. El uso de USE-BAAF es fundamental en varios procedimientos intervencionistas, y el aprendizaje de técnicas básicas de aspiración con aguja fina (BAAF) es importante para realizar un diagnóstico con alta efectividad1-4.
La precisión diagnóstica oscila entre el 68.4 y el 84.3%, dependiendo de varios factores. En primer lugar, la precisión del diagnóstico depende de la inmediatez de la revisión de la muestra para la adecuación del muestreo por un citopatólogo en el sitio de la toma, que rara vez está disponible durante el procedimiento. En segundo lugar, algunos tumores, como adenocarcinomas bien diferenciados, tumores del estroma o linfomas, son difíciles de diagnosticar basándose únicamente en la citología porque la USE-BAAF típicamente destruye la arquitectura del tejido y la inmunocitología a menudo no se puede realizar5-6.
El objetivo de este estudio es demostrar la seguridad, rendimiento diagnóstico y aspectos técnicos involucrados en la adecuación del muestreo de ganglios linfáticos por USE-BAAF con énfasis en el uso de succión. Existen actualmente en la literatura muchos artículos que hablan de los aspectos técnicos de la toma de biopsia en tumores de mediastino y abdomen por USE, pero pocos son los que hacen énfasis en la toma de biopsia de ganglios linfáticos y por lo general estas estructuras debido a su menor tamaño pueden representar un reto para cualquier ecoendoscopista experimentado.
Material y métodos
Se realizó un estudio ambispectivo incluyendo todos los pacientes con toma de biopsia de ganglios sospechosos para malignidad durante los estudios de USE realizados en el año 2018 en el Instituto Nacional de Cancerología por dos experimentados ecoendoscopistas con un equipo lineal Olympus® GF-UCT180/EU-ME2. Se analizaron las características morfológicas de los ganglios, tipo de aguja, succión (estilete vs. jeringa con presión negativa a 15 cc), número de pases y la presencia de citopatología durante el estudio como variables que pudieran tener impacto sobre la adecuación final de las muestras. Todas las biopsias se enviaron a revisión rápida y análisis final en bloque celular.
Se realizó un análisis descriptivo mediante medias y porcentajes dependiendo el tipo de variable. El análisis inferencial se obtuvo mediante pruebas paramétricas y no paramétricas dependiendo de la distribución y tipo de variable tomando en cuenta una significancia estadística de p ≤ 0.05. Finalmente incluimos un subanálisis para asociar a un diagnóstico maligno las características morfológicas de los ganglios (tamaño, forma y ecogenicidad). Se utilizó el programa estadístico SPSS® en su versión 25.
Resultados
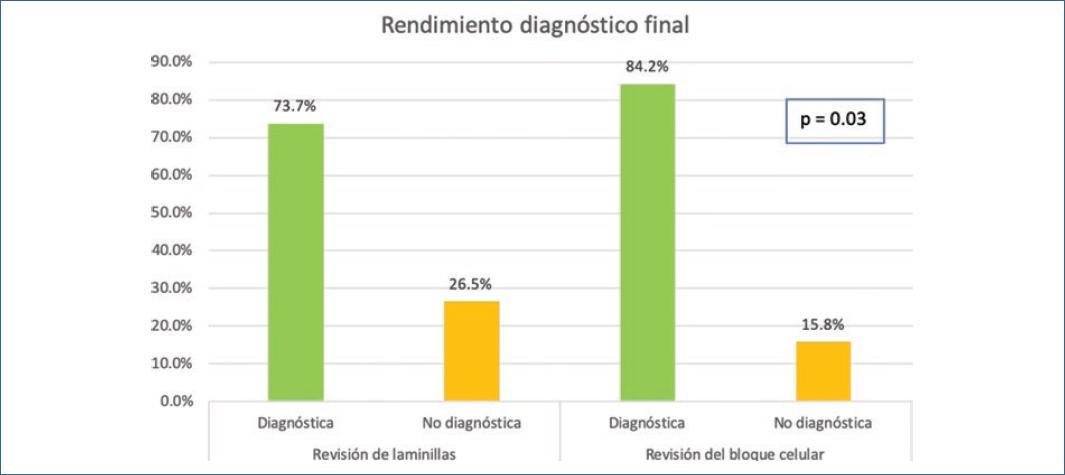
Se realizaron un total de 38 tomas de biopsias por USE de ganglios; la mayor parte de los pacientes fueron mujeres (68.4%) con edad media de 58.32 ± 9.90 años, la mayoría con localización en la región periportal (31.6%), el diagnóstico de envío principal fue tumor de páncreas (28.9%) y el resultado final predominante fue hiperplasia linfoide reactiva (39.5%). Se obtuvo material en el 100% de los estudios aunque se reportó solo un 73.7% de muestras adecuadas para el diagnóstico durante la revisión rápida de laminillas, sin embargo el rendimiento diagnóstico final fue del 84.2% (p = 0.031) después de la revisión del bloque celular (Tabla 1) (Fig. 1). Al realizar el análisis univariante no se encontró significancia estadística por parte de ninguna de las variables incluidas en el impacto de la adecuación de la muestra (Tabla 2). Tampoco se encontraron características morfológicas de los ganglios que pudieran asociarse con un resultado histológico positivo para malignidad (Fig. 2 y Tabla 3). No se reportaron complicaciones durante este estudio.
Tabla 1 Comparación de rendimiento diagnóstico de la revisión rápida vs. bloque
| Muestra | Frecuencia | Porcentaje | p ≤ 0.05 |
|---|---|---|---|
| Revisión rápida | |||
| Diagnóstica | n = 28 | 73.7% | 0.031 |
| No diagnóstica | n = 10 | 26.3% | |
| Revisión del bloque | |||
| Diagnóstica | n = 32 | 84.2% | |
| No diagnóstica | n = 6 | 15.8% | |
Tabla 2 Impacto de las variables en la adecuación de la muestra
| Variable (n = 38) | Grupos | Media ± DE/porcentaje | Valor p < 0.05 |
|---|---|---|---|
| Sexo | Mujeres (n = 26) | 68.4% | 0.144 |
| Hombres (n = 12) | 31.6% | ||
| Edad (años) | NA | 58.32 ± 9.90 | 0.588 |
| Tamaño del ganglio (mm) | NA | 19.97 ± 9.12 | 0.151 |
| Tamaño del ganglio | < 10 mm (n = 2) | 5.3% | 0.385 |
| > 10 mm (n = 36) | 94.7% | ||
| Número de pases | NA | 2.08 ± 0.71 | 0.689 |
| Número de pases | > 2 (n = 6) | 15.8% | 0.671 |
| ≤ 2 (n = 32) | 84.2% | ||
| Ecogenicidad | Hipoecoico (n = 37) | 97.4% | 0.545 |
| Hiperecoico (n = 1) | 2.6% | ||
| Localización | Periportal (n = 12) | 31.6% | 0.111 |
| Paratraqueal derecho (n = 1) | 2.6% | ||
| Celiaco (n = 8) | 21.1% | ||
| Mesentérico (n = 2) | 5.3% | ||
| Peripancreático (n = 5) | 13.2% | ||
| Subcarinal (n = 4) | 10.5% | ||
| Paraesofágico (n = 3) | 7.9% | ||
| Aortopulmonar (n = 1) | 2.6% | ||
| Cístico (n = 1) | 2.6% | ||
| Retroperitoneo (n = 1) | 2.6% | ||
| Forma | Redondo (n = 34) | 89.5% | 0.950 |
| Triangular (n = 4) | 10.5% | ||
| Tipo de aguja | Slimline (n = 18) | 47.4% | 0.385 |
| Procore (n = 18) | 47.4% | ||
| MTW (n = 1) | 2.6% | ||
| Acquire (n = 1) | 2.6% | ||
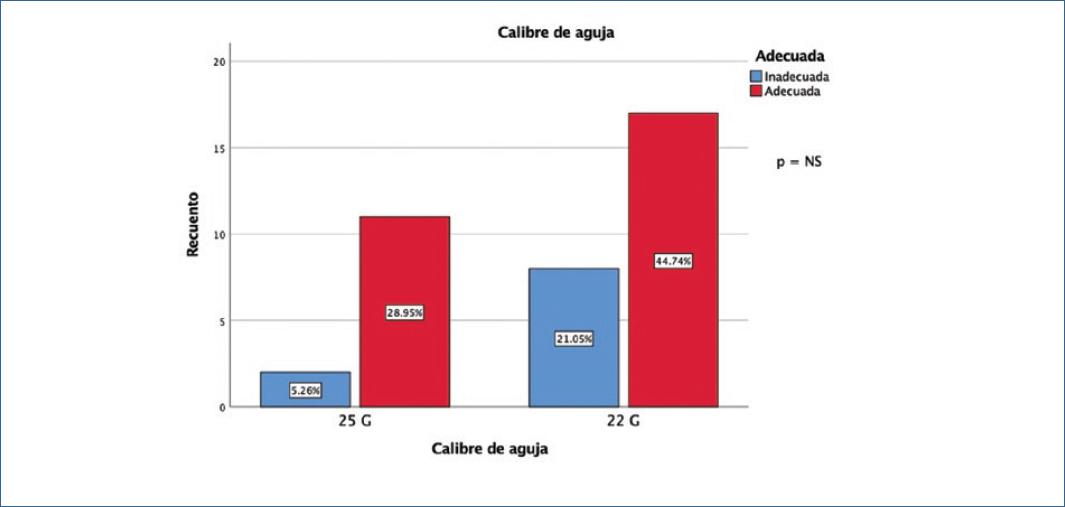
| Calibre de aguja | 22 (n = 25) | 65.8% | 0.270 |
| 25 (n = 13) | 34.2% | ||
| Succión | Con succión (n = 21) | 55.3% | 0.258 |
| Sin succión (n = 17) | 44.7% | ||
| Citopatólogo en sitio de BAAF | Presente (n = 27) | 71.2% | 0.434 |
| Ausente (n = 11) | 28.9% |
*DE: desviación estándar; NA: no aplica; BAAF: biopsia por aspiración con aguja fina.

Figura 2 A: ganglio mediastinal. B: ganglio peripancreático visualizado con asistencia de elastografía.
Tabla 3 Predictores de malignidad de acuerdo con características morfológicas de los ganglios
| Característica | Grupos | Porcentaje (%) | Valor p < 0.05 |
|---|---|---|---|
| Ecogenicidad | Hipoecoico (n = 37) | 97.4% | 0.715 |
| Hiperecoico (n = 1) | 2.6% | ||
| Localización | Periportal (n = 12) | 31.6% | 0.132 |
| Paratraqueal derecho (n = 1) | 2.6% | ||
| Celiaco (n = 8) | 21.1% | ||
| Mesentérico (n = 2) | 5.3% | ||
| Peripancreático (n = 5) | 13.2% | ||
| Subcarinal (n = 4) | 10.5% | ||
| Mediastinal (n = 3) | 7.9% | ||
| Aortopulmonar (n = 1) | 2.6% | ||
| Cístico (n = 1) | 2.6% | ||
| Retroperitoneo (n = 1) | 2.6% | ||
| Forma | Redondo (n = 34) | 89.5% | 0.174 |
| Triangular (n = 4) | 10.5% | ||
| Tamaño | < 10 mm (n = 2) | 5.3% | 0.502 |
| > 10 mm (n = 36) | 94.7% |
Discusión
La BAAF es un método de mínima invasión para muestreo citológico que se realiza después de la detección de una masa sospechosa por medio de imágenes incluido el USE, que se practica desde 19917-9. El páncreas y los ganglios linfáticos torácicos e intraabdominales son los sitios más comunes donde se toma biopsia por BAAF-USE mediante acceso endoscópico, aunque esta técnica puede usarse en otros campos como en neumología, urología y endocrinología. La técnica no es fácil de dominar, pero en manos expertas se han reportado estudios con tasas de éxito de hasta el 95%10-12. Tomando en cuenta que lo anterior se refiere a lesiones grandes, nuestro estudio tuvo un alto rendimiento diagnóstico en BAAF de ganglios al revisarse en el bloque definitivo (84.2%) comparada con la revisión rápida (73.7%) representando una diferencia del 10.5% (p = 0.031).
El USE permite obtener imágenes de lesiones desde 5 mm con posibilidad de tomar una biopsia, el tamaño de las lesiones, pequeñas (< 25 mm) o grandes (> 25 mm), no necesariamente influye en el rendimiento diagnóstico, sensibilidad, especificidad o precisión del método13. En nuestro estudio decidimos dividir el tamaño de los ganglios como grandes y pequeños con punto de corte en 10 mm donde la mayoría (94.7%) lo sobrepasó pero sin tener impacto en la adecuación de la muestra (p = 0.385) o en la asociación con malignidad (p = 0.502).
Collins, et al. demostraron que en lesiones pancreáticas el uso de la evaluación rápida en el sitio mediante BAAF-USE resultó en un menor número de pacientes sometidos a procedimientos repetitivos. De forma similar, en una revisión retrospectiva de 646 pacientes que se sometieron a BAAF-USE con evaluación rápida, se proporcionó un diagnóstico definitivo en el 97.7% de los casos, en contraste al 64.8% de los casos cuando las laminillas fueron preparadas por enfermeras técnicas de endoscopia14-15. Wani, et al. demostraron que la evaluación inmediata de la citopatología en el sitio podría no ser absolutamente vital durante la BAAF-USE de masas pancreáticas. Aunque este estudio reveló rendimiento diagnóstico comparable y muestra inadecuada durante BAAF-USE con y sin evaluación inmediata, el grupo de evaluación en el sitio requirió menos pases en comparación con la BAAF-USE sin evaluación en el sitio16. Otro estudio, de OConnor, et al., reveló hallazgos similares, sin embargo compararon sus datos de BAAF-USE sin evaluación in situ con los datos de la literatura de BAAF-USE con una evaluación in situ, por lo que incorpora un sesgo en el estudio17. En nuestro estudio la presencia de citopatólogos en sitio de la BAAF-USE no tuvo impacto en la adecuación de la muestra (p = 0.434).
Las complicaciones más comunes de la BAAF-USE son pancreatitis (1-2%), hemorragia (0-1.3%), perforación (0-0.4%) e infección (0.3%), con riesgo mínimo de bacteriemia y siembra tumoral. El rango óptimo de pases de cualquier lesión es de 2 a 6 en la mayoría de los estudios. En un estudio de Monhaty, et al. el rango de pases de aguja varió de 1 a 14 con una media de 2.6 y una mediana de 218. En un estudio de Erickson, et al. el diagnóstico de masas pancreáticas, metástasis hepáticas y lesiones de ganglios linfáticos requirió 5-6 y 2-3 pases, respectivamente, en ausencia de un citopatólogo19. La media de pases en nuestro estudio fue de 2, sin tener impacto en la adecuación de la muestra (p = 0.689). Tampoco aquellos casos en los que se dieron más de 2 pases tuvieron mejores resultados (p = 0.671).
La aplicación de succión durante la BAAF-USE ha sido controvertida porque puede causar daños a la estructura celular y la contaminación con sangre al tratar de aumentar la cantidad de células en la muestra. Diferentes niveles de presión negativa se han aplicado para buscar un equilibrio entre cantidad y calidad del espécimen20-21. Algunos de los estudios sugirieren que la succión baja o nula reduce la contaminación de sangre y mejora la calidad de la muestra22-23. Otros estudios sugieren que con una alta presión negativa se obtiene más muestra de tejido para el examen histológico, mejorado la precisión diagnóstica24-25. Sin embargo, no hay un consenso sobre la técnica de succión óptima.
La técnica de succión lenta es la técnica de succión más reciente, con una fuerza de succión muy débil. Un estudio mostró que la fuerza de succión producida por esta técnica con una aguja de 22 gauges fue menor que 2.0 kPa, que es significativamente más bajo que aquellas técnicas de succión con jeringas de 10 ml y 20 ml. Una fuerza de succión tan pequeña puede ayudar a obtener suficientes muestras con contaminación mínima de sangre26. Chen, et al. en su estudio comparan la técnica de succión lenta vs. succión con jeringas de 5, 10 y 20 ml y mostró una mayor precisión (90.3 vs. 63.2 vs. 58.8 vs. 55.6% respectivamente), lo cual fue altamente significativo. No se encontraron diferencias en cuanto a la localización de la lesión27. En nuestro estudio no hubo impacto en la adecuación de la muestra al comparar el uso succión (55.3%) vs. no succión (44.7%), teniendo en cuenta que los casos en que se aplicó fue con 15 cc (p = 0.258). Tampoco los tipos y calibres de aguja que utilizamos en este caso, 22 (65.8%) y 25 (34.2%), tuvieron repercusión en el resultado (p = 0.270) (Figs. 3 y 4).
Conclusiones
Aunque la muestra es pequeña, este es uno de los primeros estudios en su tipo en nuestra población y podemos concluir que la tasa de éxito técnico y rendimiento diagnóstico se asemejan a los reportados previamente en estudios donde se puncionan otro tipo de lesiones, sin embargo debemos tomar en cuenta que los ganglios linfáticos son estructuras más pequeñas y por lo tanto requieren de mayor destreza en la técnica de BAAF independientemente del tipo de agujas, tipo de succión, la presencia de citopatología en el sitio de la toma y las características morfológicas de las lesiones. Sugerimos enviar una muestra a revisión rápida y otra a bloque siempre que sea posible, ya que en ocasiones las muestras pueden ser reportadas como inadecuadas durante la revisión rápida pero con posibilidad de aumentar el rendimiento del diagnóstico definitivo al evaluar el bloque celular hasta un 10% más.











 nova página do texto(beta)
nova página do texto(beta)