Introducción
Las colecciones pancreáticas se forman como consecuencia de cuadros de pancreatitis aguda, pancreatitis crónica, traumatismos y/o cirugías; de la primera entidad la Clasificación de Atlanta maneja dos tipos de colecciones posteriores a la pancreatitis aguda de acuerdo con las lesiones previas: el pseudoquiste pancreático (PQP) por una pancreatitis intersticial y necrosis encapsulada posterior a una pancreatitis necrótica.
Debido a que la gran mayoría de las colecciones son asintomáticas y a que el 50% se reabsorben de manera espontánea, se sugiere que inicialmente se lleve a cabo un manejo expectante y el consenso actual es que solo en aquellos pacientes que presenten sintomatología se realice algún tratamiento. Los principales síntomas que pueden ocasionar estas colecciones son dolor abdominal, sepsis, obstrucción gástrica, obstrucción biliar e intolerancia a la vía oral.
El drenaje de colecciones, no importa la etiología, ha evolucionado a lo largo de los años conforme se desarrollan nuevas técnicas. Actualmente el drenaje endoscópico es una de las técnicas más eficaces y seguras. El uso del ultrasonido endoscópico (USE) ha demostrado ser tan exitoso como el abordaje endoscópico convencional y con semejante tasa de complicaciones en casos seleccionados; sin embargo, el uso de USE tiene como consecuencia que un número mayor de colecciones sean susceptibles de ser drenadas.
El USE presenta algunas ventajas que lo convierten en tratamiento de elección para estos pacientes: la primera es la colocación de un drenaje interno en lugar de uno externo como el drenaje percutáneo, lo que evita molestias al paciente y el riesgo de infección por malos cuidados del catéter; otra ventaja es que se puede colocar una sonda de irrigación interna, lo que igualmente disminuye la recurrencia por disfunción de catéteres, la cual se ha reportado hasta en el 70% de los casos; finalmente, una ventaja frente al drenaje convencional es la visualización de vasos en la zona de punción, lo que evita lesionarlos y provocar sangrado durante el procedimiento. Los pacientes con hipertensión portal son un grupo con especial beneficio en este sentido. Un metaanálisis realizado por Panamonta, et al. en el 2012 no demostró diferencias entre drenaje guiado por USE y endoscópico convencional, concluyendo que el USE se recomienda en pacientes con coagulopatía, hipertensión portal y con pseudoquistes no protruyentes.
Necrosis pancreática
Los casos de necrosis pancreática encapsulada tienen buenos resultados con el tratamiento endoscópico. Sin embargo, las características propias de este tipo de colecciones hacen que la tasa de éxito sea menor a la obtenida en el caso de los PQP. Para mejorar la efectividad del drenaje endoscópico se han utilizado estrategias como la colocación de múltiples prótesis, el uso de prótesis de mayor calibre y la colocación de sonda de nasocolección para irrigación e incluso, ya de manera más invasiva, la necrosectomía endoscópica directa. La implementación de estas técnicas ha aumentado el éxito del drenaje endoscópico hasta un 70-90%, como lo demuestran los estudios publicados (Tabla 1).
Tabla 1 Estudios reportados hasta el momento en relación con el drenaje de necrosis pancreática por endoscopia
| Autor/año | N | Diseño | Éxito | Complicaciones | Recurrencia |
|---|---|---|---|---|---|
| Baron, et al., 199619 | 11 | Prospectivo | 81% | 45% | 9% |
| Baron, et al., 200220 | 43 | Retrospectivo | 72% | 37% | 29% |
| Seewald, et al., 200521 | 13 | Retrospectivo | 92% | 15% | 15% |
| Hookey, et al., 200622 | 8 | Retrospectivo | 25% | 25% | 15.5% |
| Jürgensen, et al., 201223 | 35 | Prospectivo | 94% | 9% | - |
| Rana, et al., 201324 | 20 | Prospectivo | 95% | - | 0% |
Existen dos técnicas para la necrosectomía endoscópica: la necrosectomía transmural y la necrosectomía endoscópica directa. En el caso de la necrosectomía transmural el procedimiento termina al colocar al menos dos prótesis doble cola de cochino o, de preferencia, una prótesis metálica de diámetro amplio (15,16 o 20 mm) con un extremo dentro de la colección y el otro extremo dentro de la luz gástrica o duodenal.
Técnica drenaje endoscópico
Se puede realizar con o sin asistencia de fluoroscopia. En experiencia de los autores siempre se debe realizar con el paciente intubado para evitar broncoaspiación. Se requiere el uso de un ecoendoscopio lineal con un canal de trabajo terapéutico (3.7 o 3.8 mm). Una vez el paciente está anestesiado y con intubación orotraqueal se introduce el ecoendoscopio hasta el estómago o duodeno y se procede a la localización de la colección, se identifica la zona más cercana al tubo digestivo y se visualiza la pared y los vasos circundantes, intentando obtener una posición adecuada para la punción donde no haya torsión excesiva del equipo y nos permita una buena ventana terapéutica (Fig. 1A). Usualmente los PQP son fáciles de identificar por su franco contenido líquido, pero no así las colecciones necrosadas, cuyo contenido heterogéneo puede hacer más compleja la identificación y delimitación de la colección y más difícil su drenaje8. Después de conseguir una visión adecuada del sitio a puncionar se introduce una aguja calibre 19 G al canal del equipo y se realiza la punción (Fig. 1B), se aspira brevemente, se observan las características del líquido y se obtiene muestra para cultivo o análisis de laboratorio. Tras la punción y toma de muestras se avanza una guía 0.035” al interior de la colección (Fig. 1C) y posteriormente se amplia la fístula creada, para lo cual se puede utilizar un cistotomo 6F (Fig. 1D), utilizado principalmente en Europa, que cuenta con un aditamento para cauterizar la zona de punción. Después del uso del cistostomo se utilizan balones de dilatación CRE, Max Force, Hércules para dilatar la fístula hasta un diámetro que permita el paso de la prótesis sin resistencia (Fig. 1E); posteriormente se colocan las prótesis plásticas o metálicas, que perpetuarán la fístula recién creada (visión ultrasonográfica, Fig. 1F; visión endoscópica, Fig. 1G). Algunos autores recomiendan colocar una prótesis plástica a través de la prótesis metálica con el fin de disminuir la migración y evitar el contacto de la prótesis metálica con algún vaso sanguíneo (Fig. 1H). En colecciones con detritus que comprendan más del 30% del contenido de la colección o en casos de necrosis, se aconseja utilizar un drenaje nasoquístico, con éxito reportado de 79-85% (Fig. 2). La necrosectomía endoscópica directa (Fig. 3A) es recomendada por la mayoría de los autores. Consiste en introducir un endoscopio dentro de la colección y con ayuda de diferentes accesorios como canastillas de Dormia (Fig. 3A), asas de polipectomía (Fig. 3B) o trípodes (Fig. 3C) se retiran los restos necróticos a la luz del tubo digestivo (Fig. 3D) y posteriormente se irriga con solución fisiológica, algunos autores usan peróxido de hidrógeno o incluso antibióticos, en ambos casos aún se requieren más estudios para evaluar su eficacia. Este procedimiento se repite hasta obtener un completo drenaje de la colección. En los últimos años se han publicado varios estudios sobre el uso de prótesis metálica y/o plásticas, sus ventajas y desventajas; dentro de las ventajas teóricas que ofrecen las prótesis metálicas se encuentran el tiempo más corto de procedimiento al colocar solo una prótesis, mayor facilidad, el calibre mayor (por el que incluso puede pasar un endoscopio) y la menor tasa de obstrucción.

Figura 1 Drenaje de PQP por USE. (A) Delimitación de las paredes (flecha blanca), diámetro (líneas punteadas) y el sitio de punción (flecha amarilla); (B) Introducción de aguja 19 gauges (flecha amarilla); (C) Introducción de guía 0.035 (flecha blanca) a través de la aguja (flecha amarilla); (D) Introducción de cistostomo 6 french (flecha amarilla); (E) Dilatación de fístula con balón CRE (flecha amarilla) hasta 4 mm; (F) Liberación de prótesis metálica (flecha amarilla); (G) Visión endoscópica de copa interna de prótesis metálica; (H) Prótesis plástica liberada, visión endoscópica.
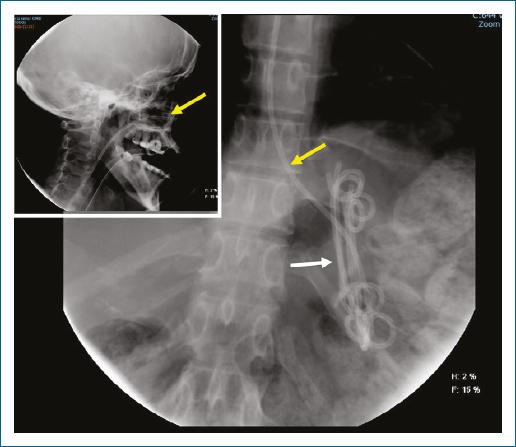
Figura 2 Drenaje Nasoquístico, compuesto por sonda nasoquística 7-10 french (flechas amarillas), con extremo distal dentro de necrosis pancreática encapsulada drenada con múltiples prótesis plásticas (flecha blanca).

Figura 3 Necrosectomía endoscópica. (A) Se observa abundante material necrótico dentro de colección; (B) Se utiliza asa con red para retiro de material necrótico; (C) Se utiliza trípode para retiro de material necrótico; (D) Se retiran restos necróticos a la luz del tubo digestivo.
A pesar de las ventajas teóricas que se esperan con las prótesis metálicas, estudios recientes han concluido que no existe diferencia en el éxito en comparación con la colocación de múltiples prótesis plásticas, la única ventaja demostrada fue un menor tiempo del procedimiento. Aún así existen casos reportados de éxito de prótesis metálica posterior al fracaso de las plásticas. Un metaanálisis que incluyó 17 estudios no encontró significancia estadística entre las diferentes prótesis (metálicas vs. plásticas) ni con el uso de una o múltiples prótesis plásticas con tasas de éxito clínico, recurrencias y complicaciones, similares tanto en drenaje de PQP como de necrosis pancreática. Un dato que aún queda sin respuesta, tanto en las prótesis metálicas como en las plásticas, es el tiempo de permanencia, que algunos autores recomiendan de mínimo un mes de tratamiento y posterior valoración, o incluso mantener la prótesis de manera permanente. El uso de prótesis especialmente diseñadas para estos procedimientos (Hot Axios®, Boston Scientific) acortan el tiempo del procedimiento y facilitan su ejecución.
En relación con las complicaciones, Seewald, et al. reportaron que en necrosectomías endoscópicas el sangrado ocurrió en el 15% de las realizadas, seguido por la perforación en el 8.7% y el embolismo portal en el 1.25% (cuatro pacientes requirieron cirugía). Aún así, la tasa de éxito global con una media de seguimiento de 31 meses fue del 72.5%
Puntos de debate en el drenaje de colecciones peripancreáticas
Dentro del tratamiento guiado por USE de las colecciones peripancreáticas existen aún múltiples puntos no resueltos. Los más importantes que debemos considerar son:
-Evaluación del conducto pancreático y drenaje transpapilar.
-Tipo de prótesis (metálicas vs. plásticas).
-Uso de drenaje nasoquístico y tipo de irrigación.
¿La colocación de una prótesis pancreática en pacientes con drenaje transmural de una CLP tiene algún efecto en la tasa de éxito o en el tiempo hasta este?
En un trabajo retrospectivo de Gordon, et al. realizado en 79 pacientes con PQP y necrosis encapsulada no se encontraron diferencias entre los grupos en relación con el éxito, tiempo hasta la resolución o complicaciones, sin embargo, a los pacientes con prótesis al pancreático se les realizó un mayor número de estudios. En un estudio retrospectivo multicéntrico de 13 centros en 6 años, se incluyeron 310 pacientes divididos en dos grupos: transmural únicamente (n = 177; 57%) frente a drenaje mixto (transmural + transpapilar; n = 133; 43%). De acuerdo con sus resultados no se encontró diferencia entre los grupos en relación con la resolución clínica o radiológica o recurrencia a las dos semanas después del retiro de las prótesis. Resultados similares se reportaron de un metaanálisis de siete estudios publicados entre 1995 y 2013 con un total de 551 pacientes, todos retrospectivos, en donde no se encontraron diferencias entre los grupos en relación con el éxito clínico, complicaciones y recurrencia.
Hasta el momento no existen estudios dirigidos a evaluar el mejor momento para evaluar el conducto pancreático por medio de pancreatografía endoscópica. Aunque los estudios mencionados anteriormente evalúan el papel del drenaje del conducto pancreático en relación con la tasa de resolución y tiempo hasta esta, nosotros creemos que la verdadera pregunta en la evaluación del conducto pancreático debe estar dirigida a la probabilidad de recurrencia de la colección. En caso de pacientes con PQP o necrosis pancreática en los cuales se tenga una fístula del conducto pancreático o síndrome del conducto desconectado es de vital importancia lograr el diagnóstico y/o tratamiento de esta situación, ya que de no hacerlo y retirar antes de tiempo las prótesis transmurales dicho retiro dará pie a la recurrencia de la colección. En los pacientes con necrosis pancreática encapsulada el síndrome del conducto desconectado puede ocurrir hasta en el 50% de los casos. Por lo anterior el conocer el estatus del conducto pancreático puede dar pie a dejar de manera indefinida las prótesis transmurales.
¿Las prótesis metálicas ofrecen una mayor tasa de resolución comparadas con las prótesis plásticas? ¿Es verdad que su mayor diámetro contribuye al éxito del tratamiento?
Recientemente se han publicado estudios en relación con prótesis metálicas que tienen la capacidad de afrontar las paredes de las estructuras en las cuales están sus extremos Axios. En un estudio multicéntrico europeo, Larghi, et al.46 demostraron que el sistema de estas prótesis es seguro, fácil de realizar y altamente efectivo técnica y clínicamente. Un punto importante en la discusión del uso de prótesis metálicas frente a plásticas es el costo. Un interesante estudio demostró que en caso de necrosis pancreática, el uso de prótesis metálicas disminuye los costos totales al permitir que el procedimiento sea en un solo paso y se repita sin necesidad de utilizar nuevamente numerosos accesorios como guías, balones de dilatación y nuevas prótesis plásticas. Hasta el momento, un solo estudio ha evaluado el efecto de las prótesis metálicas sobre la tasa de recurrencia de las colecciones líquidas. En dicho estudio se demostró que la tasa de recurrencia es baja con el uso de estas prótesis (10%).
¿Debe usarse en todos los pacientes el drenaje nasoquístico? ¿Cuál debe ser la solución y la cantidad de esta para la irrigación de la colección drenada? ¿La irrigación debe ser de manera continua o en bolos?
En el drenaje de las colecciones líquidas peripancreáticas es necesario en algunas ocasiones dejar un drenaje nasoquístico. Hasta hace muy poco tiempo este era un tópico no estudiado. Recientemente, Siddiqui, et al. realizaron un estudio retrospectivo donde se demostró que en los pacientes con colecciones que contengan detritus y en quienes se realiza el drenaje con la presencia de un drenaje nasoquístico hay hasta tres veces más posibilidades de éxito clínico en comparación con los pacientes en los cuales solo se colocan las prótesis transmurales. Contrariamente al estudio mencionado, Lopes, et al. reportaron que la colocación de un drenaje nasoquístico no demostró mayor éxito que la solo colocación de múltiples prótesis15. Jurgensen en un estudio prospectivo con 35 pacientes con seguimiento durante una media de 23 meses concluyó que sin irrigación la tasa de éxito era comparable con la literatura existente.
Existen pocos datos en relación con el tipo de irrigación. Los resultados han sido muy buenos con catéteres de 7-10 F y con irrigación de 200 ml cada 3-4 h o 1,000 para 24 h y aspiración diaria para ver las características de la colección. Aunque comúnmente se ha utilizado solución salina para la irrigación por el catéter nasoquístico, varios autores han utilizado peróxido de hidrógeno o antibióticos. Se recomienda que el tiempo de permanencia del catéter sea de aproximadamente dos semanas o cuando los signos de sepsis mejoren. Rana, et al. recomiendan la aspiración diaria de contenido por el drenaje nasoquístico y cuando este sale claro realizar una tomografía; si la colección ha mejorado se procede a retirar el catéter.
Conclusiones
La primera línea para el drenaje de colecciones peripancreáticas debe ser actualmente la endoscópica y guiada por US. Si bien el drenaje endoscópico sin guía de US ha demostrado ser efectivo y las complicaciones bajas, se debe mencionar que cuando estas se presentan son graves e incluyen la muerte. El uso del USE aumenta de manera significativa el número de pacientes candidatos al drenaje endoscópico y disminuye sustancialmente las complicaciones mayores.











 nova página do texto(beta)
nova página do texto(beta)


