Las tres leyes de la robótica
Un robot no debe dañar a un ser humano o, por su inacción, dejar que un ser humano sufra un daño.
Un robot debe obedecer las órdenes que le son dadas por un ser humano, excepto cuando estas órdenes se oponen a la primera ley.
Un robot debe proteger su propia existencia, hasta donde esta protección no entre en conflicto con la primera o segunda leyes.
Yo, Robot
Isaac Asimov
El primer videojuego que jugué fue en los 90: Super Mario Bros. Honestamente, no recuerdo lo que vi ni lo que sentí, solo sé que aprendí a jugar después de caer varias veces en el vacío o estrellarme con alguna tortuga, pez o llama de fuego. Con el pasar de los años, y después de muchos otros juegos, sé por intuición dónde y cuándo saltar y cómo no estrellarme contra los elementos.
Este es el típico ejemplo de un proceso de inteligencia natural en donde por medio del ensayo y el error se aprende, mediante la observación, los aciertos y los errores de los movimientos, creando una relación entre la observación y el movimiento que al final nos dará una habilidad: la coordinación cerebro-ojo-mano.
Entrenamiento en endoscopia
Según la Sociedad Americana de Endoscopia Gastrointestinal (ASGE, por sus siglas en inglés), antes de que los aprendices puedan ser certificados, deberán realizar un número mínimo de procedimientos para alcanzar la competencia endoscópica1. Sin embargo la formación en un entorno clínico tiene varias implicaciones médicas y legales. La adquisición de las destrezas dependerá del acortamiento de la curva de aprendizaje. Para ello debemos tener modelos más realistas.
El entrenamiento en los simuladores mecánicos, digitales, biológicos ex vivo y en animales permite las prácticas y enseñanza tutorial e incrementar el número de las repeticiones (n) para acortar la curva de aprendizaje2-7. Sin embargo, aunque los modelos tratan de recrear la realidad, carecen del realismo necesario para la capacitación, la competencia o para ser aplicable en la certificación5.
Necesitamos phantoms que recrean la realidad. Recientemente se publicó un modelo con hidrogeles de alcohol polivinílico (PVA) para disminuir el error en el diagnóstico mediante la repetición amplificada. El conocimiento de las propiedades mecánicas (coeficiente de elasticidad/rigidez) del PVA permitió que el modelo lograra la simulación de órganos y de lesiones digestivas que fueron visibles al ultrasonido endoscópico/elastografía (UES-E)8.
Error diagnóstico
¿Cuál es la consecuencia de equivocarnos en el diagnóstico? La toma de decisiones tiene un espacio de consecuencias y está asociada al error (falsos positivos o negativos), al riesgo de la prueba, al «etiquetamiento» y a la posibilidad de indicar un tratamiento «dañino». Dentro del espacio de las consecuencias, dos decisiones serán correctas (parece enfermo y lo está; no parece enfermo y no lo está) y dos incorrectas (parece enfermo y no lo está; no parece enfermo y lo está). Imaginen resecar un paciente segmento de colon sin una lesión maligna (falso +) o enviar a un sujeto a su casa porque la lesión fue omitida (falso -). Aunque ambos son errores, la gravedad es de diferente magnitud.
Mediante una tabla de 2 x 2 comparamos nuestra sospecha clínica contra el estándar de referencia y calculamos: sensibilidad (Sn), especificidad (Sp), valor predictivo positivo (VPP) y valor predictivo negativo (VPN), cociente de verosimilitud positivo (CV+) y cociente de verosimilitud negativo (CV-), eficacia diagnóstica y la prevalencia de la enfermedad.
En los EE.UU., en el 2015 se realizaron 6.1 millones de esofagogastroduodenoscopias (EGD). En Occidente, la tasa de cáncer gástrico (CG) no detectado durante la EGD fue del 2.3 al 13.9% (España: 9.1%), cifra similar al cáncer colorrectal (CCR) pospolipectomía (2.5-7.7%)9-12.
Existen tres niveles de calidad en los sistemas de salud: estructura, proceso y resultado. Un indicador de calidad es identificar las lesiones digestivas. Dentro de un modelo multidimensional podemos medir la efectividad (examen completo: desde la orofaringe hasta la 2.ª porción duodenal o de la margen anal al ciego y válvula ileocecal, o intubación ileal), eficiencia (toda lesión deberá ser identificada), seguridad (eventos adversos), cuidados (satisfacción del paciente) y la accesibilidad (tiempo de espera para programación del estudio)13.
En Occidente, la formación endoscópica tiene como objetivo mejorar las habilidades técnicas para la detección de patologías como el cáncer, esofagitis y úlceras pépticas, para que los procedimientos solo sean realizados por endoscopistas calificados14,15.
Los parámetros de calidad en colonoscopia son: a) fotodocumentación del ciego; b) tiempo retiro desde el ciego (mínimo 6 min); c) tasa de detección de adenomas (25% global: 30% en hombres y 20% en mujeres); d) limpieza colónica > 85%; e) toma de biopsias (diarrea crónica y colitis), y f) resecciones de acuerdo con el tamaño de la lesión16. El proceso cognitivo consta de dos etapas: identificación de la lesión sospechosa y diferenciación (patología). Sin embargo, la EGD diagnóstica ordinaria está relegada a los menos experimentados, quienes no están capacitados para identificar las lesiones incipientes17.
¿Cuántos procedimientos son necesarios para alcanzar la competencia en endoscopia?
El número es un requisito mínimo, ya que no existe evidencia de que impacte en la competencia. El número «mágico» es muy variable: 100 en el mundo occidental y > 1,000 en Asia. El entrenamiento adicional impactará en un mayor rendimiento diagnóstico18-20. El conocimiento cognitivo, repeticiones (entrenamiento), los sistemas estandarizados, la alta definición y de técnicas de inspección de la mucosa incrementan la tasa de detección de lesiones11,21.
¿Cuál es el efecto de la educación continua en comparación con el mantener un volumen endoscópico mínimo anual? ¿Cómo podemos mantener la capacidad de realizar exámenes de alta calidad? Según Gladwell en su libro Outliers, para ser un experto es necesario dedicar unas 10,000 horas de formación continua. A eso le llamó personas exitosas, cuyos logros están fuera de lo normal.
Un indicador importante en la EGD es el tiempo de inspección de la mucosa (meticulosidad). Si empleamos > 7 min, la posibilidad de detectar lesiones de alto riesgo (metaplasia intestinal, atrofia, displasia o cáncer) y displasias y/o CG aumentarán dos y tres veces, respectivamente. La detección de adenomas fue mayor (0.25 vs. 0.17%) en los endoscopistas lentos vs. rápidos (promedio: 3.25 vs. 2.38 min)22-25.
La detección de neoplasias gástricas ha sido correlacionada con la duración del procedimiento, 8 a 10 minutos nos asegurarán alta calidad en la EGD. La medición deberá incluir la intubación, la distensión, la limpieza con mucolíticos, antiespumantes y antiespasmódicos y la revisión minuciosa de la mucosa9,21. Sin embargo el número de indicadores de calidad sigue en aumento, ¿cómo interpretamos esto?26. Requerimos que los indicadores sean más objetivos y reproducibles. La tasa de cáncer desapercibido es la única medida de proceso que ha demostrado impactar sobre la mortalidad asociada al cáncer27,28.
La EGD y la colonoscopia con luz blanca de alta calidad (sin contraste electrónico) son el estándar de oro para la detección de las lesiones digestivas. Sin embargo, las lesiones sutiles pueden ser omitidas fácilmente. Una vez identificada una lesión podemos caracterizarla con técnicas de imagen avanzada: ácido acético, yodo-Lugol, cromoscopia electrónica (iScan, Fuji, NBI) pueden ayudar a delinear o detectar anomalías17,20.
Factores que influyen en la no detección de un cáncer
Existen factores que influyen para omitir u a lesión maligna durante la endoscopia de detección. La tabla 1 muestra los factores limitantes y las sugerencias para minimizar el riesgo de omitir un cáncer durante la endoscopia de detección en la práctica diaria17.
Tabla 1 Factores asociados al error durante la endoscopia de detección
| Error del endoscopista |
| Entrenamiento |
| Educación médica continua |
| Supervisión del entrenamiento |
| Error de muestreo |
| Biopsias múltiples |
| Muestreo adecuado |
| Meticulosidad endoscópica |
| Tolerancia paciente (sedación) |
| Reconocimiento de lesiones |
| Mucolíticos (visibilidad de la mucosa) |
| Mayor tiempo |
| Fotodocumentación |
| Errores post-EGD |
| Seguimiento |
| Notificación paciente |
| Error del patólogo |
EGD: esofagogastroduodenoscopia. Adaptada de Cho, 201618.
La falta de meticulosidad en la exploración de la mucosa se ha asociado con CG no detectados (11.3%) tres años antes del diagnóstico11, todo ello es debido a: a) falta de contraste lesiones y normalidad; b) error de muestreo (biopsias aleatorias); c) mala interpretación histopatológica (concordancia), y d) un seguimiento inapropiado (la falla en el diagnóstico)29.
La identificación de un cáncer incipiente es un verdadero reto incluso entre los endoscopistas expertos. Es necesario el conocimiento adecuado de la anatomía endoluminal y la fotodocumentación. Dentro de los elementos clave están: el conocimiento cognitivo, el «ojo endoscópico», y la inspección sistemática, estandarizada y completa de la mucosa30,31.
Emura et al.30 reportaron una tasa de detección de CG en Colombia similar a China en sujetos con riesgo promedio (0.3 vs. 0.37%) mediante el uso de la endoscopia sistemática alfanumérica codificada (SACE). Sin embargo, la efectividad fue mayor en la EGD ordinaria en comparación con el cribado (92.4 vs. 7.6%), lo cual fue explicado por la calidad de la EGD32,33. En México, la SACE aumentó la tasa de detección de metaplasia intestinal, ya que el método garantiza una mayor robustez al incluir la fotodocumentación (28 imágenes superpuestas), lo cual disminuyen los puntos ciegos durante la exploración34.
Las lesiones incipientes presentan cambios morfológicos y de coloración (palidez o decoloración), por lo que pueden ser imperceptibles. «Los endoscopistas sin conocimiento de lo que el CG incipiente parece no podrán detectarlo, aun con técnicas adecuadas»29.
La limpieza de la mucosa orofaríngea, esofágica, gástrica y colónica contribuye a mejorar la detección de lesiones incipientes al mejorar la visibilidad de la mucosa y eliminar los artefactos (espuma, líquidos residuales, alimentos). Monroy et al.35 reportaron una mejor calidad endoscópica al combinar un antiespumante (dimeticona 200 mg) con un mucolítico (N-acetilcisteína [NAC] 500 o 1,000 mg) en comparación con la dimeticona o NAC solas o sin intervención. Aún tenemos grandes dificultades para medir la calidad, la mayoría de ellas son mediciones de proceso.
Inteligencia artificial
Seth Bling, un programador, creó un simulador de inteligencia artificial (IA) hecho para aprender a jugar videojuegos. En 2018 se programó para Super Mario Bros. En las simulaciones, el programa seleccionaba en forma ordenada una nueva acción para avanzar y sortear los obstáculos. Después de 17 días, el simulador no logró completar el primer nivel. Esto debido a «movimientos espaciales complejos para saltar algunos obstáculos».
Irónicamente, este no había sido el primer experimento de Bling con algoritmos. En 2015, cuando creó el programa, lo usó en otro videojuego, Super Mario World. En esta programación alimentó al programa con un conjunto de movimientos más complejos. A partir de ellos, el programa corrió una simulación ordenada de movimientos conocida como neuroevolución de topologías aumentadas, al seleccionar y descartar los movimientos con el fin de completar el nivel. Después de 34 generaciones con 300 combinaciones distintas de cada uno de los movimientos (alrededor de 24 h), el simulador logró completar el nivel.
La inteligencia en sí no es una cualidad de la materia, ni siquiera de la materia gris. La inteligencia es una función aprendida. Una red de información capaz de emparejar la información y seleccionar un movimiento para lograr un objetivo.
A la evolución le ha tomado millones de años formar nuestra inteligencia, con siglos de ensayos, errores y obstáculos. Nosotros al crear estos programas inteligentes de selección le estamos ahorrando millones de años y espacios violentos para crecer rápidamente.
A un programa le toma 24 h aprender pasar un nivel de videojuegos. A mí me habrá tomado más al principio, porque había que ayudar a mamá con la casa, había que dejar el televisor a mis hermanos o simplemente había que comer o dormir antes de aprender el movimiento final. La IA tiene una oportunidad de crecer mucho más rápido que nosotros simplemente por el hecho de que se la puede alimentar con información ya existente y darle el tiempo para aprender nuevos movimientos o «selecciones» adecuadas que nosotros por nuestra naturaleza no podemos.
Al final tampoco es nuestro reemplazo. Porque el mundo natural tiene obstáculos espaciales complejos y que, como en el caso de la simulación de 2018, por muchas combinaciones que se tengan, se requiere de la inteligencia humana para lograr «saltar» esos espacios complejos.
Inteligencia artificial en endoscopia
El principal objetivo de IA es mejorar en la calidad del diagnóstico asistido por computadora (CAD), así como la detección y clasificación de lesiones displásicas y neoplásicas, la interpretación correcta puede ser extremadamente desafiante incluso para médicos experimentados36.
Aspectos técnicos de la inteligencia artificial y el aprendizaje automático
El software codifica un programa basado en un algoritmo que genera una entrada específica hacia una salida definida. El aprendizaje automático (AA) cambiará el paradigma. Después de la codificación, se emplean los datos de entrada y un procedimiento de formación para «aprender» sobre estos. El objetivo es que el modelo funcione en las nuevas muestras no incluidas en el entrenamiento, con lo cual los datos serán procesados de manera correcta y así, la computadora aprenderá a enfrentarse a nuevas situaciones36.
El término IA se usa para los procedimientos que incluyen el componente de aprendizaje. El sistema ocupa el reconocimiento de patrones. Existen tres tipos de procedimientos de aprendizaje37: a) supervisado, en el cual la computadora aprende de los patrones conocidos; v) no supervisado, en el que la computadora encuentra características comunes en los patrones desconocidos, y C) por reforzamiento, cuando la computadora aprende mediante ensayo y error.
Aplicaciones de la inteligencia artificial en endoscopia gastrointestinal
La IA tiene el potencial de cambiar muchos aspectos de la práctica sanitaria. La discriminación y la clasificación de imágenes tiene muchas aplicaciones dentro de la medicina. Se han desarrollado algoritmos de AA y redes neuronales (CNN) para entrenar a una computadora a diferenciar las áreas normales de las anormales. El AA es una forma de IA que permite que la plataforma mejore sin ser programada. La detección CAD se basa en latencia, que es el tiempo entre la imagen capturada y cuando esta se muestra en la pantalla38.
Las CNN han sido desarrolladas para evaluar si las imágenes/fotogramas de vídeo adquiridos por el endoscopista son informativos y para mejorar la calidad del examen mediante la evaluación de puntos ciegos y la determinación de la proporción de área de superficie mucosa examinada.
El AA se refiere a la IA en la que el algoritmo, basado en los datos brutos de entrada, analiza las características en un conjunto de datos separado sin ser programado específicamente y ofrece una salida de clasificación específica39.
El algoritmo utiliza cuadros delimitadores de coordenadas de localización de lesiones que se podrían seguir con el tiempo, que extraen una firma de apariencia de cada lesión detectada, y junto con la información del movimiento, la velocidad y la dirección, son usados para asignar un identificador a cada lesión. Este modelo fue capaz de detectar pólipos con una Sn del 96.5%. La métrica de precisión de objetos múltiples toma en cuenta los errores del algoritmo, y la puntuación del 92.8% nos dice que la mayoría de los pólipos fueron detectados e identificados de manera correcta40.
El aumento de la habilidad de los sistemas de IA no significa que en el futuro reemplazará la capacidad de los humanos para la toma decisiones múltiples. Las máquinas harán solo aquello para lo que están capacitadas. El sistema toma decisiones basándose en el entrenamiento.
La endoscopia asistida por IA puede incrementar la tasa de detección al identificar lesiones obviadas. Un sistema CAD de IA debe ser sensible, específico, con interfaces fáciles de usar, y proporcionar resultados rápidos sin prolongar sustancialmente los procedimientos41. La IA tiene el potencial de ayudar tanto a endoscopistas entrenados como a aquellos en entrenamiento. En vez de ser un sustituto para una técnica de alta calidad, deberá servir como un complemento de las buenas prácticas41.
Aplicaciones clínicas de la inteligencia artificial
Las aplicaciones de IA se pueden subdividir en tareas o asignaciones basadas en los retos clínicos en la práctica diaria y de acuerdo con los métodos endoscópicos. La tabla 2 muestra las aplicaciones reportadas del diagnóstico asistido por computadora (CAD) y la IA en varios procedimientos endoscópicos41.
Tabla 2 Aplicaciones reportadas del diagnóstico asistido por computadora e inteligencia artificial en varios procedimientos endoscópicos
| Procedimiento y aplicaciones |
|---|
| Colonoscopia |
| Detección de pólipos (en tiempo real y en imágenes fijas y vídeo)* |
| Clasificación de pólipos (neoplásicos vs. hiperplásicos)* |
| Detección de malignidad dentro de pólipos (profundidad de invasión en imágenes endocitoscópicas)* |
| Presencia de inflamación en imágenes endocitoscópicas* |
| Cápsula endoscópica inalámbrica |
| Detección y clasificación de lesiones (sangrado, úlceras, pólipos)* |
| Evaluación de la motilidad intestinal |
| Enfermedad celíaca (evaluación de la atrofia de las vellosidades, motilidad intestinal) |
| Mejorar la eficiencia de la revisión de imágenes |
| Eliminación de imágenes duplicadas y marcos de imágenes no informativos (p. ej., imágenes con desechos)* |
| Endoscopia superior |
| Identificar la ubicación anatómica* |
| Diagnóstico del estado de infección por Helicobacter pylori* |
| Detección de cáncer gástrico y evaluación de la profundidad de la invasión* |
| Displasia escamosa esofágica |
| Detección y delimitación de displasia temprana en el esófago de Barrett* |
| Segmentación de imágenes en tiempo real en endomicroscopia láser volumétrica en el esófago de Barrett* |
| Ecografía endoscópica |
| Diferenciación del cáncer de páncreas de la pancreatitis crónica y el páncreas normal |
| Diferenciación de pancreatitis autoinmune de pancreatitis crónica |
| Ultrasonido endoscópico con elastografía |
*Aplicaciones en las que se ha informado sobre el uso de aprendizaje profundo. Adaptada de Pannala et al., 202039.
Lesiones colorrectales
El mayor progreso en la aplicación endoscópica de IA se ha realizado en el colon, donde la IA se ha acercado a la implementación clínica en entornos de la vida real (Fig. 1)42.

Figura 1 Lesión de crecimiento lateral en el colon ascendente en vecindad con la válvula ileocecal: el recuadro en azul muestra la detección mediante inteligencia artificial. A: luz blanca. B: aplicación de la imagen de banda angosta. C y D: cromoscopia vital con índigo carmín.
PÓLIPOS COLORRECTALES: DETECCIÓN, CLASIFICACIÓN Y PREDICCIÓN DE CÁNCER
La IA ha sido evaluada en tres escenarios clínicos en las neoplasias colónicas: la detección de pólipos, su caracterización (adenomatosos vs. no adenomatosos) y la predicción de cáncer invasor dentro de una lesión polipoide. Los estudios publicados con CAD para la detección de pólipos (CADe) y clasificación (CADx) están sujetos a una serie de limitaciones: la selección de las imágenes de mayor calidad (sesgo de selección), la inclusión de lesiones serradas sésiles en un modelo CADe, ya que estos pólipos son precursores (30%) del CCR (Fig. 2).

Figura 2 Pólipos sésiles menores de 5 mm detectados mediante inteligencia artificial. A: en área de fácil perdida de pólipos pequeños se Identifica área sospechosa con IA. B: misma lesión con cromoendoscopia e IA. C: polipo sésil identificado con AI.
A la fecha se han realizado solo dos estudios de colonoscopia en tiempo real. Para ser clínicamente útiles, las plataformas de IA necesitarán un análisis rápido de imágenes con información en tiempo real para determinar con precisión la presencia y/o el tipo de pólipo presente43-45.
Un ensayo controlado aleatorizado prospectivo reportó los resultados de un modelo de aprendizaje profundo validado para la detección colonoscópica de pólipos en tiempo real en 1,038 pacientes (536 colonoscopia estándar y 522 colonoscopia con CAD). El sistema CAD aumentó la tasa de detección de adenoma (TDA) (29.1 vs. 20.3%) y la tasa de detección de pólipos (TDP) (45 vs. 29%), número de adenomas (53 vs. 31%) y número de pólipos (95 vs. 50%) por colonoscopia en comparación con colonoscopia no asistida. El sistema identificó todos los pólipos detectados por endoscopistas con baja tasa de falsos positivos (0.075 por colonoscopia). Se reportó una mayor tasa de detección de lesiones diminutas, sin embargo el estudio no cuantificó las tasas de falsos positivos o negativos43.
La tasa de pólipos omitidos durante la colonoscopia ha sido reportada en el 26%46. La apariencia sutil, la calidad de la limpieza intestinal, la técnica de inspección de la mucosa del colonoscopista, el moco adherente e incluso la fatiga pueden contribuir a que no sean detectados39.
La detección de pólipos neoplásicos puede dan como resultado una mayor reducción de los CCR de intervalo (CCRI). Un aumento del 1% en la TDA ha sido asociado con un 3% en la disminución en la incidencia de CCRI. Es decir, está asociado a una serie de factores como los puntos ciegos y los errores humanos. La IA puede reducir las tasas de pérdida de pólipos, particularmente en los endoscopistas con bajas TDA (Figs. 3 a 5)45.
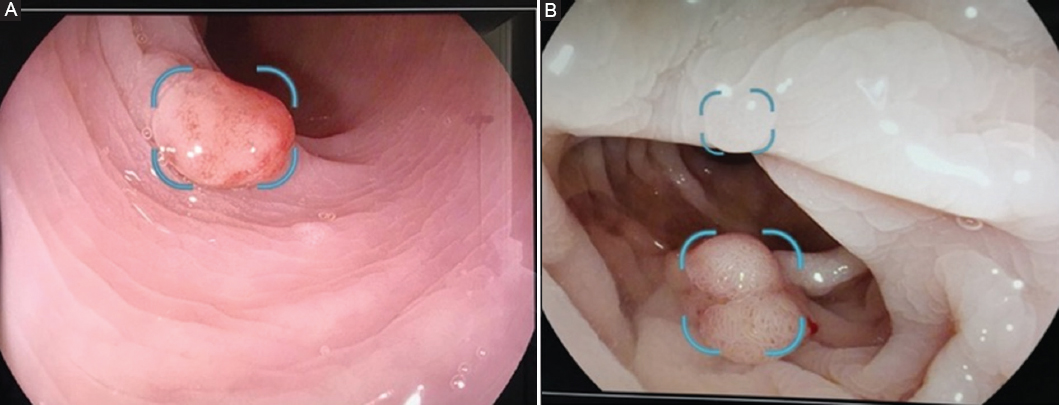
Figura 3 Pólipos sésiles detectados mediante inteligencia artificial: de 5 mm con depresión central (A) y bilobulado (B).

Figura 4 Lesión infiltrante de crecimiento lateral del sigmoides detectada mediante inteligencia artificial.

Figura 5 A y B: lesión pediculada del sigmoides detectada mediante inteligencia artificial: se puede apreciar lesión pediculada, de base ancha, con un patrón de superficie vellosa, irregular, y vasos irregulares.
Un estudio en un solo centro con el sistema de CNN analizó 8,641 imágenes con 4,088 pólipos únicos de colonoscopias de detección (2,000 pacientes). La precisión diagnóstica fue del 96.4%, con una tasa de falsos positivos del 7%. En la revisión de los expertos con la superposición de CNN como criterio estándar, la Sn y Sp para la detección de pólipos fueron del 93 y 93%, respectivamente (p < 0.00001). Los falsos positivos generados por las CNN se relacionaron con los entornos en donde la mucosa estaba colapsada (campo cercano), la presencia de artefactos, marcas de succión, imágenes de banda estrecha (NBI) y los sitios de polipectomía. Se han propuesto estrategias para el manejo de pólipos diminutos, que incluyen paradigmas de «resecar y descartar» o «dejar in situ». El CADx puede proporcionar una herramienta de apoyo para los endoscopistas para mejorar los umbrales de precisión recomendados. Los beneficios potenciales incluyeron una mejor rentabilidad, menor tiempo de procedimiento y menos eventos adversos resultantes de polipectomías innecesarias46.
La precisión diagnóstica del CADx para la clasificación de pólipos diminutos fue reportada en un 93.2% en un centro con un solo operador que incluyó 118 neoplasias colorrectales y en el que el diagnóstico patológico del pólipo resecado sirvió como criterio estándar47.
Cuatro estudios usaron CNN para clasificar los pólipos diminutos como adenomatosos o hiperplásicos después de la inspección con NBI convencional48,49, NBI de aumento50 o NBI de enfoque cercano51, utilizando la histología como criterio estándar. En los conjuntos de validación de 106 a 300 pólipos, las CNN identificaron pólipos adenomatosos en tiempo real (50 milisegundos de retraso en un estudio) con precisión diagnóstica del 88.5 al 94% y un VPN del 91.5 al 97%.
El aprendizaje profundo con CNN tiene el potencial para diferenciar adenomas de pólipos hiperplásicos con alta Sn y Sp (98 y 83%, respectivamente), predicción histológica del 94% y valores predictivos VPP 90% y VPN 97% usando fotogramas de vídeo con NBI. Aunque aún falta por demostrar su utilidad en tiempo real en los centros expertos y no expertos52.
Otro ensayo aleatorizado para la detección de pólipos (colonoscopia en tiempo real) incluyó a 685 participantes que fueron asignados al azar (proporción 1:1) a CADe (GI-Genius, Medtronic, Dublín, Irlanda) con colonoscopia con luz blanca y alta definición más CAD o colonoscopia sola. El sistema CADe mejoró la TDA al 54.8% (187 de 341) desde el 40.4% (139 de 344) en el grupo de control (riesgo relativo: 1.30; intervalo de confianza del 95% [IC95%]: 1.14-1.45). La tasa de adenomas detectados fue más alta en el grupo de CADe (media: 1.07 ± 1.54) que en el grupo de control (media: 0.71 ± 1.20) (incidencia: 1.46; IC95%: 1.15-1.86). El incremento de la tasa se observó en pólipos < 5 mm y de 5 a 9 mm de diámetro, sin aumentar con el tiempo de retirada53.
Otro estudio asistido por IA, basado en NBI con imagen no óptica magnificada, predijo la histología de las lesiones colónicas solitarias. La Sn de los pólipos hiperplásicos/serrados fue del 96.6% y el VPN del 99.6%, pero fue menor en las lesiones tubulares de adenoma/cáncer. El clasificador de imágenes de IA tuvo una alta precisión, del 88.2%, en la predicción de carcinoma con invasión profunda. La correlación del intervalo de colonoscopia de vigilancia utilizando un clasificador de imágenes de IA y la histología fue del 97.7%54.
En un estudio prospectivo de 791 pacientes consecutivos, el CADx en tiempo real caracterizó 466 pólipos diminutos del rectosigmoides con el sistema de aprendizaje profundo con un rendimiento necesario para emplear la estrategia de «diagnosticar y dejar in situ» para pólipos no neoplásicos. El sistema distinguió entre los adenomas y los pólipos hiperplásicos con una precisión del 94% y un VPN del 96%. Sin embargo, el CAD no fue útil para distinguir pólipos neoplásicos de los no neoplásicos en segmentos proximales al colon sigmoides (VPN 60.0%)44.
Hotta et al.55 reportaron la validez de endocitoscopia CAD en el diagnóstico de lesiones colorrectales neoplásicas o no neoplásicas, comparando la capacidad diagnóstica en endoscopistas no expertos con imágenes endocitoscópicas teñidas, la precisión del diagnóstico y la Sn de EB-01 (Cybernet Corp, Tokio, Japón), estas fueron del 98.0, 69.0, 96.9 y 70.8%, respectivamente. Cuando se utilizaron imágenes, la precisión diagnóstica de EB-01 fue del 96 vs. 70.4% de no expertos. La Sn fue mayor en el grupo EB-01 (96.9%) en comparación con no expertos (62.1%). La evaluación endocitoscópica teñida con imágenes demostró mayor precisión en el grupo EB- 01 (98%) en comparación con el grupo de expertos (93.3%). Sin embargo, la precisión fue similar en ambos grupos cuando se utilizan imágenes endocitoscópicas NBI, con un 96.0% en el grupo EB-01 y un 94.6% en el grupo de expertos.
El diagnóstico óptico preciso del CCR T1 y el nivel de invasión a la submucosa determinarán el enfoque de tratamiento óptimo. Las lesiones T1 confinadas a la capa SM1 (< 1,000 mm) pueden considerarse para resección endoscópica mediante técnicas en bloque con resección endoscópica de la mucosa (diámetro de la lesión 2 cm) o disección endoscópica submucosa. Cuando la lesión invade la submucosa profunda (1,000 mm o más, T2) se requiere cirugía debido al mayor riesgo de metástasis en los ganglios linfáticos56.
Un estudio aleatorizado evaluó 5,543 imágenes de endocitoscopia (2,506 no neoplasias, 2,667 adenomas y 370 cánceres invasivos) de 238 lesiones (100 no neoplasias, 112 adenomas y 26 cánceres invasivos) de una base de datos mediante un sistema CAD basado en endocitoscopia para diferenciar el cáncer invasivo de los adenomas no malignos. Se excluyeron las lesiones dentadas sésiles. El algoritmo logró una precisión del 94.1% (IC95%: 89.7-97.0) para malignidad invasora57.
Un estudio que incluyó 190 imágenes de 41 lesiones (cTis = 14, cT1a = 14 y cT1b = 13) evaluó mediante CNN la profundidad de invasión de los pólipos malignos. La Sn, Sp y precisión de diagnóstico para la invasión profunda (cT1b) del 67.5, 89.0 y 81.2%, respectivamente58.
Enfermedad inflamatoria intestinal
La precisión diagnóstica del sistema CAD fue reportada en un 91% (83-95%) para evaluar la persistencia de inflamación (histología) en imágenes endocitoscópicas obtenidas durante colonoscopia en pacientes con colitis ulcerosa59.
Otro estudio evaluó la capacidad de un sistema CAD (CNN) para identificar con precisión a los pacientes con colitis ulcerosa (precisión: 90.1%; IC95%: 89.2-90.9%) y remisión histológica (precisión: 92.9%; IC95%: 92.1-93.7%) basado en análisis informático del aspecto de la mucosa por endoscopia60.
No hay a la fecha estudios con el sistema CAD para la detección y clasificación de displasia en el entorno de colonoscopia de vigilancia para pacientes con colitis crónica.
Conclusiones
Los avances tecnológicos tienen como un objetivo fundamental, que es identificar y disminuir la fuente del error humano. Las nuevas herramientas deberán ser sometidas a exámenes rigurosos para evaluar la eficacia y su seguridad en las diferentes poblaciones de estudio mediante estudios clínicos aleatorizados. Sin embargo dichas herramientas no sustituyen al entrenamiento endoscópico, en donde se busca desarrollar las destrezas y las habilidades, por lo que deberán emplearse como un recurso adicional o herramientas de ayuda para tener mejores diagnósticos endoscópicos y disminuir la posibilidad de omitir una neoplasia maligna durante una colonoscopia de detección.











 nueva página del texto (beta)
nueva página del texto (beta)


