Introducción
El nuevo coronavirus fue nombrado SARS-CoV-2 (síndrome respiratorio agudo grave por coronavirus 2) debido a su alta homología (80%) con el SARS-CoV que causó el síndrome de dificultad respiratoria aguda con una alta mortalidad durante los años 2002-20031. La enfermedad producida por este virus puede ir desde un cuadro asintomático hasta un síndrome de dificultad respiratoria aguda que puede ser fatal.
Los cuadros de neumonía moderada cursan generalmente con fiebre y tos, y la hipoxemia no suele ser evidente; sin embargo, se pueden encontrar lesiones pulmonares en los métodos de imagen de tórax. Se han definido criterios de gravedad de la neumonía causada por el SARS-CoV-2, entre los que destaca una saturación parcial de oxígeno < 92%2.
En la neumonía atípica por COVID-19, la respuesta inflamatoria del huésped desempeña un papel muy importante dentro de la patogenia de la enfermedad, en la que participan las células de la respuesta inmunitaria innata, sobre todo los linfocitos, los neutrófilos y en menor medida las plaquetas3.
Una vez que el SARS-CoV-2 induce lesión en las células pulmonares, activa la respuesta inmunitaria del huésped reclutando macrófagos y monocitos que responden a la infección, liberando citocinas y activando las respuestas inmunitarias adaptativas de las células T y B3,4; sin embargo, una respuesta inmunitaria disfuncional puede provocar patología pulmonar grave e incluso sistémica.
La secreción de citocinas y quimiocinas atrae a las células inmunitarias, en particular a los monocitos y los linfocitos T, pero no a los neutrófilos, de la sangre al sitio infectado. El reclutamiento pulmonar de células inmunitarias de la sangre y la infiltración de linfocitos en las vías respiratorias pueden explicar la linfocitopenia y el aumento de la proporción de neutrófilos-linfocitos que se observa en alrededor del 80% de los pacientes con infección por SARS-CoV-25.
También se describe que, en la tormenta de citocinas, la linfocitopenia está estrechamente relacionada con el aumento de citocinas proinflamatorias, como la interleucina 6. Otros factores que se ha propuesto que contribuyen a la linfocitopenia incluyen a las células CD4 y CD8, las cuales muestran mayor expresión de proteínas proapoptóticas, así como la regulación a la baja de algunos genes implicados en la activación y la función de las células T en pacientes infectados por el SARS-CoV-26.
Además, se ha demostrado que las células T se ven más afectadas por el SARS-CoV2, ya que su recuento es casi la mitad del límite de referencia inferior y tienden a verse más obstaculizadas en casos graves7. En lo que se refiere a la alteración plaquetaria, se encontró que tener un nivel de plaquetas alto al inicio, y que durante el tratamiento disminuía, se correlacionaba con la progresión y el pronóstico de la enfermedad8.
El recuento de células y los índices de inflamación han resultado útiles en la evaluación de la gravedad de diversas enfermedades, ya que son fáciles de realizar, accesibles y de bajo costo9-11.
El índice de inmunidad-inflamación sistémica (IIS = neutrófilos × plaquetas/linfocitos) fue propuesto en 201412 y primero se utilizó en pacientes oncológicos como una herramienta que ayudara a determinar el pronóstico al reflejar un balance del estado inflamatorio e inmunitario del huésped12-14. Posteriormente se ha aplicado a otros padecimientos, como la sepsis15, ya que su elevación principalmente se debe al aumento de los neutrófilos y de las plaquetas con un bajo nivel de linfocitos por una respuesta inmunitaria débil. Dada la importancia de la respuesta celular en la infección por el SARS-CoV-2, el objetivo de este estudio fue determinar si el IIS puede ser un marcador de mortalidad al ingreso en pacientes con COVID-19.
Método
Aprobación ética
El estudio fue aceptado por el Comité de Ética e Investigación del Hospital General Ticomán de la Secretaría de Salud de la Ciudad de México (SEDESA), representando un riesgo mínimo. Todos los participantes o sus familiares firmaron el escrito de consentimiento informado.
Diseño del estudio y población
Realizamos un estudio transversal analítico retrospectivo observacional que incluyó 140 pacientes, 54 (38.6%) mujeres y 86 (61.4%) hombres, admitidos de mayo a agosto de 2020 en nuestra institución con COVID-19 confirmada por prueba de reacción cuantitativa en cadena de la polimerasa con transcriptasa inversa en muestras de hisopado nasofaríngeo, además de la sintomatología característica y los hallazgos de la tomografía computarizada de tórax. Excluimos a los pacientes que estuvieran en tratamiento con inmunomoduladores, quimioterapia o factor estimulante de colonias de granulocitos, así como a aquellos con enfermedades reumatológicas, hematológicas o infección por el virus de la inmunodeficiencia humana.
Método analítico
La citometría hemática de ingreso se realizó con el analizador Beckman Coukter DxH900. Todos los ensayos de laboratorio habían completado el programa de normalización y certificación.
Registramos las características epidemiológicas y demográficas, y se calcularon el IIS al ingreso y el índice neutrófilos/linfocitos (INL). Se determinaron el dímero D, la proteína C reactiva y la deshidrogenasa láctica.
Los pacientes hospitalizados fueron clasificados de acuerdo con el desenlace de egreso hospitalario, por mejoría o defunción.
Análisis estadístico
La tabulación descriptiva se realizó utilizando datos de edad, sexo, comorbilidad, necesidad de ventilación mecánica invasiva y mortalidad.
La prueba de Kolmogórov-Smirnov se empleó para determinar la normalidad de la distribución de los datos. Las variables categóricas fueron representadas como porcentajes y las variables continuas como media y desviación estándar o mediana con amplitud intercuartil, según su distribución. Para comparar los valores de las variables continuas entre los grupos de supervivientes y no supervivientes se utilizaron la prueba t de Student para muestras independientes para las variables de distribución normal, y la prueba U de Mann-Whitney para las variables de distribución no paramétrica.
Los valores de corte se calcularon de acuerdo con las curvas ROC (Receiver Operating Characteristic) y el índice de Youden, seleccionando el valor máximo de dicho índice que refleja el valor que alcanza mayores especificidad y sensibilidad posibles. Una vez determinado el punto de corte, se dividió a los sujetos en dos grupos según tuvieran un índice mayor o menor que el punto de corte. La asociación entre la mortalidad y las variables categóricas se evaluó mediante la prueba de ji al cuadrado en el análisis univariado, y las variables con significancia estadística en el análisis univariado se introdujeron a un análisis multivariado de regresión logística binaria. La razón de momios (OR, odds ratio) fue valorada considerando un intervalo de confianza del 95% (IC95%). Los datos fueron analizados con IBM SPSS versión 25. Las diferencias estadísticas se consideraron significativas cuando los valores de p eran < 0.05.
Resultados
Incluimos en el estudio 140 pacientes, de los cuales el 61.4% eran hombres y el 38.6% mujeres, con una media de edad de 52 (± 13.8) años. La comorbilidad más frecuente fue diabetes en el 28.6% e hipertensión arterial sistémica en el 25.7% de los sujetos (Tabla 1). De los 140 pacientes, 89 egresaron por mejoría y 51 fallecieron. No hubo diferencia estadística en cuanto al sexo (p = 0.27), la presencia de diabetes (p = 0.86), la hipertensión (p = 0.44) y el tabaquismo (p = 0.25) entre los supervivientes y los no supervivientes. El promedio de edad fue 10 años mayor en los no supervivientes que en los supervivientes (59 vs. 49 años; p = 0.001). El 41% de los pacientes que murieron fueron intubados durante su hospitalización, mientras que de los pacientes que egresaron por mejoría solo fueron intubados el 18% (p = 0.001).
Tabla 1 Comparación de las características clínicas entre los pacientes egresados y los que fallecieron
| Características (n = 140) | Vivos (n = 89) | Fallecidos (n = 51) | p |
|---|---|---|---|
| n (%) | n (%) | ||
| Sexo | |||
| Mujeres | 37 (41) | 17 (33) | 0.272 |
| Hombres | 52 (59) | 34 (67) | |
| Edad (años), media ± DE* | 49.37 ±13.26 | 59.28 ± 12.54 | 0.001 |
| Diabetes | 25 (62.5) | 15 (37.5) | 0.868 |
| Hipertensión | 21 (58.3) | 15 (41.7) | 0.449 |
| Tabaquismo | 8 (8.9) | 6 (11.7) | 0.25 |
| Ventilación mecánica invasiva | 9 (18) | 41 (82) | 0.001 |
| Marcadores, medianas (p 25-75) | |||
| PCR (mg/l) | 14.82 (6.9-19.30) | 14.89 (7.65-19.22) | 0.836 |
| IIS (cel/l) | 1930.81 × 109(842.70-3204) | 3239 × 109 (1906.45-5355) | 0.001 |
| INL (cel/l) | 7.5 (4.11-11.81) | 14 (8.47-21) | 0.001 |
| Dímero D (µg/ml) | 828 (379-1650) | 1690 (602-3620) | 0.005 |
| DHL (UI/l) | 380.89 (291.82-469) | 474.5 (373.5-624.5) | 0.001 |
DE: desviación estándar; DHL: deshidrogenasa láctica; IIS: índice de inmunidad-inflamación sistémica; INL: índice neutrófilos/linfocitos; PCR: proteína C reactiva.
A partir de la curva ROC y del índice de Youden (0.32) obtuvimos el punto de corte del IIS, que fue de 2332.10 × 109/l, con una sensibilidad de 0.673 y una especificidad de 0.352 (área bajo la curva [AUC]: 0.68; IC95%: 0.59-0.77; p < 0.05) (Fig. 1). En los pacientes que sobrevivieron, el IIS tuvo una media de 1930.81 × 109/l, siendo menor que en los pacientes que fallecieron, con una media de 3239 × 109/l (p = 0.001). En la tabla 1 se muestran los elementos que previamente se habían reportado como marcadores de gravedad y pronóstico en la neumonía por COVID-1916-18, en los grupos de supervivientes y no supervivientes. Mediante regresión logística obtuvimos la OR de cada una de las variables para presentar el desenlace de defunción. Como se observa en la tabla 2, el uso de apoyo mecánico ventilatorio presenta la OR más alta, con un valor de 36.4 (IC95%: 13.73-96.72; p = 0.000.). La edad mayor de 52 años obtuvo una OR de 4.27 (IC95%: 2.02-9.04; p = 0.001) y el IIS una OR de 3.78, (IC95%: 1.83-7.82; p = 0.001).
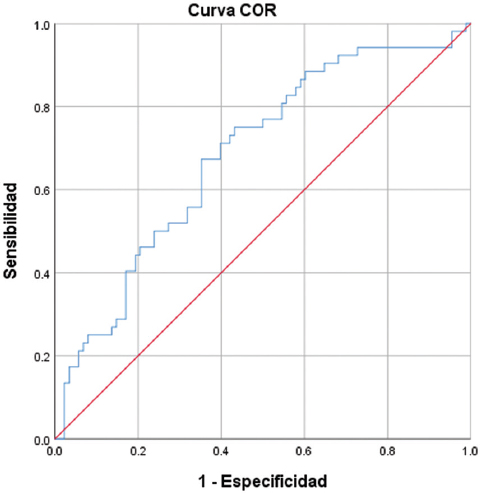
Figura 1 Área bajo la curva del índice de inmunidad-inflamación sistémica (0.68; intervalo de confianza del 95%: 0.59-0.77; p < 0.05).
Tabla 2 Análisis univariado de los diferentes factores clínicos asociados al desenlace mortalidad
| Factor | Punto de corte | OR* | IC95% | p |
|---|---|---|---|---|
| Sexo | 0.70 | 0.34-1.44 | 0.335 | |
| Edad, años | 52.5 | 4.27 | 2.02-9.04 | 0.001 |
| Diabetes | 1.06 | 0.49-2.27 | 0.657 | |
| Hipertensión | 1.34 | 0.62-2.93 | 0.981 | |
| Ventilación mecánica invasiva | 36.4 | 13.73-96.72 | 0.001 | |
| IIS | 2332.30 × 109 | 3.78 | 1.83-7.82 | 0.001 |
| INL | 10.11 | 4.18 | 2.01-8.69 | 0.001 |
| Dímero D | 934 | 2.42 | 1.15-5.05 | 0.018 |
| DHL | 421.5 | 2.7 | 1.19-6.3 | 0.016 |
DHL: deshidrogenasa láctica; IC95%: intervalo de confianza del 95%; IIS: índice de inmunidad-inflamación sistémica; INL: índice neutrófilos/linfocitos; OR: odds ratio.
*Obtenidas mediante regresión logística.
Realizamos un análisis multivariado por regresión logística de los factores que en el análisis univariado resultaron asociados a mortalidad (Tabla 3). Ya que el IIS tiene variables compartidas con el INL, realizamos dos modelos dado el riesgo de colinealidad. En el primer modelo (Tabla 3), al no excluir el INL, el IIS resultó con una p = 0.21 (IC95%: 0.68-5.41). En el segundo modelo, al excluir al INL, se encuentra el IIS con una p < 0.05 (IC95%: 1.49-7.55). En ambos modelos, la variable de la edad continúa siendo estadísticamente significativa (p = 0.006; IC95%: 3.45-8.00) para mortalidad.
Tabla 3 Análisis multivariado de los factores clínicos y su asociación con el riesgo de muerte
| Factor | p | IC95% |
|---|---|---|
| Edad | 0.006 | 1.42 -7.84 |
| IIS | 0.21 | 0.68 -5.41 |
| INL | 0.088 | 0.88-6.88 |
| Dímero D | 0.479 | 0.58 -3.13 |
| DHL | 0.060 | 0.96 -6.02 |
| Mejor modelo | ||
| Edad | 0.001 | 3.56-7.63 |
| IIS | 0.006 | 1.34-6.15 |
DHL: deshidrogenasa láctica; IC95%: intervalo de confianza del 95%; IIS: índice de inmunidad-inflamación sistémica; INL: índice neutrófilos/linfocitos. Regresión logística multivariada.
En la tabla 4 se muestran el rendimiento según el AUC, la sensibilidad y la especificidad del IIS, y los factores asociados a mortalidad.
Tabla 4 Análisis de confiabilidad de los distintos marcadores
| Marcador | AUC | Sensibilidad | Especificidad | p | Índice de Youden |
|---|---|---|---|---|---|
| IIS | 0.684 | 0.67 | 0.65 | 0.001 | 0.32 |
| INL | 0.745 | 0.67 | 0.67 | 0.001 | 0.34 |
| Dímero D | 0.649 | 0.63 | 0.58 | 0.018 | 0.21 |
| DHL | 0.692 | 0.62 | 0.62 | 0.016 | 0.24 |
AUC: área bajo la curva; DHL: deshidrogenasa láctica; IIS: índice de inmunidad-inflamación sistémica; INL: índice neutrófilos/linfocitos.
Discusión
En este estudio evaluamos si el IIS es un marcador pronóstico de mortalidad tomado al ingreso de la hospitalización de pacientes con COVID-19.
En México, según el informe hasta la semana epidemiológica número 25, al finalizar el mes de junio de 2021 se habían notificado 2,478,551 casos confirmados de SARS-CoV-2 y 231,244 defunciones19.
De modo similar a lo reportado en población China20 respecto a la mortalidad, en nuestro estudio las defunciones corresponden casi a un 40% de todos los pacientes atendidos, y aunque los reportes señalan que los varones21,22 han presentado mayor mortalidad, nosotros no encontramos diferencias estadísticamente significativas. Al igual que en otros países, encontramos que la edad es uno de los factores que determina la mortalidad22, pues nuestros resultados señalan que, tanto en el análisis univariado como al realizar la regresión logística, la edad mayor de 52 años se asocia a mortalidad con una OR de 4.27 (p = 0.001).
Respecto a la comorbilidad, las enfermedades más frecuentes en los pacientes estudiados fueron la diabetes y la hipertensión arterial sistémica; sin embargo, al realizar el análisis no encontramos diferencia estadísticamente significativa en cuanto a los grupos que se compararon, siendo el factor más determinante para el riesgo de defunción el uso de ventilación mecánica invasiva, cuyos pacientes, a pesar de su condición clínica, no pudieron ingresar a una unidad de cuidados intensivos y por ende tuvieron su seguimiento en nuestro piso de medicina interna.
El punto de corte que obtuvimos del IIS es de 2332.10 ×109/l, con una sensibilidad de 0.673 y una especificidad de 0.352 (AUC: 0.68; IC95%: 0.59-0.77; p < 0.05) (Fig. 1). Aunque el AUC muestra un rendimiento relativamente bajo, este valor no constituye el mejor análisis en este caso, ya que no hablamos de una prueba diagnóstica sino de un marcador pronóstico cuya fuerza de asociación con la probabilidad de un desenlace se valora mejor mediante la obtención de la OR.
Un estudio realizado en Wuhan (China)23 obtuvo resultados similares a los nuestros. En esta investigación evaluaron diferentes indicadores de inflamación, entre ellos el índice IIS, que se correlaciona para predecir la gravedad de la COVID-19, y encontraron una sensibilidad del 68.9%, una especificidad del 73.21% y un AUC de 0.72 con una OR de 1 (IC95%: 1.002-1.004; p = 0.006). Ellos categorizaron a los pacientes en enfermedad leve, moderada o grave, con valores de 1263.52 × 109/l (752.80-2094.42) para enfermedad grave y de 618.35 × 109/l (373.58-1123.39) para enfermedad leve. En otro reporte de Alemania24, tanto los pacientes más jóvenes como los que tuvieron un IIS más bajo a su ingreso hospitalario tuvieron mayor sobrevida que aquellos mayores de 70 años y con un IIS más alto; en este estudio el AUC fue de 0.82 (IC95%: 0.695-1; p = 0.0026), con una sensibilidad de 0.875 y una especificidad de 0.571, concluyendo, al igual que en el nuestro, que la elevación del IIS se asocia a mortalidad en los pacientes con COVID-19.
En la regresión logística univariada obtuvimos una OR de 3.78 (IC95%: 1.83-7.82; p = 0.001), por lo que consideramos que el IIS puede ser un buen elemento pronóstico; sin embargo, observamos que, respecto a los demás marcadores, la OR está por debajo tanto de la edad (OR: 4.27) como del INL (OR: 4.18), aunque por encima que el dímero D y la proteína C reactiva, marcadores que también se han utilizado como predictores de gravedad en la enfermedad16-18, pero que no siempre tenemos disponibles en nuestros centros.
La respuesta del huésped a la infección por el SARS-CoV-2, en la que participan las células del sistema inmunitario tanto innato como adaptativo, altera sobre todo la producción de linfocitos, con un aumento de su apoptosis, reflejando linfocitopenia en la mayoría de los pacientes al ser este tipo de células las principalmente afectadas25.
Los neutrófilos, además de realizar otras funciones inmunitarias, se encargan de la producción de citocinas para restringir la replicación del virus, y en lo que se refiere a las plaquetas, la trombocitopenia se detecta en el 5-41.7% de los pacientes con COVID-19 y es típicamente leve, siendo del 58-95% de los casos graves; la trombocitopenia grave solo se informa raramente en pacientes con COVID-1926.
Hasta donde sabemos, nuestro estudio es el primero en una muestra de pacientes mexicanos que explora el IIS como marcador pronóstico de mortalidad en pacientes con COVID-19 bajo el supuesto de que podría resultar un marcador de buen rendimiento debido a su capacidad para evaluar de manera rápida tanto el estado inflamatorio como el estado inmunitario de un individuo.
Aun con una OR ligeramente menor que el INL, los autores consideramos que el rendimiento del IIS se acerca en buena medida a este último y puede ser utilizado incluso en combinación con otros marcadores como estrategia que ayude a identificar el riesgo de mortalidad en este tipo de pacientes, encontrando quizá una limitante en el hecho de que no se cuente con un punto de corte establecido por laboratorio, pero que puede ser unificado según lo encontrado en estudios como este.
Así mismo, creemos que uno de los mecanismos por los cuales el IIS muestra un rendimiento más bajo en comparación con el INL es que, como ya se comentó, las plaquetas solo pueden alterarse levemente en el transcurso de la enfermedad y nuestra medición se realizó al ingreso.
Nuestra investigación puede ser un precedente para explorar en estudios futuros la capacidad pronóstica del IIS en pacientes específicos, como pudieran ser los sujetos inmunodeprimidos en los que, hipotéticamente y acorde con la fisiopatología, el IIS reflejaría mejor el estado inflamatorio que el INL.
Aunque se han utilizado diversos marcadores de gravedad, la aplicación clínica de los índices de inflamación radica en su ventaja de ser económicos, confiables y reproducibles.
Como limitaciones de nuestra investigación encontramos el número reducido de pacientes y el hecho de plantear un estudio transversal con una sola medición del IIS al ingreso hospitalario, además de que no asociamos el IIS a otras variables clínicas y bioquímicas de gravedad.
Conclusiones
En este estudio se determinó que el IIS, un índice que refleja la homeostasis entre la inflamación y el estado inmunitario del huésped, mostró unas adecuadas sensibilidad y especificidad como factor de riesgo de mortalidad determinado al ingreso en pacientes con COVID-19. Sin embargo, nuestros resultados revelan que el AUC es menor que para el INL.











 nueva página del texto (beta)
nueva página del texto (beta)


