Introducción
El coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2) es el agente causante de la COVID-19 y surgió en Wuhan, China, a fines de 2019 a partir de una fuente zoonótica. La mayoría de los casos de COVID-19 son asintomáticos o dan como resultado una enfermedad leve1,2. Sin embargo, en un porcentaje sustancial de pacientes se desarrolla una enfermedad respiratoria que requiere atención hospitalaria, y como tales infecciones pueden progresar a una enfermedad crítica con insuficiencia respiratoria hipoxémica que requiere soporte ventilatorio prolongado1.
En pacientes críticos de COVID-19, los distintos tratamientos con medicamentos como remdesivir, hidroxicloroquina, lopinavir e interferón tuvieron poco o ningún impacto en la mortalidad, la necesidad de intubación o la estancia hospitalaria3. Los glucocorticoides (GC), incluida la dexametasona, se han utilizado ampliamente como fármacos antiinflamatorios e inmunosupresores eficaces, y podrían ser beneficiosos para tratar la tormenta de citocinas inducida por el SARS-CoV-2. Varios estudios han mostrado la aplicación de GC en el síndrome respiratorio agudo grave en 2002, el síndrome respiratorio de Oriente Medio en 2012, la influenza grave y la neumonía adquirida en la comunidad1,4.
El estudio RECOVERY1, un ensayo clínico aleatorizado en el cual participaron más de 6400 pacientes hospitalizados con COVID-19, proporcionó la evidencia del tratamiento con dexametasona a dosis de 6 mg una vez al día durante un máximo de 10 días. La dexametasona logró reducir la mortalidad a 28 días en quienes recibieron asistencia respiratoria, reduciendo la mortalidad hasta un 17%; sin embargo, no se encontró ningún beneficio en los pacientes que no requirieron oxígeno. Los ensayos clínicos publicados han utilizado dosis entre intermedias y altas (prednisona 30 mg de equivalencia al día, dexametasona 125 mg).
Previo a la publicación de este estudio, muchas pautas de tratamiento de la COVID-19 declararon que el uso de GC estaba contraindicado o no recomendado. Sin embargo, la dexametasona está en la lista de medicamentos esenciales de la Organización Mundial de la Salud y está disponible en todo el mundo a bajo costo. Las pautas emitidas por los responsables médicos en el Reino Unido y por los National Institutes of Health de los Estados Unidos de América se actualizaron recomendando el uso de GC en pacientes hospitalizados con COVID-191,5. En consecuencia, la dexametasona ahora se considera el estándar de cuidado para los pacientes con COVID-19 grave6.
Varios estudios observacionales en España han mostrado una mejor respuesta cuando los GC se dan en ciclos cortos a altas dosis (el equivalente a 300-600 mg de prednisona al día). El beneficio adicional de estas dosis podría deberse a la activación de la vía no genómica de los GC, lo que daría lugar a un efecto antiinflamatorio máximo7.
En un estudio, Wang et al.8 encontraron que la administración de metilprednisolona pareció no reducir el riesgo de muerte en pacientes con neumonía por COVID-19. Fallecieron 23 de 50 pacientes, lo cual es una tasa de mortalidad bastante alta, casi del 50%. Por lo tanto, en términos de indicación, menor dosis y duración, los autores sugerían que la aplicación de metilprednisolona requiere una mayor investigación8.
Las estimaciones han sugerido que hasta el 12% de los pacientes hospitalizados con COVID-19 han requerido ventilación mecánica invasiva, y la mayoría desarrollaron síndrome de dificultad respiratoria aguda (SDRA). En el examen histológico pulmonar de pacientes con COVID-19 se ha encontrado daño alveolar difuso con membranas hialinas, características del SDRA. Además, en la COVID-19 es frecuente un estado inflamatorio y esto puede contribuir al fallo multiorgánico en los pacientes. Los GC pueden ejercer un efecto importante en el control de esta respuesta exacerbada9.
La respuesta inmunitaria antiviral es crucial para eliminar el virus invasor. Sin embargo, una respuesta inapropiada puede causar un estado hiperinflamatorio sistémico y producir complicaciones como el SDRA y falla orgánica multisistémica. El tratamiento temprano de esta hiperinflamación puede ser importante para reducir la mortalidad en pacientes con COVID-1910.
Aunque la mayoría de los pacientes infectados permanecerán asintomáticos o desarrollarán síntomas leves, hasta un 20% pueden presentar una enfermedad grave con neumonía e insuficiencia respiratoria. La administración de oxígeno es la piedra angular del tratamiento de apoyo y se requiere en aproximadamente el 15% de los casos, mientras que la ventilación mecánica invasiva es necesaria hasta en un 5-7% de los casos graves. Dado que la mortalidad en los pacientes con ventilación invasiva puede ser muy alta, detener la progresión de la insuficiencia respiratoria de moderada a grave debería reducir la mortalidad por COVID-1911.
La alta concentración de citocinas/quimiocinas inflamatorias amplifica el daño tisular destructivo a través de la disfunción endotelial y la vasodilatación, lo que permite el reclutamiento de células inmunitarias, en este caso macrófagos y neutrófilos. La fuga vascular y la función de barrera comprometida promueven la endotelitis y el edema pulmonar, lo que limita el intercambio de gases que luego facilita un ambiente hipóxico, lo cual conduce a insuficiencia respiratoria y orgánica. El medio inflamatorio induce a las células endoteliales a regular al alza las moléculas de adhesión de leucocitos, promoviendo así la acumulación de células inmunitarias que también pueden contribuir a la rápida progresión de la insuficiencia respiratoria. La hiperinflamación en el pulmón induce además cambios transcripcionales en los macrófagos y los neutrófilos que perpetúan el daño tisular que finalmente conduce a un daño pulmonar irreversible. La evidencia reciente sugiere que la inflamación sistémica induce secuelas a largo plazo en los tejidos del corazón12,13.
Los GC son tanto antiinflamatorios como inmunosupresores; se unen a los receptores intracelulares para modular la transcripción génica de mediadores proinflamatorios. También inhiben los genes que expresan la enzima ciclooxigenasa 2 para suprimir la síntesis de prostaglandinas, lipoxinas, leucotrienos y tromboxano. Se han utilizado para una amplia gama de afecciones. Los GC sistémicos e inhalados se utilizan para tratar muchos trastornos respiratorios, como el asma bronquial, la enfermedad pulmonar obstructiva crónica y la neumonitis14.
El objetivo de este estudio fue evaluar el uso de GC en los pacientes con COVID-19 hospitalizados en las distintas unidades de cuidados intensivos (UCI) del Hospital General de México. Los registros indican solo el uso de tres GC (dexametasona, hidrocortisona y metilprednisolona), encontrándose que no hay grandes diferencias entre ellos a dosis equivalentes.
Método
Estudio de tipo retrospectivo, observacional y analítico. Se recolectaron los expedientes clínicos de pacientes COVID-19 de las UCI del Hospital General de México; como medida de protección, los expedientes fueron desinfectados mediante esterilización con ozono.
Se obtuvieron los datos clínicos de pacientes mayores de 18 años que fueron hospitalizados por infección por SARS-CoV-2 con una prueba de qRT-PCR (quantitative real time polymerase chain reaction) positiva y que cumplieron con los criterios de inclusión, en el periodo del 1 de abril al 31 de diciembre de 2020. Toda la información se registró en una base de datos.
La población estudiada se dividió en dos grupos: pacientes que recibieron GC sistémicos (dexametasona, metilprednisolona e hidrocortisona) y pacientes con terapia estándar, para posteriormente comparar la evolución clínica. En las diferentes UCI, la terapia estándar consistió en medicamentos como anticoagulantes, antibióticos, analgésicos y oxígeno suplementario.
La estadística descriptiva incluyó análisis de frecuencia (porcentajes) para las variables categóricas, y medias y desviación estándar o medianas para las variables continuas. Las comparaciones se determinaron mediante la prueba de ANOVA para las variables continuas y mediante la prueba de χ2 para las variables categóricas. Todos los valores de p fueron de dos colas, con 0.05 como umbral de significancia estadística.
Resultados
Se incluyeron 1603 expedientes clínicos de pacientes adultos hospitalizados por infección causada por SARS-CoV-2 (Fig. 1), los cuales tuvieron un promedio de edad de 56 años (± 14). En la tabla 1 se muestran las principales variables clínicas de la muestra del estudio, y en la tabla 2 los valores de las principales variables bioquímicas.
Tabla 1 Principales características clínicas
| Frecuencia (n = 1603) | Porcentaje* | |
|---|---|---|
| Sexo | ||
| Hombre | 1051 | 66 |
| Mujer | 552 | 34 |
| Uso de corticosteroides | ||
| No se utilizaron | 819 | 51 |
| Dexametasona | 567 | 35 |
| Metilprednisolona | 171 | 11 |
| Hidrocortisona | 46 | 3 |
| Uso de antibacterianos | ||
| Sí | 1443 | 90 |
| No | 160 | 10 |
| Uso de anticoagulantes | ||
| Sí | 498 | 31 |
| No | 1105 | 69 |
| Asistencia mecánica ventilatoria | ||
| No requirieron | 1122 | 70 |
| Requirieron ventilación mecánica invasiva | 444 | 28 |
| Otras condiciones | 37 | 2 |
| Motivo de egreso | ||
| Defunción | 984 | 61 |
| Mejoría | 619 | 39 |
*Porcentaje redondeado.
Tabla 2 Valores en sangre de parámetros bioquímicos al ingreso al hospital (n = 1603)
| Media ± DE | Rango | |
|---|---|---|
| Dímero D | 4699 ± 9031 | 31-43,968 |
| Leucocitos | 11319 ± 6481 | 2500-45,000 |
| Neutrófilos | 9753 ± 6076 | 300-42,500 |
| Linfocitos | 1043 ± 1837 | 100-35,800 |
| Procalcitonina | 2.6 ± 10.2 | 0.01-100 |
| Ferritina | 1271 ± 1550 | 2-9966 |
| Proteína C reactiva ultrasensible | 203 ± 128 | 1-479 |
DE: desviación estándar.
En los 1603 expedientes clínicos se documentó que el promedio de hospitalización fue de 12 días (± 11). El rango de días de hospitalización fue de 0 a 109. Es importante señalar que 141 pacientes hospitalizados fallecieron en las primeras 48 horas de su estancia; 68 de ellos en las primeras 24 horas. Fue notorio que, de los 141 fallecidos en las primeras 48 horas, 109 (77%) no recibieron ni una sola dosis de GC.
La principal comorbilidad en los pacientes que recibieron GC incluyó hipertensión arterial (38.2%), diabetes mellitus (38.1%) y obesidad (30.4%), mientras que en los pacientes que recibieron la terapia estándar fueron enfermedad renal crónica (52.5%), obesidad (51%) y diabetes mellitus (49.3%).
En los expedientes de los 984 pacientes fallecidos se documentó que el 62.9% habían recibido algún GC sistémico. De los 819 pacientes que no recibieron GC sistémicos, 365 (44.6%) fallecieron, frente a 619 (79%) que sí recibieron algún GC (Fig. 2).
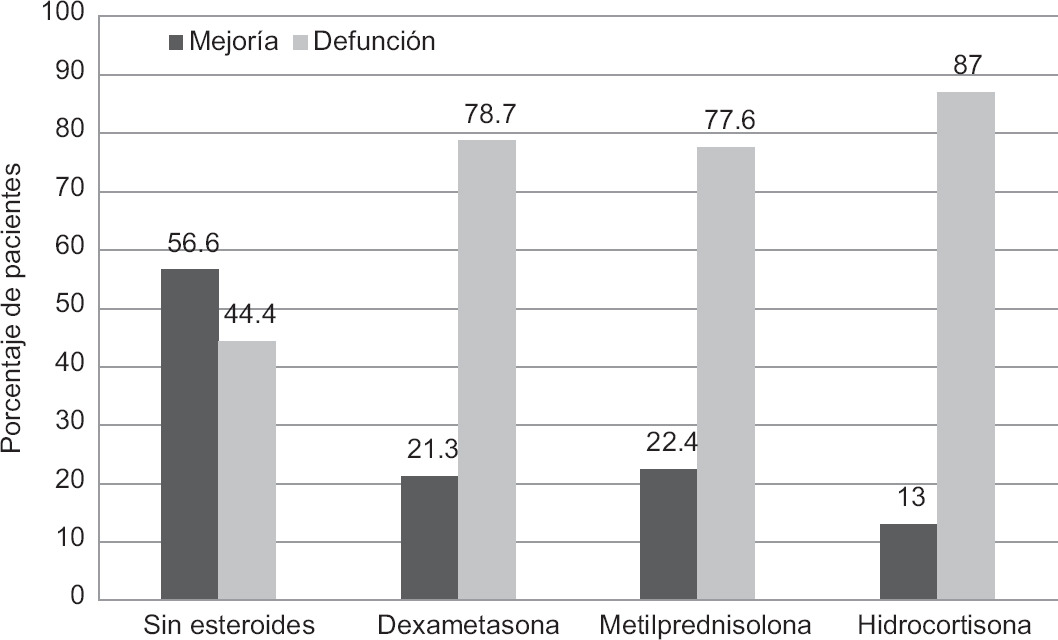
Figura 2 Motivo de egreso y terapias adyuvantes. Porcentaje de egresos por mejoría con losdiferentes tratamientos: sin esteroides (n = 454), dexametasona (n = 121), metilprednisolona(n = 38) e hidrocortisona (n = 6). Porcentaje de egresos por defunción sin esteroides (n = 363), con dexametasona (n = 446), con metilprednisolona (n = 132) y con hidrocortisona (n = 40).
En cuanto a la saturación de oxígeno, estimada mediante oximetría de pulso, el promedio fue del 73% (± 17). La fracción inspirada de oxígeno (FiO2) que se suministró a los pacientes a su ingreso se documentó que fue en promedio del 26% (± 15) (Fig. 3), señalando que si bien hubo pacientes que no requirieron oxígeno al ingreso, hubo otros que necesitaron intubación endotraqueal inmediata con apoyo mecánico ventilatorio con FiO2 del 100%.
Al dividir los expedientes clínicos de los 1603 pacientes hospitalizados en los dos grupos (los que recibieron GC sistémicos y nos lo que no) se procedió a realizar un análisis estadístico utilizando una prueba t de Student para grupos independientes; en la tabla 3 se muestran los resultados.
Tabla 3 Comparación entre los grupos de enfermos que recibieron algún tipo de corticoesteroide sistémico y los que no lo recibieron (n = 1603)
| Grupo sin corticoesteroide | Grupo con corticoesteroide | p (IC95%) | |
|---|---|---|---|
| Edad, años | 53.6 | 58.1 | 0.0001 (−6.73 a−2.32) |
| Días de hospitalización | 10.9 | 13.1 | 0.010 (−3.89 a−0.54) |
| Oximetría de pulso | 76.2 | 71.0 | 0.0001 (2.58 a 7.81) |
| Dímero D | 3,350 | 5,937 | 0.0001 (−4023 a−1149) |
| Leucocitos en sangre | 10,112 | 12,444 | 0.0001 (−3.30 a−1.36) |
| Neutrófilos en sangre | 8,538 | 10,884 | 0.0001 (−3.25 a−1.43) |
| Proteína C reactiva ultrasensible | 188 | 216 | 0.031 (−51.99 a−2.53) |
IC95%: intervalo de confianza del 95%.
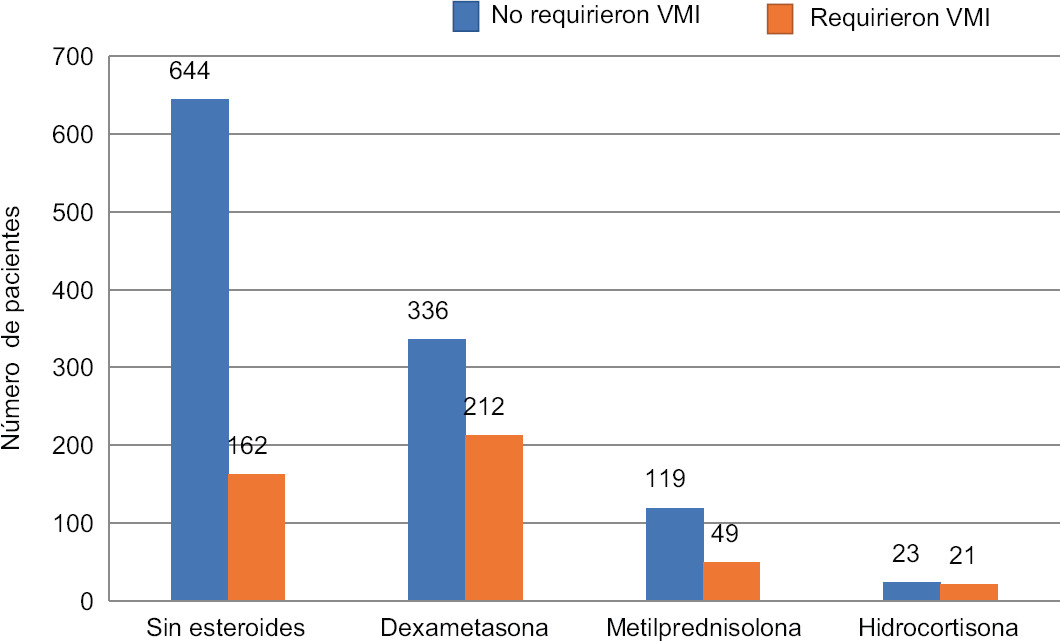
En el análisis de tablas cruzadas se identificó una razón de momios (OR, odds ratio) de 4.68 como riesgo para defunción con el uso de GC sistémicos (tabla 4). Se hicieron diversos modelos para el análisis de regresión logística binaria (mejoría/defunción) y se controlaron variables potencialmente confusoras, al evitar que en el modelo no se modificaran abruptamente las OR al introducir nuevas variables en los diferentes modelos. Finalmente, el modelo con mayor parsimonia se obtuvo teniendo como variable única el uso de GC sistémicos, con una OR de 4.68 (intervalo de confianza del 95%:3.75,5.83; p = 0.0001). En otros modelos, la edad y los valores de dímero D y de proteína C reactiva mostraron una OR levemente superior a 1, los tres con un valor de p = 0.0001.
Tabla 4 Asociación entre el uso de corticoesteroides y el desenlace durante la hospitalización
| Terapia con corticosteroides | OR (IC95%) | p |
|---|---|---|
| Mortalidad (n = 619) | 4.68 (3.75 a 5.83) | < 0.001 |
| Uso de ventilación mecánica invasiva (n = 282) | 2.26 (1.8 a 2.82) | < 0.001 |
IC95%: intervalo de confianza del 95%; OR: odds ratio.
Discusión
Durante la pandemia de COVID-19, el tratamiento de estos pacientes fue uno de los principales retos para el personal de salud. En este estudio se revisó el uso de GC en los pacientes con COVID-19 hospitalizados en las UCI del Hospital General de México. Uno de los principales tratamientos utilizados desde el inicio de forma empírica fueron los GC, mostrando beneficios en gran parte de los pacientes en comparación con otros tipos de tratamiento. Sin embargo, fue después de la publicación del estudio RECOVERY que se mostró que los pacientes con ventilación mecánica invasiva eran los que obtenían el mayor beneficio, y no todos los pacientes infectados por SARS-CoV-2 eran candidatos a este manejo, sino que tenía ciertas indicaciones1.
Distintas publicaciones en todo el mundo documentaron la evidencia científica de los beneficios de los GC en este tipo de pacientes15-17; sin embargo, también existen estudios en los que se ha observado un efecto negativo, sobre todo en pacientes con comorbilidad18-20. En el estudio de Provencio et al.21 se hace referencia a que el riesgo de muerte fue significativamente mayor en los pacientes que recibieron GC durante la hospitalización, en comparación con aquellos que no los recibieron (51.3% vs. 25.7%; p < 0.001).
En México, la mayor parte de la población que se infectó por el SARS CoV-19 contaba con una o más de las principales enfermedades en comorbilidad: hipertensión arterial, diabetes mellitus y obesidad, entre otras22-24.
En nuestro estudio, con 1603 pacientes ingresados a hospitalización por infección por SARS-CoV-2, los GC no mostraron beneficio terapéutico. El análisis del uso de los GC en las UCI mostró una mayor mortalidad durante la estancia hospitalaria y un mayor uso de ventilación mecánica invasiva. En cuanto a los días de hospitalización, no hubo diferencia significativa entre los pacientes que recibieron GC sistémicos y los que fueron tratados con terapia estándar. El sexo masculino tuvo mayor porcentaje de hospitalización y mayor requerimiento de GC. Dentro del grupo de los GC, el que se asoció a menor mortalidad y menor uso de ventilación mecánica invasiva fue la metilprednisolona. Por el contrario, la hidrocortisona fue el que mostró mal pronóstico, requiriendo mayor ventilación mecánica. Los pacientes que recibieron la terapia estándar (anticoagulantes, antibióticos y oxígeno suplementario) tuvieron un mayor porcentaje de egresos por mejoría y un menor uso de ventilación mecánica invasiva.
Una de las grandes limitaciones que tiene el presente estudio es que en los expedientes clínicos no se identificaron todas las variables para estratificar la gravedad de la enfermedad desde el punto de vista clinimétrico. Esto nos exige tomar con reservas los resultados que se presentan, ya que el uso de GC sistémicos probablemente se debió a la mayor gravedad de la enfermedad aunado al deterioro clínico de los pacientes que finalmente fallecieron, y no fue la causa ni estuvo asociado al deceso de los enfermos. Interpretarlo de otra forma nos llevaría a tomar como válida una «asociación espuria» o de «causalidad en reversa».
Otro posible sesgo en el análisis estadístico realizado fue la falta de información por expedientes clínicos incompletos; por ejemplo, no todos tenían en sus indicaciones las dosis y la duración del tratamiento con GC. Además, no se logró analizar cada una de las variables que influyeron en el motivo de egreso, como los marcadores inflamatorios, y tampoco se conocía si hubo pacientes con automedicación de GC desde su casa.
Los GC inhalados podrían ser una intervención terapéutica para pacientes con COVID-19, pues en el SDRA han demostrado reducir los niveles de marcadores inflamatorios y también parecen mejorar la fisiología pulmonar14,25. Nosotros consideramos que para mejorar la administración de los distintos GC (dexametasona, metilprednisolona e hidrocortisona) en pacientes con COVID-19 es necesario analizar la presencia de comorbilidad con cada uno de ellos y así tener un mejor manejo clínico de esta enfermedad.
Conclusiones
En los pacientes hospitalizados por COVID-19, el uso de diferentes GC (dexametasona, metilprednisolona o hidrocortisona) se asoció con un mal pronóstico. Los pacientes que recibieron GC durante la hospitalización presentaron mayor mortalidad y requirieron mayor uso de ventilación mecánica invasiva, en comparación con los pacientes que recibieron la terapia estándar.











 nueva página del texto (beta)
nueva página del texto (beta)