Introducción
Los pólipos gástricos son lesiones epiteliales que protruyen hacia el lumen gástrico y requieren estudio anatomopatológico para determinar su origen mucoso o submucoso. El amplio uso y la disponibilidad de la endoscopia de vías digestivas altas ha facilitado la detección de estas lesiones, variando de un 0.5% a un 23% y con una prevalencia del 0.8% al 2.4% en la población general. Sin embargo, solo un 10% son sintomáticos, de los cuales el 14% al 40% son pólipos hiperplásicos asociados a infección por Helicobacter pylori1,2.
Estos hallazgos se presentan de manera incidental en pacientes que consultan por síntomas gastrointestinales múltiples. Al momento de su visualización endoscópica se plantea el diagnóstico diferencial con tumores neuroendocrinos o de tejido pancreático ectópico, y dado su potencial maligno se hace mandatoria su adecuada caracterización. Además, pueden estar asociados con algunos síndromes hereditarios, como la polipomatosis familiar hereditaria y el síndrome de Peutz-Jeghers2-4.
Dentro de este grupo de patologías se encuentran los pólipos gástricos hiperplásicos, con indicación de resección cuando superan los 10 mm, en presencia de algún grado de displasia en la patología sin importar su tamaño o en caso de complicaciones. Se han descrito múltiples maneras de resección cuando son gigantes y no es posible rodearlos con el asa de polipectomía; sin embargo, en lesiones por encima de 3 cm es difícil obtener una resección en bloque, por lo cual nos permitimos proponer una técnica quirúrgica mínimamente invasiva para el manejo de los pólipos hiperplásicos gigantes, que se asocian a síndrome pilórico, no susceptibles de resección endoscópica, mostrando nuestra experiencia con la polipectomía transgástrica laparoscópica5,6.
Método
Estudio retrospectivo de serie de casos entre enero de 2015 y diciembre de 2018 en nuestra institución. Se incluyeron siete pacientes con diagnóstico de pólipos gigantes no susceptibles de manejo endoscópico que fueron llevados a abordaje laparoscópico. Las variables sociodemográficas y clínicas se resumen en la tabla 1.
Tabla 1 Variables sociodemográficas de los pacientes (n = 7)
| Características | |
|---|---|
| Edad, promedio (rango) | 51 (45-57) |
| Sexo (H: M) | 1:6 |
| Comorbilidad (n) | Hipertensión arterial (5) Hipotiroidismo (6) Diabetes mellitus tipo 2 (2) Falla cardíaca compensada (1) |
| Puntuación ASA (n) | I (5) II (2) |
| IMC promedio | 23 |
ASA: American Society of Anesthesiologists; IMC: índice de masa corporal.
Se evaluaron variables sociodemográficas, como edad, sexo, comorbilidad, puntuación ASA (American Society of Anesthesiologists), índice de masa corporal, causa de consulta a urgencias; variables preoperatorias, como el grosor del pedículo, la susceptibilidad de resección endoscópica y la patología por biopsia; y variables quirúrgicas, como el tiempo intraoperatorio, las complicaciones tempranas y tardías (sangrado, infecciones intraabdominales, fístulas), la necesidad de conversión a cirugía abierta, la necesidad de unidad de cuidado intensivo, el tiempo de estancia hospitalaria, la necesidad de reintervención y la mortalidad. En el seguimiento se evaluaron la recidiva del pólipo hiperplásico, la estenosis y la necesidad de reintervención. Se realizó seguimiento clínico y endoscópico durante un mínimo de 6 a 12 meses. Todos los pacientes se sometieron a una evaluación multidisciplinaria prequirúrgica por parte de los departamentos de gastroenterología y cirugía.
El protocolo de estudio fue aprobado por el comité de ética de cada institución e implementado de conformidad con las disposiciones de la Declaración de Helsinki y las directrices de buenas prácticas clínicas. Todos los pacientes tenían el correo electrónico y el número de teléfono celular del cirujano, para garantizar un seguimiento estricto y no perder la continuidad de la vigilancia clínica.
Técnica quirúrgica
PREPARACIÓN DEL PACIENTE
La evaluación prequirúrgica incluyó revisión del estado hemodinámico y sistémico, descartando focos infecciosos y otras causas extragástricas que pudieran ocasionar la sintomatología, mediante tomografía computarizada. Según los hallazgos se realizó la corrección de las alteraciones hidroelectrolíticas de los pacientes y se instauraron profilaxis antibiótica y tromboprofilaxis farmacológica y mecánica.
Todos los pacientes fueron valorados prequirúrgicamente por un equipo multidisciplinario compuesto por gastroenterología y cirugía general. Se realizó endoscopia de vías digestivas altas con al menos seis biopsias al pólipo y al menos cuatro a la mucosa gástrica, colonoscopia total, ultrasonografía endoscópica gástrica y tomografía computarizada de abdomen contrastada, descartando malignidad.
Según los hallazgos se proponía a los pacientes ser llevados a polipectomía transgástrica laparoscópica para realizar la resección en bloque del pólipo hiperplásico, evitando la realización de una antrectomía más gastroyeyunostomía en Y de Roux. Los pacientes y sus familias fueron informados del riesgo de la cirugía, de la posible necesidad de trócares adicionales o de conversión a cirugía abierta, y del riesgo de mortalidad.
POLIPECTOMÍA TRANSGÁSTRICA LAPAROSCÓPICA
Bajo anestesia general, el paciente es colocado en posición de litotomía con sujeción mecánica para facilitar su inclinación máxima con rotación lateral de la mesa de operación.
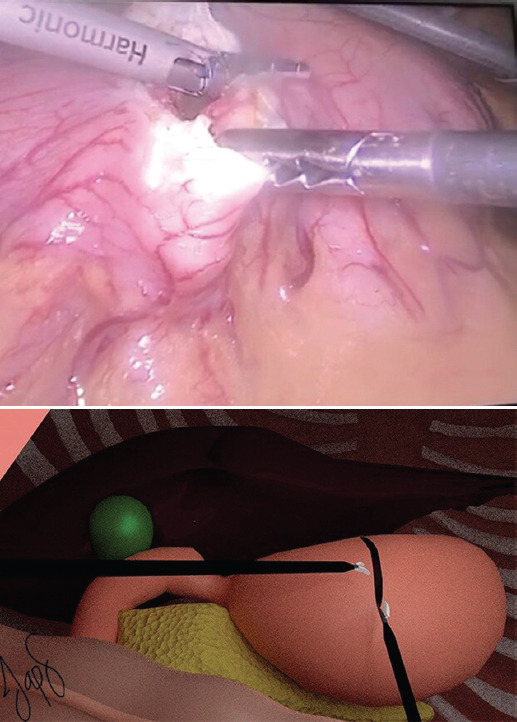
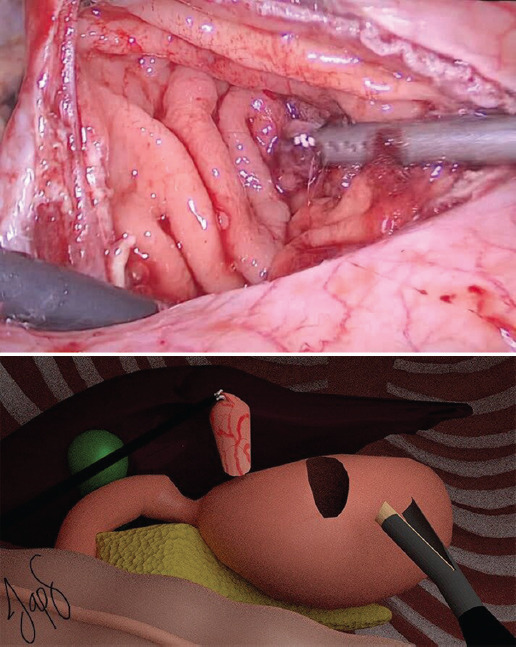
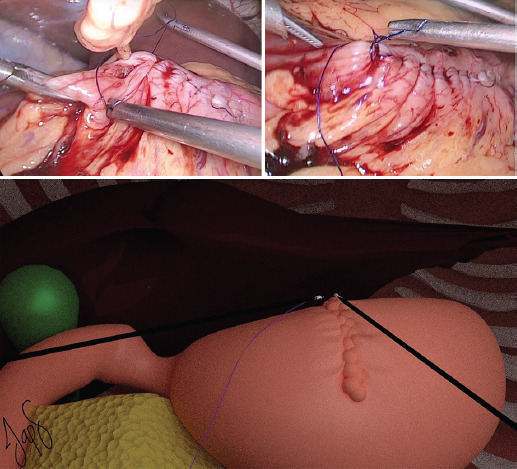
El cirujano se coloca en posición francesa en medio de las piernas del paciente y el primer ayudante se coloca a la derecha del cirujano. La instrumentadora se coloca a la derecha del primer ayudante. La creación de neumoperitoneo se realiza con técnica abierta de Hasson a nivel umbilical. Se introduce un puerto de 12 mm, se inicia un flujo de 40 l/min y manteniendo una presión de 14 mmHg se avanza un laparoscopio de 30°. Bajo visión directa se colocan tres puertos: uno de 5 mm en el flanco derecho, uno de 12 mm en el flanco izquierdo y uno de 5 mm en el hipocondrio derecho. Se realiza una gastrotomía anterior a nivel de la unión corporoantral con bisturí ultrasónico Harmonic® (Ethicon, Inc., Cincinnati, OH, USA) (Fig. 1) con el fin de identificar el pólipo (Fig. 2), el cual se fija con pinzas Grasper (Ethicon, Inc., Cincinnati, OH, USA) y se evierte elevándolo hacia el peritoneo parietal con el fin de mostrar la base del pedículo del pólipo (Fig. 3). Con un margen de 10 mm de la base en la mucosa gástrica se realiza una polipectomía con una sutura laparoscópica cortante tipo vascular de color arena (Ethicon, Inc., Cincinnati, OH, USA) (Fig. 4), se revisa la hemostasia (Fig. 5) y se realiza el cierre de la gastrotomía anterior con puntos simples continuos seromusculares mucomucosos de PDS 4-0 (Ethicon, Inc., Cincinnati, OH, USA), con endonudos laparoscópicos (Fig. 6). Se extrae la pieza quirúrgica en una endobolsa a través de una ampliación del puerto umbilical. Se aspira la cavidad. Se retiran los puertos bajo visión directa, se extrae el neumoperitoneo y se cierra la aponeurosis con puntos simples de PDS 0 (Ethicon, Inc., Cincinnati, OH, USA) en los dos puertos de 12 mm, y se cierra la piel con puntos intradérmicos de Prolene 3-0 (Ethicon, Inc., Cincinnati, OH, USA).

Figura 2 Visión laparoscópica directa del pólipo hiperplásico gigante a través de la gastrotomía anterior.
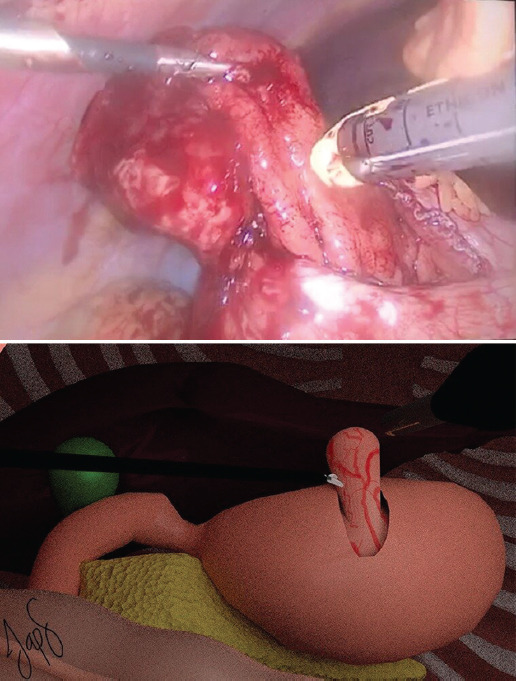
Figura 3 Eversión laparoscópica del pólipo hiperplásico gigante a través de la gastrotomía anterior.
Resultados
Durante un periodo de 4 años, siete pacientes (seis mujeres y un hombre), con un promedio de edad de 51 años, asistieron al servicio de urgencias por sintomatología de dolor abdominal, náuseas y emesis. Seis pacientes presentaban sangrado gastrointestinal alto confirmado por endoscopia de vías digestivas altas, con hallazgo de pólipo benigno gástrico gigante sintomático por síndrome pilórico no candidato a manejo endoscópico, por lo que fueron llevados a manejo laparoscópico.
Dentro de los hallazgo prequirúrgicos, todos los pacientes tuvieron pólipo gigante gástrico a nivel del antro, con un promedio de tamaño de 6.6 cm (6.2-7.1 cm) y un grosor del pedículo en promedio de 4.4 cm (4-4.9 cm). Todos los pacientes tuvieron hallazgo de H. pylori, por lo que se les inició manejo erradicador por parte del servicio de gastroenterología.
El tiempo quirúrgico promedio fue de 42 min (37-46 min), con sangrado intraoperatorio inferior 10 cc. En todos los casos se logró hacer la resección en bloque con bordes negativos. No se diagnosticaron fugas posoperatorias y se instauró la tolerancia a la vía oral a las 24 horas con inicio de dieta líquida y posterior progresión.
Durante el año de seguimiento, los pacientes fueron llevados a un mínimo de dos endoscopias de vías digestivas altas, sin hallazgos particulares ni requerimiento de intervenciones.
Discusión
Los pólipos hiperplásicos son el segundo tipo más frecuente de pólipo del epitelio gástrico. En zonas endémicas para H. pylori, como la nuestra, pueden alcanzar hasta un 75% de los pólipos gástricos. Son originados en las células epiteliales del estómago y se caracterizan por una apariencia pediculada o sésil en la endoscopia, principalmente a nivel del antro; sin embargo, macroscópicamente no se pueden diferenciar de otros tipos de pólipos, por lo cual es importante realizar la confirmación histológica debido al potencial de malignidad que presentan este tipo de lesiones, con el fin de descartar displasia y hacer un diagnóstico1,7,8.
Los síntomas más frecuentes asociados a este tipo de pólipos gigantes son sangrado gastrointestinal, anemia y obstrucción distal intermitente secundaria a prolapso del pólipo hacia el píloro, como se evidencia en nuestro estudio1,2,7,8.
Las lesiones menores de 5 mm se manejan únicamente con biopsia, usando fórceps endoscópicos estándar, ya que el diagnóstico histológico se alcanza en más del 97% de los casos. Para lesiones mayores de 10 mm, las cuales en los pólipos hiperplásicos son más del 30%, la posibilidad de pasar por alto un foco de displasia o un carcinoma in situ es alta, con un estimado de transformación maligna presentando metaplasia intestinal focal del 5% al 37%, del 2% al 20% con displasia focal y hasta del 2% al 6% con adenocarcinoma ya instaurado, por lo cual se recomienda la realización de una polipectomía completa asociada a biopsias aleatorias de la mucosa gástrica para descartar otras lesiones preneoplásicas sincrónicas, las cuales se pueden presentar hasta en un 7.1% de los casos. Además, se debe administrar manejo erradicador para H. pylori ante una infección activa, como se hizo en nuestros pacientes, tal como demostraron Nam et al.9 en su estudio de cohortes, en el que H. pylori se asoció a un aumento en el desarrollo de pólipos hiperplásicos y su erradicación favoreció 11.7 veces más la ausencia de nuevos pólipos en comparación con los sujetos controles9,10.
Las lesiones sintomáticas, las mayores de 10 mm y las que presentan displasia o cáncer deben ser llevadas a resección con asa de polipectomía. Asimismo, las lesiones de gran tamaño, como las reportadas en nuestro estudio, requieren disección submucosa endoscópica para poder completar una resección en bloque, con una baja tasa de recurrencia reportada del 0% al 3%; sin embargo, el porcentaje de resección incompleta es del 2.2% al 26.3%11-13.
También se ha reportado el uso de disección submucosa endoscópica para resecar lesiones recidivantes o residuales. Este procedimiento es difícil de realizar debido a la importante fibrosis y a la formación de úlcera cicatricial. Así lo demuestran Bae et al. en 16 pacientes llevados a disección submucosa endoscópica secundaria con un porcentaje de resección curativa del 93.8%, igual que Oka et al. con un éxito del 93.3% en completar una resección en bloque con disección submucosa endoscópica secundaria para lesiones residuales o recurrentes posterior a una mucosectomía endoscópica14,15,16,17.
En pacientes con lesiones mayores de 3 cm disminuye la posibilidad de poder realizar una resección en bloque por disección submucosa endoscópica de un 96% a un 83%, como reportan Larghi y Waxman18, así como Pimentel-Nunes et al.14 en 2015 en las guías europeas de endoscopia gastrointestinal.
Los resultados obtenidos con la polipectomía transgástrica laparoscópica son similares a los de la disección submucosa endoscópica o incluso superiores, en términos de tiempo quirúrgico y estancia hospitalaria. En el estudio de Jung et al.15 con 1623 pacientes que fueron llevados a disección submucosa endoscópica, 28 requirieron una segunda disección submucosa endoscópica, con un tiempo quirúrgico promedio de 55.1 min para el primer procedimiento y de 78.2 min para la disección submucosa endoscópica secundaria, y un sangrado de 1 a 15 cc. En nuestro estudio, el tiempo quirúrgico promedio fue de 42 min y el sangrado fue inferior a 10 cc. En cuanto a complicaciones postoperatorias, Jung et al.15 tuvieron un 3.8%, dado principalmente por perforación en 37 pacientes, a diferencia de nuestro procedimiento, con un 0% de morbilidad. La resección en bloque la lograron en el 98.7% de los pacientes y la curación en el 86.87%; porcentajes similares a los nuestros. En cuanto a la estancia hospitalaria promedio, la literatura reporta en promedio 3.5 días, mayor que la nuestra, que fue de 1 día13-18.
Posterior a la realización de una resección en bloque es importante realizar un seguimiento endoscópico, especialmente si se identifica displasia o carcinoma in situ en el pólipo mismo o en la mucosa gástrica. En pólipos mayores de 10 mm, cada 6 a 12 meses se debería realizar una colonoscopia total, ya que diversos estudios han reportado un aumento de tres veces la posibilidad de presentar adenomas colorrectales sincrónicos en pacientes con pólipos hiperplásicos gástricos, y en caso de presentar múltiples pólipos se debe descartar un síndrome polipósico hereditario, como se hizo en nuestro estudio19-21.
Conclusiones
La polipectomía transgástrica laparoscópica es una técnica factible para la resección de pólipos hiperplásicos gigantes con malignidad y displasia descartada que no puedan ser llevados a manejo endoscópico. El procedimiento podría disminuir el requerimiento de antrectomía con gastroyeyunostomía en Y de Roux con efectos directos sobre la morbilidad y la mortalidad en los pacientes. Sin embargo, se requieren más estudios que permitan replicar estos resultados.











 nueva página del texto (beta)
nueva página del texto (beta)