Introducción
Definición
La Organización Mundial de la Salud (OMS) define la tuberculosis extrapulmonar (TBEP) como aquella tuberculosis (TB) diagnosticada clínicamente y confirmada por estudios bacteriológicos que afecta a tejidos y órganos fuera del parénquima pulmonar1.
Epidemiología
La TB se encuentra dentro de las primeras diez causas principales de muerte en todo el mundo, registrándose 4500 defunciones y aproximadamente 30,000 personas que contraen esta enfermedad diariamente. México ocupa el tercer lugar en América Latina en incidencia de TB pulmonar y TBEP, presentando 23,000 casos en el año 2017, el 80% de ellos de localización pulmonar y el 20% extrapulmonar. Los Estados con mayor incidencia fueron Baja California, Sonora, Tamaulipas, Guerrero y Sinaloa2. La población de 15 a 45 años es la más afectada, observándose una mayor mortalidad en adultos mayores e incrementándose esta si existen factores de riesgo3. En cuanto a las regiones físicas del cuerpo humano de la afectación de la TB, la localización más frecuente es la pulmonar, con un 80.7%, seguida de la TBEP con un 17.7% y la meníngea con un 1.6%, predominando en los hombres4,5. En un estudio realizado en el año 2017, 528 pacientes ingresaron por sospecha de serositis por TB, de los cuales 34 presentaron TB meníngea, 14 TB pleural, 8 TB peritoneal y 2 TB pericárdica, sitios de diseminación cada vez más frecuente6.
Es importante destacar las infecciones por Mycobacterium bovis, que se encuentra en un 10% de todos los casos de TBEP, siendo relevante debido a las repercusiones clínicas que representa y el plan de tratamiento7.
Factores de riesgo
En un estudio realizado en el Hospital General de México se encontraron 420 casos de TB, el 56% correspondientes a TB pulmonar y el 44% a TBEP; el 60% fueron del sexo masculino y el 40% del sexo femenino. De los casos con TBEP, el virus de la inmunodeficiencia humana (VIH) o el sida estuvieron presentes en el 63%, el alcoholismo en el 30%, el tabaquismo en el 30% y la diabetes mellitus en el 17%. Cabe destacar que la OMS establece que las personas infectadas con VIH tienen 30 veces mayor riesgo de desarrollar la enfermedad, así como también una mayor prevalencia del complejo M. bovis8, ocasionando que la bacteria acelere la multiplicación del VIH y conduzca a una rápida progresión a sida.
Fisiopatología
La bacteria Mycobacterium tuberculosis es diseminada principalmente por el aire, por las gotitas de Flügge que contienen el bacilo y pueden ser inhaladas por personas cercanas. El desarrollo de la enfermedad ocurre en cuatro pasos: fagocitosis del bacilo, multiplicación intracelular, fase latente e infección activa del pulmón. Estos pasos pueden progresar hacia diferentes situaciones clínicas: la curación de la enfermedad, el desarrollo de la enfermedad, la infección latente y la reactivación o reinfección9. Los bacilos de M. tuberculosis presentes en los pulmones o los ganglios linfáticos pueden presentar una reactivación e ingresar a la circulación sistémica, lo que origina una diseminación extrapulmonar a diferentes sitios, como la pleura, el pericardio o el peritoneo5. En cualquier huésped susceptible, las respuestas protectoras, como la formación de granuloma, fallan y no puede limitarse la actividad de la enfermedad, favoreciendo la diseminación. Además, existe un déficit en la secreción de interleucina 4, la cual induce a los receptores tipo Toll 2 y a la activación de macrófagos, lo que determina que la infección por M. tuberculosis se vuelva latente o progresiva10. Los genes para la patogenicidad de la micobacteria se han agrupado según su función, siendo genes de la envoltura y enzimas del metabolismo celular11. Los de envoltura sintetizan proteínas que son expuestas al medio ambiente en el cual crece la bacteria; actualmente se conocen alrededor de doscientas, de las cuales las más importantes son ESAT-6 y CFP-10. Dichas proteínas disminuyen la respuesta inmunitaria innata del hospedero en las primeras etapas de la infección al inactivar a los macrófagos. Entre las enzimas del metabolismo celular se encuentran icl, lipF, fadD33, fosfolipasas C y panC/panD, las cuales se involucran en el metabolismo de los lípidos y de los ácidos grasos que la bacteria utiliza para su crecimiento11.
La participación de los neutrófilos en la inmunopatología es controvertida. Se ha reportado que los sueros de pacientes con tuberculosis pulmonar activa inducen una serie de cambios en la morfología nuclear de los neutrófilos en donantes de sanos. Los cambios globales dominantes fueron la apoptosis (precedida por picnosis y cariorrexis) y la netosis (con extrusión de ADN entremezclado con elastasa, mieloperoxidasa: MPO e histona: HIS) en algunos casos. Todos los sueros de pacientes con tuberculosis pulmonar activa indujeron algunos cambios, y estos cambios también fueron frecuentes en un número significativo de donantes con contacto del hogar. Los sueros de individuos sanos sin contacto no produjeron cambios o solo cambios menores (principalmente picnosis o inflamación nuclear, pero no apoptosis ni netosis). Estos cambios se atribuyeron a la corta vida normal del neutrófilo in vitro12.
Tuberculosis ocular
La incidencia es del 1.4 al 18% de las TBEP. Se puede adquirir por extensión local directa, afectando los ojos y los tejidos orbitales circundantes. Las manifestaciones clínicas pueden ser exoftalmos, afección unilateral, diplopía debido a alteración del nervio craneal, dacrioadenitis, abscesos, blefaritis crónica, conjuntivitis, tuberculomas, úlceras, escleritis nodular y erosiones corneales, entre otras13.
Tuberculosis cutánea
Tiene una incidencia del 1 al 1.5%. Se puede adquirir por inoculación directa y se caracteriza por manifestaciones clínicas como pápulas inflamatorias, placas verrugosas, nódulos supurativos, úlceras crónicas y otras lesiones atípicas, con predominio en zonas como la cara, el cuello y el torso. Existen dos tipos de TB cutánea: la endógena, que presenta tres subtipos (orificial, escrofuloderma o lupus vulgar), y la exógena, subclasificada en chancro tuberculoso y tuberculosis cutánea verrugosa14,15.
Tuberculosis intestinal
La TB abdominal es rara. Puede coincidir con cirrosis hepática, carcinomatosis, sarcoma y pacientes con diálisis peritoneal. Aparece como consecuencia de la reactivación de la TB latente diseminada por la ingesta de alimentos contaminados o la ingesta de esputo de la TB pulmonar. Los síntomas son inespecíficos, como dolor abdominal crónico, fiebre, pérdida de peso, disminución del apetito, diaforesis nocturna, deterioro del estado general, desnutrición, diarrea y en ocasiones malabsorción intestinal. Con frecuencia hay ascitis, bandas fibrosas y adherencias entre asas intestinales, y pueden presentarse complicaciones como obstrucción intestinal, abscesos y hemoperitoneo16.
Tuberculosis meníngea
Con una incidencia del 1 al 2%, se considera la diseminación más grave, ya que desarrolla importantes complicaciones y secuelas neurológicas e incluso la muerte. Sus manifestaciones son inespecíficas, secundarias a la fibrosis meníngea basilar y la inflamación vascular: malestar general, fatiga, anorexia, vómito, cefalea, cambios de la personalidad, parálisis de los nervios craneales II, III, IV, VI y VIII, accidentes vasculares cerebrales, convulsiones e hidrocefalia secundaria a exudado tuberculoso que se acumula en la base cerebral; en las etapas finales se caracteriza por ocasionar espasticidad y coma17,18. Los signos meníngeos pueden estar ausentes19.
Tuberculosis miliar
Está causada por la diseminación linfohematógena de los bacilos que puede ocurrir durante la infección primaria con micobacterias o cuando hay una reactivación de una infección latente. Se presenta en diferentes formas, pero la afectación de múltiples sistemas es una característica común, siendo los pulmones los principales lesionados, seguidos del hígado, el bazo y el sistema nervioso central. Suele producir un cuadro clínico inespecífico, con fiebre y diaforesis de predominio nocturno, anorexia, pérdida de peso y tos20.
Derrame pleural tuberculoso
Se debe principalmente a la ruptura del foco caseoso subpleural que conduce a la entrada al espacio pleural, con generación de una reacción inflamatoria y aumento de la permeabilidad capilar, así como afluencia de proteínas, lo que estimula una mayor formación de líquido pleural. Se puede resolver de manera espontánea o evolucionar a un derrame con loculaciones y empiema21.
Tuberculosis genitourinaria
Es la segunda localización extrapulmonar más común (5 al 30% de los casos). Afecta el epidídimo o la próstata, comúnmente en hombres de 30 a 50 años22. En fases iniciales puede ser asintomática, y cuando se extiende al uréter y la vejiga da síntomas de síndrome miccional con piuria estéril y microhematuria en el 90% de los casos23. La formación de granulomas conduce a fibrosis y estenosis del uréter, originando uropatía obstructiva con desarrollo de hidronefrosis23.
Linfadenitis tuberculosa cervical
Es la localización extrapulmonar más frecuente en adultos y niños24. Su diagnóstico es difícil, debido a que existen diversos factores etiológicos que causan crecimiento de los nodos linfáticos25. Suele presentarse unilateral, única o múltiple, ubicada principalmente en los ganglios axilares, torácicos y abdominales y pueden presentar necrosis, fluctuar y producir úlceras, así como fistulas en un 10% de los casos, y salida de caseum al exterior (escrófula)26,27.
En el Hospital General de México Eduardo Liceaga se realizó un estudio en 87 pacientes con tuberculosis ganglionar cervical de los cuales 67(77%) presentaron linfadenopatía unilateral (51 en la cadena linfática derecha y 16 en la izquierda), los restantes 20 pacientes presentaron linfadenopatía bilateral24,28.
Las micobacterias no tuberculosas comúnmente involucradas son Mycobacterium avium, Mycobacterium gordonae y Mycobacterium xenopi. En estudios de pacientes con linfadenopatía cervical se han informado micobacterias no tuberculosas solo en el 6.6% de los casos, identificando Mycobacterium intracellulare, M. gordonae y Mycobacterium fortuitum. Mycobacterium kumamotonense es una micobacteria de crecimiento lento que pertenece al complejo Mycobacterium terrae. La condición de los sujetos portadores de VIH con micobacterias no tuberculosas27 ocurre después de que el recuento de CD4 sea < 200 células/mm3.
Tuberculosis osteoarticular
Representa el 9 al 20% de las TBEP. Entre ellas se encuentran la artritis tuberculosa, la osteomielitis tuberculosa y la espondilodiscitis tuberculosa o mal de Pott (representa el 50% de los casos)28. Esta última se caracterizada por una infección del disco intervertebral y de los dos cuerpos vertebrales adyacentes. Suele iniciar en la cara anterior de los cuerpos vertebrales y de allí extenderse al disco. En casos avanzados, la infección progresa hacia los tejidos blandos adyacentes, produciendo abscesos paravertebrales y afectación de la parte posterior del cuerpo vertebral y del canal medular, pudiendo originar compresión medular28. Presenta síntomas como dolor mecánico (90% de los casos), acompañado de síntomas generales29.
La artritis tuberculosa se ha descrito en el 30% de los casos de tuberculosis ósea, erosiona el hueso de la articulación y ocasiona destrucción del cartílago adyacente. Las manifestaciones clínicas son monoartritis crónica de articulaciones grandes, como la coxofemoral o la sacroilíaca (12-15%), seguidas de la rodilla (10%), el hombro (7%), el tobillo (7%), el codo (2%) y la muñeca (2%), además de presentar aumento lento del dolor, disminución del arco de movilidad e inflamación local, acompañados de síntomas30.
La osteomielitis tuberculosa es considerada rara (2-3% de los casos de TB ósea) y tiene predominio en niños. Sus manifestaciones clínicas son dolor, edema local, fiebre, diaforesis nocturna y, en etapas tardías, puede presentar fistulización a la piel31.
Tuberculosis peritoneal
Representa el 25 al 50% de los casos de TB abdominal y el 0.1 al 0.7% de todos los casos de TB. Afecta a personas entre 35 y 45 años de edad. Existen tres tipos: 1) ascitis húmeda con alto líquido ascítico y alto contenido proteico; 2) el tipo fibrocito, caracterizado por adherencias entrelazadas del intestino a lo largo del epiplón y el mesenterio; y 3) el tipo plástico seco, con reacción inflamatoria, adherencias fibrosas difusas y nódulos a lo largo del peritoneo. El 70% de los pacientes presentan fiebre, el 60% pérdida de peso, dolor y distensión abdominal, y el 15% diarrea, aunque el hallazgo más relevante es la ascitis32. Además de la diseminación conocida hay otras dos vías: por ingesta de leche o esputo infectados, que provocan tubérculos epitelioides en la submucosa intestinal con su consiguiente necrosis caseosa y ulceración hasta afectar capas más profundas e infectar el peritoneo y los vasos linfáticos, o por diseminación directa de un foco adyacente, como las trompas de Falopio o un absceso en el psoas32,33.
Serositis
Un sitio cada vez más frecuente de diseminación son las serosas, como la pleura, las meninges, el pericardio y el peritoneo, originando un exudado y el acúmulo de gran cantidad de líquido. Si bien representan menos del 1% de todas las formas extrapulmonares, tienen una alta mortalidad34.
Diagnóstico
El diagnóstico definitivo se establece con un cultivo positivo para M. tuberculosis; sin embargo, el diagnóstico de TBEP es difícil, dado que las muestras obtenidas de lugares poco accesibles pueden ser paucibacilares, lo que disminuye la sensibilidad de la prueba diagnóstica. Existen diferentes métodos diagnósticos para tuberculosis, los cuales se dividen en directos e indirectos (Tabla 1).
Tabla 1 Métodos directos e indirectos para diagnosticar tuberculosis
| Métodos directos | Métodos indirectos |
|---|---|
| 1. Tinción de Ziehl-Neelsen | |
| 1. Histopatología; se considera el método de elección para el diagnóstico de tuberculosis extrapulmonar | |
| 2. Microscopía | |
| 2. Biopsia de escisión con análisis histológico sistemático, tinción de Ziehl-Neelsen y cultivo de M. tuberculosis, y citología de muestra por aspiración con aguja fina | |
| 3. El cultivo sigue siendo el método de referencia para el diagnóstico de tuberculosis pulmonar y extrapulmonar, ya que identifican la especie y la sensibilidad a los fármacos. Entre ellos destacan: | |
| - Medio de cultivo de Lowenstein-Jensen | 3. Pruebas serológicas basadas en anticuerpos; pruebas cutáneas (Mantoux), ensayo de liberación de interferón gamma y actividad de adenosina desaminasa |
| - Sistema BACTEC MGIT 960 (tubo indicador de crecimiento de micobacterias) | |
| - Base de agar (Middlebrook 7H10/11) | La prueba cutánea de la tuberculina (Mantoux) solo detecta la presencia o ausencia de infección, es decir, la exposición a M. tuberculosis o tuberculosis latente. La OMS solo acepta dos tuberculinas como estándar: PPD-S PPD y PPD RT 23 |
| 4. Estudios para detección de antígenos | Otros métodos indirectos: |
| - Compuestos orgánicos volátiles | |
| 5. Detección molecular: pruebas de amplificación de ácidos nucleicos, como la reacción en cadena de la polimerasa y el ensayo molecular automatizado Xpert MTB/RIF | - Detección de betalactamasas |
| Su sensibilidad es del 85% y su especificidad del 97% Estas pruebas tienen un papel importante para la tuberculosis meníngea | |
| Actualmente existen tres métodos; de ellos, los dos
primeros son recomendados por la OMS: - NAAT basado en cartuchos (CB-NAAT) - Ensayo de sonda lineal (LPA) - Amplificación mediada por bucle (LAMP) |
La microscopia convencional de frotis tiene una baja sensibilidad (0 a 40%) en comparación con el cultivo (del 30 al 80%)35. La prueba Xpert MTB/RIF detecta la TB tanto pulmonar como extrapulmonar, así como la resistencia a la rifampicina36-38.
En un estudio realizado en el Hospital General de México Dr. Eduardo Liceaga sobre costo-beneficios de los métodos diagnósticos se concluyó que las diferentes formas de TBEP demuestran que las «recientes» técnicas de diagnóstico, como la reacción en cadena de la polimerasa y la adenosina desaminasa, ofrecen bastantes ventajas (Fig. 1)39-42.
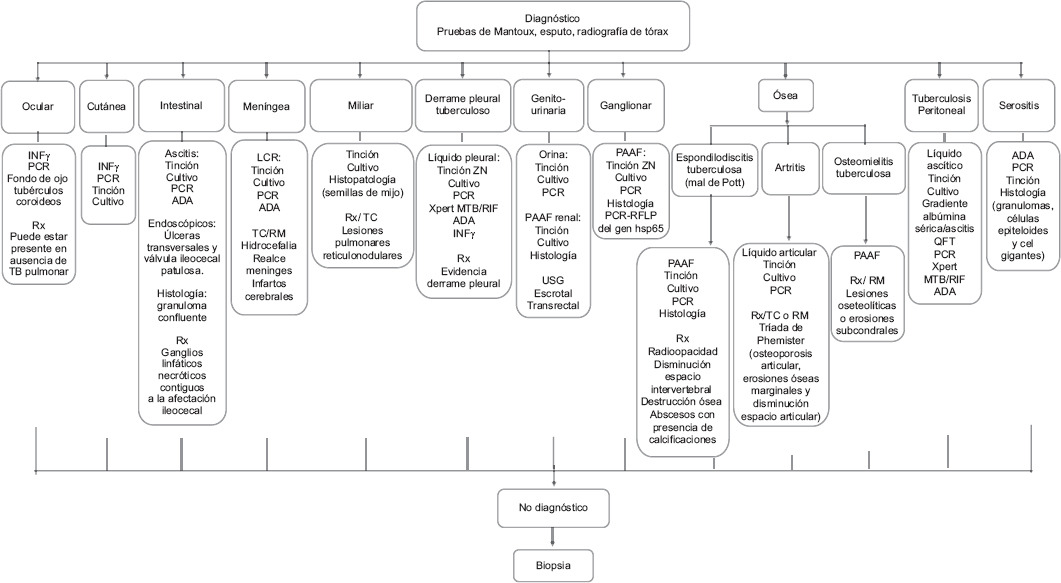
Figura 1 Métodos diagnósticos para identificar diferentes tipos de tuberculosis extrapulmonar. ADA: adenosina desaminasa; INFγ: interferón gamma; LCR: líquido cefalorraquídeo; PAAF: punción-aspiración con aguja fina; QFT: QuantiFERON; RFLP: restriction fragment length polymorphism; RM: resonancia magnética; Rx: radiografía; TB: tuberculosis; TC: tomografía computarizada; USG: ultrasonografía; ZN: Ziehl-Neelsen.
Tratamiento
El objetivo general del tratamiento de la TB es erradicar la infección, evitar la progresión a un estado activo, mejorar el estado clínico del paciente o la exacerbación de la resistencia, y prevenir la recaída (Tabla 2)43,44.
Tabla 2 Tratamientos para la tuberculosis extrapulmonar
| 6 m | Isoniazida | Incluyendo TBEP, excepto de SNC, hueso y articulaciones | |
| 2HRZE/4HR | Rifampicina | ||
| Pirazinamida | |||
| Etambutol | |||
| Primario acortado | Intensiva | Isoniazida | 300 mg |
| Primera línea | 60 dosis (2 m) | Rifampicina | 600 mg |
| Tratándose de TBEP (SNC, hueso y articulaciones) | Lunes-sábado | Pirazinamida | 1500-2000 mg |
| Etambutol | 1200 mg | ||
| Sostén | Isoniazida | 800 mg | |
| 45 dosis (10 m) | Rifampicina | 600 mg | |
| 3/7 días | |||
| Retratamiento | Recaída: 8 m | 2HRZES/1HREZ/5H3R3E3 | |
| Fracaso | COEFAR (Comité Estatal de Farmacorresistencia) | ||
| Retratamiento estandarizado | 24 m | G1: orales de primera línea útiles en TB-MFR→E, Z | |
| Segunda línea | G2: inyectables→S, KM, AM, CM | ||
| G3: fluoroquinolonas→OFX, LFX, MFX | |||
| G4: bacteriostáticos orales de segunda línea→ETO, PTO, CS, TRD, PAS | |||
| G5: poca eficacia→CFX, AMX/CLV, CLR, LZD, TH, IPM/CLN, CLR, DOSIS ALTAS DE H | |||
| Retratamiento individualizado | Se administra en cualquier localizacion de la enfermedad/GANAFAR (Grupo Asesor Nacional de Farmacorresistencia) | ||
| Segunda línea | |||
| TBEP | Intensiva | Isoniazida | |
| 2 m | Rifampicina | ||
| Lunes-sábado | Pirazinamida | ||
| Etambutol | |||
| Sostén | Isoniazida | ||
| 10 m | Rifampicina | ||
| 3/7 d | |||
| Meningitis y pericarditis tuberculosa | 6 a 8 sem | Utilizar terapia adyuvante inicial con corticoesteroides (dexametasona o prednisolona) | |
| Tratamiento de observacion directa | Si se cuenta con riesgo de incumplimiento | ||
| TB causada por Mycobacterium bovis | Se prolonga el régimen, debido a que se ha reportado hasta en un 38% resistencia a la pirazinamida | ||
AM: amikacina; AMX/CLV: amoxicilina/clavulanato; CFX: ciprofloxacino; CLR: clariromicina; CM: Capreomicina; CP: capreomicina; CS: cicloserina; E: etambutol; ETO: etionamida; H: isoniazida; IPM/CLN: imipenem/cilastatina; KM: kanamicina; LFX: levofloxacino; LZD: linezolid; MFR: Multifarmacoresistente; MFX: moxifloxacino; OFX: ofloxacino; PAS: ácido paraaminosalicílico; PTO: protionamida; R: rifampicina; S: Estreptomicina; SNC: sistema nervioso central; TB: tuberculosis; TBEP: tuberculosis extrapulmonar; TH: tioacetazona; TRD: terizidona; Z: pirazinamida.
Discusión
En el año 2018, alrededor de 1.5 millones de personas murieron por TB y cerca de 10 millones de personas se infectaron por micobacterias tuberculosas alrededor del mundo. La meta global de la Organización Mundial de la Salud es reducir un 90% la incidencia de los casos y un 80% la mortalidad por tuberculosis para el año 203045. En México, su incidencia ocupa el tercer lugar en América Latina2.
En Polonia, en 2018 se reportaron 5487 casos de TB, de los cuales el 95% fueron TB pulmonar y el 5% TBEP. De todos los casos, 83 (1.5%) pacientes mostraron solo resistencia a la isoniazida y 48 (0.9%) presentaron multirresistencia a los fármacos antituberculosos45. En México, estas cifras corresponden al 80% y el 20% para TB pulmonar y TBEP, respectivamente2.
En Argentina, en 2019 se notificaron 12,499 casos de TB, resultando la incidencia un 6% más alta que en 2018. Los nuevos casos representaron el 93.3%. Del total de los casos, el 78.6% fueron TB pulmonar, el 11.1% TBEP y el 10.3% no contaban con la localización anatómica. Se registraron 325 (2.6%) casos de TB resistente, y de estos, el 43.1% fueron multirresistentes y el 2.1% extensamente resistentes46.
La enfermedad por TB requiere una amplia atención sobre todo en países de América Latina, aunque sin perder de vista al resto de los continentes, ya que cada vez se incrementa más la resistencia a los fármacos antituberculosos y se encuentra una mayor frecuencia de cepas distintas que requieren métodos diagnósticos de biología molecular que solo se suelen encontrar en hospitales de concentración de tercer nivel, como se ha analizado en este estudio.
Por otra parte, la enfermedad por micobacterias no tuberculosas ha visto un incremento en China, país donde se realizó un estudio que incluyó 607 casos de micobacterias no tuberculosas durante el periodo 2013-2016 y se encontró que las especies más prevalentes fueron M. avium complex (44.5%), Mycobacterium abscessus complex (40.5%), Mycobacterium kansasii (10%) y M. fortuitum (2.8%)47, mientras que en México, entre enero de 2013 y diciembre de 2014, se estudiaron 120 pacientes y se encontró que el 30.8% se infectaron por una micobacteria no tuberculosa; de estas infecciones, las más prevalentes fueron por M. avium (54.1%) y M. intracellulare (18.9%), y otras especies de micobacterias no tuberculosas representaron el 27%44.
Conclusiones
A pesar de que en los últimos años se ha establecido la estrategia de la OMS para reducir la mortalidad y la incidencia de la TB, tal reducción podrá ser visible cuando exista un número más preciso de pacientes diagnosticados y los centros hospitalarios de primer y segundo nivel de atención, si se tiene la sospecha para el diagnóstico de TB, refieran de manera oportuna los casos a un hospital de tercer nivel, ya que el problema de estas formas de tuberculosis radica en la dificultad para llegar a un diagnóstico definitivo, debido a que tanto los síntomas clínicos como las pruebas de imagen pueden ser inespecíficas.











 nueva página del texto (beta)
nueva página del texto (beta)


