Introducción
El cáncer colorrectal (CCR) es una de las neoplasias más frecuentes, registrando anualmente más de un millón de nuevos casos1. Aproximadamente el 65% de los pacientes presentan metástasis, siendo las hepáticas las más habituales2. El 15-25% de los pacientes con CCR presentan metástasis hepáticas (MH) en el momento del diagnóstico, y el 20-25% las desarrollará durante el seguimiento3.
El tratamiento de elección de las MH de CCR es la resección quirúrgica completa, al ser el único tratamiento que obtiene una supervivencia aceptable a largo plazo (supervivencia a 5 años del 40-67% según las series)4,5.
Tradicionalmente, solo los pacientes sin enfermedad metastásica extrahepática que tuvieran un máximo de tres MH de un tamaño relativamente pequeño y que se previera un margen de resección de al menos 1 cm eran candidatos a tratamiento quirúrgico5. Sin embargo, en la última década se ha producido un cambio en estos criterios para aumentar el número de pacientes candidatos a tratamiento quirúrgico. Esto ha sido posible principalmente gracias a los avances en los tratamientos oncológicos, la radiología intervencionista y la cirugía, así como por las mejoras en las pruebas de imagen y la optimización preoperatoria de los pacientes6.
La descripción del mínimo margen de resección medido en milímetros es una constante en la literatura actual5,7-13. El problema consiste en definir desde un punto de vista oncológico cuál es el mínimo margen requerido. Durante muchos años se ha considerado como referencia un margen de resección > 1 cm11,14-17. En 2012, Cucchetti et al.16 publicaron un metaanálisis, con 2823 pacientes, en el que un margen de resección < 1 cm influyó directamente sobre la supervivencia libre de enfermedad (SLE), pero no sobre la supervivencia global (SG). Recientemente, Margonis et al.10, sobre 11,147 resecciones hepáticas, sí observaron un peor pronóstico en los pacientes con márgenes < 1 mm, planteando la posibilidad de conseguir una distancia de 1 cm siempre que sea posible. No obstante, el aumento del número de resecciones hepáticas cada vez más complejas (proximidad de las MH a estructuras biliares o vasculares, multinodularidad, etc.), especialmente al conseguir reducir el tamaño de las lesiones con la administración de quimioterapia (QT) neoadyuvante, ha aumentado la necesidad de obtener márgenes negativos, aunque sean mínimos7. Progresivamente se han ido estrechando los márgenes hasta el punto de que, en la actualidad, autores como Vandeweyer et al.15, Hamady et al.18, Bodingbauer et al.19 y Welsh et al.20 han determinado como margen negativo la distancia de 1 mm. En la última década se han publicado estudios que han demostrado que la anchura del margen de resección no afecta significativamente a la supervivencia siempre que sea negativo (resección R0)10,15,18,21 o incluso aunque exista afectación microscópica del mismo (resección R1)9,19,22. Por otra parte, la resección de una metástasis apoyada sobre una rama principal vascular intrahepática es considerada actualmente como una resección R1 (R1 vascular). Este despegamiento de la metástasis del vaso permite tanto disminuir el número de hepatectomías mayores en pacientes con enfermedad que desde el inicio se ha considerado resecable como considerar resecable una enfermedad que de otra forma sería irresecable, y todo ello sin afectar a la supervivencia del paciente23.
Las indicaciones quirúrgicas actuales se resumirían en la posibilidad de conseguir una resección R0 de la enfermedad hepática y extrahepática, dejando suficiente hígado remanente. Ya que la modificación de estos criterios es relativamente reciente, aún no se conocen bien los resultados a medio y largo plazo. En este contexto, hemos intentado aportar nuestra experiencia en el tratamiento quirúrgico de las MH de CCR evaluando la influencia de la afectación microscópica del margen tumoral sobre la SG de los pacientes con MH de CCR intervenidos bajo criterios «ampliados», prestando especial importancia a los factores clínicos y patológicos de dichos pacientes.
Método
Pacientes
Se ha realizado un estudio retrospectivo que ha incluido 144 pacientes intervenidos de cualquier tipo de resección hepática con intención curativa entre enero de 2010 y marzo de 2018. Todos los pacientes fueron diagnosticados de CCR confirmado histológicamente y además presentaban MH sincrónicas o metacrónicas, consideradas resecables en el momento de la decisión quirúrgica (posibilidad de llevar a cabo una resección R0). No se incluyeron pacientes con resecciones R2 (márgenes macroscópicamente afectados)7 ni aquellos en los que se evidenció carcinomatosis peritoneal y no se realizó ningún tipo de resección. El trabajo se ha desarrollado en la unidad de cirugía hepatobiliopancreática y trasplante hepático del servicio de cirugía general y del aparato digestivo del Hospital Clínico Universitario Lozano Blesa, de Zaragoza, España. Este estudio ha contado con la aprobación de la dirección médica de dicho hospital y del Comité Ético de Investigación Clínica de Aragón.
Evaluación preoperatoria
Los casos con enfermedad hepática considerada irresecable o no óptimamente resecable recibieron QT neoadyuvante y fueron reevaluados trimestralmente. Salvo excepciones, se utilizaron esquemas de oxaliplatino (FOLFOX o XELOX) asociando en determinados pacientes cetuximab, panitumumab o bevacizumab. En caso de asociar metástasis pulmonares, se valoró su resección conjuntamente con el servicio de cirugía torácica.
Los pacientes con MH sincrónicas se consideraron para cirugía en dos tiempos (cirugía secuencial clásica CCR/MH o inversa MH/CCR)24 o en un solo tiempo (cirugía combinada CCR + MH)25. En todos los casos es posible asociar una cirugía hepática en dos tiempos, que puede incluir técnicas de embolización o ligadura portal asociadas o no a transección hepática (ALPPS, associating liver partition and portal vein ligation for staged hepatectomy)26,27. En caso de prever la necesidad de resección de al menos cinco segmentos, se realizó una tomografía computarizada (TC) con cálculo del volumen hepático remanente, considerando insuficiente un valor < 25% en hígados sanos y < 35% en hígados patológicos. En los pacientes con enfermedad resecable, pero con elevado riesgo de desarrollar insuficiencia hepática posoperatoria, se indicó una técnica de oclusión portal calculando nuevamente el volumen hepático remanente a las 4-5 semanas o a los 10-15 días en caso de ALPPS.
Tratamiento quirúrgico
En cuanto a la cirugía hepática, se llevaron a cabo resecciones abiertas y laparoscópicas, estas últimas con menor frecuencia. En la cirugía abierta, generalmente se realizó una laparotomía subcostal derecha que podía ampliarse a la izquierda de la línea media o hacia el apéndice xifoides, e incluso la incisión en J descrita por Makuuchi. En todos los casos se revisó la cavidad abdominal y se evaluó el hígado mediante ecografía intraoperatoria. En la transección hepática se empleó un bisturí ultrasónico con efecto «cavitación» y un sistema de sellado también ultrasónico. Cuando se consideró necesario, se realizó la maniobra de Pringle asociada o no a clampaje de venas suprahepáticas. A elección del cirujano, los pedículos portales y las venas suprahepáticas se seccionaron y ligaron manualmente o con endograpadora. En general, tras la hepatectomía los pacientes ingresaban en la unidad de cuidados intensivos (UCI), donde habitualmente permanecían unas 24-48 horas, tras lo cual pasaban a la planta de cirugía general.
Seguimiento
Después del alta hospitalaria se realizaron controles coordinados por parte de los servicios de cirugía y oncología, valorando la necesidad de tratamiento adyuvante. En todos los pacientes se realizó un seguimiento ambulatorio al mes y a los 3 meses tras la cirugía durante el primer año, cada 3-6 meses durante los primeros 3 años y luego un control anual de forma indefinida. Los controles fueron clínicos (anamnesis y exploración física), analíticos (pruebas de función hepática, valores de CEA y CA 19.9, etc.) y con pruebas de imagen (TC toracoabdominopélvica alternada con una ecografía simple y radiografía de tórax). Además, cada 1 o 2 años se realizó control endoscópico del colon.
Análisis estadístico
La muestra se ha dividido en dos grupos de pacientes en función de si la cirugía consiguió una resección R0 (n = 104, 72.2%) o R1 (n = 40, 27.8%). Ambos grupos se han comparado según las características clinicopatológicas detalladas a continuación. También se han determinado y comparado los resultados a largo plazo (supervivencia actuarial a 1, 3 y 5 años).
Los parámetros analizados son edad, sexo, riesgo ASA, localización del CCR, estadio tumoral, QT adyuvante poscolectomía, sincronicidad de las metástasis, localización de las metástasis, valor de CEA al diagnóstico, QT neoadyuvante prehepatectomía, hepatectomía mayor o menor, transfusión intraoperatoria, mortalidad posoperatoria, Clavien Dindo I-IV, estancia media, QT adyuvante poshepatectomía, nueva hepatectomía y supervivencia.
El análisis estadístico se realizó con el programa SPSS Statistics 21.0. Primero se llevó a cabo un análisis descriptivo, utilizando en el caso de las variables cualitativas tablas de frecuencias y sus porcentajes, y en el caso de las cuantitativas los valores de la media, la mediana, la desviación típica y el rango intercuartílico en función de si seguían o no una distribución normal (evaluada mediante la prueba de Kolmogórov-Smirnov).
En cuanto a la estadística inferencial, para la comparación entre variables cuantitativas con una distribución normal se han utilizado la prueba t de Student-Fisher o el análisis de la varianza ANOVA. En las comparaciones entre variables cuantitativas con distribución no normal se han utilizado las pruebas no paramétricas U de Mann-Whitney y de Kruskal-Wallis. Respecto a las variables cualitativas, las comparaciones se establecieron mediante la prueba de c2. Para el análisis de supervivencia se han realizado curvas de Kaplan-Meyer, y para el contraste de hipótesis, el test de log-rank. Para completar el estudio se ha utilizado además el modelo de regresión de Cox. Consideramos estadísticamente significativo un valor de p < 0.05.
Definiciones
La resección R0 se caracteriza por una ausencia total de tumor en los márgenes de resección con una distancia libre de tumor ≥ 1 mm7, mientras que la resección R1 se define como la presencia microscópica de tumor en los márgenes de resección con una distancia libre <1 mm7; en caso de invasión microscópica, la opinión adicional del cirujano diferenció las resecciones R1 de las R27. Se han considerado MH sincrónicas aquellas que estaban presentes en el diagnóstico del CCR o que aparecieron en los 3 meses siguientes. Las diagnosticadas a partir de los 3 meses se han considerado metacrónicas4,18. Se ha definido como hepatectomía menor la resección de hasta tres segmentos hepáticos, y hepatectomía mayor la resección de tres o más segmentos28. Para la valoración de la estancia media hospitalaria se han tenido en cuenta tanto los días de ingreso en la sala de hospitalización como los días de ingreso en la UCI. Consideramos complicaciones posoperatorias las acontecidas durante los 90 días siguientes a la realización de la hepatectomía4 y definidas por la clasificación de Clavien y Dindo en 200929. La SG se ha definido desde la fecha de la cirugía hepática hasta la última revisión en consulta o hasta el fallecimiento. Quedaron excluidos del análisis estadístico de SG los cinco pacientes que fallecieron en el posoperatorio inmediato (90 días tras la hepatectomía).
Resultados
Pacientes con resección R0 (Tabla 1)
Este grupo constaba de 104 pacientes, de los cuales 69 (66.3%) eran hombres y 35 (33.7%) eran mujeres. La edad media en este grupo fue de 66.2 ± 10.4 años. De ellos, 87 (83.7%) presentaban un riesgo ASA I-II y 17 (16.3%) un riesgo ASA III-IV.
Tabla 1 Distribución de los pacientes en ambos grupos (R0 y R1) y en función de las variables analizadas, y valores de p tras realizar el contraste de hipótesis para cada una de las variables
| Grupo resección R0 | Grupo resección R1 | p | |
|---|---|---|---|
| Casos, n (%) | Casos, n (%) | ||
| Factores dependientes del paciente | |||
| Edad, años (n = 144) | 66.2 ± 10.4* | 63.3 ± 11.7* | 0.158 |
| Sexo (n = 144) | |||
| Hombre | 69 (66.3%) | 28 (70%) | 0.675 |
| Mujer | 35 (33.7%) | 12 (30%) | |
| Riesgo ASA (n = 144) | |||
| ASA 1-2 | 87 (83.7%) | 32 (80%) | 0.502 |
| ASA 3-4 | 17 (16.3%) | 8 (20%) | |
| Factores dependientes del tumor primario CCR | |||
| Localización (n = 144) | |||
| Colon | 67 (64.4%) | 27 (67.5%) | 0.793 |
| Recto | 36 (34.6%) | 13 (32.5%) | |
| Colon y recto | 1 (1%) | 0 (0%) | |
| Estadio tumoral (n = 144) | |||
| I-II | 15 (14.4%) | 3 (7.5%) | 0.280 |
| III-IV | 89 (85.6%) | 36 (90%) | |
| Desconocido | 0 (0%) | 1 (2.5%) | |
| QT adyuvante poscolectomía (n = 144) | |||
| No | 69 (66.3%) | 25 (62.5%) | 0.664 |
| Sí | 35 (33.7%) | 15 (37.5%) | |
| Factores dependientes de las metástasis hepáticas | |||
| Sincronicidad (n = 144) | |||
| Sí | 60 (57.7%) | 23 (57.5%) | 0.983 |
| No | 44 (42.3%) | 17 (42.5%) | |
| Localización (n = 144) | |||
| Unilateral | 71 (68.3%) | 21 (52.5%) | 0.078 |
| Bilateral | 33 (31.7%) | 19 (47.5%) | |
| CEA al diagnóstico, ng/ml (n = 144) | 14.8 ± 4* | 13.8 ± 2* | 0.735 |
| QT adyuvante prehepatectomía (n = 144) | |||
| No | 75 (72.1%) | 26 (65%) | 0.403 |
| Sí | 29 (27.9%) | 14 (35%) | |
| Factores dependientes de la resección hepática (n = 144) | |||
| Segmentos resecados (n = 144) | |||
| Hepatectomía menor (< 3 segmentos) | 68 (65.4%) | 29 (72.5%) | 0.415 |
| Hepatectomía mayor ( ≥ 3 segmentos) | 36 (34.6%) | 11 (27.5%) | |
| Transfusión intraoperatoria (n = 144) | |||
| No | 75 (72.1%) | 28 (70%) | 0.903 |
| Sí | 28 (26.9%) | 11 (27.5%) | |
| Desconocido | 1 (1%) | 1 (2.5%) | |
| Mortalidad ingreso posoperatorio (Clavien Dindo V) (n = 144) | |||
| No | 101 (97.1%) | 38 (95%) | 0.535 |
| Sí | 3 (2.9%) | 2 (5%) | |
| Morbilidad ingreso posoperatorio (Clavien Dindo I-IV) (n = 144) | |||
| No | 59 (56.7%) | 23 (57.5%) | 0.822 |
| Sí | 42 (40.4%) | 15 (37.5%) | |
| Estancia media, días (n = 139) | 8 ± 4* | 8 ± 2* | 0.960 |
| Factores dependientes del seguimiento | |||
| QT adyuvante poshepatectomía (n = 139) | |||
| Sí | 64 (63.4%) | 25 (65.8%) | 0.791 |
| No | 37 (36.6%) | 13 (34.2%) | |
| Nueva hepatectomía | |||
| No | 77 (76.2%) | 27 (71.1%) | 0.530 |
| Sí | 24 (23.8%) | 11 (28.9%) | |
*Si la variable cuantitativa sigue una distribución no normal (p < 0.05) mediante la prueba de Kolmogórov-Smirnov se han empleado como medida de tendencia central la mediana y como medida de dispersión el recorrido intercuartílico. Para muestras independientes se ha realizado una prueba de Levene para la igualdad de varianzas. Si p < 0.05, la prueba t para la igualdad de varianzas no asumirá varianzas iguales para esa variable. Si p > 0.05, la prueba t para la igualdad de varianzas asumirá varianzas iguales para esa variable.
El tumor primario se localizó en el colon en 67 pacientes (64.4%), en el recto en 36 pacientes (34.6%) y en 1 paciente (1%) se diagnosticó un tumor en colon y recto de forma simultánea. Un total de 89 pacientes (85.6%) tenían un estadio III-IV, mientras que 15 (14.4%) se encontraban en estadio I-II. La QT adyuvante poscolectomía se administró en el 33.7% (35) de los pacientes.
Las MH fueron diagnosticadas de forma sincrónica en 60 pacientes (57.7%) y de forma metacrónica en 44 (42.3%). La distribución fue unilobar en 71 pacientes (68.3%) y bilobar en 33 (31.7%). Se administró QT neoadyuvante a 29 pacientes (27.9%). La mediana del valor de CEA fue de 14.8 ± 4 ng/ml.
En 68 pacientes (65.4%) se realizó una hepatectomía menor y en 36 (34.6%) una hepatectomía mayor. Durante la intervención quirúrgica, 28 pacientes (26.9%) requirieron transfusión sanguínea. Respecto a la morbimortalidad posoperatoria, 3 pacientes (2.9%) fallecieron (Clavien Dindo V), 42 (40.4%) sufrieron complicaciones de menor o mayor gravedad (Clavien Dindo I-IV) y 59 (56.7%) presentaron una evolución favorable sin complicaciones significativas. Exceptuando los pacientes que fallecieron en el posoperatorio inmediato en esta cohorte, la mediana de la estancia hospitalaria fue de 8 ± 4 días.
La QT adyuvante tras la hepatectomía se administró a 64 pacientes (63.4%). Durante el seguimiento, 24 pacientes (23.8%) requirieron una nueva hepatectomía, mientras que en 77 pacientes (76.2%) no se realizó un nuevo tratamiento quirúrgico sobre el hígado.
Pacientes con resección R1 (Tabla 1)
Este grupo incluyó 40 pacientes, de los cuales 28 (70%) eran hombres y 12 (30%) eran mujeres. La edad media de este grupo fue de 63.3 ± 11.7 años. De ellos, 32 (80%) presentaban un riesgo ASA I-II y 8 (20%) un riesgo ASA III-IV.
El tumor primario se localizó en el colon en 27 pacientes (67.5%) y en el recto en 13 pacientes (32.5%). Hubo 36 pacientes (90%) que se encontraban en estadio III-IV en el momento del diagnóstico del CCR y 3 (7.5%) que se encontraban en estadio tumoral I-II. El estadio tumoral de 1 paciente era desconocido (2.5%). Se administró QT adyuvante poscolectomía a 15 pacientes (37.5%).
Las MH fueron diagnosticadas de forma sincrónica en 23 pacientes (57.5%) y metacrónica en 17 (42.5%). La distribución de las MH fue unilobar en 21 pacientes (52.5%) y bilobar en 19 (47.5%). Fueron tratados con QT neoadyuvante 14 pacientes (35%), mientras que 26 (65%) no recibieron este tratamiento. La mediana del valor de CEA en la cohorte R1 fue de 13.8 ± 2 ng/ml.
Se realizó una hepatectomía menor en 29 pacientes (72.5%) y una hepatectomía mayor en 11 (27.5%). Durante la intervención, 11 pacientes (27.5%) requirieron transfusión de hemoderivados. Respecto a la morbimortalidad posoperatoria, 2 pacientes (5%) fallecieron (Clavien Dindo V), 15 (37.5%) sufrieron complicaciones de distinta gravedad (Clavien Dindo I-IV) y 23 (57.5%) presentaron una evolución favorable sin complicaciones. Para los pacientes que no fallecieron en el posoperatorio inmediato, la media de la estancia hospitalaria fue de 8 ± 2 días. En esta cohorte, 25 pacientes (65.8%) fueron tratados con QT adyuvante. Durante el periodo de seguimiento, 11 pacientes (28.9%) requirieron una nueva intervención quirúrgica hepática.
Comparación entre ambos grupos (Tabla 1)
Al comparar ambos grupos de pacientes (R0 y R1), ninguno de los factores estudiados dependientes del paciente (edad, p = 0.158; sexo, p = 0.675; riesgo ASA, p = 0.502), del cáncer primario (localización colon-recto, p = 0.793; estadio tumoral, p = 0.280; QT adyuvante poscolectomía, p = 0.664), de la enfermedad metastásica (sincronicidad, p = 0.983; localización bilobar, p = 0.078; CEA al diagnóstico, p = 0.735) ni de la indicación de neoadyuvancia (p = 0.403) ha mostrado diferencias significativas en función de la afectación del margen.
El curso evolutivo de los pacientes basado en la morbimortalidad posoperatoria a 90 días no ha sido diferente en función de la afectación microscópica del margen tumoral (mortalidad, p = 0.535; morbilidad, p = 0.822). La estancia media hospitalaria tampoco mostró diferencias significativas (p = 0.960).
Ambos grupos fueron comparables en cuanto al porcentaje de pacientes sometidos a hepatectomía mayor y menor (p = 0.415), y a la necesidad de transfusión intraoperatoria (p = 0.903). En cuanto a la indicación de tratamiento con QT adyuvante tras la hepatectomía y a la realización de una segunda hepatectomía, tampoco hubo diferencias entre ambos grupos (p = 0.791 y p = 0.530, respectivamente).
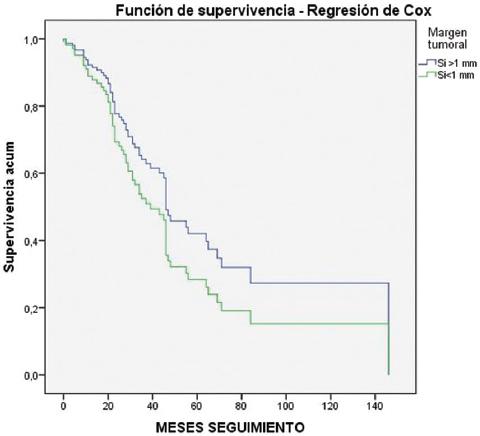
La supervivencia actuarial a 1, 3 y 5 años fue, según el tipo de resección, la siguiente: en la cohorte de resección R0, 89.4%, 63.6% y 44%, con una media de seguimiento de 67.57 ± 8.59 meses; y en la cohorte de resección R1, 83.6%, 57.4% y 23%, con una media de seguimiento de 41.19 ± 4.89 meses. En la evaluación de la supervivencia también se tuvieron en cuenta aquellos pacientes que durante el seguimiento requirieron una segunda hepatectomía. El análisis univariante mediante el estadístico log-rank no evidenció diferencias significativas en cuanto a supervivencia entre ambas cohortes (p = 0.118) Los resultados del análisis mediante regresión de Cox son similares (p = 0.160) (Tabla 2 y Fig. 1).
Tabla 2 Supervivencia actuarial a 1, 3 y 5 años tras la hepatectomía. Se incluye el valor de P tanto del análisis log-rank como mediante regresión de Cox
| Supervivencia actuarial | ||||||
|---|---|---|---|---|---|---|
| Seguimiento, meses (X ± DT) | 1 año | 3 años | 5 años | p log-rank | p Cox | |
| Resección (n = 139) | ||||||
| R0 (≥ 1 mm) | 67.57±8.59 | 89.4% | 63.6% | 44% | 0.118 | 0.160 |
| R1 (< 1 mm) | 41.19±4.89 | 83.6% | 57.4% | 23% | ||
DT: desviación típica; X: media.
Discusión
En nuestro centro, los criterios de resecabilidad para las MH de CCR se han ampliado basándose en un enfoque más agresivo que combina, entre otras, cirugía, QT neoadyuvante y adyuvante, técnicas de destrucción local y de oclusión portal, y resección de la enfermedad extrahepática, y que ante una recidiva plantea una nueva hepatectomía cuando es posible. Todo esto ha permitido aumentar el número de pacientes candidatos a cirugía.
El estudio histológico de la pieza de resección puede orientar el pronóstico e informa de la eficacia de la cirugía realizada. Consideramos el número de resecciones R0 como un índice de calidad, ya que un margen afecto tradicionalmente se ha considerado de mal pronóstico5,15,21,30,31. Autores como Laurent et al.13 consideran que el margen de resección es el factor pronóstico más importante sobre el cual el cirujano es capaz de actuar, en especial con la ayuda de la ecografía intraoperatoria.
En nuestra serie, la resección R1 se logró en el 27.8% de los casos (40/144 pacientes), cifra inferior a la descrita en series como la de De Haas et al.7 (46.3%), superponible a la de autores como Sasaki et al.12 (27.5%), Bodingbauer et al.19 (24.4%) y Mao et al.32 (30.8%), y superior a las de otros como Ayez et al.9 (13%), Laurent et al.13 (10%) y Andreou et al.33 (14%). En nuestro trabajo, las cohortes fueron homogéneas y comparables en todas las variables del estudio. Ninguno de los factores estudiados dependientes del paciente (edad, sexo, riesgo ASA), del cáncer primario (localización colon-recto, estadio tumoral, QT adyuvante poscolectomía), de la enfermedad metastásica (sincronicidad, localización bilobar, CEA al diagnóstico) ni de la indicación de neoadyuvancia nos ha permitido prever preoperatoriamente en qué pacientes hubiese sido más probable realizar una resección R1.
Para autores como Poultsides et al.34, las MH múltiples, grandes, centrales o próximas a estructuras biliares o vasculares se han relacionado con una mayor dificultad para obtener márgenes libres, dada la complejidad de la cirugía. En el estudio multicéntrico del grupo GAST35, la sincronicidad, la localización central y la resección de más de cuatro MH se relacionaron con un mayor número de resecciones R1. En nuestro estudio se ha observado una tendencia a un mayor número de lesiones bilobares en el grupo R1 (47.5% vs. 31.7%; p = 0.078), por lo que nuestros resultados parecen concordar con lo afirmado por Poultsides et al.34 y Eveno et al.36, para quienes la afectación bilobar sí implicó mayor número de resecciones R1. Recientemente, Mao et al.32 han publicado un trabajo que relacionaba en una escala descrita por Sasaki et al.37,38 la carga tumoral (tamaño y número de MH) con la recurrencia y la supervivencia en 286 pacientes (88 con resección R1). Observaron que el impacto de una resección R1 era más importante en los pacientes con baja carga tumoral, ya que en aquellos con alta carga tumoral el pronóstico empeoraba con independencia de que la resección fuera R032. Esto orienta a que existen factores biológicos inherentes al propio tumor que implican una mayor agresividad y un peor pronóstico. Para Truant et al.39, las resecciones R1 se asociaron con resecciones más complejas y con una enfermedad más avanzada, y a pesar de que las resecciones R1 no se comportaron como un factor de peor supervivencia en su serie, reflejaban una enfermedad más agresiva. El hecho de que la resección R1 no se comportara como factor de mal pronóstico lo atribuyeron a la eficacia de la QT neoadyuvante, que disminuyó la recurrencia en el margen tumoral del 31.3% al 19.2% en pacientes con resecciones R1.
El objetivo de la QT neoadyuvante es convertir en resecables las lesiones inicialmente irresecables o no óptimamente resecables, y de esta forma poder realizar una cirugía radical39,40. Ng et al.41 observaron que la respuesta de las MH a la neoadyuvancia no solo se basó en una reducción concéntrica de la masa tumoral y en el porcentaje de células viables, sino también en la ausencia de microsatelitosis a una distancia mayor de 4 mm. En nuestro trabajo no se ha observado relación entre la administración de neoadyuvancia y la resección R1 (p = 0.403). Nuestros resultados son similares a los de Ayez et al.9, dado que el 29.9% de los pacientes recibieron neoadyuvancia (27.9% de los R0 y 35% de los R1), pero contrastan con los de Laurent et al.13, en cuyo estudio el 86% de los pacientes recibieron neoadyuvancia. Según Lehmann et al.40, en pacientes con lesiones resecables, pero con factores de mal pronóstico (lesiones múltiples, bilobares, sincrónicas), la neoadyuvancia puede ayudar a identificar a los pacientes buenos respondedores con biología tumoral favorable que pueden obtener un beneficio de supervivencia. Algunos estudios33,42 no observaron diferencias en la supervivencia entre los grupos R1 y R0 en pacientes con buena respuesta histopatológica. En contra, los pacientes con respuesta subóptima y resección R1 presentaron una supervivencia inferior a la del grupo R033,42. Andreou et al.33 recomiendan que los pacientes con escasa respuesta a la QT neoadyuvante, en los que se anticipan unos márgenes de resección próximos, sean tratados con QT de segunda línea antes de plantear el tratamiento quirúrgico, y que incluso este se plantee solo si es factible conseguir una resección R0.
Considerando como margen positivo la presencia de tumor a menos de 1 mm del borde de resección, el grupo del Paul Brousse7 publicó sus resultados en 436 pacientes (202 resecciones R1), concluyendo que, a pesar de una mayor tasa de recurrencia de las resecciones R1, su supervivencia fue similar a la de los pacientes con resección R0 siempre que recibieran QT adyuvante a la hepatectomía. En nuestro estudio recibieron QT adyuvante el 64% (63.4% de los R0 y 65.8% de los R1). Salvo excepciones, en nuestro centro se indica en pacientes con resección R1 para eliminar los depósitos microscópicos tumorales, aunque ambos grupos fueron comparables en cuanto a la indicación de QT adyuvante (p = 0.791). Por lo tanto, el impacto del margen dependería no solo del paciente, sino también de la biología tumoral y de la utilización de QT moderna. Esto puede haber contribuido a que la resección R1 en nuestra serie no se haya confirmado como factor pronóstico sobre la supervivencia. Para Truant et al.39, la respuesta a la QT neoadyuvante ayuda a conseguir márgenes, aunque sean más estrechos, y el uso combinado de QT adyuvante puede ayudar a reducir los depósitos residuales tumorales en el margen (micrometástasis). Coincidimos con este grupo39 y con el de Hamady et al.18 en que la QT perioperatoria debe ser la norma en pacientes con enfermedad avanzada. No obstante, nuestro grupo considera que, con independencia de la QT, obtener un margen de resección R0 debe ser el objetivo principal de la cirugía.
El margen R1 no se ha confirmado como un factor de riesgo para la recurrencia en series como las de Muratore et al.11, Figueras et al.14, Vandeweyer et al.15 y Hamady et al.18. La recurrencia en los pacientes con resección R1 en la serie de Pawlik et al.21 fue del 40.4%, del 68.8% en la de Muratore et al.11 y del 74% en la de De Haas et al.7. Konopke et al.35 relacionaron un margen < 2 mm con un aumento significativo de la recurrencia global y hepática, pero al igual que en nuestro trabajo la supervivencia de los pacientes R1 no fue significativamente menor que la de los pacientes R0. En nuestro estudio, la supervivencia global a 1, 3 y 5 años fue de 89.4% vs. 83.6%, 63.6% vs. 57.4% y 44% vs. 23%, respectivamente (p = 0.160), resultados que están en la línea de los aportados por De Haas et al.7, Muratore et al.11, Vandeweyer et al.15, Bodingbauer et al.19, Pawlik et al.21, Kokudo et al.43 y Wray et al.44. Por otra parte, De Haas et al.7 compararon las recidivas hepáticas en pacientes con resección R0 y R1, y fueron mayores en el grupo de resección R1, aunque no ocurrían siempre en los márgenes de resección sino también en otras localizaciones hepáticas, de modo que las recidivas en el margen de resección eran comparables entre los pacientes con resecciones R0 y R1. Obtuvieron supervivencias medias de 77 y 84 meses para los grupos R0 y R1, respectivamente, y supervivencias globales a 5 y 10 años del 61% y el 43% en el grupo R0 y del 57% y el 37% en el grupo R1. En la misma línea, Bodingbauer et al.19 estudiaron la recidiva tanto hepática como extrahepática en función del margen de resección, y concluyeron que el estado del margen de resección no influyó sobre la recidiva extrahepática ni hepática, y en esta última tampoco observaron diferencias en cuanto a las recidivas en el margen de resección o en otro lugar del parénquima hepático. En nuestro estudio, el 23.8% de los pacientes con resección R0 y el 28.9% de los pacientes con resección R1 requirieron durante el seguimiento una nueva hepatectomía. La diferencia entre ambos grupos en cuanto al número de nuevas hepatectomías no fue estadísticamente significativa (p = 0.530), lo cual iría en consonancia con lo publicado por De Haas et al.7 y Bodingbauer et al.19. A pesar de que en nuestro trabajo y en los suyos el estudio la SG incluyó a los pacientes que requirieron nueva hepatectomía, no registramos la SLE ni el lugar de la recidiva hepática, como sí hicieron ellos7,19. A pesar de esto, los resultados de las publicaciones de De Haas et al.7 y Bodingbauer et al.19 cuestionarían el carácter inherente de la recidiva en el propio margen de resección de las resecciones R1.
En la literatura actual se han analizado las diferencias en cuanto a supervivencia entre pacientes con resección R0 y los pacientes con resección R1. En algunos estudios7,13,19 no se observaron diferencias significativas en la supervivencia global entre las resecciones R0 y R1. Estos resultados orientan a que no poder conseguir márgenes negativos no debe ser una contraindicación para el tratamiento quirúrgico de las MH. En nuestro trabajo tampoco se observaron diferencias significativas en cuanto a la SG a 1, 3 y 5 años, aunque las diferencias en la SG entre los pacientes con resección R0 y con resección R1 a 5 años no fueron llamativas (44% y 23%, respectivamente; p = 0.160).
El presente estudio ha pretendido realizar una fotografía de los resultados de la práctica diaria en nuestro hospital, pero presenta, al igual que otros19,36, el sesgo de un tamaño muestral relativamente pequeño. En un futuro, con la incorporación de más pacientes al análisis estadístico y un mayor tiempo de seguimiento, será más factible realizar un análisis multivariante y podremos aclarar la verdadera influencia del margen sobre la supervivencia. Estos sesgos también pueden justificar determinadas cifras llamativas en nuestro estudio, pero no estadísticamente significativas, como por ejemplo la mortalidad posoperatoria (2.9% en el grupo R0 vs. 5% en el grupo R1; p = 0.535), si bien este parámetro puede verse influenciado por otras variables no estudiadas en nuestro trabajo, como la comorbilidad del paciente (no valorada a través del riesgo ASA)45 o la propia dificultad de la hepatectomía (basada en la necesidad de maniobras de Pringle por proximidad de las MH a estructuras vasculares, etc.)23.
La QT neoadyuvante moderna, junto con el desarrollo de nuevas técnicas quirúrgicas, han mejorado la seguridad en la realización de cirugías limitadas conservadoras de parénquima, con una mortalidad posoperatoria casi nula y una baja tasa de morbilidad46. Aunque algunos grupos han relacionado las resecciones no anatómicas con mayores tasas de resecciones R17,20, otros autores no han encontrado ninguna relación36, incluso tras resecciones laparoscópicas47. Vigano et al.23 publicaron un estudio con 226 pacientes sometidos a cirugías limitadas y compararon la influencia del margen R1 parenquimatoso y del margen R1 vascular. Por definición, para el grupo de Milán el despegamiento de la MH de un vaso intrahepático mayor es una resección R1 (R1 vascular), del mismo modo que exponer la MH a través de la línea de transección también lo es (R1 parenquimatosa)23. Consideran que en los pacientes con MH inicialmente irresecables o no óptimamente resecables el despegamiento vascular puede convertirlas en resecables, mientras que en los pacientes con MH resecables de entrada se puede disminuir el número de hepatectomías mayores.
Otro aspecto ampliamente analizado es la utilización de un elemento de disección y coagulación (en nuestro centro se utiliza un bisturí ultrasónico con efecto «cavitación» y un sistema de sellado también ultrasónico) que volatilizan, aspiran y coagulan el tejido adyacente a la MH durante la transección, brindando un margen adicional de 1-2 mm según Pawlik et al.21 o de hasta 5 mm según Bodingbauer et al.19. Coincidimos con Hamady et al.18, Poultsides et al.34 y Postriganova et al.47 en que el análisis histológico tiende a infraestimar la distancia del margen conseguido, sobreestimando el porcentaje de resecciones R1. Por tanto, el margen verdaderamente importante es el que queda en el paciente y no en la pieza de resección, aunque es este último el que objetiva el patólogo.
Estamos de acuerdo con Margonis et al.10 y otros autores18,48 en la necesidad de hallar marcadores biológicos e inmunohistoquímicos que complementen a los clinicopatológicos y que permitan orientar la agresividad biológica tumoral, como ha expuesto el grupo de Muratore et al.11. En nuestro estudio, los factores relacionados con una mayor agresividad biológica (como el estadio del CCR, la sincronicidad de las MH, las MH bilobares o los valores elevados de CEA) no han sido diferentes en función del margen obtenido, por lo que tampoco nos han orientado acerca de en qué pacientes la biología tumoral era menos favorable. Según Tanaka et al.42, ante un tumor con mayor agresividad biológica el impacto negativo del margen obtenido tras la cirugía es más secundario.
Ciertos estudios han demostrado que la cifra de CEA preoperatorio tiene valor pronóstico y, aunque su función exacta no está clara, un nivel alto de CEA podría reflejar una mayor agresividad tumoral, favoreciendo la diseminación peritoneal y la recidiva extrahepática49. De acuerdo con otros autores12,49, creemos que el nivel de CEA tanto al diagnóstico de las MH de CCR como antes de la hepatectomía se puede comportar como un indicador indirecto de agresividad biológica del tumor y de su respuesta a la QT. Sin embargo, en nuestro caso no ha servido para prever la afectación microscópica del margen (p = 0.735). En contra de nuestros resultados, el grupo del Paul Brousse7 observó que un CEA > 10 ng/ml fue un factor independiente de peor pronóstico sobre la supervivencia global, a diferencia de la resección R1, que no lo fue, y por eso concluyen que es la biología tumoral el factor que más influye en el pronóstico.
A pesar de perseguir siempre una cirugía R0, en vista de nuestros resultados, no consideramos la imposibilidad técnica para finalmente llevarlas a cabo y acabar realizando resecciones R1 como una contraindicación formal para la cirugía siempre y cuando no implique una resección R27,15. La justificación para esta actitud se basa en la administración de protocolos cada vez más efectivos de QT neoadyuvante y adyuvante. A pesar de que nuestros resultados muestran una supervivencia en los pacientes con margen R1 del 23% a 5 años, el planteamiento de la administración de QT aislada si se contraindica la cirugía es una opción únicamente paliativa, con una supervivencia media de 4.5-21 meses tras el diagnóstico8,48,50. En nuestro estudio, los pacientes con resección R1 han presentado una supervivencia solapable a la de los pacientes con resección R0, por lo que parece razonable nuestra actitud agresiva de combinar la cirugía con QT neoadyuvante y adyuvante a la hepatectomía7,44,48,50.
Por otra parte, los casos con resección R1 que sufren recurrencia de su enfermedad tienen la misma posibilidad en nuestro comité de tumores de plantearse una nueva resección hepática (p = 0.530), aplicación de radiofrecuencia (RF) si la recurrencia es hepática o plantearse una resección de la enfermedad extrahepática, de forma que la supervivencia tiende a igualarse a la de los pacientes R0. Postriganova et al.47 observaron que la mayoría de las recurrencias locales tras cirugías conservadoras eran nuevamente resecables, por lo que la posibilidad de realizar una nueva hepatectomía pudo contribuir a que las supervivencias de los pacientes R0 y R1 fueran solapables.
Nuestro estudio tiene varias limitaciones. Se trata de un trabajo unicéntrico y retrospectivo con una muestra de 144 pacientes, que es un número limitado si se compara con otros estudios de la literatura. El análisis efectuado fue univariante y no multivariante. Aunque se ha tenido en cuenta la aplicación de QT neoadyuvante y adyuvante, las diferencias en cuanto a la estructura sanitaria propia de cada país, la selección de pacientes, los protocolos utilizados y la duración del tratamiento han hecho que algunos de los resultados sean difíciles de interpretar y comparar con los de otros grupos de trabajo. Tampoco hemos podido describir la QT utilizada en cada paciente ni hemos podido identificar los pacientes «buenos» o «malos» respondedores a la neoadyuvancia.
Conclusiones
En nuestra serie de pacientes, la SG no ha sido diferente en función de la afectación microscópica del margen tumoral. Por lo tanto, consideramos indicada la hepatectomía en cualquier paciente (sin contraindicación para una cirugía mayor) con MH resecables siempre que se mantenga un remanente hepático suficiente, con independencia de la afectación microscópica final del margen tumoral.
Ninguno de los factores estudiados dependientes del paciente, del cáncer primario, de las MH y de la indicación de QT neoadyuvante nos ha permitido prever preoperatoriamente en qué pacientes hubiese sido más probable realizar una resección R1, así como tampoco lo han hecho los factores relacionados con una mayor agresividad biológica tumoral.
Por último, destacamos que en nuestro centro la ampliación de los criterios de resecabilidad para las MH de CCR, basados en un enfoque más agresivo, ha permitido aumentar el número de pacientes candidatos a cirugía, y consideramos que es una estrategia correcta que respeta los estándares de calidad establecidos.
Para el futuro, un estudio con mayor número de pacientes y un seguimiento más prolongado, junto con la publicación de nuevos estudios aleatorizados, podrán llegar a demostrar el verdadero beneficio de este tratamiento multidisciplinario agresivo. No obstante, hasta la identificación de factores biológicos inherentes al propio tumor que actualmente todavía se desconocen, esta política parece la indicada a la vista de los resultados obtenidos en el presente trabajo.











 text new page (beta)
text new page (beta)