Introducción
El coriocarcinoma es un tumor agresivo de la placenta que forma parte de las enfermedades trofoblásticas gestacionales. Hasta en un 50% de los casos procede de la malignización de una mola hidatiforme, aunque existe otro porcentaje que deriva de un embarazo ectópico, un aborto o incluso un embarazo a término. Entre los factores de riesgo están los antecedentes de abortos, embarazo múltiple, nuliparidad o edad mayor de 35 años. La patogenia viene determinada por la invasión de las células del trofoblasto a la decidua con capacidad metastásica preferentemente en los pulmones, aunque hay casos descritos con metástasis hepáticas y cerebrales. El cuadro clínico más frecuente incluye sangrado vaginal, hemoptisis, dolor en el pecho, náuseas y vómitos1. Destaca también una elevación de la fracción beta de la hormona gonadotrofina coriónica humana, que es un marcador tumoral base del diagnóstico y de la respuesta al tratamiento. La alta producción de gonadotrofina coriónica puede ser la causa de manifestaciones en otros órganos, como quistes tecaluteínicos en los ovarios, hiperplasia endometrial, hiperplasia de lobulillos mamarios e hipertiroidismo secundario al aumento de la producción de gonadotrofina2. El tratamiento principal es médico y se basa en la administración de metotrexato, ácido folínico, actinomicina D, etopósido o vincristina. Desde el punto de vista quirúrgico, la histerectomía se realiza cuando hay resistencia a la quimioterapia. La tasa de supervivencia es del 85-94% si no existe enfermedad metastásica. Con metástasis, la supervivencia disminuye según el órgano afectado: un 70% en caso de afectación cerebral, un 27% si es el hígado y un 10% cuando están afectados ambos.
Caso clínico
Mujer de 22 años, embarazada de 34 semanas, sin alergias ni otros antecedentes de interés. Embarazo bien controlado y con parámetros y controles todos ellos dentro de la normalidad. Acude a urgencias por presentar metrorragia y hemoptisis de forma espontánea, con ligera disnea. En el servicio de urgencias se realiza una exploración física en la que destacan taquicardia, hipoventilación pulmonar basal derecha y restos de sangre en la vagina, sin otros hallazgos de interés. Se solicitan analítica de sangre con bioquímica, fracción beta de la gonadotrofina coriónica humana (b-hCG) y hormonas tiroideas, hemograma, pruebas de coagulación y radiografía de tórax.
La analítica de sangre muestra una hemoglobina de 9.5 g/dl, b-hCG de 267,789 mUI/ml y hormonas tiroideas elevadas con disminución de la hormona estimulante del tiroides; el resto de los parámetros dentro de la normalidad. La radiografía de tórax se informa con abundantes infiltrados compatibles con metástasis más derrame pulmonar de predominio derecho (Fig. 1). Ante los hallazgos se solicita tomografía computarizada, en la que se objetivan abundantes nódulos en ambos pulmones con componente necrótico (Fig. 2) y placenta posterior con captación heterogénea y crecimientos nodulares/mamelonados (Fig. 3), todo ello compatible con metástasis de coriocarcinoma a confirmar por anatomía patológica.

Figura 1 Radiografía de tórax que muestra infiltrados pulmonares bilaterales compatibles con metástasis con derrame pulmonar de predominio derecho.
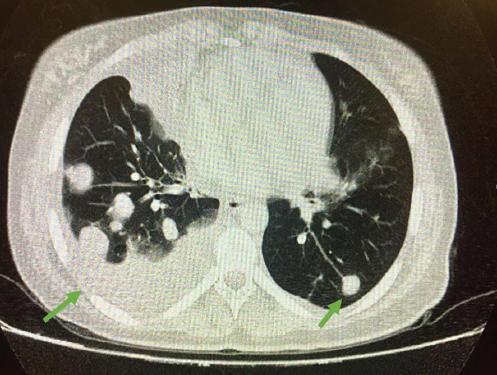
Figura 2 Tomografía computarizada pulmonar que muestra múltiples lesiones sospechosas de metástasis, la mayoría rodeadas de halo en «vidrio deslustrado» y de captación heterogénea, probablemente necróticas, con atelectasia en el lóbulo medio derecho.
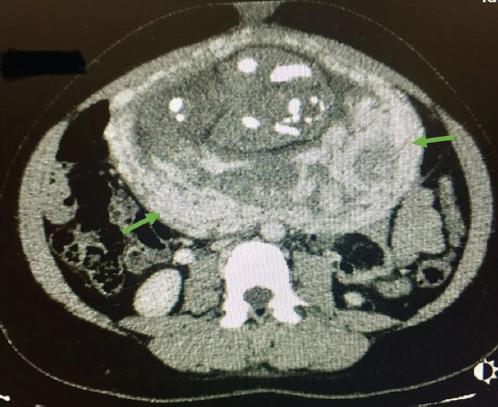
Figura 3 Placenta en posición posterior, de hasta 4 cm de espesor. Presenta una densidad heterogénea, con formaciones nodulares y mamelonadas de predominio superior.
Dado el embarazo, el deseo de un futuro nuevo embarazo y la gravedad del cuadro, el equipo interdisciplinario, formado por dos anestesiólogos y dos ginecólogos, decide realizar una cesárea programada de forma preferente para iniciar tratamiento con quimioterapia lo antes posible.
Antes de la cirugía se realiza tratamiento con propiltiouracilo y propanolol para estabilizar la tiroides y evitar una crisis tirotóxica, y se administra betametasona intramuscular para completar la maduración pulmonar. Por la posibilidad de sangrado, se realizan pruebas cruzadas y se reservan tres unidades de concentrados de hematíes.
El día de la cirugía se realiza nueva analítica de sangre, que muestra una hemoglobina de 8 mg/dl y un hematocrito del 25%, con el resto de los parámetros dentro de la normalidad. Se decide realizar una transfusión de una unidad de concentrado de glóbulos rojos y se canalizan dos vías periféricas gruesas (16 G). Se monitoriza a la paciente con pulsioxímetro, presión arterial y electrocardiograma, y se realiza anestesia subdural con bupivacaína hiperbara al 0.5% (11 mg) y morfina (0,1 mg). Tras la anestesia, la paciente presenta hipotensión que se resuelve con una infusión de fenilefrina a razón de 50 mg/min. Comienza la cirugía con incisión de Pfannenstiel y se extrae al feto. La cirugía transcurre sin incidencias y al finalizar se realiza bloqueo plano transverso del abdomen bilateral con levobupivacaína al 0.25% (30 ml) y se traslada a la paciente a la unidad de reanimación, con evolución favorable y alta a las 48 horas a la unidad de oncología, donde una vez confirmado el diagnóstico por anatomía patológica se inicia tratamiento con el esquema EMACO (etopósido 100 mg/m2 los días 1-2, actinomicina D 0,5 mg los días 1-2, metotrexato 300 mg/m2 el día 1, vincristina 1 mg/m2 el día 8 y ciclofosfamida 600 mg/m2 el día 8, en ciclos repetidos cada 14 días).
Los valores de b-hCG descendieron desde el inicio del tratamiento: 191,702.31 mUI/l a los 3 días, 36,353.73 mUI/l a los 7 días y 80.38 mUI/l al mes, hasta negativizarse tras la administración de seis ciclos con otro ciclo de 6 semanas de refuerzo. La exploración ginecológica y las últimas pruebas de imagen realizadas (ecografía ginecológica y tomografía computarizada) no muestran evidencia de enfermedad a los 6 meses.
Discusión
El coriocarcinoma es un tumor gestacional perteneciente al grupo de enfermedades trofoblásticas gestacionales y con gran capacidad de invadir vasos, lo que facilita su diseminación y la aparición de metástasis regionales, pulmonares, cerebrales y en otros órganos. Las metástasis pulmonares son las más frecuentes (80%), seguidas de las vaginales (30%), las hepáticas y las cerebrales (10%). En caso de metástasis hepáticas o cerebrales es necesario realizar una búsqueda exhaustiva de metástasis pulmonares. Desde el punto de vista etiológico se encuentra asociado con la edad, el grupo sanguíneo del sistema ABO, abortos previos, uso de anticonceptivos orales y factores ambientales todavía no aclarados3. Para su diagnóstico y la valoración de la respuesta al tratamiento es muy importante determinar la b-hCG, porque unos valores elevados orientan la enfermedad y el seguimiento evolutivo de sus cifras ofrece una visión de la efectividad del tratamiento.
El tratamiento de primera línea del coriocarcinoma de bajo riesgo (Tablas 1-2) es la quimioterapia con metotrexato4, añadiendo etopósido, vincristina y actinomicina/ciclofosfamida en el caso del coriocarcinoma de alto riesgo. La quimioterapia debe continuarse hasta que se negativice la b-hCG, y luego se debe administrar un ciclo de consolidación. Durante todo el tratamiento hay que monitorizar la respuesta con determinaciones seriadas de la b-hCG. La histerectomía no se recomienda como tratamiento de primera línea. Sin embargo, puede ser considerada antes de la quimioterapia cuando no existen metástasis o en pacientes sin deseos de futuras gestaciones. La histerectomía como tratamiento coadyuvante a la quimioterapia puede plantearse en pacientes con enfermedad local, paridad cumplida o coriocarcinoma resistente a la quimioterapia. La supervivencia es del 85-94% si no existe enfermedad metastásica, pero con metástasis la supervivencia disminuye según el órgano afectado5,6.
Tabla 1 Clasificación FIGO (Federación Internacional de Ginecología y Obstetricia)
| Estadio | Criterio |
|---|---|
| Estadio I | Enfermedad intraútero |
| Estadio II | Tumor trofoblástico gestacional que se extiende fuera del útero, pero que se limita a los órganos genitales (anejos, vagina, ligamentos anchos) |
| Estadio III | Enfermedad trofoblástica gestacional que se extiende hasta los pulmones, con o sin afectación de vías genitales conocida |
| Estadio IV | Todos los otros sitios de metástasis |
Tabla 2 Puntuación pronóstica
| 0 | 1 | 2 | 4 | |
|---|---|---|---|---|
| Edad | Hasta 39 años | Más de 40 años | - | - |
| Antecedentes de embarazo | Mola hidatiforme | Aborto/desconocido | Término | - |
| Tamaño tumoral (cm) | - | 3-5 cm | > 5 cm | - |
| Fracción beta gonadotrofina coriónica humana | 103 | 103-104 | 104-105 | > 105 |
| Fallo de quimioterapia anterior | - | - | Un fármaco | Dos o más fármacos |
| Lugar de metástasis | Pulmón Vagina | Riñón Bazo | Gastrointestinal | Cerebro Hígado |
| Numero de metástasis | 1-4 | 4-8 | > 8 | |
| Bajo riesgo: 0-6 puntos Alto riesgo: 7- 13 puntos Ultra alto riesgo: más de 13 puntos |
Bajo riesgo: tratamiento metotrexato
Alto riesgo: tratamiento poliquimioterapia |
|||
En nuestro caso, debido al deseo de futuras gestaciones y a la presencia de enfermedad metastásica, se optó por realizar cesárea y posterior quimioterapia.
Conclusión
El coriocarcinoma es un tumor del tejido placentario de baja incidencia y muy sensible a la quimioterapia. La clínica se debe tanto al propio tumor como a su producción hormonal. La b-hCG constituye el pilar fundamental para su diagnóstico y para la valoración de la respuesta al tratamiento. El tratamiento de primera línea consiste en la administración de quimioterapia, reservándose la histerectomía para casos seleccionados. Pese a ser un tumor muy agresivo, la tasa de supervivencia es alta, pero disminuye según la afectación de otros órganos.











 nova página do texto(beta)
nova página do texto(beta)


