Introducción
Actualmente el mundo ha sido paralizado por la propagación del nuevo coronavirus SARS-CoV-2 descubierto en diciembre de 2019, agente que provoca la enfermedad denominada COVID-191. Es una enfermedad contagiosa en humanos para la cual no existen tratamiento específico ni vacuna para prevenirla, y genera un síndrome respiratorio agudo grave en personas susceptibles2. En el origen del SARS-CoV-2 se han sugerido dos escenarios plausibles: un proceso de selección natural en un huésped animal antes de la transferencia zoonótica o la transferencia en humanos después de la transferencia zoonótica3. El virus se diseminó rápidamente por el mundo, llegando a Europa en menos de 2 meses y después a América. Debido a su alto contagio y morbilidad, esta infección es considerada por la Organización Mundial de la Salud (OMS) como una emergencia global4. La tasa de mortalidad inicial fue del 2.9% en la provincia de Hubei, China5, y rápidamente progresó al 5.5% global. Algunos países han presentado cifras de mortalidad superiores al 10%, como Italia, España y México1, lo cual sugiere que algo están haciendo mal para controlar la aparición de casos nuevos6.
En México, el primer caso fue detectado en un individuo que viajó a Italia a finales de febrero de 20207 y rápidamente se sumaron casos que llegaron de España, Francia y los Estados Unidos de Norteamérica, entre otros8. La estrategia mexicana para responder a la COVID-19 ha sido polémica, porque no se realizan pruebas masivas a población abierta. La vigilancia centinela que se aplicó estudia solo a aquellos individuos que reúnen la definición de caso sospechoso y a sus contactos (cuando es posible) que debieran de ser sometidos a una prueba diagnóstica para SARS-CoV-29.
En toda enfermedad infecciosa se espera tener nuevos casos secundarios por cada caso reportado en la población susceptible, y este conocimiento se utiliza para analizar el potencial de transmisión de la enfermedad10. La OMS estimó en un inicio que la COVID-19 producía entre 1.4 y 2.5 infecciones secundarias por cada caso inicial identificado11,12. Es indudable que existe una gran proporción no cuantificada de casos que nunca llegarán a ser estudiados por presentar una sintomatología leve o ser asintomáticos, mientras que otros se agravarán rápidamente y morirán antes de recibir atención médica hospitalaria para la COVID-19. Veinte semanas han pasado desde la aparición del primer caso en México y ya se reporta un total de 349,396 casos confirmados y 39,485 defunciones por COVID-19, con una letalidad que supera el 11%. Lo reportado diariamente por la autoridad sanitaria en México es un valor incompleto que no incluye todos los «casos centinela» que pudieran existir, lo que modifica el escenario epidemiológico y complica cualquier predicción que se pueda hacer acerca de esta enfermedad. Debido a la elevada infecciosidad del SARS-CoV-2 entre la población susceptible, el objetivo de las intervenciones epidemiológicas (distanciamiento social, uso de cubrebocas, realización de pruebas inmunológicas, aislamiento de contactos, cierre de fronteras, etc.)13 es disminuir el número de reproducción de nuevos casos. El número efectivo de reproducción de la infección (Rt) es una métrica epidemiológica que puede usarse para evaluar el contagio de agentes infecciosos, y representa el número promedio de infecciones en el tiempo «t» por caso infectado en el transcurso de su infección14,15. Si Rt se mantiene en menos de 1.0, la incidencia de nuevas infecciones disminuye, lo que finalmente resulta en el control de la epidemia. En cambio, si Rt es > 1, entonces las infecciones aumentarán (dependiendo de cuánto mayor sea por encima de 1.0 el número de reproducción) hasta lograr el punto máximo de la curva epidémica y eventualmente declinarán debido a la adquisición de inmunidad de rebaño14.
El objetivo de este estudio fue analizar el incremento de los casos centinela de COVID-19 en México calculados a partir del número efectivo de reproducción de la infección (Rt), y comparar su evolución con lo reportado por Italia, España y los Estados Unidos de Norteamérica durante las primeras 20 semanas de evolución de la epidemia.
Método
Con la información disponible en la OMS (www.who.int), el Centro de Ciencia e Ingeniería de Sistemas de la Universidad Johns Hopkins de Maryland, en los Estados Unidos de Norteamérica (coronavirus.jhu.edu), y la Unidad de Inteligencia Epidemiológica y Sanitaria de la Secretaría de Salud de México (www.coronavirus.gob.mx), se realizó un estudio transversal analítico a partir de los casos reportados como positivo para COVID-19 (SARS-CoV-2) en México16. Para conocer los «casos centinela» que se encontraban ocultos en la población se construyó un modelo estocástico mediante el cálculo del número efectivo de reproducción de la infección (Rt) de acuerdo con la metodología propuesta por Wallinga y Lipsitch17 y a partir de un modelo en población susceptible, infectada y recuperada derivado de la ecuación de Lotkae-Euler18, que es una ecuación lineal que se expresa como [ Rt = 1 + r * T ] y es diferente a la ecuación exponencial [Rexp = exp (r*T)], la cual toma en cuenta la variabilidad en el tiempo de generación de nuevos casos como una aproximación al factor exponencial. Para lo anterior realizamos el siguiente procedimiento: primero se calculó la incidencia acumulada (IA) por semana de los casos de COVID-19 en México del 29 de febrero al 24 de julio de 2020, se analizó el incremento semanal de casos en la IA que se denominó «r» (tasa de crecimiento exponencial o aumento del número de casos nuevos por día), porque se conoce que la IA en los brotes de una enfermedad infecciosa aumenta inicialmente de manera aproximadamente exponencial con el tiempo (por lo tanto, la incidencia presenta un crecimiento exponencial). Se definió el valor «T» como el tiempo en días entre la infección de un caso índice y un caso secundario generado a partir del caso índice, que por estudios previos en COVID-19 se sabe que se encuentra en un promedio de 5.8 ± 2.6 días12,19-21; para este estudio lo definimos como 4.0 días de acuerdo con lo publicado por Guan, et al.22. La finalidad de este procedimiento fue obtener una mejor aproximación al total de casos ocultos en la población que no han sido cuantificados por los motivos ya expuestos. En la tabla 1 se encuentra el cálculo de Rt a partir del incremento diario de casos de COVID-19 durante las primeras 20 semanas de la epidemia en México. Para conocer el total de infecciones respiratorias agudas graves ocurridas durante el primer semestre de 2019 y 2020 se consultó el Boletín Epidemiológico del Sistema Nacional de Vigilancia Epidemiológica (Sistema único de información) de la Secretaría de Salud (https://www.gob.mx/salud).
Tabla 1 Cálculo del número efectivo de reproducción de la infección (Rt) a partir del incremento diario de casos de COVID-19 durante las primeras 20 semanas de la epidemia en México
| Semana | Casos positivos | Casos negativos | Casos sospechosos | Incidencia acumulada* | r† | Rt‡ |
|---|---|---|---|---|---|---|
| 1 | 53 | 653 | 706 | 0.04 | -- | -- |
| 2 | 314 | 3747 | 4061 | 0.2 | 0.2 | 1.83 |
| 3 | 727 | 14718 | 15445 | 0.5 | 0.3 | 2.31 |
| 4 | 1345 | 33375 | 34720 | 1.0 | 0.4 | 2.96 |
| 5 | 2575 | 62565 | 65140 | 2.0 | 0.9 | 4.90 |
| 6 | 3758 | 97683 | 101441 | 2.9 | 0.9 | 4.75 |
| 7 | 6757 | 48849 | 55606 | 5.3 | 2.3 | 10.51 |
| 8 | 9376 | 84206 | 93582 | 7.4 | 2.0 | 9.30 |
| 9 | 11422 | 123470 | 134892 | 9.0 | 1.6 | 7.49 |
| 10 | 15306 | 172153 | 187459 | 12.1 | 3.0 | 13.31 |
| 11 | 19472 | 199039 | 218511 | 15.4 | 3.3 | 14.21 |
| 12 | 22330 | 232385 | 254715 | 17.7 | 2.2 | 10.06 |
| 13 | 22776 | 299713 | 322489 | 18.0 | 0.3 | 2.41 |
| 14 | 30162 | 349530 | 379692 | 23.9 | 5.8 | 24.41 |
| 15 | 34858 | 377576 | 412434 | 27.6 | 3.7 | 15.89 |
| 16 | 35535 | 414221 | 449756 | 28.1 | 0.5 | 3.15 |
| 17 | 41093 | 482041 | 523134 | 32.5 | 4.4 | 18.62 |
| 18 | 42685 | 499491 | 542176 | 33.8 | 1.2 | 6.05 |
| 19 | 44961 | 535462 | 580423 | 35.6 | 1.8 | 8.21 |
| 20 | 46093 | 574011 | 620104 | 36.5 | 0.9 | 4.59 |
| Promedio | 391,598 | 4,604,887 | 4,996,485 | + 1.9 | 8.6 |
*Casos por 100,000 habitantes (considerando una población para México de 126,190,788 habitantes.
†r = casos nuevos - casos de la semana anterior.
‡Rt = 1 + r * T, donde T es el tiempo entre la infección de un caso índice y la aparición de un caso secundario (4 días).
Incremento semanal = (casos positivos × 100) / casos sospechosos. Fuente: información estadística del 29 de febrero al 24 de julio de 2020, disponible en www.coronavirus.gob.mx.
Con los datos obtenidos se construyó una base de datos con ayuda del paquete estadístico Excel para Windows® versión 2007, y se realizó un análisis descriptivo para resumir los datos encontrados acerca del comportamiento de los casos para México y en comparación con los datos reportados por Italia, España y los Estados Unidos de Norteamérica. Se calcularon la prevalencia, la incidencia acumulada y la letalidad para la información epidemiológica obtenida, que se resumieron en tablas de frecuencias y figuras de dispersión. Para el análisis inferencial de las curvas presentadas se utilizó la prueba t de Student para las variables numéricas y de razón para el análisis intragrupo, para la comparación de la evolución de la enfermedad entre México, Italia, España y los Estados Unidos de Norteamérica durante las primeras 20 semanas de evolución de la epidemia se utilizó la prueba de análisis de varianza de un factor; el análisis post hoc con estadístico de Tukey se realizó para conocer aquellos datos que producían una diferencia en la evolución de la enfermedad. Un valor de p ≤ 0.05 se consideró como estadísticamente significativo.
Resultados
Desde el inicio de la pandemia de COVID-19 en México se ha buscado lograr el aplanamiento de la curva epidémica mediante la aplicación de algunas estrategias de mitigación y contención. Sumado a lo anterior, se ha mantenido un sistema de vigilancia centinela que aplica solo un muestreo de los casos que llegan a alguna unidad hospitalaria con un cuadro grave de la enfermedad. De acuerdo con los datos obtenidos en este estudio, considerando el conteo de casos por la autoridad sanitaria de México hasta la tercera semana de julio de 2020, se tiene un total de 390,516 casos de COVID-19, pero si agregamos los casos centinela calculados se tiene un aproximado de 3,780,195 casos (p = 0.0002). En la tabla 2 y la figura 1 se resumen los casos nuevos reportados cada semana por la Secretaría de Salud de México desde el inicio de la pandemia.
Tabla 2 Comparación entre casos y defunciones semanales por COVID-19 durante las primeras 20 semanas de la epidemia en México
| Semana | Casos | Defunciones | ||||
|---|---|---|---|---|---|---|
| Nuevos | Centinela* | Suma | Nuevas | Centinela† | Suma | |
| 1 | 53 | 451 | 504 | 0 | 22 | 22 |
| 2 | 198 | 1727 | 1925 | 2 | 86 | 88 |
| 3 | 597 | 5182 | 5779 | 26 | 257 | 283 |
| 4 | 1295 | 11241 | 12536 | 97 | 556 | 653 |
| 5 | 2518 | 21856 | 24374 | 171 | 1082 | 1253 |
| 6 | 3600 | 31248 | 34848 | 390 | 1547 | 1937 |
| 7 | 6416 | 55691 | 62107 | 665 | 2757 | 3422 |
| 8 | 8794 | 76332 | 85126 | 803 | 3778 | 4581 |
| 9 | 11551 | 100263 | 111814 | 1311 | 4963 | 6274 |
| 10 | 14197 | 123230 | 137427 | 1712 | 6100 | 7812 |
| 11 | 19401 | 168401 | 187802 | 2217 | 8336 | 10553 |
| 12 | 22044 | 191342 | 213386 | 2536 | 9471 | 12007 |
| 13 | 26439 | 229491 | 255930 | 3769 | 11360 | 15129 |
| 14 | 29734 | 258091 | 287825 | 3442 | 12776 | 16218 |
| 15 | 33708 | 292585 | 326293 | 4684 | 14483 | 19167 |
| 16 | 36307 | 315145 | 351452 | 4823 | 15600 | 20423 |
| 17 | 39996 | 347165 | 387161 | 3991 | 17185 | 21176 |
| 18 | 42902 | 372389 | 415291 | 4367 | 18433 | 22800 |
| 19 | 44474 | 386034 | 430508 | 4178 | 19109 | 23287 |
| 20 | 46292 | 401815 | 448107 | 4496 | 19890 | 24386 |
| Suma | 390,516 | 3,389,679 | 3,780,195 | 43,680 | 167,789 | 211,469 |
*Casos centinela: ajuste de casos obtenido al multiplicar los casos diarios reportados por el valor de Rt calculado (8.6).
†Defunciones centinela: ajuste de muertes ocurridas al multiplicar las defunciones diarias reportadas por la letalidad global conocida (4.95%).
Fuente: información estadística del 29 de febrero al 24 de julio de 2020, disponible en https://covid19.who.int/.

Figura 1 Comparación de casos nuevos y centinela de COVID-19 en México del 29 de febrero al 24 de julio de 2020. Casos centinela: ajuste de casos obtenido al multiplicar los casos diarios reportados por el valor de Rt calculado (8.6). Adaptado de World Health Organization.15
Para el caso de las defunciones se tendría también un subregistro: mientras la cifra oficial reporta en México 43,680 defunciones, el cálculo por esta metodología muestra un aproximado de 211,469 defunciones (p = 0.001). En la figura 2 se resume la información de las defunciones presentadas cada semana y el cálculo de las defunciones centinela por COVID-19 en México del 29 de febrero al 24 de julio de 2020.
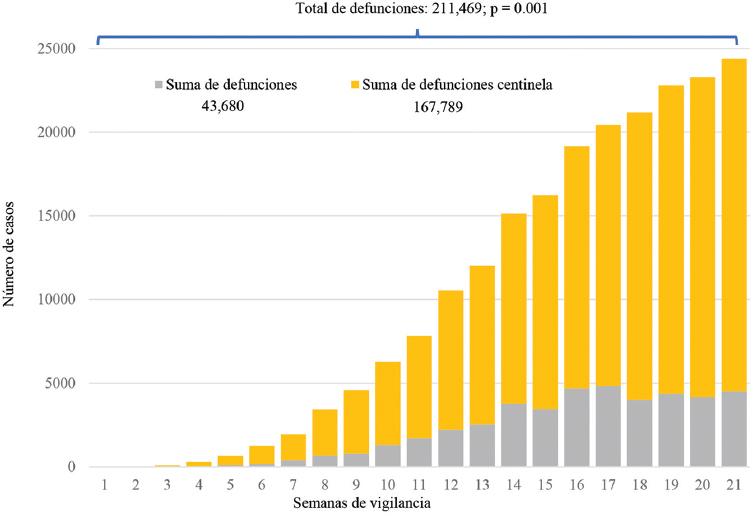
Figura 2 Comparación de defunciones nuevas y centinela de COVID-19 en México del 29 de febrero al 24 de julio de 2020. Defunción centinela: ajuste de muertes ocurridas al multiplicar las defunciones diarias reportadas por la letalidad global conocida (4.95%). Adaptado de World Health Organization.15
Un método más preciso de proyectar la evolución de los casos es mediante la IA en la población susceptible de enfermar. Así, a diferencia de Italia y España, que lograron un control en el aumento de los casos durante las primeras 10 semanas, en México la IA para los casos de COVID-19 se encuentra en aumento constante. Mientras Italia presenta una IA de 2.7 casos por 100,000 habitantes en la semana 20, España 26.0 por 100,000 habitantes y los Estados Unidos de Norteamérica (el país con más casos ocurridos en el mundo) 140.6 por 100,000 habitantes, en México, si agregamos los casos centinela, la IA es de 341.1 por 100,000 habitantes. Lo anterior se asocia con los casos acumulados: Italia 244,976 casos, España 272,389, los Estados Unidos de Norteamérica 4,009,746 casos y México 3,780,195 casos centinela (F = 20.18; p = 0.000000001). Es evidente que tanto México como los Estados Unidos de Norteamérica marcan una diferencia significativa en la evolución de los casos de la pandemia en comparación con lo ocurrido en España e Italia. En la tabla 3 y la figura 3 se presenta la comparación de la IA entre casos y defunciones semanales por COVID-19 durante las primeras 20 semanas de la epidemia en México, Italia, España y los Estados Unidos de Norteamérica.
Tabla 3 Comparación de incidencia acumulada entre casos y defunciones semanales por COVID-19 durante las primeras 20 semanas de la epidemia en México, Italia, España y los Estados Unidos de Norteamérica
| Semana | Casos | Defunciones | ||||||
|---|---|---|---|---|---|---|---|---|
| Italia | España | USA | México* | Italia | España | USA | México* | |
| 1 | 33.5 | 12.23 | 0.4 | 0.04 | 1.4 | 0.1 | 0.01 | 0.02 |
| 2 | 53.6 | 41.01 | 4.0 | 0.3 | 3.6 | 1.2 | 0.02 | 0.1 |
| 3 | 64.3 | 101.21 | 26.6 | 1.5 | 7.5 | 6.1 | 0.2 | 0.2 |
| 4 | 53.2 | 112.26 | 51.4 | 4.5 | 9.3 | 12.0 | 0.9 | 0.5 |
| 5 | 45.7 | 79.38 | 66.1 | 9.9 | 8.5 | 13.2 | 3.3 | 1.0 |
| 6 | 39.1 | 63.8 | 61.1 | 19.3 | 8.2 | 10.3 | 5.4 | 1.5 |
| 7 | 32.1 | 40.7 | 61.5 | 27.6 | 5.2 | 5.3 | 4.2 | 2.7 |
| 8 | 23.1 | 15.4 | 58.7 | 49.2 | 3.8 | 5.5 | 4.9 | 3.6 |
| 9 | 14.7 | 11.9 | 45.8 | 67.4 | 2.8 | 2.9 | 3.9 | 5.0 |
| 10 | 10.7 | 15.2 | 49.4 | 88.6 | 2.3 | 1.4 | 3.2 | 6.2 |
| 11 | 7.5 | 9.8 | 48.0 | 108.9 | 1.6 | 1.1 | 2.5 | 8.4 |
| 12 | 5.5 | 9.2 | 44.5 | 148.8 | 1.0 | 1.1 | 2.3 | 9.5 |
| 13 | 3.5 | 3.6 | 51.5 | 169.1 | 0.8 | 2.2 | 2.3 | 12.0 |
| 14 | 3.0 | 4.9 | 44.0 | 202.8 | 0.8 | 0.8 | 1.6 | 12.9 |
| 15 | 2.6 | 4.9 | 53.2 | 228.0 | 0.5 | 1.7 | 1.3 | 15.2 |
| 16 | 3.0 | 5.4 | 73.4 | 258.5 | 0.2 | 0.0 | 1.8 | 16.2 |
| 17 | 2.1 | 4.4 | 97.9 | 278.5 | 0.2 | 0.0 | 1.3 | 16.8 |
| 18 | 2.3 | 7.1 | 116.9 | 306.8 | 0.2 | 0.0 | 1.3 | 18.1 |
| 19 | 2.3 | 13.5 | 114.9 | 329.1 | 0.2 | 0.0 | 1.3 | 18.5 |
| 20 | 2.7 | 26.0 | 140.6 | 341.1 | 0.1 | 0.0 | 1.8 | 19.3 |
*Calculado a partir de los casos centinela obtenidos considerando el valor de Rt (8.6).
Adaptado de World Health Organization.15
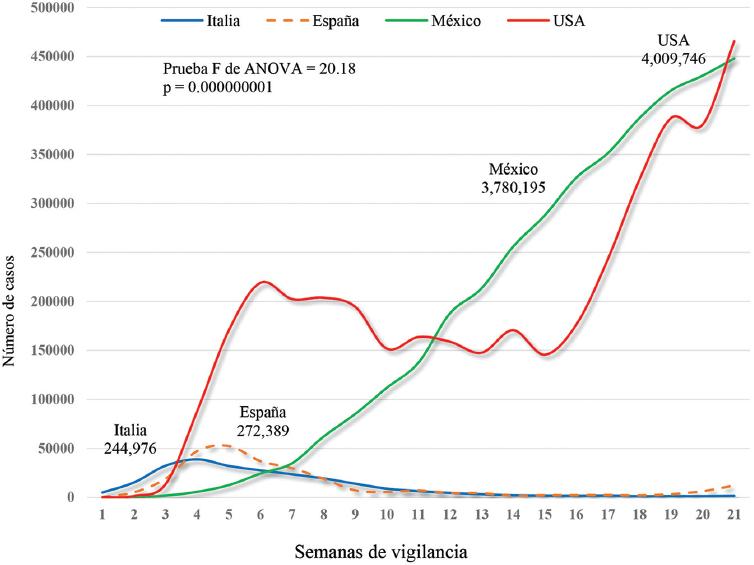
Figura 3 Comparación de casos de COVID-19 en Italia, España, los Estados Unidos de Norteamérica (USA) y México (casos centinela) del 29 de febrero al 24 de julio de 2020. Casos centinela: ajuste de casos obtenido al multiplicar los casos diarios reportados por el valor de Rt calculado (8.6). Adaptado de World Health Organization.15
En las tablas 2 y 3, y en la figura 4, se resumen las defunciones ocurridas para los países comparados con México. Como puede verse, México presenta una incidencia de defunciones de 19.3 por 100,000 habitantes, mientras que en Italia es de 0.1 por 100,000 habitantes, en España de 1.7 por 100,000 habitantes y en los Estados Unidos de Norteamérica de 1.8 por 100,000 habitantes. Lo anterior se origina en las defunciones totales observadas, que para Italia son 35,090, para España 29,858, para los Estados Unidos de Norteamérica 143,663 y para México 211,469 (sumando las defunciones centinela) (F = 12.69; p = 0.000001).

Figura 4 Comparación de muertes por COVID-19 en Italia, España, los Estados Unidos de Norteamérica (USA) y México (defunciones centinela) del 29 de febrero al 24 de junio de 2020. Defunción centinela: ajuste de muertes ocurridas al multiplicar las defunciones diarias reportadas por la letalidad global conocida (4.95%). Adaptado de World Health Organization.15
En la figura 5 se aprecia que Italia tiene la mayor letalidad por COVID-19 del mundo (14.3), y le siguen España y México con 11.3 y 11.2, respectivamente. Los Estados Unidos de Norteamérica presentan una letalidad de 3.6 y han logrado mantenerse en un valor similar al valor global de 4.1 (F = 20.43; p = 0.00001). La letalidad se encuentra fuertemente influenciada por el número de casos detectados mediante pruebas de tamizaje, y este hecho produce un sesgo en este dato. Por ese motivo, tanto México como España e Italia presentan una letalidad elevada que no es real y que indudablemente disminuiría si se realizaran más pruebas diagnósticas para COVID-19. Un valor más real resulta de calcular la IA para las defunciones ocurridas; en la tabla 3 se resume esta información, y se puede observar un descenso constante y gradual para Italia, España y los Estados Unidos de Norteamérica, pero no así para México, que sigue en incremento.
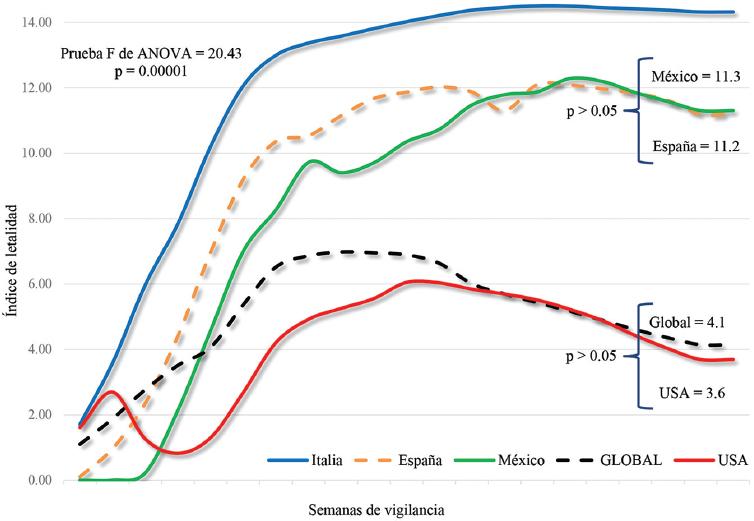
Figura 5 Comparación de la letalidad global de la COVID-19 en Italia, España, los Estados Unidos de Norteamérica (USA) y México.
Es indudable que la vigilancia centinela aplicada cada año en México nos permite realizar un seguimiento puntual de las infecciones respiratorias agudas graves. Durante el mes de enero, tanto en 2019 como en 2020, hubo más de dos millones de infecciones respiratorias agudas graves, descendiendo de forma paulatina y sincrónica en ambos casos hasta inicios del mes de marzo, pero en 2020 en ese momento se observa un aumento que duró hasta los primeros días de abril, cuando se produjo un descenso acelerado, lo cual puede ser explicado por las medidas de mitigación aplicadas para limitar la diseminación del SARS-CoV-2 en la población (distanciamiento social, cierre de la economía y Jornada Nacional de Sana Distancia), que se mantuvieron hasta mediados del mes de mayo, cuando la población recluida en sus hogares entró en fatiga y la afectación de su economía condicionó un regreso paulatino a las actividades, y en consecuencia un incremento de casos que duró hasta el mes de junio, cuando nuevamente se invitó a la población a mantenerse en sus hogares al establecerse un semáforo nacional de señalización por colores (rojo, naranja, amarillo y verde) en cada Estado del país. Con el semáforo rojo se permiten únicamente las actividades económicas esenciales, en naranja se permite que las empresas de actividades económicas no esenciales trabajen con el 30% del personal para su funcionamiento, en amarillo están permitidas todas las actividades laborales y en verde se permiten todas las actividades, incluidas las escolares. Cabe mencionar que la mayoría del país se mantiene en rojo desde entonces. En la figura 6 se muestra la incidencia de infecciones respiratorias agudas graves durante el primer semestre de los años 2019 y 2020 en México.
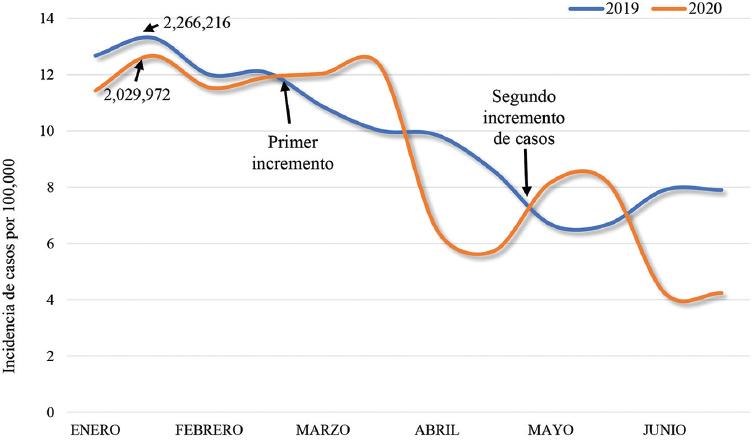
Figura 6 Comparación de la incidencia de infecciones respiratorias agudas durante el primer semestre de los años 2019 y 2020 en México (casos por 100,000). Fuente: Boletín Epidemiológico del Sistema Nacional de Vigilancia Epidemiológica (Sistema único de información) de la Secretaría de Salud, disponible en https://www.gob.mx.
Discusión
La infección por SARS-CoV-2 tiene una velocidad de contagio más elevada que la observada en otras enfermedades virales similares. La rápida propagación del SARS-CoV-2 requiere la generación de evidencia para ayudar a mitigar su daño global. Los datos comunicados por China durante su brote epidémico fueron un 80% de casos leves, solo un 15-20% precisaba ingreso hospitalario y un 3-5% requirieron ingreso en la unidad de cuidados intensivos22. Quizá solo estamos viendo la punta del iceberg, porque la mayoría de los países del mundo no pueden realizar el número suficiente de pruebas a su población y los casos que reportan son únicamente aquellos que se encuentran dentro de ese 15-20% que tuvieron acceso a recibir atención medica, quedando una gran cantidad de casos sin identificar. La medición precisa con los indicadores clínicos y epidemiológicos apropiados es un paso necesario para reducir la carga individual y poblacional de la pandemia en curso. Los modelos matemáticos de transmisión se han convertido en herramientas de gestión invaluables en la planificación para el control de enfermedades infecciosas emergentes17. Una variable clave en tales modelos es el número reproductivo R en sus diferentes formas de cálculo. Una de estas formas es el número efectivo de reproducción de la infección (Rt)18, que si es < 1 indica una escasa capacidad de expansión de una enfermedad infecciosa, mientras que valores de Rt > 1 indican la necesidad de emplear medidas de control para limitar su extensión. Es preocupante que para México se tenga un valor tan alto (8.6), ya que el país se encontraría cursando una pandemia sin control y navegando a ciegas al no conocer dónde se encuentran los casos para poder contener y mitigar la enfermedad. Yuan, et al.23 calcularon el valor de Rt en algunos países europeos y encontraron que para Italia era de 3.2, para la región de Lombardía (Italia) de 6.3, para Francia de 6.3, para Alemania de 6.0 y para España de 5.0; los autores concluyeron que en esos países el valor de Rt era > 2 y en consecuencia el brote de COVID-19 continuaría en tanto no se realizaran medidas de prevención y control más estrictas para frenar la propagación de la enfermedad. No hay que olvidar que la estricta cuarentena aplicada en la ciudad de Wuhan, provincia de Hubei, China, pudo frenar rápidamente los casos de COVID-1924. Sumado a lo anterior, es necesario realizar el número suficiente de pruebas para la detección del virus con el fin de estimar de forma más precisa las tasas de contagio en población de riesgo, aislando a los casos sospechosos y cortando así la cadena de contagios25.
Las primeras semanas de un brote son críticas para desarrollar una comprensión profunda de la dinámica de transmisión y de la gravedad de la enfermedad26. En México, en un principio no se aplicaron de manera eficiente las medidas de contención de la COVID-19, lo que provocó la rápida llegada de casos de Italia, España y los Estados Unidos de Norteamérica7.
La vigilancia centinela es útil en enfermedades emergentes y en lugares donde las condiciones socioeconómicas no permiten tener un sistema de vigilancia mejor27. A partir de la pandemia de influenza en 2006 se estableció el «Plan nacional de preparación y respuesta ante la pandemia de influenza»28,29, que sentó las bases para el seguimiento cada año de las infecciones respiratorias agudas con énfasis en la influenza estacional30. Sin embargo, la influenza es una enfermedad que ya conocemos. En cambio, la COVID-19, que se inició en marzo de 2020 en México, es una enfermedad nueva, desconocida para nosotros, sin tratamiento disponible aún y con un índice de contagiosidad mayor que el del SARS-CoV-112,31; por ese motivo, quizá el modelo centinela no era la mejor opción de vigilancia para la identificación de nuevos casos.
En la COVID-19, la identificación de individuos asintomáticos es un desafío que no se había visto con otros virus respiratorios. Estos sujetos pueden ser contagiosos durante varios días32,33, convirtiéndose en propagadores muy eficientes del SARS-CoV-2. En Wuhan, China, se observó que hasta un 79% de los sujetos asintomáticos no diagnosticados fueron los responsables de las infecciones en la población susceptible34. En México, el exceso de movilidad de la población y una falsa percepción de bajo riesgo para la COVID-19 han originado una falla en las estrategias de contención de la enfermedad. Ahora sabemos que las medidas de distanciamiento social35 pueden tener un efecto de «rebote», principalmente cuando la población susceptible pertenece a un estrato socioeconómico débil y que para sobrevivir tiene que salir a trabajar todos los días36, situación en la cual se encuentra un alto porcentaje de la población.
De acuerdo con la comparación realizada en los países incluidos en este estudio, el número de casos informados por la autoridad sanitaria de México no es congruente con el patrón esperado de crecimiento para un país con más de 126 millones de habitantes y que es atacado por una enfermedad infecciosa, letal, de rápida transmisibilidad y sin un tratamiento preciso.
La transmisión aérea podría explicar, en parte, las altas tasas de transmisión secundaria que se han observado en muchos países, incluido México; sin embargo, la autoridad sanitaria no ha tenido una política clara a este respecto y se ha dudado mucho de la implementación obligatoria del uso de cubrebocas en la población, incluso cuando ya se sabe que es una medida de control epidémico que demostró su eficacia para reducir la transmisión del SARS-CoV-2 en lugares como Taiwán, Hong Kong, Singapur y Corea del Sur37.
Por último, es importante recordar que la letalidad es un indicador de mortalidad que depende de la capacidad de identificar casos y muertes durante el proceso de vigilancia epidemiológica, y nos permite resumir tanto la magnitud como el impacto del proceso epidémico. Las diferencias observadas en la letalidad entre Italia, España, México y los Estados Unidos de Norteamérica pueden justificarse por las diferencias poblacionales, factores socioeconómicos y ambientales, y el acceso a la atención médica. Para el caso de México, los resultados de este estudio indican que la hipótesis más probable es la falta de identificación de casos no detectados por no realizar pruebas diagnósticas para SARS-CoV-2 en población susceptible, y como consecuencia un falso aumento en la magnitud de la letalidad. No debemos olvidar que México ocupa los primeros lugares en el mundo en tasas de obesidad, diabetes mellitus, hipertensión arterial y otras enfermedades crónicas degenerativas; todas estas condiciones son factores de riesgo reconocidos para mortalidad por COVID-19 e influyen para provocar un exceso de mortalidad que ya ha sido observado por algunos estudios en México38 y en el mundo39-41.
Como debilidades de nuestro estudio podemos mencionar el tipo de estudio y la ausencia de seguimiento de los casos de infección por COVID-19 por falta de acceso a esta información.
Podemos concluir que el aplanamiento de la curva epidémica en México no se ha logrado y es urgente seguir aplicando las estrategias de mitigación y contención de la pandemia de COVID-19 en la población. El modelo centinela, de la forma en que ha sido aplicado para la vigilancia epidemiológica en México, presenta una pérdida importante de información no cuantificada. Es necesario reforzar la vigilancia epidemiológica mediante una mejor estrategia de detección de casos en nuestro país. La llegada del SARS-CoV-2 ha representado un reto sin precedentes para la salud pública en México.











 nueva página del texto (beta)
nueva página del texto (beta)


