Introducción
El cáncer oral ocupa la octava posición en el ranking mundial de incidencia de cáncer1,2. Cada año, aproximadamente 11 de cada 100,000 adultos son diagnosticados con este tipo de cáncer3-5. En México, en 2018, GLOBOCAN reportó una incidencia de 1.48 por cada 100,000 individuos6. Actualmente, la octava edición del sistema de clasificación TNM del American Joint Committee on Cancer (AJCC) se utiliza para estadificar y dar pronóstico al carcinoma de células escamosas de cabeza y cuello. La etapificación ganglionar de este sistema se basa en el número, el sitio y el tamaño de los ganglios (nódulos) linfáticos positivos. Pruebas recientes sugieren que, además de estos factores, el número de ganglios positivos y el cociente o la densidad de ganglios linfáticos (LNR o LND, por sus siglas en inglés) son un factor pronóstico crítico que no se incluyó en el sistema de estadificación TNM7. Así, un predictor adicional y emergente para predecir el resultado de los pacientes con cáncer de cavidad oral es la LND o el LNR, que se define como la proporción de ganglios linfáticos positivos con respecto al número total de ganglios linfáticos resecados8. En 2009 se realizó un estudio de cohorte con 201 pacientes con diagnóstico de carcinoma de células escamosas aerodigestivo que se sometieron a cirugía y disección de ganglios linfáticos, en el que se determinó el valor pronóstico del LND en la supervivencia global, la supervivencia libre de enfermedad (SLE) y la supervivencia sin falla locorregional. Se halló que la mediana de la supervivencia general fue de 40.70 meses y de 30.11 meses en los pacientes con LNR ≤ 0.06 y > 0.06, respectivamente. Además, los autores concluyen que el LNR > 0.06 es un factor pronóstico significativo para una menor supervivencia general de los pacientes con carcinoma escamoso de cavidad oral. Por tanto, recomiendan tratamientos adyuvantes más intensivos, como quimioterapia con radioterapia y seguimiento a corto plazo para aquellos pacientes con LNR > 0.069. Posteriormente, mediante un estudio en 386 pacientes con cáncer de la cavidad oral que se sometieron a tratamiento quirúrgico con o sin terapia adyuvante, se identificó una mediana de LNR de 0.06 como punto de corte relevante y se concluyó que el LNR estaba significativamente asociado con la supervivencia global (≤ 0.06 vs. 0.06: 58 vs. 28%) y con la supervivencia específica de enfermedad ((≤ 0.06 vs. 0.06: 65 vs. 34%). Además, también se encontró que el LNR era el único predictor significativo del resultado en los pacientes que recibían radioterapia adyuvante. Debido a los altos índices de recurrencia y de mortalidad de la enfermedad en los pacientes con cáncer de cavidad oral, es necesaria la búsqueda de mejores predictores de supervivencia y factores pronósticos de recurrencia10.
En este sentido, diversos estudios proponen evaluar el LNR como factor pronóstico independiente para el riesgo de recurrencia local, regional o a distancia del carcinoma oral de células escamosas en pacientes sometidos a disección ganglionar de cuello, y además evaluando otras variables como la etapa patológica, la invasión perineural, la invasión linfovascular, la afección de los márgenes, la extensión extranodal, el subsitio de la cavidad oral, el grosor del tumor, la adyuvancia, el sexo y la edad sobre la recurrencia local, regional o a distancia, para así descartar que los resultados obtenidos sean por estas variables10-14.
Por tal motivo se desarrolló el presente estudio, cuyo objetivo fue evaluar el LNR como factor pronóstico independiente asociado a recurrencia en pacientes con carcinoma de cavidad oral de células escamosas sometidos a resección del tumor y disección ganglionar de cuello.
Método
Estudio de tipo retrospectivo observacional, con muestreo no probabilístico. Se incluyeron pacientes con diagnóstico de carcinoma oral de células escamosas sometidos a resección y disección ganglionar durante el periodo de enero de 2007 a diciembre de 2018 en el servicio de cirugía oncológica del Centro Médico de Noreste, Unidad Médica de Alta Especialidad No. 25 del Instituto Mexicano del Seguro Social; se excluyeron los pacientes con expediente incompleto. Para la realización del estudio se solicitó la autorización al comité de ética e investigación del centro. No fue necesario solicitar el consentimiento informado debido a la naturaleza retrospectiva del estudio. La SLE se definió como el tiempo desde la fecha de la cirugía hasta la última fecha reportada en el expediente clínico.
Para el análisis estadístico se usó el paquete estadístico SPSS V.24, empleando estadística descriptiva e inferencial. Se utilizó la prueba de ji al cuadrado para identificar diferencias entre los grupos. Las pruebas de Kaplan-Meier y log rank fueron empleadas para el análisis de la SLE, y la regresión de Cox para los análisis univariado y multivariado. Se estableció la significancia estadística con p ≤ 0.05 bilateral.
Resultados
Se incluyeron 88 pacientes con diagnóstico de carcinoma oral de células escamosas sometidos a resección tumoral y disección ganglionar de cuello para su análisis. Del total del grupo, el 45% (n = 40) eran hombres y el 54% (n = 48) eran mujeres, con una edad media de 60.42 (± 14.28) años. El principal sitio de localización tumoral fue la lengua (75%), seguida de las encías (13%). De acuerdo con la etapificación de la enfermedad, el 61% de los casos se encontraban en etapas tempranas (I-III) y el restante 39% se encontraba en etapa clínica IV. En cuanto al estadio de la enfermedad, el T patológico predominante fue T2 (36.8%, n = 32) y el N predominante fue N0 (46%, n = 40).
Los 88 pacientes fueron sometidos a resección quirúrgica y disección ganglionar. La media de ganglios resecados fue de 20.07 (± 12.55), con una mediana de positividad de 1.27 (1-8). El LNR fue < 0.06 en el 58% y ≥ 0.06 en el restante 42%.
Con respecto a los márgenes de disección, el 70% de los casos presentó R0; adicionalmente, se observó invasión linfovascular y perineural negativa en el 77% y el 91% de los casos, respectivamente. En cuanto al grado de diferenciación, el 76% (n = 67) eran de grado 2. Posterior al tratamiento quirúrgico, el 72% recibió adyuvancia con quimioterapia con o sin radioterapia. No se encontraron diferencias entre los grupos al realizar la prueba de ji al cuadrado, exceptuando los ganglios (N) (p = 0.001) y la etapa clínica (p = 0.001) (Tabla 1).
Tabla 1 Características generales y resultados clínicos
| Características clínicas y demográficas | ||||
|---|---|---|---|---|
| Característica | LNR < 0.06 (n = 51) n (%) | LNR ≥ 0.06 (n = 37) n (%) | Total (n = 88) n (%) | p |
| Sexo | ||||
| Hombre | 22 (43) | 18 (49) | 40 (45) | 0.668 |
| Mujer | 29 (57) | 19 (51) | 48 (54.5) | |
| Edad, años | ||||
| Media | 59 | 61.38 | 60.42 | 0.440 |
| Desviación estándar | 15.32 | 12.85 | 14.28 | |
| Localización | ||||
| Lengua | 38 (74) | 28 (76) | 66 (75) | 0.703 |
| Encías | 6 (12) | 5 (13) | 11 (12) | |
| Piso de cavidad oral | 4 (8) | 4 (11) | 8 (10) | |
| Labio | 3(6) | 0 (0) | 3 (3) | |
| Estadio (T) | ||||
| T1 | 15 (27) | 8 (21) | 23 (25) | 0.156 |
| T2 | 22 (43) | 10 (27) | 32 (36) | |
| T3 | 9 (18) | 14 (38) | 23 (25) | |
| T4 | 6 (12) | 5 (14) | 11 (14) | |
| Ganglios (N) | ||||
| N0 | 40 (78) | 0 (0) | 40 (45) | 0.001* |
| N1 | 9 (18) | 11 (30) | 20 (23) | |
| N2 | 1 (2) | 25 (68) | 26 (30) | |
| N3 | 1 (2) | 1 (3) | 2 (4) | |
| Etapa clínica | ||||
| I | 13 (26) | 0 (0) | 13 (15) | 0.001* |
| II | 15 (29) | 0 (0) | 15 (17) | |
| III | 15 (29) | 11 (30) | 26 (29) | |
| IV | 8 (16) | 26 (70) | 34 (39) | |
| Bordes | ||||
| R0 | 36 (71) | 26 (70) | 62 (70) | 0.961 |
| R1 | 6 (12) | 5 (13) | 11 (13) | |
| R2 | 9 (17) | 6 (17) | 15 (17) | |
| Grado histológico | ||||
| 1 | 10 (20) | 4 (11) | 13 (16) | 0.535 |
| 2 | 37 (72) | 30 (81) | 67 (76) | |
| 3 | 4 (8) | 3 (8) | 7 (8) | |
| IV | ||||
| Negativo | 37 (72) | 31 (84) | 68 (77) | 0.304 |
| Positivo | 14 (28) | 6 (16) | 20 (23) | |
| IP | ||||
| Negativo | 48 (94) | 32 (86) | 80 (91) | 0.273 |
| Positivo | 3 (6) | 5 (14) | 8 (9) | |
| Número de ganglios (media) | 20 (2-58) | 20 (2-77) | 20.07 (2-77) | 0.577 |
| Ganglios positivos (mediana) | 1 (0-8) | 1 (0-5) | 1 (0-8) | 0.938 |
| Tratamiento adyuvante | ||||
| Sí | 33 (65) | 30 (81) | 63 (72) | 0.102 |
| No | 18 (35) | 7 (19) | 25 (28) | |
| Recurrencia | ||||
| Recurrencia | 15 (29) | 18 (49) | 33 (37) | 0.078 |
| Sin enfermedad | 36 (71) | 19 (51) | 55 (63) | |
LNR: cociente de ganglios linfáticos; IP: Invasión Perineural; IV: Invasión Vascular; P: Valor de significancia estadística; R0: Sin persistencia de enfermedad; R1: Persistencia de enfermedad microscópica; R2: Persistencia de enfermedad macroscópica.
*Significancia estadística (p < 0.05).
En el análisis de la SLE, no se alcanzó la mediana de SLE en ninguno de los grupos, con diferencias estadísticamente significativas en la prueba de log rank (p = 0.018) (Fig. 1).
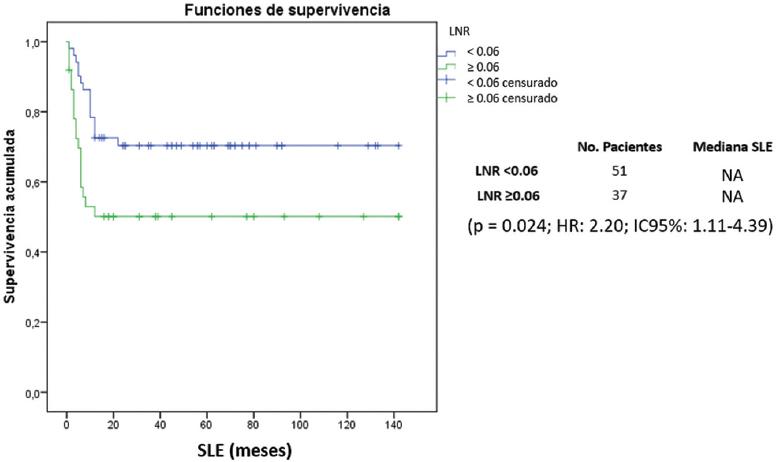
Figura 1 Análisis de la supervivencia libre de enfermedad. HR: hazard ratio; IC95%: intervalo de confianza del 95%; LNR: cociente de ganglios linfáticos; NA: no alcanzada; SLE: supervivencia libre de enfermedad.
En el análisis univariado se encontraron como predictores de SLE el LNR (p = 0.024; hazard ratio [HR]: 2.20; intervalo de confianza del 95% [IC95%]: 1.11-4.39) y la etapa clínica (p = 0.004; HR: 1.76; IC95%: 1.19-2.59) (Tabla 2). Por otro lado, en el análisis multivariado, el LNR y la etapa clínica no se mantuvieron como predictores de recurrencia, con p = 0.227 y p = 0.191, respectivamente (Tabla 2).
Tabla 2 Análisis multivariado. Regresión de Cox
| Variables | Univariado | Multivariado | ||
|---|---|---|---|---|
| p | HR (IC95%) | p | HR (IC95%) | |
| LNR ≥ 0.06 | 0.024* | 2.20 (1.11-4.39) | 0.548 | 1.27 (0.57-2.80) |
| Localización | 0.750 | 0.95 (0.743-1.24) | - | - |
| Etapa clínica | 0.004* | 1.76 (1.19-2.59) | 0.95 | 3.84 (0.72-18.72) |
| Grado 2 | 0.445 | 0.611 (0.17-2.16) | - | - |
| Bordes | 0.448 | 1.47 (0.55-3.75) | - | - |
| Invasión vascular | 0.445 | 0.71 (0.29-1.72) | - | - |
| Invasión perineural | 0.987 | 0.99 (0.30-3.24) | - | - |
| Adyuvancia | 0.564 | 0.808 (0.39-1.66) | ||
HR: hazard ratio; IC95%: intervalo de confianza del 95%; LNR: cociente de ganglios linfáticos.
*Significancia estadística (p < 0.05).
Discusión
El cáncer oral es un problema de salud pública, ya que es una importante causa de morbilidad y mortalidad2, y ocupa la octava posición en el ranking mundial de incidencia de cáncer. En México, en 2018, GLOBOCAN reportó una incidencia de 1.48 por cada 100,000 individuos6, siendo así el carcinoma oral de células escamosas o cáncer epidermoide el más frecuente de todas las neoplasias orales malignas, abarcando al menos el 90% de todas ellas2,5,8. Posterior al tratamiento inicial, un número importante de pacientes sufre recaídas locales y regionales, por lo que si se lograra identificar un factor pronostico preciso permitirá ofrecer terapias más radicales y hacer un seguimiento más estrecho de esos pacientes para detectar de forma temprana las recaídas, pudiendo rescatar nuevamente a los pacientes con otras terapias oncológicas y con ello disminuir la morbimortalidad y los gastos en tratamientos y cuidados paliativos que genera la detección tardía de casos. Así pues, un predictor adicional y emergente del resultado de los pacientes con cáncer de cavidad oral es el LNR. Varios estudios retrospectivos han informado que el LNR es predictivo para la supervivencia global12,13-20, la supervivencia específica de la enfermedad13-18, la SLE13,18,21 y el control locorregional16,19,21. En el presente estudio se observaron diferencias significativas en el análisis de la SLE (p = 0.018) entre los pacientes con LNR < 0.06 y aquellos con LNR ≥ 0.06.
Gil, et al.9 evaluaron el papel del LNR en el carcinoma de cavidad oral mediante un estudio en 386 pacientes con cáncer de la cavidad oral. En el análisis multivariado, el LNR (punto de corte de 0.06) mostró ser el único predictor independiente para falla locorregional. En el estudio de Prabhu, et al.19 se incluyeron 350 pacientes y se halló que el LNR se asoció significativamente con la recurrencia locorregional al emplear un punto de corte de 0.2; así, los pacientes con una LNR mayor o igual que este valor tenían un alto riesgo de recurrencia locorregional. Igualmente, Lieng, et al.22-24 determinaron la importancia pronóstica del LNR en 72 pacientes con carcinoma oral de células escamosas y ganglios positivos. Encontraron que los pacientes con un LNR > 0.143 experimentaron una mayor tasa de recurrencia regional.
En el presente estudio se encontraron como predictores de SLE el LNR y la etapa clínica. Sin embargo, en el análisis multivariado, el LNR y la etapa clínica no se mantuvieron como predictores de recurrencia.
Nuestro estudio presenta algunas limitaciones, como su naturaleza retrospectiva y el tamaño de la muestra. Por ello, se sugiere ampliar el tamaño muestral y hacer un estudio que incluya el análisis por etapa de la enfermedad en relación con el tipo de resección y el LNR.
Conclusiones
El presente estudio es de gran utilidad ya que, aun cuando el LNR no se mantuvo como predictor único de SLE, podría ser una herramienta que ayude en la determinación del riesgo de recurrencia locorregional en pacientes con carcinoma de cavidad oral. Por tal motivo, sería necesario ampliar la muestra para mejorar la estimación y replicar el análisis incluyendo un subanálisis por etapa clínica de la enfermedad.











 nova página do texto(beta)
nova página do texto(beta)


