Introducción
El cáncer colorrectal (CCR) es la tercera causa de morbimortalidad oncológica en el mundo, tanto en hombres como en mujeres. De acuerdo con el registro GLOBOCAN, en 2012 la incidencia estimada fue de 17.2 nuevos casos por cada 100,000 habitantes, con una tasa de mortalidad de 8.4/100,000, la cual se incrementó al 9.2% en 20181-3.
En el continente americano, la incidencia estimada es de 246,000 nuevos casos, con una mortalidad de aproximadamente 112,000 personas cada año. Las tasas de incidencia y mortalidad en América Latina y el Caribe son menores que en los Estados Unidos de América y Canadá, con excepción de las de Uruguay, Argentina, Barbados y Trinidad y Tobago, cuyas cifras son mayores que en el resto de América Latina y similares a las de Norteamérica. En México, el CCR ocupa el tercer lugar en incidencia entre las enfermedades oncológicas en ambos sexos, y el quinto lugar en mortalidad en hombres y el sexto en mujeres1,2.
La incidencia y la mortalidad del cáncer están creciendo rápidamente en todo el mundo. De acuerdo con las estimaciones de la Organización Mundial de la Salud (OMS) en 2015, CCR representó la tercera causa de muerte en general y la segunda causa de muerte por cáncer en los adultos mayores de 70 años. El registro GLOBOCAN estimó para el año 2018 la detección de 18.1 millones de nuevos casos y 9,6 millones de muertes-cáncer en el mundo. El continente americano representa el 21% de la incidencia y el 14.4% de la mortalidad por cáncer3,4.
Las diferencias en los patrones de mortalidad pueden explicarse por las distintas infraestructuras de salud, el tratamiento y el acceso a la atención médica, y los mayores costos del diagnóstico4. Los países en transición hacia niveles más altos de desarrollo humano, como los de América Central y del Sur, y los de Europa del Este, han mostrado un incremento en la incidencia de CCR. Los países de América Central y América del Sur (incluida Cuba) están experimentando rápidos cambios sociodemográficos y epidemiológicos, y la naturaleza de los problemas de salud está pasando por una transición de enfermedades infecciosas a enfermedades crónicas, incluido el cáncer5. Recientes estimaciones indican que el 15% de los cánceres de colon y el 8% de los cánceres rectales ocurrirán en América Latina (incluyendo el Caribe)4,5.
El CCR se puede dividir en hereditario y esporádico. En la mayor parte de los casos presenta un desarrollo progresivo a partir de una lesión premaligna (adenomatosa), que después de un período de alrededor de 10 años da origen a una lesión maligna, lo que se conoce como «secuencia adenoma-carcinoma»6,7. Por ello, al presentar un «período de ventana», es posible detectar y tratar oportunamente lesiones premalignas e incluso cánceres en etapas tempranas, lo cual repercute en la expectativa de vida y en los gastos del sector salud de manera positiva.
Es importante recordar que el CCR solo presenta síntomas en las etapas avanzadas de la enfermedad. En general, el paciente acude a la consulta ante la presencia de datos de alarma (diagnóstico clínico usual). La magnitud de la hemorragia es variable y es una consecuencia del traumatismo del tejido neoplásico debido al paso de la materia fecal a través del colon; es decir, es un signo de alarma asociado con el crecimiento tumoral. Es en dicho problema donde reside la importancia de establecer programas de escrutinio para población general, en individuos asintomáticos y mayores de 50 años. Las pruebas utilizadas en programas de tamizaje, idealmente, deberían tener un bajo costo, buenas sensibilidad y especificidad, ser fáciles de aplicar, no invasivos y tener buena adherencia8-10.
Entre las pruebas utilizadas para el tamizaje de CCR en diferentes países se encuentran los estudios de sangre oculta en heces, la rectosigmoidoscopia flexible, la colonoscopia y la colonografía por tomografía computarizada. Sin embargo, solo los exámenes de sangre oculta en heces por prueba de guayaco y la sigmoidoscopia flexible han demostrado disminuir la incidencia y la mortalidad de este tipo de cáncer en estudios controlados y aleatorizados11-16.
Los estudios menos invasivos, de menor costo, y por lo tanto de mayor aceptación entre la población, son los de sangre oculta en heces. El avance más reciente para evaluar la sangre oculta en heces es la prueba inmunoquímica fecal (FIT, fecal immunochemical test). Su predecesora, la prueba de guayaco, se basa en la detección de peroxidasa en sangre, por lo que también puede reaccionar de manera inespecífica a la peroxidasa presente en alimentos como carnes rojas, frutas y algunos vegetales, y además puede dar falsos negativos si el paciente se encuentra consumiendo altas dosis de vitamina C, la cual bloquea la reacción de la peroxidasa. Por otra parte, la FIT se basa en una reacción antígeno-anticuerpo específica para detectar globina humana, y cuenta con la ventaja de ser más específica para el sangrado digestivo bajo, ya que la globina proveniente del tubo digestivo alto es degradada por enzimas digestivas antes de llegar al tracto inferior13.
Existen dos tipos de FIT: cualitativa y cuantitativa. La primera arroja un resultado positivo o negativo, mientras que la segunda indica la concentración de globina. La FIT cuantitativa es de elección para el tamizaje de poblaciones, ya que brinda la ventaja de seleccionar un punto de corte para positividad de la prueba dependiendo de las características del propio equipo (recomendaciones del proveedor) y del nivel de riesgo de la población que se está sometiendo a escrutinio, y por tanto se pueden seleccionar de manera más confiable aquellos pacientes que ameritan estudio de colonoscopia; es decir, permite al clínico seleccionar un balance entre sensibilidad y especificidad dependiendo de la población estudiada y de los recursos endoscópicos con los que se cuenta13-16.
Actualmente no existe una recomendación universal para el escrutinio del CCR, pero la mayoría de las guías y de los consensos recomiendan iniciarlo a partir de los 50 años en personas con riesgo bajo y a los 40 años en personas con riesgo elevado. En todo el mundo, el estudio más recomendado y utilizado es la colonoscopia; sin embargo, es importante destacar que esto es más frecuente en los países desarrollados, mientras que en los países en vías de desarrollo la recomendación más frecuente para el tamizaje es la identificación de sangre oculta en heces. En México, el programa para escrutinio del CCR basado en sangre oculta en heces va dirigido a personas con riesgo bajo, mayores de 50 años, y se recomienda realizar anualmente la prueba (de guayaco o inmunoquímica); en caso de que dicha prueba se encuentre alterada, se deberá realizar colonoscopia14-16.
El objetivo del presente estudio es reportar los hallazgos de un programa de escrutinio para CCR mediante FIT en población abierta en México, con el fin de determinar la prevalencia de lesiones tempranas asociadas a CCR.
Método
Se realizó un estudio transversal, prospectivo, descriptivo y multicéntrico, con la participación de los Estados de México, Veracruz, Chiapas, Yucatán y Puebla, iniciado en mayo de 2015 y finalizado en enero de 2016. Mediante convocatoria en centros de salud de diferentes niveles y a través de medios de difusión masiva, se invitó a la población abierta mayor de 50 años a participar en un programa de escrutinio para cáncer de colon. Se excluyó a los pacientes con antecedente personal de CCR, enfermedad inflamatoria intestinal, melena, hemorroides con hemorragia activa o datos de alarma, como pérdida de peso injustificada. Se recabaron los datos personales del paciente, se otorgó un número de identificación con el cual se rotuló el dispositivo para la toma de la muestra de heces, y se explicó el proceso para la recolección de la muestra en casa. Una vez recabada la muestra, fue almacenada en refrigeración para su posterior traslado a un centro de lectura en la Ciudad de México, donde se llevó a cabo el análisis de las muestras de manera centralizada. Se realizó una FIT cuantitativa específica para hemoglobina (Hb) humana, la cual se procesó mediante el método de prueba automatizado OC FIT-CHEK® (Polymedco-Endomedica S.A. de C.V.)17,18. El punto de corte se estableció en 100 ng/ml para considerar la prueba como positiva, de acuerdo con las recomendaciones del proveedor. Los pacientes con resultados positivos fueron contactados para realizarles una colonoscopia, la cual se realizó previo consentimiento informado y tras preparación intestinal.
En los casos en que durante la colonoscopia se identificaron pólipos, o con sospecha de malignidad, se recolectaron biopsias para su posterior análisis histopatológico.
El protocolo fue aprobado por el Comité de Ética Institucional y se siguió cumpliendo los derechos de los pacientes de acuerdo con la Declaración de Helsinki. No hubo ningún apoyo económico ni remuneración para los sujetos de estudio, quienes aceptaron participar de forma voluntaria.
Para el análisis se utilizó estadística descriptiva y para la comparación de variables entre grupos con distribución anormal se empleó la prueba U de Mann Withney. Se usó el paquete estadístico SPSS versión 11.00 y se estableció significancia estadística cuando p fue < 0.05.
Resultados
Se proyectó el uso de 1,000 FIT cuantitativas, de las cuales 900 (90%) fueron aplicadas y finalmente 751 (75%) fueron devueltas y procesadas (Fig. 1). De las pruebas procesadas, 51 resultaron positivas (≥ 100 ng/ml), es decir, el 6.8% (intervalo de confianza del 95%: 5.5-8.2), con variaciones según las regiones, desde el 4.2% en Yucatán hasta el 10.2% en Ciudad de México, dependiendo también de la cantidad de muestras totales proporcionadas por cada región (Fig. 2 y Tabla 1). El 59.5% del total de los sujetos incluidos (n = 447) fueron mujeres, y la media de edad fue de 57 años, con un promedio de índice de masa corporal de 27 kg/m2 (Tabla 2).
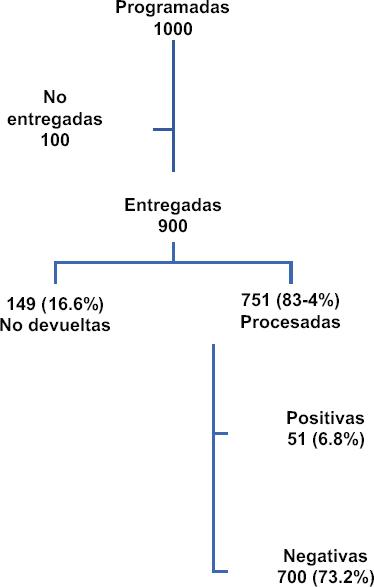
Figura 1 Proyección y procesamiento después de la aplicación de 1000 pruebas inmunoquímicas fecales cuantitativas para la detección de sangre oculta en heces.

Figura 2 Porcentaje de muestras aplicadas por cada Estado de la República. 1: Veracruz, Veracruz. 2: Ciudad de México. 3: Tuxtla Gutiérrez, Chiapas. 4: Mérida, Yucatán. 5: Puebla, Puebla.
Tabla 1 Pruebas inmunoquímicas de sangre oculta en heces (FIT) y colonoscopias realizadasM
| Estado | FIT realizadas n (%) | FIT positivas N (%) | Colonoscopias realizadas |
|---|---|---|---|
| Tuxtla Gutiérrez, Chiapas | 133 (18) | 12 (9) | 12 |
| Ciudad de México | 118 (16) | 12 (10.2) | 8 |
| Veracruz, Veracruz | 430 (57) | 25 (5.8) | 18 |
| Puebla, Puebla | 22 (3) | 0 (0) | 0 |
| Mérida, Yucatán | 48 (6) | 2 (4.2) | 2 |
| Total | 751 | 51 (6.8) | 40 (78.4%) |
Tabla 2 Características sociodemográficas de la muestra poblacional
| Veracruz, Veracruz | Tuxtla Gutiérrez, Chiapas | Ciudad de México | Mérida, Yucatán | Puebla, Puebla | Total | |
|---|---|---|---|---|---|---|
| N (%) | 430 (57%) | 133 (19%) | 118 (17%) | 48 (6%) | 22 (3%) | 751 (100%) |
| Edad, años (DE) | 59.9 (5.2) | 56.3 (4.4) | 57.9 (9.3) | 55.2 (5.5) | 56.1 (4.3) | 57.0 (5.7) |
| Hombres | 140 | 50 | 80 | 22 | 12 | 304 |
| Ratio hombre:mujer | 0.48 | 0.6 | 2.1 | 0.84 | 1.2 | 0.68 |
| Índice de masa corporal, kg/m2 | 28.2 | 27.0 | 26.4 | 27.2 | 26.3 | 27.0 |
DE: desviación estándar.
Se contactó a los 51 pacientes con resultado positivo y se logró el seguimiento de 40 (78.4%) de ellos por medio de colonoscopia. Del los 40 estudios endoscópicos realizados, en cinco (12.5%) no hubo hallazgo de lesiones colorrectales. Para el análisis se dividieron en dos grupos de acuerdo con el resultado de la colonoscopia: pacientes con hallazgo de lesiones no neoplásicas y pacientes con lesiones neoplásicas (pólipos sin y con potencial de malignidad, y cáncer ya establecido).
En 20 pacientes se encontraron únicamente hallazgos no neoplásicos, como proctitis (2), enfermedad hemorroidal (12), enfermedad diverticular (5), colitis ulcerosa crónica inespecífica (2), angiodisplasia (2) y colitis amebiana (2). En 15 pacientes hubo hallazgos neoplásicos, como pólipos sin atipias (2), pólipos hiperplásicos en el recto de 10 mm y 4 mm (1), adenomas tubulares < 5 mm sin displasia (4), adenomas tubulares con displasia leve (4), adenomas túbulo-vellosos con displasia leve (2), adenoma serrado (1) y adenocarcinoma invasor moderadamente diferenciado en el recto (1). En este último grupo de pacientes se reportaron también hallazgos no neoplásicos, como divertículos (2), pólipo hiperplásico (1), colitis ulcerosa crónica inespecífica (2) y fisura anal (1).
De las 751 pruebas procesadas, 51 (6.8%) resultaron positivas, pero solo en 40 de estos pacientes se llevó a cabo una colonoscopia, con hallazgo de lesiones premalignas en 11 de ellos, lo que corresponde al 1.4% del total de los sujetos incluidos en el estudio, y hubo un paciente con adenocarcinoma invasor (0.13%). Se calculó una tasa de 15.9 pacientes con lesiones neoplásicas con potencial de malignidad y cáncer por cada 1,000 sujetos evaluados, y de 1.3 pacientes con cáncer colorrectal por cada 1,000 sujetos evaluados, de acuerdo con la metodología de estudios previos.
Respecto a la comparación de la cuantificación de la Hb entre los grupos se reportó una diferencia estadísticamente significativa entre los pacientes con FIT positiva sin hallazgos de lesiones colorrectales por colonoscopia y aquellos con FIT positiva en los que sí hubo hallazgos por colonoscopia, tanto neoplásicos como no neoplásicos (p = 0.027, U de Mann-Whitney). De igual forma, al comparar las cifras de Hb en los pacientes sin hallazgos endoscópicos y en los pacientes con hallazgos únicamente neoplásicos se evidenció una significancia estadística aún mayor (p = 0.001, U de Mann-Whitney). Se demostró una diferencia significativa al comparar las cifras de Hb en los pacientes con hallazgos neoplásicos contra las de aquellos con hallazgos no neoplásicos (p = 0.014, U de Mann-Whitney) (Tablas 3 y 4).
Tabla 3 Promedio de hemoglobina en heces (ng/ml) en la prueba inmunoquímica de sangre oculta en heces (FIT)
| Cololonoscopias | FIT positivas | p | |||
|---|---|---|---|---|---|
| Total | Total | Sin lesiones colorrectales | Lesiones no neoplásicas | Lesiones neoplásicas | |
| N | 40 | 5 | 20 | 15 | |
| Porcentaje | 100 | 12.5 | 50 | 37.5 | |
| Hemoglobina (ng/ml) | 842 | 245 | 609.9 | 1350,2 | 0.014 |
| Desviación estándar | 916 | 213 | 604.9 | 1186.6 | |
Discusión
Actualmente existe suficiente evidencia en todo el mundo para afirmar que la FIT es más sensible y específica para la detección de lesiones neoplásicas colorrectales que la prueba de guayaco, y además favorece una mayor adherencia a los programas de escrutinio por su practicidad, costo-beneficio y no invasividad13. En este estudio, por primera vez en México demostramos que debería utilizarse esta prueba en población abierta en todo el país, ya que encontramos que el 6.8% de las pruebas son positivas y que el 1.4% y el 0.13% de nuestra población podrían tener lesiones premalignas o adenocarcinoma invasor, respectivamente.
En 1996 se llevó a cabo en Uruguay un estudio piloto realizando el primer escrutinio con FIT en población asintomática en América Latina, modelo en el cual nos basamos para el desarrollo del presente estudio19. Incluyeron de forma prospectiva 1,000 sujetos usuarios del servicio de salud pública de Uruguay, asintomáticos, mayores de 50 años y sin antecedentes personales ni familiares de CCR (riesgo promedio). El 80.5% de los participantes (805) completaron el estudio y, de ellos, el 14.6% (117) fueron positivos, por lo que se les indicó una colonoscopia, que se realizó en 70 pacientes. Se encontraron 75 lesiones colorrectales en 48 pacientes, correspondiendo más de la mitad a pólipos, 28 de ellos adenomas. Posteriormente, en el año 2006, el grupo de investigación uruguayo publicó los resultados de un programa nacional de escrutinio con una muestra de 60,405 sujetos20. La comparación de los resultados obtenidos en los diferentes estudios se muestra en la tabla 5.
Tabla 5 Comparación de resultados entre países según la literatura mundial
| Uruguay 199619 | Uruguay 200620 | Tailandia 201313 | México 2015 | |
|---|---|---|---|---|
| FIT | ||||
| Número total | 1000 | 60,405 | 127,301 | 900 |
| Procesadas | 805 (8.5%) | 56,262 (93.1%) | 80,012 (62.9%) | 751 (83.4%) |
| Positivas | 117 (14.6%) | 5299 (9.4%) | 873 (1.1%) | 51 (6.8%) |
| Colonoscopias | 70 | 3234 | 627 | 40 |
| Número de lesiones neoplásicas | 48 (68.5%) | 1266 (39.1%) | 188 (29.8%) | 15 (37.5%) |
| Número de casos de cáncer* | No reportado | 306 (9.4%) | 23 (3.7%) | 1 (2.5%) |
| Detección de neoplasia avanzada por cada 1000 casos* | No registrado | 14.6 | 28.7 | 1.3 |
FIT: prueba inmunoquímica de sangre oculta en heces.
*Porcentaje sobre el número de colonoscopias realizadas.
El porcentaje de pacientes con resultado positivo en la FIT y hallazgo endoscópico de lesión neoplásica fue del 37.5% en nuestro estudio, en contraste con el 35% publicado en 2015 en el primer escrutinio efectuado en México mediante colonoscopia como único método de cribado21. Sin embargo, en todo el mundo esta cifra varía ampliamente desde el 16% hasta el 43%, según los diferentes estudios. De igual forma, la tasa de detección de neoplasia avanzada por cada 1,000 sujetos evaluados oscila entre 1.1 y 2115,16,22; en el presente estudio fue de 1.3 por cada 1,000 sujetos.
Si bien el estudio de García-Osogobio, et al.21 fue el primero sobre un programa de tamizaje para CCR reportado en el país, cabe señalar que se realizó en un tercer nivel de atención en los empleados de un solo centro privado en la Ciudad de México y con una muestra pequeña (n = 123). Nuestro estudio representa el primer esfuerzo multicéntrico en diversas partes del país y dirigido realmente a población abierta, la cual representa el objetivo primario de los programas nacionales de escrutinio para cualquier neoplasia.
El punto de corte utilizado en nuestro estudio fue de 100 ng/ml, medida basada en la concentración de Hb en el líquido tampón, al igual que en el estudio realizado en Uruguay. Sin embargo, los consensos internacionales recomiendan la estandarización de la unidad de medida a microgramos por gramo (μg/g), es decir, la cantidad de Hb por cada gramo de heces22,23.
En diversos estudios realizados en todo el mundo se ha demostrado que el promedio de cuantificación de la Hb aumenta de acuerdo con el grado de malignidad de la lesión. Por ejemplo, Fenocchi, et al.24 reportaron los siguientes promedios de Hb según el tipo de lesión: para adenoma 320 ng/ml, para adenoma avanzado 608 ng/ml, para cáncer precoz 730 ng/ml y para cáncer avanzado 931 ng/ml. En nuestro estudio no fue posible identificar esta correlación, probablemente por el pequeño tamaño de la muestra total en comparación con otros estudios y la cantidad de lesiones halladas (solo un paciente con cáncer). Sin embargo, se demostró una diferencia estadísticamente significativa al comparar las cifras de Hb en los pacientes con hallazgos neoplásicos contra las de aquellos con hallazgos no neoplásicos (p = 0.014, U de Mann-Whitney).
La sensibilidad, la especificidad y los valores predictivos positivo y negativo de la FIT para la detección de CCR han sido reportados como el 100%, el 90%, el 16% y el 100%, respectivamente, y para todas las neoplasias como el 74%, el 93%, el 45% y el 98%, respectivamente. Una determinación fecal puede detectar el 100% de los CCR y el 74% de las neoplasias colorrectales significativas25. Por otra parte, unas tasas de positividad de la FIT de entre el 3% y el 5.9% son aceptables para realizar un escrutinio poblacional26,27. En Japón, 6 millones de personas (el 17% de la población elegible) han sido sometidas a la prueba27.
En los países desarrollados (Estados Unidos de América y Canadá, Australia, Nueva Zelanda y la mayoría de los países europeos), la incidencia y la mortalidad del CCR han disminuido o se han estabilizado desde la década de 1970 debido a la reducción de la exposición a los factores de riesgo, la detección y la prevención tempranas, y la mejora de los tratamientos, a diferencia de lo ocurrido en los países en transición hacia niveles más altos de desarrollo humano, como los de América Central y del Sur, y los de Europa del Este, donde el CCR ha aumentado3.
El CCR tiene una incidencia cercana al 5%, por lo cual es considerado como un verdadero problema de salud pública. Los programas de escrutinio son herramientas importantes para controlar la incidencia del CCR. Sin embargo, para ser efectivos deberían ir dirigidos a la población apropiada. El objetivo es la detección de lesiones precancerosas y de CCR incipiente en una población asintomática sin antecedentes de cáncer ni de lesiones precancerosas28,29.
La OMS ha implementado programas de escrutinio del CCR en las políticas poblacionales. El cáncer de mama y el CCR son los únicos con suficiente evidencia de la eficacia de su cribado para prevenir la ocurrencia o la progresión mediante un tratamiento adecuado28,29.
La tasa de detección de CCR puede fluctuar entre 0.37 y 0.45 dependiendo del punto de corte de la Hb (50-225 ng/ml), y se ha reportado que el número necesario de colonoscopias para detectar un caso de cáncer es de 11.7 con el punto de corte de 100 ng/ml30.
Si bien nuestro estudio representa un primer gran esfuerzo, es importante mencionar algunas de sus limitaciones. A pesar de ser un un estudio multicéntrico, puede observarse una gran heterogeneidad en la realización de FIT y de colonoscopias, y existen algunos sesgos de referencia y de selección. Por otro lado, es importante destacar que al realizar la colonoscopia también hay múltiples factores que pueden ser difíciles de controlar, como el tipo y la preparación de la colonoscopia, la técnica y la experiencia del endoscopista o de los centros, e incluso el tipo de equipo utilizado. Aun así, la importancia de nuestro estudio reside en que los hallazgos son similares a los reportados en otros lugares, y en los sitios donde más se capturaron pacientes, Ciudad de México, Chiapas y Veracruz, donde las cifras de positividad y la tasa de detección de lesiones premalignas fueron muy similares.
Conclusiones
En términos generales, los resultados de nuestro estudio concuerdan con lo reportado en la literatura mundial, apoyando así la iniciativa de fomentar el establecimiento de un tamizaje formal dentro del sector de salud pública. Se requiere un seguimiento y ampliar el tamaño de la muestra con el fin de evaluar el impacto sobre la incidencia y la mortalidad a largo plazo.











 text new page (beta)
text new page (beta)


