Introducción
El abordaje del cáncer rectal ha sufrido marcados cambios en las últimas décadas. Los avances en técnicas quirúrgicas menos agresivas y en el tratamiento neoadyuvante con quimiorradioterapia (QRT) han logrado un importante aumento de la supervivencia y una disminución de la morbilidad y de la recidiva local1-3. Para la correcta toma de decisiones resulta esencial un estadiaje previo por imagen lo más preciso posible, donde la resonancia magnética (RM) ha demostrado su valor4-6.
Hoy en día sigue habiendo puntos controvertidos acerca de la RM aplicada al cáncer rectal, como por ejemplo la utilidad de las secuencias potenciadas en difusión (DWI)7,8. Si bien existe acuerdo en que las secuencias T2 de alta resolución (HRT2w) son esenciales para su valoración, se ha planteado el valor potencial de la DWI para la evaluación post-QRT o la detección de respuesta completa9-13. Persiste cierto debate sobre su uso en el estadiaje primario o ganglionar14-16; un reciente artículo de consenso no recomienda la DWI en dichos casos, pero metaanálisis previos destacan la escasez y la heterogeneidad de la evidencia disponible5,11,17.
Existen muy pocos estudios sobre la influencia de la DWI en el estadiaje locorregional (TN), a pesar de su uso habitual en la práctica diaria y su relevancia clínica en la toma de decisiones18. Igualmente, hay pocos datos sobre su rendimiento en radiólogos menos experimentados, en quienes la DWI presentaría potencialmente mayor interés al facilitar la visualización y delimitación del tumor y la detección de ganglios perirrectales12,15,19,20.
El objetivo de nuestro estudio fue evaluar si añadir secuencias DWI mejora la eficacia diagnóstica de las secuencias HRT2w para diferenciar mediante RM estadios precoces (0-I) de estadios avanzados (II-IV) en el cáncer rectal, así como valorar si existen diferencias entre radiólogos expertos en RM rectal y otros menos expertos.
Método
Estudio retrospectivo transversal basado en RM de estadificación de cáncer rectal realizadas en nuestro centro. El estudio fue aprobado por el Comité Hospitalario de Ética en Investigación; dada su naturaleza retrospectiva, no se solicitó consentimiento informado.
Pacientes
Las RM se realizaron entre enero de 2011 y julio de 2016, y fueron incluidas consecutivamente hasta alcanzar una muestra final de 100 (Fig. 1). El estudio abarcó pacientes tanto con cirugía tras el estadiaje primario como con tratamiento neoadyuvante previo a la cirugía (post-QRT). Los criterios de inclusión fueron: a) cáncer de recto confirmado mediante colonoscopia y biopsia; b) RM rectal con una técnica correcta de acuerdo con el protocolo establecido, con todas las secuencias disponibles para revisión y sin artefactos significativos; c) RM de seguimiento post-QRT cuando se realizó tratamiento neoadyuvante; y d) escisión mesorrectal total o resección abdominoperineal tras la RM con pieza quirúrgica completa. En la estadificación primaria, el período máximo admitido hasta la cirugía fue de 9 semanas (media: 34.7 días). En los casos post-QRT, se incluyeron aquellos con cirugía entre 6 y 10 semanas después del final del tratamiento (media: 64.1 días). La RM de seguimiento post-QRT fue la considerada en el estudio cuando se realizó tratamiento neoadyuvante; se excluyeron los casos con un período de 5 semanas o menos entre el final de la QRT y la RM de seguimiento (media: 40.7 días).
La necesidad de QRT se valoró por el Comité Hospitalario de Tumores Colorrectales. En general, no se consideraron indicación de QRT los estadios IIA con infiltración superficial por imagen, sin factores de mal pronóstico. Los casos con tumores localizados en el tercio superior del recto o en la unión rectosigmoidea se evaluaron individualmente3. La pauta de neoadyuvancia consistió en 825 mg/m2 12 horas de capecitabina por vía oral, concomitante con un ciclo largo de radioterapia (50.4 Gy en 25 sesiones)21.
Para el análisis histopatológico, las muestras quirúrgicas se fijaron en formalina durante 24 horas. Se tomaron cortes representativos del área del tumor y de las posibles zonas de infiltración; todos los ganglios detectados se aislaron de la grasa perirrectal y se incluyeron por entero. Dos patólogos (con 7 y 10 años de experiencia en tumores colorrectales) establecieron el estadio anatomopatológico, que fue el estándar de referencia del estudio.
Protocolo de RM
Los estudios se realizaron en un equipo de RM de 1.5 T (Magnetom Avanto; Siemens) con bobina de superficie de 16 canales. A todos los pacientes se les administró previamente 50 ml de gel por vía rectal y 20 mg de bromuro de butilescopolamina por vía intramuscular. El protocolo de RM utilizado se muestra en la tabla 1.
Tabla 1 Parámetros técnicos del protocolo de resonancia magnética utilizado en el estudio
| T2w | HRT2w | DWI | |
|---|---|---|---|
| Plano | Axial, coronal, sagital | Axial, coronal, sagital | Axial |
| Referencia | Pelvis | Eje del tumor | Pelvis |
| TR/TE | 4700/95 ms | 4000/95 ms | 5000/70 ms |
| Grosor de corte | 6 mm | 3 mm | 5 mm |
| Matriz | 256 × 230 | 256 × 230 | 192 × 115 |
| FOV | 340 | 200 | 300 |
| Duración | 150 s | 135 s | 200 s |
DWI: secuencias potenciadas en difusión; FOV: field of view; HRT2w: secuencia T2 de alta resolución;TR/TE: tiempo de repetición/tiempo de eco; T2w: secuencia T2.
Evaluación de las imágenes
Las imágenes se valoraron en monitores de alta resolución con Picture Archiving and Communication System (PACS; General Electric). Cada caso fue evaluado por 10 radiólogos con diferentes grados de experiencia en la estadificación del cáncer de recto por RM: tres (ER) con experiencia previa de 6, 5 y 3 años (aproximadamente 40 casos/año); otros tres (NER) con 7, 4 y 2 años de experiencia en RM en áreas diferentes a la gastrointestinal; y cuatro residentes de radiología (RR) en sus últimos años de especialización, con conocimientos generales sobre RM abdominal. Al comienzo del estudio, los NER y los RR recibieron un entrenamiento básico (2 horas) por parte de un radiólogo experimentado, con revisión y discusión de varios ejemplos del mismo centro.
Todos ellos revisaron los casos de forma individual y ciega, salvo por el antecedente de biopsia positiva para neoplasia rectal. La revisión de cada caso se llevó a cabo en dos fases: la primera se basó en el análisis únicamente con secuencias HRT2w, y tras un período de lavado mínimo de un mes y aleatorización, la segunda fase consistió en una nueva valoración de cada caso, esta vez con secuencias tanto HRT2w como DWI.
La valoración del tumor principal con HRT2w se basó en la presencia o la persistencia de focos de engrosamiento o masas sólidas de intensidad intermedia en la pared rectal, considerando como signo de infiltración un margen borroso con lobulaciones o extensión hacia la grasa adyacente. La aparición de una marcada hipointensidad en la RM de seguimiento post-QRT se consideró indicativa de fibrosis. Con DWI, el criterio de sospecha de malignidad fue la presencia o la persistencia de una alta intensidad de señal en valores altos de b con hipointensidad en ADC. Para la determinación de afectación extramural se correlacionaron los hallazgos con su localización en HRT2w.
En la valoración de los ganglios regionales, los criterios de malignidad en HRT2w fueron morfológicos: presencia de heterogeneidad de señal intranodal, márgenes externos irregulares o forma redondeada22. Cada ganglio se valoró mediante una escala de confianza de 1 a 3 (1 = maligno; 2 = dudoso; 3 = benigno), con un recuento del número de ganglios por grado en cada paciente; la presencia de dos o más criterios se consideró sugestiva de malignidad, mientras que uno solo se clasificó como dudoso. En DWI se consideró como criterio de sospecha la presencia de hiperintensidad del ganglio en valores altos de b en comparación con la señal de fondo suprimida de la grasa mesorrectal, asociada a hipointensidad difusa o focal en ADC. Para la evaluación conjunta con HRT2w y DWI se aportaba un grado de sospecha en la escala basado en HRT2w y, en caso de existir sospecha en DWI, se bajó un grado la puntuación (por ejemplo, HRT2w dudoso + sospecha en DWI = maligno). El tamaño del ganglio no se incluyó, ya que durante el diseño y la recogida de datos no se habían publicado límites claros ni criterios mixtos9,23. Los ganglios laterales no se evaluaron, pues la técnica quirúrgica no siempre incluyó una linfadenectomía sistemática.
Basándose en estos datos, se determinó el estadio locorregional de ambas fases paciente a paciente, de acuerdo con las directrices del American Joint Committee on Cancer (AJCC)24. Para ello solo se consideraron los ganglios descritos como grado 1 (malignos) de la escala.
Análisis estadístico
Se realizó con los paquetes estadísticos IBM SPSS Statistics 24.0 (IBM Corp), Epidat 4.1 (SERGAS, Xunta de Galicia) y MedCalc 12.2.1 (Ostend). Los resultados se agruparon en las diferentes fases según el grado de experiencia, calculando los valores medios del grupo.
Los datos histológicos se dicotomizaron en estadios 0-I y estadios II-IV, con el objetivo de valorar el rendimiento en la detección de tumores localmente avanzados. La elección del punto de corte se hizo teniendo en cuenta los cambios terapéuticos que pueden derivar de este: en el estadiaje primario, la necesidad de QRT previa a la cirugía; en el control post-QRT, la variación de factores pronósticos y la posibilidad de técnicas quirúrgicas menos agresivas en caso de reducción de la extensión tumoral3.
La precisión diagnóstica se valoró mediante el cálculo del área bajo la curva (AUC) ROC (Receiver Operating Characteristic) para cada revisión y observador. Además, se determinaron la sensibilidad, la especificidad, el valor predictivo positivo (VPP), el valor predictivo negativo (VPN), las razón de verosimilitud positiva (RVP) y la razón de verosimilitud negativa (RVN). Su significación estadística se evaluó mediante la prueba exacta de Fisher (p < 0.05), y la significación de las diferencias entre valores con el método de DeLong (en curvas ROC) y el test de McNemar (resto de los parámetros). También se calcularon las tasas de sobreestadiaje e infraestadiaje, así como el acuerdo intragrupo entre múltiples observadores para las categorías dicotómicas definidas mediante el estadístico kappa de Fleiss; este se valoró según la escala propuesta por Landis y Koch (0.00-0.20: pobre; 0.21-0.40: ligera; 0.41-0.60: moderada; 0.61-0.80: considerable; 0.81-1.00: casi perfecta)25.
Resultados
La muestra incluyó 54 casos de estadificación primaria con cirugía posterior y 46 controles post-QRT previos a la cirugía. Los datos demográficos y anatomopatológicos se presentan en la tabla 2. La tabla 3 muestra los resultados de precisión, sensibilidad, especificidad, VPP, VPN, RVP y RVN; todos los resultados expuestos corresponden a la estadificación locorregional final (incluyendo T y N). Los valores fueron estadísticamente significativos (p < 0.05), salvo los correspondientes al AUC y la sensibilidad/especificidad post-QRT sin DWI por los NER, así como la sensibilidad/especificidad post-QRT por los RR tanto sin como con DWI. Al comparar las revisiones sin y con DWI, no se hallaron diferencias estadísticamente significativas.
Tabla 2 Datos demográficos y sobre el estadiaje histológico posquirúrgico de la muestra
| Datos demográficos | |||
|---|---|---|---|
| Edad media | 63 años (40-85) | ||
| Hombres (75) | 65.5 años (42-85) | ||
| Mujeres (25) | 61.4 años (40-82) | ||
| Tipo de estudio RM e histología | |||
| Estadiaje primario | 54 casos | ||
| – Adenocarcinoma | 50 | ||
| – Sin malignidad | 4 | ||
| – N.º ganglios (mediana) | 14 (5-46) | ||
| Estadiajeposneoadyuvancia | 46 casos | ||
| – Adenocarcinoma | 42 | ||
| – Sin malignidad | 4 | ||
| – N.º ganglios (mediana) | 12 (4-33) | ||
| Tipo de cirugía (exéresis del mesorrecto) | |||
| Abordaje anterior | 80 casos | ||
| Amputación abdominoperineal | 20 casos | ||
| Estadiaje histológico (pieza quirúrgica) | |||
| Estudio primario | Estudio posneoadyuvancia | ||
| Estadiaje local | |||
| 0 | 9 | 7 | |
| I | 15 | 12 | |
| IIA | 10 | 9 | |
| IIB | 1 | 1 | |
| IIIA | 5 | 7 | |
| IIIB | 9 | 10 | |
| IIIC | 5 | 0 | |
| Tumor (T) | |||
| T0 | 4 | 4 | |
| T1 - 2 | 25 | 24 | |
| T3 | 20 | 16 | |
| T4 | 5 | 2 | |
| Adenopatías positivas (N) | |||
| N0 | 35 | 28 | |
| N1 | 10 | 15 | |
| N2 | 9 | 3 | |
Tabla 3 Resultados del análisis estadístico
| AUC | Sensib. | Especif. | VPP | VPN | RVP | RVN | Kp | ||
|---|---|---|---|---|---|---|---|---|---|
| Estadiaje global | |||||||||
| ER | HRT2w | 0.735 | 87.1% | 50.4% | 69.9% | 74.7% | 1.75 | 0.25 | 0.49 |
| HRT2w + DWI | 0.675 | 83% | 48.1% | 67.9% | 68.1% | 1.6 | 0.35 | 0.54 | |
| NER | HRT2w | 0.653 | 82.7% | 40.5% | 63.5% | 65.2% | 1.39 | 0.42 | 0.55 |
| HRT2w + DWI | 0.693 | 84.2% | 45% | 65.7% | 69.4% | 1.53 | 0.35 | 0.48 | |
| RR | HRT2w | 0.637 | 79.8% | 37.2% | 62.7% | 58.1% | 1.27 | 0.54 | 0.44 |
| HRT2w + DWI | 0.623 | 82% | 32% | 61.5% | 57.2% | 1.2 | 0.56 | 0.48 | |
| Estadiaje primario | |||||||||
| ER | HRT2w | 0.769 | 86.7% | 58.3% | 72.2% | 77.7% | 2.08 | 0.22 | 0.5 |
| HRT2w + DWI | 0.701 | 80% | 56.9% | 69.9% | 69.4% | 1.85 | 0.35 | 0.54 | |
| NER | HRT2w | 0.703 | 76.3% | 56.3% | 67.4% | 66.6% | 1.74 | 0.42 | 0.6 |
| HRT2w + DWI | 0.725 | 80.3% | 56.3% | 68.5% | 70.5% | 1.83 | 0.35 | 0.53 | |
| RR | HRT2w | 0.67 | 79.2% | 45.8% | 64.6% | 63.7% | 1.46 | 0.45 | 0.46 |
| HRT2w + DWI | 0.633 | 77.5% | 39.6% | 61.5% | 58.4% | 1.28 | 0.56 | 0.49 | |
| Estadiaje post-QRT | |||||||||
| ER | HRT2w | 0.693 | 87.7% | 40.4% | 67.6% | 69.6% | 1.47 | 0.3 | 0.48 |
| HRT2w + DWI | 0.643 | 86.4% | 36.8% | 66% | 65.6% | 1.36 | 0.37 | 0.5 | |
| NER | HRT2w | 0.574* | 90.5%* | 19.1%* | 60% | 60% | 1.11 | 0.49 | 0.23 |
| HRT2w + DWI | 0.642 | 88.9% | 29.8% | 62.9% | 66.6% | 1.26 | 0.37 | 0.34 | |
| RR | HRT2w | 0.594 | 80.6%* | 26.3%* | 60.8% | 48.7% | 1.09 | 0.73 | 0.4 |
| HRT2w + DWI | 0.608 | 87%* | 22.4%* | 61.4% | 54.8% | 1.12 | 0.58 | 0.44 | |
*Resultados estadísticamente no significativos.
Precisión diagnóstica (AUC, área bajo la curva), sensibilidad, especificidad, valores predictivos positivo y negativo (VPP y VPN), razones de verosimilitud positiva y negativa (RVP y RVN) y acuerdo intragrupo entre varios observadores (Kp) para la muestra completa de RM (Est. global) y las subcategorías de estadiaje primario o posneoadyuvancia (post-QRT). Los resultados se agrupan de acuerdo con el grado de experiencia de los radiólogos, así como según el uso únicamente de secuencias T2 de alta resolución (HRT2w) o con difusión añadida (HRT2w + DWI) para la evaluación.
ER: radiólogos con experiencia previa en estadiaje de cáncer de recto; NER: radiólogos sin experiencia previa en estadiaje; RR: residentes de radiología.
Los ER mostraron una moderada disminución de la precisión con el uso de DWI tanto en el estadiaje primario como post-QRT (0.068 y 0.05, respectivamente). En el resto de los parámetros hubo mínimos cambios con tendencia al empeoramiento al agregar DWI, destacando la caída de un 8.3% del VPN y un 6.7% la sensibilidad en el estadiaje primario, con un 3.7% de aumento del infraestadiaje (Tabla 4).
Tabla 4 Tasas de sobreestadiaje e infraestadiaje
| Est. global | Est. primario | Est. post-QRT | |||||
|---|---|---|---|---|---|---|---|
| Sobreest. | Infraest. | Sobreest. | Infraest. | Sobreest. | Infraest. | ||
| ER | HRT2w | 21.3% | 7.3% | 18.5% | 7.4% | 24.6% | 7.2% |
| HRT2w + DWI | 22.3% | 9.6% | 19.1% | 11.1% | 26% | 8% | |
| NER | HRT2w | 26.4% | 9.6% | 20% | 12.8% | 34.5% | 5.4% |
| HRT2w + DWI | 24.4% | 8.8% | 20% | 10.7% | 30% | 6.3% | |
| RR | HRT2w | 27% | 11.5% | 24% | 11.5% | 30.4% | 11.4% |
| HRT2w + DWI | 29.2% | 10.2% | 26.8% | 12.5% | 32% | 7.6% | |
Tasas de sobreestadiaje e infraestadiaje (%) para la muestra completa de RM (Est. global) y las subcategorías de estadiaje primario o posneoadyuvancia (post-QRT). Los resultados se agrupan de la misma forma que en la tabla 3.
DWI: secuencias potenciadas en difusión; ER: radiólogos con experiencia previa en estadiaje de cáncer de recto; HRT2w: secuencias T2 de alta resolución; NER: radiólogos sin experiencia previa en estadiaje; RR: residentes de radiología
Por el contrario, los NER presentaron ligeras mejoras al añadir DWI, principalmente en el subgrupo post-QRT (aumento de 0.068 en precisión y 10.7% en especificidad; disminución de 0.12 en RVN y 4.5% en sobreestadiaje). Los RR mostraron peores resultados de AUC (0.037), especificidad (6.2%) y VPN (5.3%) en el estadiaje primario, sin otros cambios. Tampoco en el subgrupo post-QRT se produjeron grandes modificaciones, aunque destacó una mejora de la sensibilidad (6.4%), el VPN (6.1%) y la RVN (0.15), con disminución del infraestadiaje (3.8%).
Las concordancias entre observadores del mismo grupo fueron de ligeras a moderadas (kappa: 0.23 a 0.6) en todos los grupos, sin identificar cambios destacables al añadir DWI, salvo un aumento en la concordancia post-QRT de los NER.
Discusión
En nuestro estudio no se han encontrado diferencias significativas en la distinción entre estadios iniciales y avanzados al añadir DWI a la HRT2w, en ninguno de los grupos de radiólogos ni en los subgrupos de pacientes. Sin embargo, destacó cierta tendencia a la obtención de peores resultados al añadir DWI en los ER, principalmente en el estadiaje primario.
Aunque existen numerosos estudios respecto a la valoración por RM del grado de infiltración por el tumor principal (T) y la afectación ganglionar (N), hay poca información sobre la eficacia diagnóstica del estadiaje locorregional. Sin embargo, este es clínicamente relevante para la toma de decisiones y aporta un acercamiento más representativo de la práctica diaria18. Únicamente hemos hallado tres artículos publicados al respecto y solo uno evalúa los cambios secundarios a añadir DWI, si bien con diferencias metodológicas que dificultan la comparación.
En un estudio sobre los cambios de la neoplasia secundarios a QRT visualizados solo con HRT2w, Suppiah, et al.26 refieren una precisión para el estadio local del 43%. Basándose en los datos brutos aportados en su artículo, para la determinación de estadios localmente avanzados (II-IV) pueden calcularse una sensibilidad del 82.8%, una especificidad del 35.7%, un VPP del 76.3% y un VPN del 45.4%, próximos a los de nuestro estudio. Para la valoración post-QRT con HRT2w y DWI, van den Broek, et al.27 hallaron una precisión global del 28-47% (incluyendo todos los estadios).
La mayor parte de los estudios sobre RM en el cáncer rectal se han realizado en centros de alto nivel con radiólogos muy experimentados. Aunque esta sería la circunstancia más deseable, ello no refleja necesariamente los resultados de la práctica diaria, en general en centros más pequeños y con profesionales menos especializados10,18. Sin embargo, es en estos casos en los que la DWI presentaría potencialmente mayor interés, pues estudios previos demostraron que puede facilitar la visualización y la delimitación del tumor (Fig. 2), así como la detección de ganglios perirrectales, por lo que podría ser de gran ayuda para los radiólogos en proceso de aprendizaje12,15,19,20.
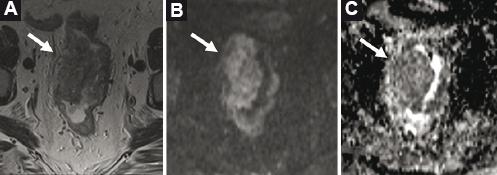
Figura 2 Ventaja de la difusión. Varón de 77 años con cáncer de recto alto, estadiaje primario. Secuencia axial TSE T2 de alta resolución. A: se observa una masa dependiente de la pared rectal (flecha) con prominencia hacia la luz; existen alteraciones de la grasa adyacente que en ocasiones podrían plantear dudas al diferenciar entre reacción desmoplásica e infiltración. B: la difusión muestra hiperintensidad de la masa con hipointensidad en ADC. C: compatibles con restricción, con pequeños tractos de similar comportamiento protruyendo hacia la grasa, lo que sugiere infiltración. En la pieza quirúrgica se confirmó un estadio IIA (T3N0).
En los grupos de radiólogos inexpertos de nuestro estudio, aunque la ausencia de significación limita las conclusiones, destaca cierta tendencia a una mejor valoración post-QRT al añadir DWI. Ello no es sorprendente, ya que las secuelas del tratamiento y los focos de persistencia tumoral pueden ser difíciles de valorar y diferenciar (Fig. 3)6,28,29. Se ha descrito que la DWI puede ayudar a detectar y delimitar el tumor viable post-QRT20,30,31. Es razonable pensar que dicho beneficio de la DWI se haga más evidente con menos experiencia12,15,19,20, por lo que su uso podría ser recomendable al comienzo de la curva de aprendizaje. Únicamente Sassen, et al.32 hacen referencia a la correlación de los resultados con un radiólogo sin experiencia previa en el estadiaje del cáncer rectal, pero solo referida a la determinación de la respuesta completa post-QRT, por lo que no es comparable con nuestros resultados. Este mostró peor AUC (0.74 a 0.7) y VPP (100% a 80%) al agregar DWI, pero mejor sensibilidad (20 a 40%).

Figura 3 Limitación de la difusión. Varón de 68 años con cáncer de recto medio y quimiorradioterapia neoadyuvante. Control por RM previo a la cirugía. Secuencia axial TSE T2 de alta resolución. A: se aprecia un engrosamiento mural (flechas) con moderada heterogeneidad interna que puede plantear dudas sobre la persistencia de tumor viable, sin signos de infiltración adyacente. B: imagen en difusión y ADC. C: no se observan focos sospechosos de restricción evidente, lo que podría interpretarse como resolución completa. La pieza quirúrgica demostró un estadio I (yT1N0), con focos milimétricos aislados de tumor, no detectables con la técnica disponible.
Nuestro estudio presenta varias limitaciones. En primer lugar, su carácter retrospectivo. Segundo, era posible cierto sesgo de aprendizaje, principalmente en los radiólogos menos experimentados, pero esto se evitó en la medida de lo posible al no aportar información sobre sus resultados a lo largo del estudio. Los sesgos de memoria se evitaron mediante aleatorización y separación entre lecturas. Tercero, los criterios de malignidad ganglionar en nuestro estudio siguen la recomendación de basarse solo en aspectos morfológicos8,9,33, sin aplicar las últimas recomendaciones de consenso publicadas coincidiendo con la fase final de adquisición de datos5. Sin embargo, en nuestra opinión, los resultados siguen siendo valiosos: a diferencia del tamaño (nuevo criterio añadido), los criterios morfológicos son subjetivos, por lo que es ahí donde la adición de DWI podría condicionar cambios más significativos30,31.











 nueva página del texto (beta)
nueva página del texto (beta)



