Introducción
El colangiocarcinoma es un tumor maligno originado en el epitelio de los conductos biliares. Es un tumor infrecuente, que representa alrededor de un 2% de los tumores malignos en el ser humano1, pero es la segunda neoplasia maligna más frecuente del hígado2.
De acuerdo con su ubicación, los colangiocarcinomas se han clasificado como intrahepáticos, hiliares (también conocidos como tumores de Klatskin) y distales. Los colangiocarcinomas hiliares (CH) son los más frecuentes y representan aproximadamente un 50-70% de todos los colangiocarcinomas3,4.
El único tratamiento curativo actualmente disponible es la cirugía con márgenes negativos3,5. En este grupo de pacientes, la mediana de sobrevida global varía entre 19 y 39 meses6. Sin embargo, la cirugía resectiva se asocia a una elevada morbimortalidad7. Sin tratamiento quirúrgico, su pronóstico suele ser malo, con una sobrevida promedio menor de 1 año8-10.
Los factores previamente reportados que determinan la sobrevida a largo plazo son el estadio T, el compromiso linfonodal, el margen quirúrgico positivo y la diferenciación tumoral6.
El objetivo del presente estudio es determinar la sobrevida a largo plazo y analizar los factores asociados a esta en los pacientes operados por CH con intención curativa.
Método
Pacientes
Estudio de cohorte no concurrente. Se incluyeron todos los pacientes sometidos a cirugía con intención curativa por CH en el Hospital Clínico de la Pontificia Universidad Católica de Chile entre enero de 2002 y diciembre de 2016. Los criterios de exclusión fueron: pacientes sin indicación quirúrgica y pacientes sometidos a cirugías no resectivas (laparotomía o laparoscopía exploradora) o paliativas.
Los criterios de irresecabilidad fueron: pacientes con enfermedad en etapa IV, enfermos con adenopatías metastásicas alejadas del pedículo hepático, pacientes con extensión intrahepática del tumor sin una zona segura para realizar la anastomosis biliodigestiva, pacientes en los cuales fuese factible realizar una cirugía con márgenes negativos pero que el futuro remanente hepático fuese insuficiente para tolerar la cirugía (pese a procedimientos como la embolización portal preoperatoria), tumores que comprometían la confluencia biliar y se extendían por los ductos biliares segmentarios de forma bilateral, tumores con extensión unilateral en la vía biliar intrahepática y compromiso vascular unilateral con atrofia del lóbulo contralateral.
Manejo preoperatorio y cirugía
En el preoperatorio se realizó el diagnóstico de CH en pacientes con un tumor de aspecto maligno en los estudios de imagen (tomografía computada, resonancia magnética y en algunos casos también tomografía por emisión de positrones) en el conducto hepático común próximo a la confluencia, en la confluencia de los conductos hepáticos o en la confluencia, y que afectara los conductos hepáticos izquierdo o derecho. No se realizó biopsia sistemática para certificar el diagnóstico de CH. El drenaje preoperatorio de la vía biliar se realizó según decisión del cirujano tratante, tras el análisis de cada caso en particular. En general, el drenaje se indicó en pacientes con bilirrubina > 10 mg/dl. No se realizó embolización portal preoperatoria en ningún paciente, dado que los futuros remanentes hepáticos fueron considerados suficientes. La ubicación del tumor se estratificó según la clasificación de Bismuth-Corlette11.
Se comenzó la cirugía mediante una laparotomía exploradora para descartar carcinomatosis peritoneal, metástasis y extensión de la enfermedad más allá del ligamento hepatoduodenal. Posteriormente se realizó la resección de la vía biliar asociada a una hepatectomía en la mayoría de los pacientes, linfadenectomía completa del ligamento hepatoduodenal y, en caso necesario, resección vascular más su respectiva reconstrucción. En algunos pacientes se realizó una maniobra de Pringle intermitente según decisión del cirujano.
Se realizó una biopsia intraoperatoria para descartar neoplasia en los márgenes de sección de la vía biliar. Cuando el margen fue positivo, se realizó una nueva resección hasta alcanzar márgenes microscópicos negativos (R0).
Registro, seguimiento y análisis estadístico
Se revisaron las fichas clínicas y los informes de anatomía patológica. Se diseñó una base de datos en el software Microsoft Excel para el registro de datos demográficos y clínicos, informes de anatomía patológica, morbimortalidad posoperatoria (definida hasta los 90 días posteriores a la cirugía) y sobrevida de los pacientes en el seguimiento.
Los resultados de la biopsia diferida se consignaron según la clasificación TNM (Union for International Cancer Control/American Joint Committee on Cancer, 7th edition). Las complicaciones posoperatorias se estratificaron según la clasificación de Clavien-Dindo12, considerando como mayores aquellas ≥ III. La insuficiencia hepática posoperatoria se definió como aquella de grado B o mayor según el International Study Group of Liver Surgery13.
Los pacientes fueron seguidos tras la cirugía de forma ambulatoria cada 3 meses durante los primeros 2 años con exploración física, exámenes de laboratorio (incluyendo pruebas hepáticas y marcador tumoral CA 19-9) y tomografía computada de tórax, abdomen y pelvis. Tras este periodo, los controles fueron cada 6 meses hasta los 5 años, para posteriormente realizar controles anuales.
Para la descripción de variables continuas se utilizaron los estadígrafos mediana y rango. La descripción de las variables cualitativas se realizó mediante frecuencias absolutas y porcentajes. Se realizó un análisis univariable de los factores asociados a la sobrevida mediante el método de Kaplan Meier, comparando entre los grupos mediante test de log-rank. Aquellos factores que en el análisis univariable presentaron un valor de p < 0.05 fueron ingresados a un análisis multivariable mediante regresión de Cox para modelar los riesgos que afectaban la supervivencia de la población en estudio. Se utilizó el programa SPSS 22.0 (SPSS Inc., Chicago, IL, EE.UU.) para el análisis estadístico, considerando significativo un valor de p < 0.05.
Resultados
Durante el periodo en estudio se operaron 30 pacientes por CH con intención curativa. La mediana de edad fue de 65.5 años (rango: 33-84); 24 (80%) pacientes fueron de sexo masculino. Las restantes variables demográficas se detallan en la tabla 1.
Tabla 1 Variables demográficas y clínicas de los pacientes en estudio
| Variables | N = 30 |
|---|---|
| Sexo | |
| - Masculino | 24 (80%) |
| - Femenino | 6 (20%) |
| Edad | 65.5 (33-84) |
| Colangitis preoperatoria | 5 (16.7%) |
| CA 19-9 (U/ml) | 240 (1.4-1580) |
| Bilirrubina preoperatoria (mg/dl) | 5.9 (0.7-24.6) |
| Drenaje preoperatorio de la vía biliar | 10 (33.3%) |
| - Mediante colangiopancreatografía retrógrada endoscópica | 4 (13.3%) |
| - Mediante punción transparietohepática | 6 (20%) |
De acuerdo con la clasificación de Bismuth-Colette, los CH más frecuentes fueron los de tipo III B, en 12 pacientes (40%), seguidos por los de tipo III A, en 8 enfermos (26,7%), como se detalla en la tabla 2. La cirugía más frecuentemente realizada fue la hepatectomía izquierda más resección de la vía biliar, en 13 casos (43.3%); fue necesario realizar una resección vascular en 5 (16.7%) pacientes.
Tabla 2 Variables quirúrgicas
| Variables | N = 30 |
|---|---|
| Clasificación de Bismuth-Corlette | |
| - II | 4 (13.3%) |
| - IIIA | 8 (26.7%) |
| - IIIB | 12 (40%) |
| - IV | 6 (20%) |
| Cirugía efectuada | |
| - Hepatectomía izquierda más resección de vía biliar | 13 (43.3%) |
| - Hepatectomía derecha extendida más resección de vía biliar | 7 (23.3%) |
| - Hepatectomía derecha más resección de vía biliar | 4 (13.3%) |
| - Hepatectomía izquierda extendida más resección de vía biliar | 3 (10%) |
| - Resección de vía biliar aislada | 3 (10%) |
| Resección vascular | 5 (16.7%) |
| - Resección de vena porta | 4 (13.3%) |
| - Resección parcial de vena cava inferior | 1 (3.3%) |
| Reconstrucción portal | |
| - Puente venoso | 2 (6.6%) |
| - Prótesis vascular de politetrafluoroetileno | 2 (6.6%) |
| Tiempo operatorio (minutos) | 360 (240-720) |
| Sangrado intraoperatorio estimado (ml) | 1500 (120-2000) |
| Glóbulos rojos transfundidos (unidades) | 2 (0-8) |
| Maniobra de Pringle | 8 (26.7%) |
| Tiempo total de maniobra de Pringle (minutos) | 45 (20-90) |
El margen quirúrgico resultó negativo en 27 (90%) pacientes. Seis (20%) pacientes presentaron compromiso ganglionar en la biopsia operatoria. El estadio TNM más frecuente fue el II, en 20 enfermos (66.7%), como se especifica en la tabla 3.
Tabla 3 Variables histopatológicas
| Variables | N = 30 |
|---|---|
| Diámetro tumoral máximo (cm) | 3 (1.2-6) |
| Diferenciación | |
| - Bien diferenciado | 18 (60%) |
| - Moderadamente diferenciado | 8 (26.7%) |
| - Mal diferenciado | 4 (13.3%) |
| Infiltración linfovascular | 15 (50%) |
| Infiltración perineural | 3 (10%) |
| Margen quirúrgico | |
| - Negativo | 27 (90%) |
| - Positivo | 3 (10%) |
| Estadio T* | |
| - T2a | 15 (50%) |
| - T2b | 8 (26.7%) |
| - T3 | 5 (16.7%) |
| - T4 | 2 6.7%) |
| Estadio N* | |
| - N0 | 24 (80%) |
| - N1 | 6 (20%) |
| M0* | 30 (100%) |
| Estadio TNM* | |
| - II | 20 (66.7%) |
| - III | 8 (26.7%) |
| - IV | 2 (6.7%) |
*Clasificado de acuerdo con la Union for International Cancer Control/American Joint Committee on Cancer, 7th edition.
Dos (6.6%) pacientes presentaron lesiones vasculares en el intraoperatorio. Uno de ellos tuvo una lesión de la vena cava inferior y el otro una lesión de la vena suprahepática izquierda. En ambos casos, las lesiones se repararon mediante sutura, logrando una adecuada hemostasia. No se presentaron complicaciones posteriores relacionadas con estas lesiones.
Veintiún (70%) pacientes presentaron complicaciones en el posoperatorio; la más frecuente fue la colección intraabdominal, en 7 (23.3%) pacientes, como se detalla en la tabla 4. Las complicaciones clasificadas como Clavien-Dindo ≥ III se presentaron en 10 (33.3%) pacientes. Ocho (26.7%) pacientes requirieron reoperación. Fallecieron 3 (10%) pacientes en el periodo posoperatorio: dos debido a una trombosis portal y el otro por un shock séptico secundario a una colección intraabdominal.
Tabla 4 Morbimortalidad posoperatoria
| Variables | N = 30 |
|---|---|
| Complicaciones posoperatorias | 21 (70%) |
| - Colección intraabdominal | 7 (23.3%) |
| - Fístula biliar externa | 6 (20%) |
| - Trombosis portal | 4 (13.3%) |
| - Insuficiencia hepática | 3 (10%) |
| - Hemoperitoneo | 2 (6.7%) |
| - Biliperitoneo | 1 (3.3%) |
| - Colangitis | 1 (3.3%) |
| - Hemorragia digestiva baja | 1 (3.3%) |
| - Hepatitis isquémica | 1 (3.3%) |
| Clasificación de Clavien-Dindo | |
| - I | 2 (6.7%) |
| - II | 9 (30%) |
| - IIIa | 2 (6.7%) |
| - IIIb | 4 (13.3%) |
| - IVa | 1 (3.3%) |
| - V | 3 (10%) |
| Reoperación | 8 (26.7%) |
| Trombectomía portal | 2 (6.7%) |
| Drenaje percutáneo guiado por tomografía computada | 2 (6.7%) |
| Estadía posoperatoria (días) | 13.5 (5-60) |
| Mortalidad operatoria | 3 (10%) |
| Reingreso hospitalario | 6 (20%) |
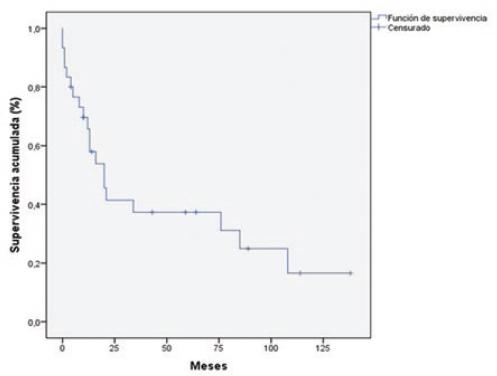
Se realizó quimioterapia y radioterapia adyuvante en 7 (23.3%) y 5 (16.7%) pacientes, respectivamente. Las sobrevidas al año, a los 5 años y a los 10 años fueron del 65.7%, el 37.3% y el 16.6%, respectivamente (Fig. 1). Once (36.7%) pacientes presentaron recidiva en el seguimiento, con una mediana de tiempo de 15 meses (rango: 3-48) desde la cirugía original. De estos pacientes, 5 (45.5%) presentaron recidiva en el hígado, 5 (45.5%) en la vía biliar y 1 (9%) en el pulmón.
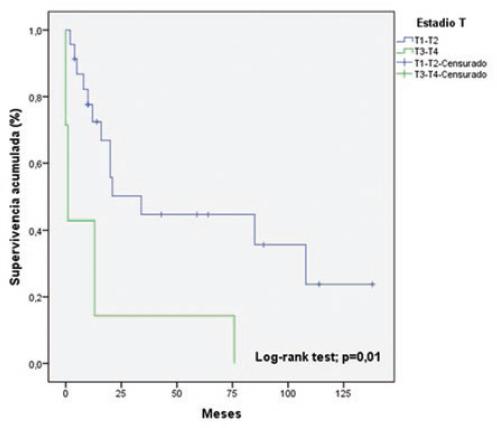
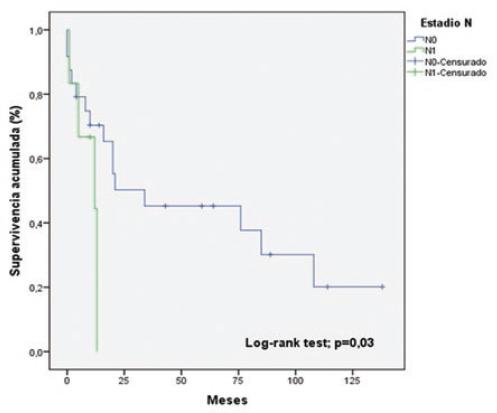
La tabla 5 muestra el análisis univariable de los factores asociados a la sobrevida. Las variables que resultaron estadísticamente significativas fueron los estadios T (p = 0.01) (Fig. 2) y N (p = 0.03) (Fig. 3). En la regresión de Cox (Tabla 6), la única variable asociada a la sobrevida fue el estadio T (hazard ratio: 0.309; intervalo de confianza del 95%: 0.101-0.942; p = 0.03).
Tabla 5 Análisis univariable de factores asociados a la sobrevida
| Variable | Categoría | N = 30 | Sobrevida (meses) | p |
|---|---|---|---|---|
| Edad | < 65 años | 13 (43.3%) | 59.1 ± 17.4 | 0.87 |
| ≥ 65 años | 17 (56.7%) | 45.8 ± 12.8 | ||
| Sexo | Masculino | 24 (80%) | 50.8 ± 11.2 | 0.97 |
| Femenino | 6 (20%) | 54.8 ± 24.1 | ||
| Colangitis preoperatoria | Sí | 5 (16.7%) | 20.4 ± 9.1 | 0.34 |
| No | 25 (83.3%) | 62.3 ± 13 | ||
| CA 19-9 | < 240 U/ml | 14 (46.7%) | 55.8 ± 16.6 | 0.94 |
| ≥ 240 U/ml | 16 (53.3%) | 48.5 ± 13.4 | ||
| Bilirrubina preoperatoria | < 2 mg/dl | 9 (30%) | 93.5 ± 20.8 | 0.08 |
| ≥ 2 mg/dl | 21 (70%) | 36.8 ± 10.7 | ||
| Drenaje preoperatorio de vía biliar | Sí | 10 (33.3%) | 25.7 ± 10.7 | 0.26 |
| No | 20 (66.7%) | 65.7 ± 14.3 | ||
| Bismuth-Corlette | I-II | 4 (13.3%) | 58.3 ± 12.8 | 0.77 |
| III-IV | 26 (86.7%) | 42.5 ± 21 | ||
| Resección vascular | No | 25 (83.3%) | 64.1 ± 13.4 | 0.16 |
| Sí | 5 (16.7%) | 13.8 ± 7 | ||
| Tiempo operatorio | < 360 min | 17 (56.7%) | 66.3 ± 16.6 | 0.19 |
| ≥ 360 min | 13 (43.3%) | 39.3 ± 13.9 | ||
| Transfusiones de glóbulos rojos | No | 19 (63.3%) | 81.1 ± 18.9 | 0.13 |
| Sí | 11 (36.7%) | 29.2 ± 8.9 | ||
| Maniobra de Pringle | Sí | 8 (26.7%) | 45.8 ± 18.7 | 0.56 |
| No | 22 (73.3%) | 58.4 ± 14.1 | ||
| Diámetro tumoral | < 3 cm | 14 (46.7%) | 72 ± 14.8 | 0.09 |
| ≥ 3 cm | 16 (53.3%) | 39.1 ± 13.6 | ||
| Diferenciación | Bien diferenciado | 18 (60%) | 65.3 ± 15.1 | 0.42 |
| Moderadamente y mal diferenciado | 12 (40%) | 28.8 ± 11 | ||
| Infiltración linfovascular | No | 15 (50%) | 72.6 ± 17.2 | 0.17 |
| Sí | 15 (50%) | 37.8 ± 12.2 | ||
| Infiltración perineural | No | 3 (10%) | 51.3 ± 20.1 | 0.42 |
| Sí | 27 (90%) | 53.7 ± 12.5 | ||
| Márgenes | Negativos | 27 (90%) | 61.6 ± 12.6 | 0.33 |
| Positivos | 3 (10%) | 10.6 ± 1.5 | ||
| Estadio T* | T1-T2 | 23 (76.7%) | 69.3 ± 14 | 0.01 |
| T3-T4 | 7 (23.3%) | 14.8 ± 9.6 | ||
| Estadio N* | N0 | 24 (80%) | 69 ± 13.6 | 0.03 |
| N1 | 6 (20%) | 9.4 ± 2.1 | ||
| Quimioterapia adyuvante | Sí | 7 (23.3%) | 56.1 ± 19 | 0.63 |
| No | 23 (76.7%) | 56.3 ± 14 | ||
| Radioterapia adyuvante | Sí | 5 (16.7%) | 51.6 ± 22.8 | 0.95 |
| No | 25 (83.3%) | 58 ± 13.3 |
*Clasificado de acuerdo con la Union for International Cancer Control/American Joint Committee on Cancer, 7th edition.
Tabla 6 Análisis multivariable de factores asociados a la sobrevida
| Variable | Categoría | Hazard ratio | Intervalo de confianza del 95% | p |
|---|---|---|---|---|
| Estadio T* | T1-T2 T3-T4 | 0.309 | 0.101-0.942 | 0.03 |
| Estadio N* | N0 N1 | 0.591 | 0.159-2.199 | 0.43 |
*Clasificado de acuerdo con la Union for International Cancer Control/American Joint Committee on Cancer, 7th edition.
Discusión
En el presente estudio, la sobrevida a largo plazo es similar a la reportada en series previas con mayor tamaño muestral4,14,15. En el análisis multivariable, el único factor asociado a la sobrevida fue el estadio T.
Las características clínicas y demográficas de los pacientes analizados son similares a las reportadas en estudios previos6,16. El drenaje preoperatorio de la vía biliar se realizó según decisión de cada cirujano tratante, y se utilizó en un 33.3% de los pacientes, lo cual difiere de otras series, en las que generalmente se realiza en la mayoría de los enfermos6,7,16. La utilidad real del drenaje preoperatorio de la vía biliar es aún materia de debate. La ictericia obstructiva se asocia a colangitis, disfunción renal y hepática17,18, pero el drenaje preoperatorio se asocia a colangitis, mayor estadía hospitalaria y, en casos excepcionales, metástasis en el trayecto del drenaje transparietohepático19,20. Un metaanálisis no demostró mayor beneficio con el drenaje preoperatorio de la vía biliar en pacientes con CH21. Una indicación absoluta del drenaje preoperatorio de la vía biliar es previo a la realización de una embolización portal, debido a que la ictericia reduce la hipertrofia hepática que se desea obtener21. En el presente estudio no se realizó embolización portal antes de la cirugía en ningún paciente, debido a que los futuros remanentes hepáticos se consideraron suficientes en los estudios de imagen preoperatorios.
La mayoría de los pacientes (86.7%) presentaban un CH clasificado como III o IV según la clasificación de Bismuth-Corlette11, por lo cual requirieron cirugías que combinaban resección de la vía biliar más hepatectomía. En solo 3 (10%) pacientes se realizó una resección aislada de la vía biliar; de ellos, dos pacientes resultaron con márgenes quirúrgicos negativos. Existe evidencia de que la hepatectomía asociada a la resección de la vía biliar, independientemente del estadio, permite una mayor tasa de cirugía R0 que la resección aislada de la vía biliar22-26.
En cuanto a la resección vascular, la mayoría de los estudios señalan que no se asocia a una disminución significativa de la sobrevida a largo plazo27-30. En el presente estudio, solo cinco pacientes requirieron una resección vascular, lo cual no modificó su posterior sobrevida.
Veintisiete (90%) pacientes resultaron con márgenes quirúrgicos negativos, lo que supone un porcentaje mayor que los reportados en estudios previos6,7,14-16. Esto podría deberse a la rigurosa selección de los pacientes en los estudios de imagen preoperatorios y a la continua evaluación de los enfermos en comités oncológicos multidisciplinarios.
Se presentaron complicaciones en 21 (70%) pacientes; aquellas calificadas como mayores ocurrieron en 10 (33.3%), lo cual es comparable con lo reportado en estudios previos, en los que la morbilidad posoperatoria varía entre el 14% y el 72%29,31-33. La mortalidad operatoria se presentó en 3 (10%) pacientes, lo cual se encuentra dentro del rango de otras publicaciones, en las que va del 0% al 15%34-37.
Cabe destacar que, a diferencia de otros estudios, no se encontró asociación entre la sobrevida y los márgenes negativos, la diferenciación tumoral y la invasión perineural. Esto podría deberse a la cantidad relativamente baja de pacientes en estudio, lo cual aumenta la probabilidad de presentar un error de tipo II en la metodología de la presente investigación.
Las limitaciones de este estudio son su carácter observacional, unicéntrico y retrospectivo, y el ya mencionado pequeño tamaño muestral si se compara con otras series publicadas previamente7,16,38.
Conclusiones
Los pacientes operados por CH con intención curativa en nuestro centro presentan una adecuada sobrevida a largo plazo, con una elevada morbimortalidad asociada, pero que es comparable a la de estudios previos. En el análisis multivariable, el único factor que se asoció a la sobrevida fue el estadio T.
La cirugía de los CH requiere habitualmente grandes resecciones hepáticas, incluido el segmento caudado, junto con la totalidad de la vía biliar afectada y la posterior reconstrucción; es decir, es una cirugía de alta demanda técnica que se realiza en pacientes que a veces no se encuentran en un adecuado estado nutricional y general, por ictericia e infecciones asociadas. Esto explica las altas tasas de morbimortalidad en este trabajo y en la literatura internacional. Por ello, debe ser realizada por cirujanos de experiencia y en centros con recursos adecuados.











 nueva página del texto (beta)
nueva página del texto (beta)