Introducción
Los tumores periampulares son procesos neoplásicos originados de la cabeza del páncreas, el duodeno, el conducto biliar común distal o el ámpula de Vater. Los tumores ampulares primarios (TAp) son concretamente del complejo ampular1,2. Es importante distinguir los TAp del resto de los tumores periampulares por su mejor pronóstico y por ser frecuentemente localizados y detectados en estadios tempranos3.
Los TAp pueden ser benignos o malignos. Los adenomas vellosos y tubulovellosos benignos son los más frecuentes, aunque son considerados lesiones premalignas4. Por otro lado, el adenocarcinoma es el tipo histológico maligno más frecuente y sus variedades, por orden de frecuencia, son intestinal, pancreatobiliar, adenocarcinoma poco diferenciado, mucinoso-intestinal y papilar invasivo5-8.
Estos tumores son relativamente raros, con una incidencia estimada en 3-4 casos por millón5-7. Conforman el 7% de todos los tumores periampulares y el 0.2% de los tumores del tracto gastrointestinal9. Son más frecuentes en los hombres, con una relación de ≈ 2:1, y la edad promedio de los pacientes en el momento del diagnóstico es de 65 años7,10-14.
Para la evaluación diagnóstica de los carcinomas ampulares se utilizan instrumentos endoscópicos, radiológicos e histopatológicos2. Sin embargo, aunque la colangiopancreatografía retrógrada endoscópica (CPRE) es un estudio útil para el diagnóstico de los tumores ampulares, no permite realizar una adecuada estadificación2,12.
El análisis histopatológico (HP) de la pieza quirúrgica se ha considerado como método de referencia para el estadiaje locorregional de los TAp10,11,13,15-17. Actualmente, diversos estudios han valorado la utilidad del ultrasonido endoscópico (USE), el ultrasonido intraductal (USID), la tomografía computarizada y la resonancia magnética para este objetivo. Al momento, el USE y el USID se han considerado los mejores estudios para ese fin10,13,16,18.
Independientemente del estadio, la pancreatoduodenectomía es el tratamiento de elección en lesiones malignas invasivas del ámpula de Vater, pues la resección quirúrgica con márgenes negativos es el único tratamiento potencialmente curativo3,19-21. Por otro lado, para los adenomas ampulares, la escisión endoscópica o ampulectomía endoscópica ha surgido como un método curativo con buenos resultados22. Debido a su carácter poco invasivo, algunos autores ahora han propuesto esta técnica como alternativa para el tratamiento de tumores malignos, sobre todo si se cumplen algunas condiciones, como estadio Tis o T1, tamaño menor de 2 cm y grado histológico bien diferenciado23,24. Sin embargo, el tratamiento de estos tumores es aun controversial debido a la dificultad de una estadificación preoperatoria correcta mediante imagen o endoscopía.
Aunque existen estudios en otras partes del mundo que han analizado el desempeño del USE en el estadiaje locorreginonal de los TAp, en México no se ha reportado información al respecto. Los resultados descritos varían notablemente y existe limitada consistencia. Además, al ser el USE un instrumento dependiente del operador, es necesario contar con evidencia que justifique las actitudes terapéuticas de un centro de salud. Dicha evidencia no existe en nuestro hospital ni en ningún otro centro hospitalario del país.
El objetivo de este estudio fue evaluar el desempeño del USE en la estadificación locorregional de los TAp utilizando como referencia el análisis HP posquirúrgico. A nuestro conocimiento, es el primer estudio en México que evalúa el desempeño de esta prueba para la estadificación de dichos tumores tomando como referencia el estudio HP posquirúrgico.
Método
Estudio retrospectivo de casos evaluados prolectivamente. Los pacientes incluidos fueron aquellos con sospecha de TAp por estudios previos de CPRE o USE, y enviados para estadifiación por USE, y posible resección quirúrgica del tumor por pancreatoduodenectomía. Los pacientes fueron reclutados del 1 de enero de 2012 al 31 de mayo de 2018. Todos fueron atendidos en el Servicio de Ultrasonido Endoscópico del Hospital de Especialidades del Centro Médico Nacional Siglo XXI. Se excluyeron los pacientes con cirugías abdominales previas que alteraran la visualización por USE o si estaban recibiendo terapia paliativa por enfermedad metastásica. Con el objetivo de tener mayor consistencia en las evaluaciones ultrasonográfica, todos los USE fueron realizados por un solo operador. Así mismo, cuando se realizó una pancreatoduodenectomía, esta fue ejecutada en nuestra unidad por el mismo cirujano. El tiempo entre el USE y la resección quirúrgica tuvo una mediana de 7 días. En todos los pacientes incluidos se obtuvo información sobre su edad y sexo, así como la historia clínica y los estudios de laboratorio previos.
Ultrasonido endoscópico
Para este estudio se utilizaron equipos de USE radial (Fujinon EO-53OUT2) y lineal (Fujinon EG-58OUR), uno u otro dependiendo de la necesidad de toma de biopsia durante el procedimiento. Todos los análisis se realizaron por medio de un abordaje por vía transduodenal y transgástrica. Con el estudio de USE se obtuvo evidencia de la presencia de prótesis biliar, el tamaño tumoral en su diámetro mayor (milímetros) y la condición de invasión del tumor a estructuras vecinas (duodenal, pancreática y ductal). Para la estadificación tumoral se utilizó el sistema TNM25. Se consideró la afección exclusivamente ampular cuando la lesión tumoral, identificada en el USE como una masa hipoecoica, crecía hacia la luz y afectaba hasta la submucosa duodenal. La invasión a la pared duodenal se consideró cuando la lesión lograba traspasar la muscular propia de la pared duodenal, donde puede afectar la porción ductal intraampular. La invasión pancreática se consideró cuando la lesión sobrepasaba la pared duodenal y contactaba la glándula pancreática. Para la estadificación con el sistema TNM se definió T1 como una masa hipoecoica con extensión intraampular y hasta la submucosa duodenal; T2 cuando la masa hipoecoica intraampular alcanzaba a contactar la muscular propia duodenal sin sobrepasarla; T3 si existían imágenes compatibles con invasión tumoral a páncreas, colédoco, tejido periduodenal o peripancreático, siempre sobrepasando la muscular propia duodenal; y T4 cuando hubo invasión al eje celiaco, la arteria mesentérica superior o la arteria hepática común. Para el estadio N, se consideró N0 en ausencia de imágenes compatibles con invasión a nódulos regionales; N1 con involucro de uno a tres nódulos regionales; y N2 con cuatro o más nódulos regionales involucrados.
Análisis histopatológico
El análisis HP se llevó a cabo en las piezas quirúrgicas (pancreatoduodenectomías). Se colocaron en bloques de parafina cortes seriados de las estructuras, y se utilizó tinción de hematoxilina y eosina para el análisis al microscopio.
Se recopilaron los siguientes datos: tipo y grado de diferenciación tumoral, tamaño tumoral macroscópico de su diámetro mayor en milímetros, invasión a estructuras vecinas (duodenal, pancreática y ductal) y estadio (T y N).
Análisis estadístico
Se utilizaron la prueba de ji al cuadrado de McNemar (variables dicotómicas), la prueba eta (variable nominal con ordinal) y la prueba t de Student pareada para observar las diferencias en variables continuas y discretas, respectivamente. Así mismo, se determinó el grado de correlación entre la medición del tamaño del tumor por USE y la obtenida de la pieza quirúrgica por medio de correlación de Pearson. La estimación del desempeño del USE se calculó con la exactitud por medio de la concordancia observada en los parámetros de invasión duodenal, pancreática o ductal y estadio (T y N); se utilizó el estimador kappa para el estadio (T y N). Todos los análisis se realizaron con el paquete estadístico SPSS versión 20 y se utilizó un nivel de significancia estadística de p < 0.05.
Aspectos éticos
Los procedimientos se realizaron bajo el consentimiento informado firmado de los pacientes como parte de la atención otorgada y de acuerdo con los lineamientos del hospital.
Resultados
Durante el periodo de enero de 2012 a mayo de 2018 se estadificaron por USE 68 pacientes con TAp. Un gran porcentaje regresó a su ciudad de origen para el manejo médico o quirúrgico (n = 47) y otros presentaron enfermedad avanzada con criterios de irresecabilidad (n = 7). Solo 14 pacientes fueron sometidos a pancreatoduodenectomía y estadificación tumoral por HP en este hospital, y son los analizados en este estudio (Fig. 1). La edad promedio de los pacientes fue de 63 años y hubo mayor proporción del sexo femenino (70%). El tipo histológico más común consistió en el adenocarcinoma intestinal bien diferenciado (35.5%). La mayoría de los estudios endoscópicos se realizaron con ultrasonido lineal (70%). El 43% de los pacientes portaban prótesis biliar colocada previamente al USE para el manejo de la ictericia obstructiva (Tabla 1).
Tabla 1 Características basales de los pacientes y de los tumores
| Variable | N = 14 |
|---|---|
| Edad en años (± desviación estándar) | 63 (± 12) |
| Sexo | |
| Femenino | 10 (71.4%) |
| Masculino | 4 (28.6%) |
| Tipo de USE | |
| Lineal | 10 (71.4%) |
| Radial | 4 (28.6%) |
| Prótesis biliar | |
| Sí | 6 (42.9%) |
| No | 8 (57.1%) |
| Tipo histológico | |
| Adenocarcinoma intestinal | 5 (35.7%) |
| Adenocarcinoma pancreatobiliar | 3 (21.4%) |
| Adenocarcinoma papilar invasivo | 2 (14.3%) |
| Adenocarcinoma no especificado | 4 (28.6%) |
| Diferenciación tumoral | 9 (64.3%) |
| Bien diferenciado | 5 (35.7%) |
| Moderadamente diferenciado |
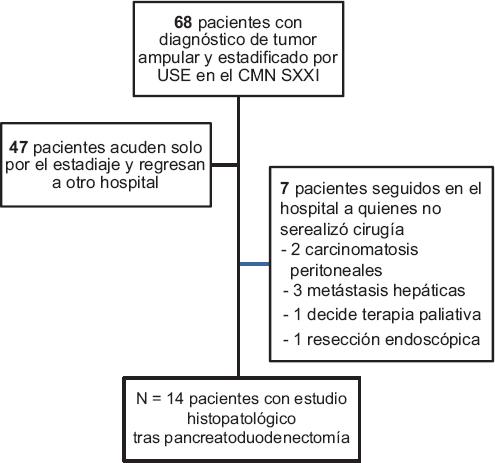
Figura 1 Flujograma de pacientes. CMN SXXI: Centro Médico Nacional Siglo XXI; USE: ultrasonido endoscópico.
En relación con el tamaño tumoral, encontramos una correlación de R = 0.653 (p = 0.01) entre las mediciones obtenidas por USE contra el HP, cuyas mediciones fueron muy semejantes en ambos estudios (media: 23.9 ±10 contra 22.1 ± 16 mm, respectivamente) (Tabla 2).
Tabla 2 Características tumorales por ultrasonido y por estudio histopatológico
| Variable | USE (N = 14) | HP (N = 14) | p |
|---|---|---|---|
| Tamaño tumoral promedio (mm±desviación estándar) | 23.9 (± 10) | 22.14 (± 16) | 0.59* |
| Invasión pared duodenal | |||
| Sí | 7 (50.0%) | 6 (50.0%) | 1.00† |
| No | 7 (50.0%) | 8 (50.0%) | |
| Invasión pancreática | |||
| Sí | 4 (28.6%) | 5 (35.7%) | 1.00† |
| No | 10 (71.4%) | 9 (64.3%) | |
| Invasión ductal | |||
| Sí | 5 (35.7%) | 5 (35.7%) | 1.00† |
| No | 9 (64.3%) | 9 (64.3%) | |
| T | |||
| T1 | 0 (0%) | 3 (21.4%) | 0.86‡ |
| T2 | 6 (42.9%) | 2 (14.2%) | |
| T3 | 8 (57.1%) | 9 (64.2%) | |
| T4 | 0 (0%) | 0 (0%) | |
| N | |||
| N0 | 8 (57.1%) | 9 (64.3%) | 1.00† |
| N1 | 6 (42.9%) | 5 (35.7%) |
*Prueba t de Student pareada.
†Prueba de ji al cuadrado de McNemar.
‡Prueba de eta. Valor de P para prueba t de Student pareada y prueba exacta de Fisher. HP: histopatología; N: nódulos; T: tamaño; USE: ultrasonido endoscópico.
En cuanto a la invasión de la pared duodenal, de los 14 casos hubo concordancia de invasión en cinco y de no invasión en seis; en los tres restantes con discordancia, dos fueron sobreestadificados por el USE y en uno el USE no detectó la invasión del tumor. Por tanto, la concordancia observada fue del 78.5% (11/14) (Tabla 3). En la evaluación de la invasión pancreática, la concordancia observada fue del 78.5% (11/14); en tres pacientes se encontró concordancia de invasión y en ocho de no invasión por ambos estudios. Para los tres casos con discordancia, dos fueron invasiones no detectadas por USE y uno sobreestadificado por USE. Finalmente, con respecto a la invasión ductal, la concordancia observada fue del 57.1% (8/14), con un acuerdo de invasión en dos casos y de no invasión en seis; la discordancia en los seis restantes fue por infraestadificación en tres y por sobreestadificación en los otros tres.
Tabla 3 Relación entre la invasión duodenal, pancreática y ductal por ultrasonido y por estudio histopatológico
| Invasión duodenal | HP | ||
|---|---|---|---|
| Sí | No | Total | |
| USE | 2 | 7 | |
| Sí | 5 | 6 | 7 |
| No | 1 | 8 | 14 |
| Total | 6 | 75% | 78.5% |
| Exactitud | 83.3% | ||
| Invasión páncreas | |||
| USE | 3 | 1 | 4 |
| Sí | 2 | 8 | 10 |
| No | 5 | 9 | 14 |
| Total | 60% | 88.8% | 78.5% |
| Exactitud | |||
| Invasión ductal | |||
| USE | 2 | 3 | 5 |
| Sí | 3 | 6 | 9 |
| No | 5 | 9 | 14 |
| Total | 40% | 66.6% | 57.1% |
| Exactitud | |||
HP: histopatología; USE: ultrasonido endoscópico.
Al evaluar el estadio T (Tabla 2) de los tumores en el USE no se detectaron T1 ni T4, y estos últimos tampoco fueron identificados por HP. Con ambos métodos, los T3 fueron los más frecuentes (USE 57.1% y HP 64.2%) y no hubo diferencias estadísticamente significativas en la distribución por métodos (p = 0.86). De los 14 pacientes analizados, existió concordancia en 10 casos (dos T2 y ocho T3) (71.4%). La tendencia de este parámetro es a sobreestadificar, pues de los cuatro pacientes mal estadificados tres correspondieron a estadios más tempranos (21.4%) (T1) y uno a un estadio mayor (7%) (T3) (Tabla 4). Se estimó el valor kappa para el estadio T, el cual mostró un valor de 0.500 (p = 0.003).
Tabla 4 Relación entre el estadio T por ultrasonido y por estudio histopatológico
| HP | ||||
|---|---|---|---|---|
| T1 | T2 | T3 | Total | |
| USE | ||||
| T1 | 0 | 0 | 0 | 0 |
| T2 | 3 | 2 | 1 | 6 |
| T3 | 0 | 0 | 8 | 8 |
| T4 | 0 | 0 | 0 | 0 |
| Total | 3 | 2 | 9 | 14 |
| Exactitud | 0% | 100% | 88.8% | 71.4% |
HP: histopatología; USE: ultrasonido endoscópico.
Con respecto al estadio N de los tumores, existió concordancia en siete casos (cinco N0 y dos N1) (Tabla 2). La tendencia de este parámetro es a sobreestadificar, pues de los siete pacientes mal estadificados cuatro correspondieron a estadios más tempranos (28%) (N0) y tres a estadios más tardíos (N1) (21.4%) (Tabla 5). De igual manera, se estimó el valor kappa para el estadio N tumoral y fue de −0.043 (p = 0.87).
Discusión
Ante el posible beneficio de poder estadificar los tumores ampulares antes de tomar la decisión de un procedimiento quirúrgico muy riesgoso, usar el USE para este propósito ha sido muy alentador; sin embargo, su utilidad aún necesita ser evaluada en nuestras condiciones de trabajo. Por ello, en este estudio se evaluó su desempeño considerando el análisis HP como el método de referencia. Nuestros resultados indican una buena correlación con respecto a la medición del tamaño tumoral (R de Pearson = 0.653), una exactitud moderada del 78.5, 78.5 y 57.1% para determinar el grado de invasión duodenal, pancreática y ductal, respectivamente, una exactitud adecuada para el estadio T (71.4%, kappa = 0.500) y una mala exactitud en la determinación del estadio N (50%; kappa = −0.043).
Tal como ha sido informado en otros estudios, los tamaños tumorales medidos por USE y HP son muy similares17,26, y por tanto podemos afirmar que es factible estimar el tamaño real del tumor por medio del USE. Esta alta correlación permite usar la medición del USE para apoyar en gran parte el plan quirúrgico en estos pacientes.
En cuanto a la exactitud del USE para la detección de invasión tumoral a estructuras vecinas, como la pared duodenal, el páncreas y los conductos biliares intrapancreáticos, en otras partes del mundo se han reportado valores tan altos como del 90% para cada parámetro11,12,26. Nosotros encontramos una exactitud menor, en particular para la invasión ductal. Estudios previos han señalado que la presencia de una prótesis biliar puede dificultar seriamente la estadificación del tumor por USE para invasión ductal27-29. Es de hacer notar que seis pacientes (40%) tenían esta condición, y en tres de ellos se observó una clasificación menos exacta, pues en nuestro medio, al ser un hospital de referencia con tiempos de atención muchas veces largos, a los pacientes se les trata la ictericia obstructiva potencialmente letal antes de enviarlos a su estadificación. Por otro lado, la sobreestadificación de la extensión puede ser atribuida al edema inflamatorio peritumoral, debido a las características del tumor o a su manipulación cuando se coloca la prótesis. Estas imágenes pueden confundir la expansión tumoral30. Otra causa pudiera ser la necesidad de mayor capacitación. Tal error de sobreestadificación implica una frecuencia más alta de pancreatoduodenectomías, lo cual podría impactar en la morbilidad; sin embargo, puede existir a su vez una mayor tasa de éxito quirúrgico en relación con la resección total tumoral. Una mayor exactitud observamos en la evaluación de la invasión a la pared duodenal y el páncreas. Esta invasión suele mostrar imágenes más nítidas y por tanto fáciles de detectar, además de la adecuada capacidad del USE para identificar la capa muscular duodenal.
La exactitud calculada en nuestro estudio para el estadio T tumoral (71.4%) se encuentra dentro de los valores reportados en la literatura (60-90%)10-13,16-18,26. En nuestros pacientes, el uso del USE no nos permitió detectar los tumores T1, pues los tres pacientes en esta condición fueron sobreestadificados e identificados como tumores T2. Todos tenían tumores polipoides con edema en su sitio de implantación, lo cual pudo ser la causa de la sobreestadificación. Son necesarios más estudios para confirmar esta situación. La mayor exactitud se encontró al estadificar los tumores T3 (88.8%), tal como ha sido encontrado por otros autores11,16-18, pues la masa tumoral es mayor y más evidente con cualquier método de evaluación. Cabe destacar que, en nuestra serie, solo un caso fue infraestadificado. Otros estudios han reportado valores kappa de 0.51 a 0.56 para el estadio T10,17, pero en este trabajo el estimado se encuentra ligeramente por debajo (0.500). Como ya se mencionó, el grado de edema perilesional está relacionado con la sobreestimación de los tumores. Sería necesario concentrar la atención en la distinción de la inflamación y la expansión tumoral para una mejor estadificación por USE y, en definitiva, su realización previamente a cualquier manipulación tumoral.
En cuanto a la exactitud calculada para el estadio tumoral N (50%), la encontramos por debajo de lo informado en otros estudios10,11,13,17,18 que la estiman en un 60-80%. Los criterios para calificar a un nódulo linfático como metastásico por USE (bordes regulares, márgenes marcados, homogeneidad hipoecoica, < 2 cm) se presentan en solo el 25% de los ganglios con metástasis; además, dos de estos criterios pueden ser un hallazgo de ganglios normales28,31. Para poder corroborar el estado de los ganglios y lograr diferenciarlos de una adenopatía inflamatoria es necesaria la biopsia ganglionar, lo cual incrementaría los costos exponencialmente.
Varias limitaciones deben ser consideradas en nuestro estudio. La primera es el tamaño de la muestra, que fue relativamente pequeño, pues se sabe que la incidencia de esta patología es baja en nuestro medio y en todo el mundo. Esto no permitió la evaluación de la precisión de nuestros estimados. Por último, el resultado de patología dependió del patólogo en turno y no de un consenso en el servicio, lo cual podría modificar el grado de confiabilidad en relación con la estadificación de estos estudios.
Conclusiones
El USE es una herramienta no invasiva que parece permitir una medición adecuada de los tumores ampulares. Se recomienda continuar la capacitación y prestar mayor atención en la distinción del tumor y el edema perilesional, así como un análisis previo a la colocación de una prótesis biliar o a la manipulación tumoral. Para una mejor estadificación podría ser necesaria la biopsia de los ganglios identificados. Es necesario realizar estudios con mayor tamaño de muestra para mejorar la precisión de los resultados.











 nova página do texto(beta)
nova página do texto(beta)


