Antecedentes
La reconstrucción del ligamento cruzado anterior (LCA) es una de las prácticas de la cirugía ortopédica más frecuentes. En las últimas dos décadas, debido al notable desarrollo económico en el mundo y al aumento progresivo de la actividad deportiva cada vez más competitiva, la cirugía del LCA ha tenido un acelerado crecimiento. En Estados Unidos, estudios realizados durante el año 2007 reportaron una incidencia anual de 1 en 3,000 individuos.1,2
En los inicios de la década de los 80, para realizar la reconstrucción del LCA se utilizaron ligamentos sintéticos. Los resultados fueron malos, con una inaceptable alta tasa de fallo y frecuentes complicaciones: los tendones se rompían con facilidad, no soportaban las cargas fisiológicas y se favorecía la sinovitis. A pesar de estos malos resultados, la utilización de estos injertos permitió el desarrollo de la experiencia en el procedimiento.3,4
El LCA tiene una resistencia de 2,160 N, una rigidez de 242 N/mm y un área transversal máxima de 44 mm2. Presenta una longitud media de 38 mm y un ancho promedio de 11 mm. Las funciones principales son la resistencia a la traslación anterior de la tibia de 90%; es un restrictor secundario a la rotación tibial -factor que ha tomado relevancia en la actualidad después de la difusión de la reconstrucción mediante doble banda-, además de soportar fuerzas en valgo y varo. Por ello, un injerto ideal busca reunir las siguientes condiciones:4,5 mínima morbilidad del sitio donante, lograr una fijación estable, promover una incorporación biológica rápida y permitir una rehabilitación acelerada.
Una de las principales ventajas de poder medir y cuantificar la evolución de las lesiones del LCA es que nos permite comparar objetivamente los diferentes tratamientos. Los índices se pueden dividir en dos tipos: los objetivos, que son aquéllos que evalúan diferencias medibles con instrumentos, como, por ejemplo, la evaluación artométrica de la rodilla con el KT-1000 y los subjetivos, que son aquellos que evalúan la satisfacción general del paciente. Se ha demostrado en diferentes publicaciones que aquellas escalas que evalúan datos de síntomas subjetivos y de función articular son los que mejor se correlacionan con la satisfacción del paciente.6,7,8,9
El IGF-1 y la lesión de LCA
Las citocinas comprenden a las interleucinas (citocinas producidas por leucocitos), los interferones, los factores de necrosis tumoral, los factores estimulantes de colonias, que controlan la hematopoyesis y las quimiocinas (polipéptidos endógenos con actividad quimiotáctica para diferentes poblaciones de leucocitos).10
El factor de crecimiento semejante a la insulina tipo 1, también conocido como somatomedina C o IGF-1 (por sus siglas en inglés, insulin-like growth factor-1), es una proteína que en humanos es codificada por el gen IGF.11 El IGF-1 es una hormona similar en estructura molecular a la insulina, ya que juega un papel importante en el crecimiento infantil (los mayores niveles se producen en la pubertad, los menores en la infancia y la vejez) y en el adulto continúa teniendo efectos anabolizantes.12 Se trata de una cadena simple de polipéptidos que muestra una estructura homóloga a la proinsulina y tiene una importancia en el crecimiento normal así como en la cicatrización. Este factor de crecimiento se une a dos tipos de receptores y está regulado por un grupo específico de proteínas de unión.13 El IGF-1 en la reparación de los ligamentos de rodilla es un importante mediador en todas las fases de la cicatrización, particularmente durante la fase inflamatoria y proliferativa. Aquellos tejidos lesionados carentes de este factor de crecimiento están en una desventaja en el proceso cicatrizal.
Sciore, et al. demostraron que los niveles de IGF-1 en conejos son cinco veces más altos en comparación con los controles después de tres semanas de la lesión de los ligamentos colaterales de la rodilla. El papel más importante parece ser la estimulación de la proliferación y migración de los fibroblastos y otras células al sitio de la lesión y que, subsecuentemente, incrementan la producción de colágena y matriz extracelular en estas células durante la fase de remodelación. La capacidad del IGF-1 para estimular la producción de colágena y fibronectina in vitro se ha demostrado en cultivos de ratas.13,14
Los seres humanos producen aproximadamente 30 μg del IGF-1 al día hasta cumplir los 30 años y, a partir de ese momento, la producción decrece con la edad. En la unión al IGF-1R, un receptor tirosina quinasa, inicia la señalización intracelular; el IGF-1 es uno de los activadores naturales más potentes de la transducción de señal, un estimulador del crecimiento y proliferación celular y también un importante inhibidor de la muerte celular programada. El IGF-1 luego estimula el crecimiento del cuerpo de forma sistémica y tiene efectos promotores del crecimiento en casi todas las células del cuerpo, especialmente en las del musculoesquelético, cartílago, hueso, hígado, nervios, piel, células hematopoyéticas y pulmones.15,16
Los niveles del IGF se pueden medir en la sangre, con un rango de normalidad de 10 a 1000 ng/ml. En 1957, Salmon y Duaghada formularon la hipótesis de la somatomedina y demostraron que ésta mediaba la acción de la hormona de crecimiento (GH) sobre la capa epifisaria de los huesos largos, siendo su acción imprescindible para el crecimiento longitudinal del esqueleto. La acción paracrina y autocrina del IGF en el cartílago de crecimiento es la que estimula los condrocitos a proliferar y entrar en la zona proliferativa. En el caso de los IGF, existe una gran familia de proteínas de transportes de los IGF, conocida como IGFBP (insulin-like growth factor binding proteins), que modula la vida media de los IGF e incluso parecen modular la interacción de los IGFs con su receptor o ejercer acciones directas sobre la proliferación celular.16
Papel de las citocinas en la osteoartrosis secundaria a la lesión del LCA
Entre 50 y 60% de los pacientes postoperados de plastía de LCA tiene evidencia radiográfica de osteoartrosis después de cinco años. Esta observación sugiere la importancia de otros factores en la fisiopatología de la osteoartrosis postraumática después de lesiones del LCA, que incluyen, entre otras, reacciones inflamatorias intraarticulares. Los altos niveles de citocinas inflamatorias tales como la IL-1β, IL-6 y TNFα se han detectado en rodillas con lesión del LCA en fase aguda y crónica.15 La respuesta inflamatoria mediada por citocinas puede jugar un papel importante en los cambios en los túneles de la reconstrucción del LCA. Las interleucinas 6, 8 y 1β promueven la actividad osteosclástica y pueden contribuir a la reabsorción ósea.
En animales de experimentación (conejos), se ha descrito una cicatrización más lenta y menos completa en la región articular de los túneles. Esto sugiere un papel importante del medio ambiente sinovial en la integración del injerto. Diferentes estudios han reportado niveles patológicamente altos de citocinas en el líquido sinovial después de una lesión de LCA en forma crónica y después de la reconstrucción del LCA, pero la historia natural del estudio del líquido sinovial en humanos permanece aún sin investigarse.16
Los túneles óseos están expuestos a niveles elevados de citocinas, principalmente IL-1β y IGF-1, lo que posiblemente induzca a osteólisis. En el estudio de Berg, et al. se investigó la cicatrización dentro del túnel óseo en un modelo animal y se encontró una cicatrización más lenta e incompleta en la región articular que en el resto del túnel.17 Cuando los aloinjertos están dentro de las articulaciones, se detectaron niveles elevados de factor de necrosis tumoral (TNF) y de IL-1β, lo que puede soportar la teoría de que esas citocinas están relacionadas con la reabsorción del injerto. Las interleucinas 6 y 8 son proinflamatorias y tienen un papel importante en el daño del cartílago y del hueso. La IL-6 en el medio sinovial reduce la producción de colágena tipo II, incrementa la producción de metaloproteasas y se considera que es la citocina maestra en la degradación subcondral y ósea. Hasta el momento, el papel de los factores de crecimiento como el IGF-1 no ha sido determinado en la lesión y reparación del LCA, tanto en modelos animales como en humanos.17,18
Siguiendo esta misma línea, el popósito de este estudio fue investigar si la reconstrucción del LCA de rodilla con autoinjerto tiene una mayor producción de IGF-1 en líquido sinovial en comparación con el aloinjerto.
Material y métodos
Se trata de un estudio experimental, analítico, prospectivo y longitudinal, con pacientes militares en activo a quienes se les realizó reconstrucción artroscópica del LCA en el período comprendido de Agosto de 2016 a Octubre de 2017. Para el presente trabajo, se calculó una muestra de 20 pacientes para cada grupo.
Criterios de inclusión: pacientes militares en activo, con lesión del LCA, cuya evolución hubiera sido de tres a 11 meses y fueran candidatos a reconstrucción del LCA por vía artroscópica, de ambos sexos, de los 20 a los 40 años y con un índice de masa corporal menor a 28.0, sin antecedente de accidentes previos y sin antecedentes de cirugía ortopédica previa a la lesión del LCA de rodilla.
Criterios de exclusión: pacientes que se encontraran bajo un tratamiento médico y pacientes sin expediente clínico o con cirugía de revisión.
Criterios de eliminación: aquellos pacientes que voluntariamente decidieran abandonar el estudio o con antecedentes de complicaciones postoperatorias inmediatas como infecciones y pacientes que abandonaron el estudio durante el período de seguimiento.
Estrategia experimental: a todos los pacientes con lesión del LCA se les proporcionó información con el alcance y los objetivos de este protocolo, invitándolos a participar en el estudio. Además se les dio a firmar la carta de consentimiento informado por triplicado: una copia se entregó al paciente, una se integró a su expediente y otra al archivo del investigador principal. Al mismo tiempo, se le explicó a cada paciente las ventajas y desventajas del tipo de injerto (sea aloinjerto o autoinjerto) que se emplearía en la plastía del LCA, siendo la aleatorización de la intervención de la siguiente manera: se colocaron 40 papelitos en un frasco de cristal (20 con la leyenda autoinjerto y 20 con la leyenda aloinjerto) y cada paciente tomó un papel para conformar dos grupos de 20 pacientes. De esa forma, se decidió a quién se le colocaría autoinjerto y a quién aloinjerto en su cirugía. La cirugía se programó en la agenda del investigador principal y se efectuó conforme el espacio quirúrgico.
La primera medición de escala de Lysholm-Tegner se realizó el día de su hospitalización. Asimismo, la primera muestra de líquido sinovial se obtuvo en el primer paso de la cirugía, ya con el paciente anestesiado y bajo técnica aséptica al realizar el portal lateral a la rodilla. Mediante la introducción de una guía del lente artroscópico, se aspiró 1 ml de líquido sinovial y se procedió a realizar la reconstrucción del LCA, empleando un solo tipo de fijación para el injerto denominada «all-inside». Finalmente, se empleó un torniquete de isquemia en el muslo ipsilateral a una presión de 250 mmHg el tiempo necesario para efectuar la cirugía.
La muestra de líquido sinovial se vació en un microtubo y se colocó en una hielera manteniéndolo a 4 oC hasta transportarlo al Laboratorio de Investigación de la Escuela Militar de Graduados de Sanidad. La muestra se centrifugó a 3,000 rpm durante 10 minutos a 4 oC. Se tomaron dos alícuotas de 0.5 ml del sobrenadante con ayuda de una micropipeta y se almacenaron en microtubos a una temperatura de -80 oC. El botón celular se mezcló en el mismo microtubo con 1 ml de suero fetal bovino y se almacenó a -80 oC. Cuando se utilizó aloinjerto, las muestras biológicas se etiquetaron con número arábigos consecutivos, según se fueron incluyendo los pacientes en el estudio. En el caso de los pacientes con autoinjerto, se etiquetaron con números romanos para diferenciar entre un grupo y otro. En ambos casos se les agregó en la etiqueta la letra «P», «30» o «90», que corresponde a la toma prequirúrgica, 30 días o 90 días del postoperatorio, respectivamente.
Los pacientes cursaron su evolución postoperatoria con analgesia intravenosa, con tres dosis de antibiótico profiláctico y hielo local. Al siguiente día, fueron dados de alta y la primera revisión postoperatoria se efectuó en la consulta externa a los 15 días del postoperatorio. Después, a los 30 días se realizó una revisión clínica, una nueva valoración de la escala de Lysholm y la segunda muestra de líquido sinovial. A los 90 días, se efectuó la tercera medición de la escala de Lysholm y la tercera muestra de líquido sinovial. Estas muestras se obtuvieron con técnica aséptica y a través de una artrocentesis vía lateral y se siguió el mismo procedimiento de transportación, separación por centrifugación y almacenamiento descrito para la primera muestra, hasta el momento de su análisis que se realizó por conveniencia administrativa en un solo tiempo.
Determinación del IGF-1
Una vez que se obtuvieron las tres muestras de la totalidad de los pacientes que se incluyeron en el estudio, se procedió con el proceso de descongelación de las muestras y se realizó la determinación de IGF-1 mediante la técnica de ensayo por inmunoabsorción ligado a enzimas (ELISA, por su acrónimo del inglés Enzyme-Linked ImmunoSorbent Assay), de tipo competitivo, siguiendo las instrucciones del fabricante, utilizando un control positivo y uno negativo.
Para la determinación de IGF-1 se utilizó el kit comercial IGF-1 600 ELISA, catálogo EIA-4140 de la marca DRG Diagnostics. Los estándares, los controles y las muestras fueron analizados por duplicado. Se utilizaron seis calibradores para la construcción de la curva estándar (0 a 600 ng/ml) y se analizó un control bajo y un control alto, los cuales eran parte del kit para la validación de los resultados. Las muestras se diluyeron 1:2 y su resultado se reportó en ng/ml.
Para la comparación de variables categóricas, se realizó la prueba de t de Student; para las variables cuantitativas no paramétricas se utilizó a prueba U de Mann-Whitney; para la comparación de los niveles de IGF-1 en función del tiempo y el tipo de injerto, se usó ANOVA de una vía. Se consideró una significancia estadística si el valor de p fue menor o igual a 0.05. Se utilizaron los programas estadísticos Sigma Plot versión 11 y SPSS versión 21.
Resultados
En el presente estudio se incluyeron 40 pacientes que cumplieron con los criterios de selección de la muestra; ningún paciente fue excluido o eliminado. La distribución por sexo fue de 32 pacientes del sexo masculino (80%) y ocho pacientes del femenino (20%). La edad promedio fue de 28 ± 5 años, con un intervalo de 20 a 40 años. No se observó diferencia significativa entre los grupos (p = 0.471, mediante prueba de U de Mann-Whitney).
El índice de masa corporal promedio fue de 24.59 ± 2.41, con un intervalo de 20 a 28.5. Sólo un paciente presentó un índice de masa corporal de 28.5, el cual correspondió a un paciente del sexo masculino de 38 años de edad, que pertenecía al grupo de autoinjerto. La rodilla afectada con mayor frecuencia fue la derecha en 27 de los casos (67.5%) y en 13 casos (32.5%) fue la izquierda. En ningún caso se presentó lesión bilateral. En relación con el tiempo de evolución promedio con el cual se operaron los pacientes, éste fue de 7.2 ± 2.9 meses, con un intervalo de tres a 12 meses. En cuanto a la actividad que desempeñaban al momento de la lesión, encontramos que 14 pacientes estaban realizando fútbol (35%), 10 en descenso de soga (25%), cinco pacientes en rapel (12.5%), cinco en básquetbol (12.5%), tres en paracaidismo (7.5%) y uno mientras corría en campo (2.5%).
Para este estudio, se evaluó si había lesión en los meniscos y en el cartílago articular como un factor de sesgo de los resultados. Se encontraron que 26 pacientes tenían meniscos sanos (65%), en siete casos el menisco lateral estaba lesionado (17.5%), en dos casos lo era el medial (5%) y en cinco casos ambos meniscos estaban lesionados (12.5%). También se encontró en el transoperatorio que 14 pacientes cursaban sin ninguna lesión en el cartílago (35%), pero en 12 pacientes tuvieron lesión grado I (30%); ocho pacientes (20%), lesión grado II; cinco pacientes (12.5%), lesión grado III y un paciente (2.5%), lesión grado IV, determinado por la escala de Outerbridge.
En la Figura 1 se pueden apreciar los resultados que arrojaron la escala de Lysholm al momento de la cirugía, a los 30 días y a los 90 días.
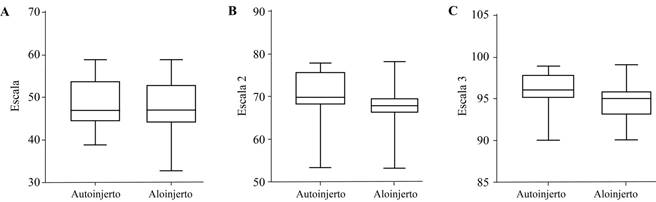
Figura 1: Escala de Lysholm al día 1 A), día 30 B) y día 90 C), según el tipo de injerto, aplicando t de Student. No se observaron diferencias estadísticamente significativas (p > 0.05 en los tres tiempos medidos).
Para el análisis estadístico de los niveles de IGF-1, se consideró un análisis de varianza de 1 vía (ANOVA), considerando como primer vía el tipo de injerto y, como segunda vía, el tiempo postquirúrgico. Debido a que los datos no pasaron la prueba de normalidad, se realizó un análisis post hoc con la prueba de U de Mann-Whitney. En el grupo de aloinjerto, la concentración promedio de IGF-1 fue: 2.60 ± 0.17 ng/ml al día 1; 2.80 ± 0.15 ng/ml al día 30 y 3.02 ± 0.16 ng/ml al día 90 del postquirúrgico. Dentro de este grupo, no se observó diferencia significativa entre la medición basal (día 1) y los 30 días después del injerto (p > 0.05), pero a los 90 días se observó un aumento significativo de los niveles de IGF-1 en comparación con el día 1 (p < 0.001).
En el grupo de autoinjerto, la concentración promedio del IGF-1 fue: para el día 1 de 2.60 ± 0.13 ng/ml, 3.13 ± 0.12 ng/ml para el día 30 y 3.38 ± 0.13 ng/ml para el día 90 del postquirúrgico. En este grupo, se observó un aumento significativo de los niveles de IGF desde los 30 días en comparación con la medición basal (p = 0.002). También se observó una diferencia significativa entra los 30 y 90 días postquirúrgicos y también entre los 90 días y el día 1 (p < 0.001) al comparar los niveles de IGF-1 entre ambos grupos (autoinjerto vs aloinjerto) (Figura 2).

Figura 2: Niveles de IGF-1 en líquido sinovial según el tipo de injerto empleado en la reconstrucción de LCA, previo a la cirugía, 30 y 90 días después.
Se realizó también el análisis estadístico para comparar los resultados de la escala funcional de Lysholm, empleando la prueba estadística de U de Mann-Whitney (por resultar los datos no paramétricos) para tratar de encontrar significancia estadística con criterio de alfa = 0.05 y un nivel de confianza de 95%. Al comparar ambos grupos con sus mediciones de la escala de Lysholm los días 1, 30 y 90 en ambos grupos de pacientes no presentaron diferencia estadísticamente significativa al reportar p = 0 .504, p = 0.108, p = 0.143 para el día 1, 30 y 90, respectivamente. Asimismo, se aplicó la prueba de Kruskal-Wallis para conocer si la actividad física que causa la lesión de LCA está asociada con un estado físico de la rodilla al momento de la cirugía y con las evaluaciones posteriores, según la escala de Lysholm para descartar alguna asociación, ya que el valor de p fue de 0.412; 0.166 y 0.622 a los días 1, 30 y 90, respectivamente, resultados que no representan una significancia estadística.
Discusión
La importancia de estudiar la respuesta inflamatoria del injerto radica en las observaciones hechas en escasos estudios, como el de Bigoni et al.,19 quienes, en sus observaciones, sugieren la importancia de factores diferentes a los mecánicos en la fisiopatología de la osteoartrosis postraumática después de una lesión de LCA. Los altos niveles de citocinas inflamatorias (interleucinas y TNF-α) encontrados en rodillas lesionadas, tanto en fases agudas como crónicas, sugieren que las citocinas pueden promover el catabolismo del cartílago a través de la síntesis de los radicales libres y metaloproteasas y, en consecuencia, participan en el desarrollo de la osteoartrosis.8,19,20,21
En la interpretación de los resultados, la muestra se consideró representativa, ya que se reportaron estas lesiones en pacientes jóvenes y que realizan actividades físicas intensas y deportivas, con tasas de lesiones meniscales y de cartílago muy similares a las reportadas en otros estudios.1,15 En nuestros resultados a los 90 días, se encontró diferencia estadísticamente significativa al medir los niveles de IGF-1, siendo éstos un factor de crecimiento muy importante en la integración del injerto al túnel óseo y a la fijación del mismo; sin embargo, no se encontraron estudios con los cuales se pueda comparar. En cuanto a la evolución clínica a los 30 y 90 días de medición de las escalas de Lysholm, no se hallaron diferencias estadísticamente significativas; no obstante, es necesario ampliar el tiempo de seguimiento de estos pacientes, ya que se pueden presentar fallas en el injerto después de este período, toda vez que el proceso biológico de ligamentización tarda aproximadamente ocho meses, así podría correlacionarse con los niveles de IGF-1.
El papel más importante parece ser la estimulación de la proliferación y migración de los fibroblastos y otras células al sitio de la lesión y que subsecuentemente incrementa la producción de la colágena y matriz extracelular durante la fase de remodelación ósea.23 El Registro Nacional Noruego de pacientes intervenidos de una rotura del LCA, entre 2004 y 2006, demostró que, de 3,475 pacientes, 26% tenía lesiones del cartílago, 47% tenía roturas meniscales y 15% presentaban ambas. Además, calcularon que la lesión del cartílago en una rodilla adulta aumenta 1% por cada mes que transcurre desde que se produce la lesión hasta el día de la cirugía y que las lesiones de cartílago son dos veces más frecuentes si hay una rotura meniscal y viceversa.24 En una revisión sistemática para determinar la relación entre artrosis de rodilla y rotura o reparación del LCA, Lestad et al. vieron en siete estudios prospectivos y 24 retrospectivos que la prevalencia de artrosis en pacientes con rotura aislada del LCA estaba entre 0 y 13%. Para los pacientes con rotura de LCA y lesión meniscal, la prevalencia se situó entre 21 y 48%.25 Son numerosos los trabajos que demuestran el elevado riesgo de aparición de lesiones meniscales y cartilaginosas con una rodilla inestable. Se ha calculado que durante el primer año después de una rotura del LCA sin reparar, se desarrollan lesiones meniscales, hasta en 40% de los casos, generalmente del menisco interno. Esta cifra aumenta hasta 60% a los cinco años y 80% a los 10 años.25
Entre las limitaciones del estudio se presentaron cinco muestras hemáticas en líquido sinovial que no fueron evaluadas y que correspondieron a los pacientes que tenían menos tiempo de evolución de la lesión (tres meses aproximadamente). Además del tiempo de seguimiento (tres meses), el cual no permitió determinar el impacto real del tipo de injerto (aloinjerto vs autoinjerto) ni la evolución clínica de este tipo de reconstrucción en relación con la resistencia del tendón injertado, tampoco se realizó una evaluación del túnel óseo con radiografías, tomografía axial computada o mediante la RMN a los 12 meses de postoperatorio, con el fin de evaluar la integración del injerto al hueso.











 nueva página del texto (beta)
nueva página del texto (beta)


