Antecedentes
Bruns fue el primero en reconocer en 1890 las principales características de la amiotrofia diabética.1 El término fue acuñado por Hugh Garland en 1955 cuando reportó a 12 pacientes adultos mayores con diabetes tipo II.2 Estos autores describieron un desorden caracterizado por un dolor severo en la cadera y muslo seguido de una debilidad asimétrica y pérdida que afecta los músculos de la pierna.1,2,3,4 La etiología es controversial y se han propuesto dos hipótesis, tanto isquémica como metabólica.5 También conocida como amiotrofia diabética proximal, neuropatía diabética proximal, plexopatía diabética lumbosacra, mononeuropatía isquémica múltiple, neuropatía femoral-ciática y neuropatía femoral.6 Los estudios de electrodiagnóstico son a menudo más consistentes con una lesión neurogénica atribuida a una radiculopatía lumbosacra, plexopatía o neuropatía crural proximal.6,7,8 La diferenciación clínica del síndrome Bruns Garland y del síndrome de cauda equina puede ser difícil, ocasionalmente los pacientes son sometidos a operaciones innecesarias debido a una sospecha de lesión espinal lumbar.9
Caso clínico
Masculino de 59 años de edad comienza repentinamente con un desequilibrio seguido de 10 días de debilidad en las extremidades inferiores y pérdida de los esfínteres. Tenía antecedentes de 18 años de diabetes mellitus con un control glucémico deficiente, en tratamiento con agentes hipoglucémicos orales, también refirió miocardiopatía hipertrófica y dislipidemia mixta recientemente diagnosticada. El paciente comenzó con desequilibrio que obstaculizó su deambulación, no refirió antecedentes de traumas previos. Evolucionó rápidamente agregando dolor severo y persistente en las extremidades inferiores, de tipo opresivo y alternado con calambres, refirió parestesia en las cuatro extremidades, pérdida de peso, disfunción eréctil y pérdida de control de esfínteres, 10 días después no era capaz de caminar.
El paciente fue atendido en la sala de urgencias. A la exploración física sus funciones mentales estaban preservadas y nervios craneales inalterados. Se encontraron disestesias en las extremidades superiores, parestesia y debilidad en las extremidades inferiores (fuerza muscular de 3/5 en la extremidad izquierda y 2/5 en la derecha) que fue predominantemente proximal.
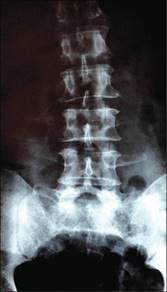
Las radiografías anteroposterior y lateral de la columna lumbosacra (Figuras 1 y 2) evidenciaron espondilolistesis L5-S1 nivel II de Meyerding, cambios degenerativos, fusión y espondiloartrosis. Al principio se sospechó que los resultados combinados sugerían un síndrome de cauda equina; sin embargo, la IRM mostraba cambios Modic tipo 3, degeneración de disco intervertebral y pérdida de altura en L5 y S1. No hubo compresión del canal vertebral, compresión de la raíz nerviosa, ni extrusión discal (Figuras 3 y 4).

Figura 3: RM corte axial con ligera hipertrofia facetaria que oblitera ligeramente el receso lateral derecho.

Figura 4: RM en corte sagital T2. Espondiloartrosis sin evidencia de obliteración del conducto medular.
El principal diagnóstico diferencial fue el síndrome de Guillain-Barré, Bruns Garland contra el síndrome de cauda equina. Las pruebas inmunológicas e inflamatorias fueron normales, así como el perfil reumatológico. La electromiografía reveló neuroconducción motora negativa de ambos, peroneo y tibial izquierdo, latencia prolongada, amplitud reducida y reducción de la velocidad de la neuroconducción motora del tibial derecho. Neuroconducción sensitiva negativa del peroneo superficial bilateral. Los resultados combinados fueron consistentes con axonal severo y polineuropatía desmielinizante. Considerando los aspectos clínicos del paciente, amiotrofia diabética (síndrome de Bruns Garland) fue el diagnóstico más probable.
El paciente mejoró rápidamente con el tratamiento basado en antineuríticos, control diabético, terapia física y rehabilitación. Cuatro meses después del diagnóstico recuperó la fuerza muscular, no presentó alteraciones en la marcha ni pérdida del equilibrio, su sensibilidad se recuperó y el dolor cedió.
Discusión
El síndrome de Bruns-Garland o amiotrofia diabética, un tipo de neuropatía diabética, es una extraña complicación de la diabetes mellitus. Se le ha conocido por diferentes nombres, incluidos el síndrome de Bruns Garland, mielopatía diabética o mononeuropatía múltiple.1,3,4,8 Su etiología aún se mantiene en controversia, las teorías más aceptadas son la lesión isquémica y el trastorno metabólico (hiperglucemia). Las principales características de la amiotrofia diabética son debilidad, pérdida de sensibilidad y dolor, principalmente en los músculos cuádriceps. Los pacientes también se quejan de síntomas sensoriales en el muslo como dolor severo, disestesias y parestesia. La diferenciación clínica de la amiotrofia diabética del síndrome de cauda equina puede ser difícil. El síndrome de Bruns Garland se sugiere más que el síndrome de cauda equina por la relativa ausencia de dolor de espalda en la presencia de dolor de piernas y dolor nocturno; y la presencia de debilidad es sugestiva de afectación radicular múltiple.1,5,9,10 Además de la presentación neurológica, el paciente mostró lesión estructural de la columna lumbar, espondilolistesis grado II Meyerding, lo cual hace pensar que el déficit neurológico fue debido a una compresión de las raíces nerviosas y la posibilidad de una descompresión quirúrgica se evalúa sin el estudio de electrodiagnóstico, ya que el síndrome de cauda equina es más frecuente que se presente con lesión estructural de la columna; sin embargo, se realiza la IRM y muestra cambios Modic tipo 3, degeneración de disco intervertebral y pérdida de la altura del disco en L5 S1. No hubo compresión del canal medular, compresión de la raíz nerviosa, ni extrusión discal. Se discutió la posibilidad de un diagnóstico falso positivo como una razón para un mal resultado después de una cirugía de columna lumbar.9,10 La participación de la diabetes de la raíz nerviosa espinal puede simular más enfermedades comunes de la columna. El estudio electrofisiológico de los miotomas afectados muestra evidencia de polirradiculoneuropatía axonal con reducción de las amplitudes motoras y sensoriales y desaceleración de la velocidad de conducción.11 Estos hallazgos clínicos proporcionan una alta sospecha diagnóstica de síndrome de Bruns Garland en el diagnóstico diferencial.
El curso natural del síndrome de Bruns Garland (amiotrofia diabética) es variable y a pesar de que la mayoría de los pacientes mejora, la recuperación es gradual e incompleta, tal y como fue en nuestro paciente. Según la literatura, el dolor se resuelve entre 16 y 20 semanas, pero la debilidad muscular puede requerir hasta un año o más para mejorar.1,2,3,4,5,7,9,12
El tratamiento ortopédico del síndrome de Bruns Garland consiste en antineuríticos, narcóticos, fármacos antiepilépticos, terapia física y el mejoramiento de la condición metabólica. Las terapias inmunomoduladoras se consideran parte del tratamiento del síndrome de Bruns Garland. Se ha reportado comúnmente que los corticosteroides e inmunoglobulinas intravenosas son los tratamientos con eficacia que más se sugieren.12
Todos los pacientes con un posible síndrome de cauda equina y antecedentes de diabetes mellitus deben ser considerados como diagnóstico diferencial del síndrome Bruns Garland (amiotrofia diabética). Los estudios de electrodiagnóstico (EMG y potenciales evocados) así como los estudios radiológicos deben utilizarse para apoyar el diagnóstico. El tratamiento puede variar de una descompresión quirúrgica urgente o sólo a rehabilitación física. En los pacientes con síndrome de Bruns Garland (amiotrofia diabética) se sabe que los síntomas empiezan repentinamente, pasando a imitar una compresión de la raíz discal. Ambos problemas requieren consideración y tratamiento.











 nueva página del texto (beta)
nueva página del texto (beta)