Introducción
La reconstrucción de grandes defectos de huesos largos a menudo es el principal desafío en el salvamento de las extremidades, sin importar la etiología de la pérdida ósea.1
A través del tiempo se han empleado distintas técnicas para que se realice la neoformación ósea adecuada. En 1986 Masquelet describió un procedimiento de dos etapas en el que una membrana de tejido inducida por un espaciador de cemento en un defecto óseo facilitó la consolidación del injerto óseo y por lo tanto, evitó la reabsorción.2 La primera etapa implica el desbridamiento de todo el tejido desvitalizado, utilizando reducción abierta y fijación interna y la colocación de un espaciador de cemento con o sin antibióticos. En la segunda etapa, que se realiza al menos seis semanas después de la anterior, se retira el espaciador y el vacío resultante se llena con injerto óseo.3
Las principales propiedades de la membrana son prevenir la reabsorción del injerto y secretar factores de crecimiento. La membrana inducida aparece como una cámara biológica, lo que permite la concepción de numerosos modelos experimentales de reconstrucción ósea. Este concepto probablemente podría extenderse a otras reparaciones de tejidos.1
Por otra parte, los cirujanos ortopédicos tienen la opción de elegir transferencias óseas vascularizadas, transporte óseo, injertos óseos alogénicos, sustitutos del injerto óseo y muchos otros medios para tratar las pérdidas de tejido óseo. El injerto de peroné no vascularizado y el injerto de hueso esponjoso proporcionan un medio confiable para tratar tales afecciones en los países en vías de desarrollo.4 Dentro de estas opciones, el estándar de oro en la literatura es el hueso esponjoso cosechado de la crestas ilíacas.5
El injerto peroneo es un método frecuentemente manipulado en los defectos creados por escisiones tumorales, pérdidas traumáticas o por secuelas de infección en pediatría,6 su uso se origina a principios del siglo XX y fue el estándar de oro para la reconstrucción biológica por más de 60 años, principalmente para lesiones de origen neoplásico o infeccioso.7
El peroné es utilizado debido a su fácil acceso y mínima morbilidad para el sitio donador,6 sobre todo por: su excelente y resistente estructura ósea, potencial osteogénico importante, se obtiene mediante procedimiento más sencillo, evita el uso de costosos implantes y no afecta de manera considerable el sitio donante. A diferencia de los aloinjertos no tiene problemas de inmunogenicidad ni riesgos de transmisión de infección,8 por lo que se ha vuelto una práctica solución para los defectos óseos en hospitales localizados en los países en vías de desarrollo.9
Se ha observado que los defectos mayores de 5 a 7 cm, por lo general no deben ser candidatos a un injerto peroneo no vascularizado. Sin embargo, el origen de este parámetro se respalda en evidencia no específica.10
El objetivo del presente estudio fue demostrar los resultados en la neoformación ósea tibial, utilizando la técnica de inducción de membrana más la transposición de peroné ispsolateral no vascularizado.
Caso clínico
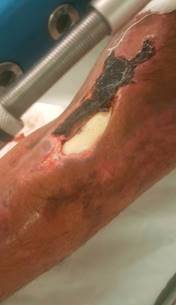
Masculino de 25 años con antecedente de lesión por arma de fuego tipo retrocarga en cara anterolateral y tercio medio de pierna izquierda, con diagnóstico inicial de fractura de tibia izquierda expuesta con pérdida ósea de 7 cm, clasificación Gustilo IIIB, AO 42C3 IO4NV1MT2 (Figura 1).
Manejo inicial: se otorgó manejo inicial en un hospital auxiliar mediante control de daños con fijación externa y múltiples aseos quirúrgicos. Posterior a 20 días de hospitalización se envía al hospital de especialidades para establecer tratamiento definitivo.
Manejo en el hospital de especialidades: se observó a su ingreso pérdida de tejido músculo tegumentario en el compartimento anterolateral del tercio proximal y medio diafisario tibial de aproximadamente 15 cm de diámetro, con exposición de fragmentos óseos (proximal y distal) y pérdida de hueso de aproximadamente 7-9 centímetros de diáfisis tibial, con abundante tejido necrótico circundante y tejido de granulación en tejido celular subcutáneo debido a las terapias de presión negativa proporcionadas previamente (Figura 2). Durante los cuatro primeros meses de hospitalización se realizaron múltiples aseos quirúrgicos y la colocación de injerto cutáneo.

Figura 2: Lesión músculo-tegumentaria posterior a realizar múltiples aseos en hospital de primera atención.
Primera intervención quirúrgica. Al término de los primeros cuatro meses se realizó el primer intento de la técnica de inducción de membrana (colocación de injerto cutáneo y posteriormente la colocación del espaciador de cemento), teniendo una evolución tórpida caracterizada por necrosis tegumentaria del injerto y exposición del polimetilmetacrilato (PMMT) (Figura 3).
Primera reintervención: al haber presentado falla en la intervención inicial se realizó nuevamente la primera fase para la formación de membrana con rotación de colgajo de gastrocnemio medial e injerto cutáneo de muslo ipsolateral y la colocación de cemento óseo, evolucionando satisfactoriamente (Figura 4). Ocho semanas después se realizó la segunda fase colocando injerto óseo de cresta ilíaca, trasposición de 10 cm de peroné no vascularizado y matriz ósea desmineralizada con cierre de membrana (Figura 5); se le agregó una protección con fijación externa monoplanar.

Figura 4: Resultado de nueva colocación de primer tiempo de colocación de PMMC con rotación de colgajo de gastronemio medial y cobertura de injerto cutáneo.
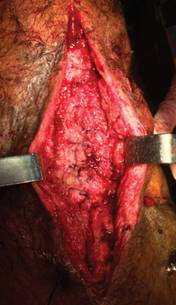
Figura 5: Segundo tiempo con colocación de peroné e injerto de cresta, mostrando cierre de tejido circundante a membrana.
Se retiró la fijación externa a los 10 meses. Al momento de deambular, el paciente presenta fractura lineal de la consolidación ósea proximal (Figura 6).
Segunda reintervención: la presencia de la fractura de consolidación motivó la realización de curetaje y reubicación del injerto de peroné proximal con protección de placa LCP tibia proximal (Figura 7).

Figura 7: Resultado de reintervención de osteosíntesis de fractura de consolidación proximal con placa LCP tibia proximal.
Cuatro meses después de la segunda reintervención, el paciente mostró consolidación completa, con marcha dependiente de bastón y el miembro pélvico izquierdo con heridas afrontadas, sin datos de infección.
Técnica
Primera fase de inducción de membrana posterior a complicación por necrosis tegumentaria y exposición de PMMT: decúbito supino, anestesia regional, asepsia antisepsia, debridación de tejido necrótico, retiro de PMMT y aseo abundante. Se observó pérdida ósea de aproximadamente 7 cm en el tercio proximal con medio diafisario de tibia, con pérdida de músculo tegumentaria circunferencial de 13 cm, se realizó preparación con canalización de fragmentos óseos, se colocó fijación externa monoplanar con preservación de espacio óseo de 7 cm, se preservó el espacio con PMMT en forma cilíndrica de 7 cm, se hizo incisión de 20 cm en cara medial de pierna para la rotación de porción medial de gastrocnemio medial, se realizó cobertura del colgajo con injerto de piel de muslo izquierdo de aproximadamente 12 cm por 10 cm.
Segunda fase de inducción de membrana más colocación de peroné no vascularizado: mediante abordaje lateral tercio medio diafisario de peroné se extrajeron 10 cm de peroné no vascularizado respetando periostio. Posteriormente se realizó abordaje medial diafisario tibial respetando colgajo musculocutáneo de 15 cm, se extrajo el PMMT, se recanalizaron los fragmentos óseos proximal y distal, se colocó transposición de peroné no vascularizado más injerto de cresta y matriz ósea 10 cm3, a continuación cierre cuidadoso de membrana inducida con monocryl.
Discusión
Las pérdidas óseas postraumáticas son un reto para el cirujano ortopedista, en el presente estudio se valoró el uso combinado de la técnica de inducción de membrana con la inclusión de la trasposición de peroné ipsolateral no vascularizado con un defecto postraumático de 7 cm.
Se utilizó el autoinjerto de peroné no vascularizado (libre) debido a que ha demostrado ser un método tan útil y confiable como el injerto vascularizado en lesiones de resección ósea por presencia de neoplasias.11
En la actualidad se han discutido principalmente dos importantes limitaciones de la técnica tradicional de Masquelet: a) la cantidad y fuente de injerto esponjoso necesaria para rellenar adecuadamente el defecto óseo recubierto por la membrana inducida y b) el tiempo promedio para su consolidación que es de ocho meses aproximadamente,12 lo cual a menudo hace que su uso se vea limitado. Otras de las complicaciones más frecuentemente reportadas en la literatura para la técnica de inducción de membrana son: consolidación parcial, necesidad de un injerto secundario o/y mal alineamiento en las extremidades.2
La colocación de autoinjerto de peroné podría disminuir notablemente la necesidad de hueso esponjoso y otorgar un mejor soporte para el apoyo precoz como lo fue en el presente caso.
Una consideración importante a tomar en cuenta para el paciente es el tiempo de apoyo que depende de cada una de las técnicas: en el caso de la realizada por Masquelet se recomienda el apoyo parcial entre el cuarto y quinto mes y la carga completa entre el sexto y octavo mes.13 Por otra parte, en la trasposición de peroné no vascularizado se ha reportado apoyo a partir de la vigésima semana al retirar el fijador externo, alcanzando datos de consolidación radiológica completa a los 12 meses y una hipertrofia y/o tibialización del peroné a los 4.5 años.14
A los cuatro meses de la última intervención por fractura en sitio de anastomosis ósea el paciente en estudio mostró deambular con apoyo únicamente de bastón.











 nova página do texto(beta)
nova página do texto(beta)