Introducción
La displasia fibrosa (DF) es un trastorno benigno que afecta el desarrollo del hueso en adolescentes y adultos jóvenes y representa 7% de los tumores óseos benignos.1 La DF se clasifica en monostótica (afección a un hueso) y poliostótica (múltiples huesos). La primera forma de afección es la más común, en 75 a 80% de los casos. El hipertiroidismo, la hipofosfatemia, la acromegalia, la hiperprolactinemia y la enfermedad de Cushing son factores endócrinos asociados a DF.2 Histopatológicamente la lesión consiste en la sustitución de tejido esponjoso del canal medular por tejido fibroso que resulta en la formación de trabéculas formadas por tejido óseo inmaduro. Este crecimiento anormal ocasiona deformidad y microfracturas patológicas.
Bioquímicamente la elevación del AMPc intracelular secundaria a la mutación de la Gsα puede estimular la expresión de protooncogenes como el C-fos, la expresión de éste puede alterar la diferenciación celular, la proliferación osteoclástica y permitir el desarrollo de la DF. Los niveles elevados de IL-6 ocasionan el incremento desmesurado de osteoclastos en los huesos afectados y se correlacionan con DF.2,3
Ataca por igual a hombres y mujeres. Los huesos más afectados en la DF monostótica son arcos costales (28%) seguidos de fémur proximal (23%) y huesos craneofaciales (20%).3 En la poliostótica las lesiones son más severas y afectan el esqueleto óseo general hasta en 75%, la afectación en fémur se presenta en 90%, en tibia 81%, en pelvis 78% y en pie 73%.
Clínicamente se manifiesta con aumento de volumen, dolor en el hueso afectado, deformidad y alteración de la marcha. La deformidad genera mandíbula prominente, inclinación tibial, nódulos en arcos costales así como la longitud de las extremidades. Las manifestaciones extraesqueléticas son hiperpigmentación de la piel con un tipo de manchas color café con leche, similar al síndrome de McCune-Albright. El síndrome de Mazabraud predispone al desarrollo de DF poliostótica.4,5
Durante el embarazo el aumento de las concentraciones hormonales en pacientes con DF exacerba la proliferación excesiva de osteoclastos en los huesos afectados y un mayor índice de fracturas patológicas.5,6
En la DF el incremento del dolor y del volumen de la lesión dan sospecha de malignización.
La fosfatasa alcalina y la hidroxiprolina urinaria se elevan en 75% de los pacientes con DF, el diagnóstico definitivo es por histopatología.3,5
Radiológicamente se observan lesiones líticas con reacción perióstica, disrupción cortical y tumoración en tejidos blandos, imagen en «vidrio esmerilado», calcificaciones denominadas como signo de las «palomitas de maíz»;6 la tomografía axial computarizada (TAC) delimita la extensión de las lesiones, en la resonancia magnética (RM) las lesiones se observan hipointensas en fase T1 y son variables en T2, con degeneración quística, afectación en tejidos blandos y da sospecha de transformación maligna. En la gammagrafía ósea se identifica la distribución de las lesiones, fundamentalmente en la DF poliostótica, pero cuando el estudio es negativo no excluye la patología.6,7
El tratamiento médico es a base de bifosfonatos orales o intravenosos, los cuales mejoran el grosor cortical; la osificación progresiva y la funcionalidad disminuyen los niveles de N-telopéptido, del diámetro de la lesión y del dolor y previenen las fracturas patológicas en la DF. El tratamiento quirúrgico se aplica cuando falla el tratamiento conservador, corrige la deformidad progresiva y disminuye el dolor. Los malos resultados se observaron con más frecuencia en pacientes con esqueleto inmaduro.7,8,9 El objetivo del presente trabajo es mostrar el resultado exitoso de un caso de displasia fibrosa de fémur proximal manejado con prótesis tumoral.
Caso clínico
Femenino de 30 años de edad con fractura de cadera izquierda a los 15 años de edad no asociada a evento traumático, el manejo fue conservador y la paciente presentó discrepancia en la longitud de ambas extremidades inferiores por acortamiento del lado afectado. A los 29 años de edad, la paciente se embaraza, durante este tiempo el acortamiento de la extremidad afectada aumentó 5 cm. La radiografía de pelvis mostró deformidad radio-opaca en cabeza femoral izquierda en «cayado de pastor» (Figura 1), datos confirmados por tomografía axial computarizada (Figura 2), por lo que se solicitó valoración por endocrinología manejándola con bifosfonatos y su embarazo concluyó adecuadamente. En el puerperio mediato sufrió caída desde su plano de sustentación, contusión directa en cadera izquierda, dolor, incremento de la deformidad, crepitación ósea y la radiografía simple mostró la deformidad ya mencionada con una fractura subtrocantérica en sitio de displasia, imagen de vidrio despulido, de apariencia quística en cuello femoral, zona trocantérica y subtrocantérica (Figura 3). Ante estos hallazgos se le realizó resección del sitio de lesión y colocación del Sistema Modular de Revisión Femoral ArcosMR (Figura 4). A los 10 meses de la operación la evolución de la paciente era satisfactoria (Figura 5).
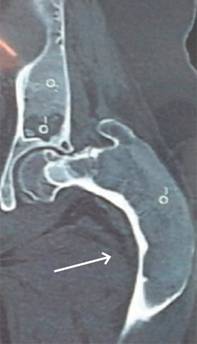
Figura 2: Imagen de una tomografía axial computarizada de fémur proximal izquierdo en la que se observa deformidad con intensidades heterogéneas que involucra cuello y cabeza femoral izquierdos.

Figura 3: Fractura subtroncantérica en sitio de displasia de fémur proximal, deformidad en varo en el sitio de lesión.
Discusión
La DF es una patología benigna que inicia con la presencia de una lesión fibrosa en el canal intramedular. Fue descrita por primera vez en 1938 por Lichtenstein y Jaffe en 1942 reafirmó la presencia de esta patología. La prevalencia e incidencia de esta patología son difíciles de estimar, pero se calcula que conforma 7% de los tumores óseos benignos.1,10,11
DiCaprio MR et al. refieren que esta patología es resultado de la falla en la remodelación del hueso en respuesta al estrés mecánico y en la maduración de las trabéculas óseas. Se asocia a la mutación en el gen Gsα que ocurre en el cromosoma 20q13.2-13.3 3. Además, Cheng J et al. descubrieron en su estudio que existe un incremento en la proliferación y diferenciación inapropiada de los osteoclastos que han sido implicados en la patogénesis de la enfermedad. Cuando se afecta un solo hueso se denomina monostótica y poliostótica cuando varios huesos se ven afectados.5
Las lesiones por DF observadas por estudios radiográficos son hallazgos comúnmente incidentales que determinan la presencia de zonas radiopacas con persistencia del contorno liso cortical, esclerosis, radiolucidez (elementos fibrosos) y soluciones de continuidad (fracturas patológicas). Para determinar la extensión de la lesión a nivel óseo y la afectación de tejidos blandos se utiliza TAC y resonancia magnética nuclear (RMN). La apariencia quística en algunas lesiones corresponde con áreas de necrosis, mientras que la destrucción cortical asociada a masas en tejidos blandos indica degeneración maligna (1% de los casos) con lo que se agrega mayor sintomatología.6
Las formas más frecuentes de degeneración maligna de la DF son osteosarcoma, fibrosarcoma e histiocitoma fibrosa maligna. Anderson N et al. valoraron 1,122 casos en los que reportaron 28 sarcomas secundarios a la degeneración de la DF poliostótica (6.7%) vs. monostótica (1.9%).7
El tratamiento médico para la DF está enfocado en la disminución del dolor que se presenta con mayor frecuencia en adultos que en niños (p < 0.005), afecta por igual a mujeres y hombres. Según Chapurlat RD et al. en el tratamiento deben usarse antiinflamatorios no esteroideos (AINE), analgésicos opiáceos y bifosfonatos para la afección ósea. Actualmente se han utilizado nuevas terapias mediadas por anticuerpos como el tanezumab (anti-NGF) y denosumab (8OPg) así como bloqueadores sensitivos más potentes como inhibidores NGF, antagonistas de la TRPV1, inhibidores de CSFR1 y pregabalina.8
El tratamiento quirúrgico se realiza cuando la DF es muy sintomática o tiene degeneración maligna, por lo que la toma de biopsia es el primer paso. Kushare IV et al. refieren que este tratamiento se aplica si los pacientes presentan dolor considerable, deformidad y/o fracturas patológicas desplazadas y consiste en curetajes, resecciones y colocación de implantes de tipos diversos. Las osteotomías y osteosíntesis se utilizan dependiendo del grado de deformidad.
Debido a las características de la lesión de esta paciente se decidió colocar una prótesis tumoral en fémur proximal izquierdo, ya que este tipo de prótesis tiene menor riesgo de que haya desanclaje del material de osteosíntesis, y gracias a la cual se logró recuperar la longitud correcta de la extremidad inferior afectada,9 lo que se demuestra con la evolución de dicha paciente.











 nova página do texto(beta)
nova página do texto(beta)





