Introducción
La infección de una articulación1,2 con o sin material protésico ha sido uno de los grandes problemas ortopédicos; esto se debe no sólo a su complejidad diagnóstica, sino también a sus efectos devastadores cuando no se trata de manera precoz. La dificultad para diagnosticar una infección articular con o sin implante con gran precisión recae en la falta de un test diagnóstico que se considere estándar de oro, con alto grado de exactitud.3
Estudios como la determinación de VSG y PCR son pruebas muy sensibles (96%), pero poco específicas (59%).3 La determinación de glóbulos blancos en líquido sinovial mayor a 1,700 células/μL o > 65% de polimorfonucleares3 se considera positiva para infección, sólo que estos valores cambian con la articulación que se analiza.4 El cultivo de líquido sinovial presenta una sensibilidad de 81% y especificidad de 94%;5 sin embargo, se cuenta con una incapacidad de 2 a 18% para aislar el germen debido al uso de medios de cultivo inapropiados, formación de biofilm o un período de incubación inadecuado.6,7
Otros marcadores -tales como interleucina 6 (sensibilidad de 87% y especificidad de 100%),8 interleucina 8, alpha 2 macroglobulina- se muestran prometedores,3 pero requieren reactivos e infraestructura compleja, lo que eleva su costo.
La esterasa leucocitaria9,10,11,12,13 es una enzima secretada por neutrófilos que están recluidos en el sitio de infección, ha sido utilizada con éxito como test diagnóstico de un proceso infeccioso urinario;14,15,16,17 hay que recalcar su importancia en otros tejidos y fluidos, como en la determinación de peritonitis bacteriana,18 líquido pleural,19 esputo,20 lavado broncoalveolar,21 oído medio22 y mucosa gástrica.23 Parvizi y colaboradores10 resaltaron en 2011 su utilidad para diagnosticar un proceso infeccioso articular con una sensibilidad de 80.6% y especificidad de 100%.
El cambio colorimétrico de la almohadilla correspondiente a la determinación de leucocitos en el test de la esterasa leucocitaria es debido a la hidrólisis del ácido carbónico heterocíclico por la presencia de esterasa leucocitaria; esta reacción únicamente es posible ante la presencia de leucocitos en líquido sinovial. Una vez hidrolizado el ácido carbónico, reacciona con la sal de diazonio (la cual viene en la almohadilla) y produce la presencia de color violeta en la almohadilla.10
Un proceso infeccioso articular es un reto para el ortopedista, conduce a gastos médicos muy elevados para la institución de salud y el entorno familiar; por ello, diagnosticar de manera temprana y precisa se vuelve no sólo una necesidad de salud, sino un imperativo económico y social. Actualmente, no se cuenta con mucha experiencia en México utilizando el test de esterasa leucocitaria. Este estudio busca mejorar la toma de decisión diagnóstica ante un proceso infeccioso articular y contribuir al entendimiento de la misma. Según nuestra búsqueda realizada en PUBMED, OVID y EBSCO, no se cuenta con estudios para determinar la exactitud que tiene la prueba de esterasa leucocitaria en población mexicana.
Material y métodos
Se diseñó un estudio prospectivo de casos y controles para evaluar la eficacia del test de esterasa leucocitaria de Noviembre de 2015 a Abril de 2016. Se obtuvo consentimiento informado de todos los pacientes previo a la toma de muestra de líquido sinovial; además, esta investigación fue aprobada por el Comité de Ética local.
El primer grupo (casos) se conformó de individuos con diagnóstico establecido de infección periprotésica o artritis séptica de rodilla que ingresaron para ser atendidos en nuestra institución. El segundo grupo (controles) fue formado por sujetos atendidos en nuestra unidad para manejo quirúrgico de patología degenerativa de rodilla, sin proceso infeccioso. Se excluyeron personas inmunocomprometidas por VIH-SIDA, cáncer o tuberculosis, así como enfermos con proceso infeccioso articular que previamente fueron sometidos a aseo y desbridamiento quirúrgico.
El líquido sinovial para ambos grupos fue aspirado de manera intraoperatoria y extraoperatoria mediante técnica estéril tras la realización de asepsia y antisepsia con yodopovidona y aislamiento con campos estériles en la rodilla a evaluar; se utilizó una jeringa de 5 o 10 ml con aguja de 20 g × 32 mm. Todas las muestras procesadas fueron más de 2 ml de líquido sinovial; se excluyeron las muestras insuficientes o francamente hemáticas.
Se utilizó la tira reactiva COMBI-SCREEN 11SYS (Analyticon Biotechnologies, Alemania) (Figura 1) para determinar la presencia de esterasa leucocitaria en líquido sinovial, colocando dos gotas del mismo en la almohadilla correspondiente a la lectura de leucocitos; se evaluaron dos tiras por cada muestra para evitar falsos positivos. La lectura colorimétrica manual fue realizada por dos observadores diferentes del personal de salud dentro de la sala de quirófano o consulta externa. El líquido restante se envió a laboratorio para su cultivo.

Figura 1: Tira reactiva COMBI-SCREEN 11SYS (Analyticon Biotechnologies, Alemania); se marca la segunda almohadilla correspondiente a la determinación de esterasa leucocitaria.
La lectura se estableció a los 120 segundos de acuerdo a recomendaciones del fabricante y se clasificó de la siguiente manera: negativo (blanco), trazas (violeta muy tenue), + (violeta claro) y ++ (violeta oscuro) (Figura 2). Los resultados, tanto del test de esterasa leucocitaria como del cultivo, se vaciaron en una cédula y se agregaron al expediente clínico de los pacientes.
Métodos estadísticos
Se realizó la comparación del resultado del test de esterasa leucocitaria con respecto al resultado del cultivo en ambos grupos. Únicamente el resultado positivo dos cruces del test de esterasa leucocitaria fue considerado positivo para infección articular con o sin implante.
El análisis para el cálculo de sensibilidad, especificidad, valor predictivo positivo y negativo, índice de concordancia Kappa y valores estadísticos se llevó a cabo mediante el programa IBM SPSS Statistics 22, Python versión 2.7.
Resultados
En nuestro estudio se obtuvieron muestras de líquido sinovial de manera intraoperatoria en 63 rodillas y una en consulta externa. Se excluyeron 12 muestras de líquido sinovial debido a que no cumplieron con el volumen mínimo de 2 ml, lo cual nos impedía realizar la prueba de la esterasa leucocitaria y el cultivo. El grupo se conformó de 19 casos (infección articular con o sin implante) y 45 controles (sin infección articular).
La edad media encontrada en nuestro grupo fue de 67 años (en un rango de 27 a 87 años) y una moda de 73 años, con 50% de hombres y 50% de mujeres (32 pacientes por grupo); predominó el lado izquierdo (36 individuos, con un porcentaje de 56%). El grupo de control estuvo conformado por sujetos sin proceso infeccioso articular cuyo diagnóstico más común fue gonartrosis grado IV de Kellgren y Lawrence (43 personas de la cohorte mencionada, 67.2% del total de la población); hubo dos aflojamientos periprotésicos asépticos (3.1%). El grupo de casos estaba formado por enfermos con proceso infeccioso articular con o sin implante protésico asociado; hallamos 12 casos de infección periprotésica (18.8%), cinco de artritis séptica (7.8%), uno de osteomielitis de tibia proximal y uno de seudoartrosis séptica de fémur distal con invasión articular por contigüidad (1.6%, respectivamente).
De los 19 casos categorizados como infectados bajo los criterios institucionales, 11 presentaron cultivos de líquido sinovial positivos y dos más fueron positivos al segundo cultivo. Entre los agentes más comúnmente asilados encontramos Enterococcus faecalis como agente más común (cinco casos, 38.4%) Staphylococcus sp. (cuatro casos, 30.7%) Seudomona aeruginosa (dos casos, 15.3%), Acinetobacter baumannii (un caso, 7.6%) y Enterobacter cloacae/aerogenes (un caso, 7.6%). Cuatro de los pacientes diagnosticados como proceso infeccioso articular que presentaron cultivos negativos fueron sometidos a ciclos de antibióticos antes de la toma de líquido sinovial. Ningún individuo categorizado con ausencia de infección articular reportó cultivo positivo.
Se realizó la prueba de la esterasa leucocitaria en las 64 muestras de líquido sinovial utilizando dos tiras por cada observador; se consideró como positiva para un proceso infeccioso articular (con o sin implante asociado) la lectura colorimétrica de la esterasa leucocitaria con dos cruces (++) y como negativa si el resultado colorimétrico correspondió a negativo, trazas y una cruz (+), de acuerdo con lo recomendado por Parvizi y colaboradores.3 Se encontró una adecuada concordancia interobservador, sin presentarse discrepancia en cuanto a resultado positivo contra negativo. Se identificaron 19 pruebas positivas y 45 negativas. Ningún sujeto del grupo control presentó prueba de esterasa leucocitaria positiva.
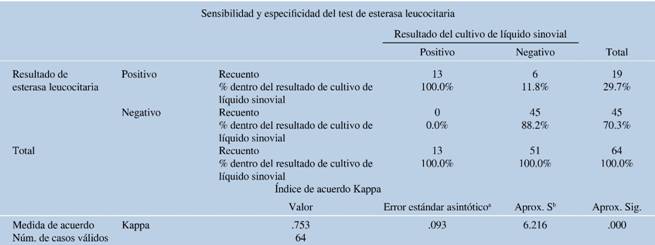
Considerando dos cruces como positiva ante proceso infeccioso articular, la esterasa leucocitaria mostró una sensibilidad de 100%, especificidad de 88.24%, con un valor predictivo positivo de 68.42% y valor predictivo negativo de 100%, con un índice de concordancia Kappa de .753 (Tabla 1).
Discusión
Parvizi y su grupo10 fueron los primeros en demostrar la utilidad de la esterasa leucocitaria con una especificidad y sensibilidad elevadas. En nuestro estudio encontramos una sensibilidad de 100% y especificidad de 88.2%, con un valor predictivo positivo de 68.42% y valor predictivo negativo de 100%; con un índice de concordancia Kappa de .753, congruente con lo reportado. Esto nos permite detectar un proceso infeccioso contra uno inflamatorio en fases tempranas con alta probabilidad de acierto, lo que justificaría la necesidad de realizar un desbridamiento quirúrgico ante una prueba positiva o de más pruebas diagnósticas en caso de ser negativa. Además, cabe resaltar el índice de concordancia Kappa de 0.753 (buena), por lo cual puede ser reproducida en cualquier centro de atención médica.
En nuestros resultados, ninguna de las personas con gonartrosis asociada a proceso inflamatorio o aquellas con aflojamiento periprotésico aséptico presentó resultados colorimétricos positivos de dos cruces; no se contó con pacientes con artropatía por cristales (gota y seudogota) ni procesos inflamatorios reumáticos. Aunque la literatura24 menciona que con dichas artropatías no se obtienen marcadores de esterasa leucocitaria positivos más de una cruz, se recomienda elaborar más estudios con números más representativos para evaluar el comportamiento de la esterasa leucocitaria en dichas patologías.
Para darle el valor adecuado a esta prueba de escrutinio, debemos conocer sus limitaciones. Encontramos, principalmente, dificultad para la lectura colorimétrica ante una muestra contaminada francamente hemática o purulenta, lo cual puede sesgar el resultado. Está reportada en la literatura12,24 la centrifugación de la muestra para separar la contaminación excesiva hemática, con adecuados resultados; sin embargo, para este estudio no se contó con el recurso para comprobar su efectividad. Con respecto a la variación del resultado colorimétrico interobservador, no encontramos subjetividad ante la lectura manual de casos positivos francos (dos cruces) contra los negativos, sólo hallamos discrepancia en cuatro pruebas, ambas negativas, entre negativo y negativo trazas, lo cual no altera ni afecta el resultado ni la reproducibilidad de la prueba.
Recomendamos realizar al menos dos pruebas de esterasa leucocitaria por evento y que este test diagnóstico no reemplace a otras pruebas como el conteo celular de líquido sinovial, VSG, PCR, tinción de Gram y cultivo de líquido sinovial.
Actualmente, no cuenta con amplia difusión en México; el objetivo de este estudio fue demostrar la reproducibilidad y precisión de esta prueba para diagnosticar un proceso infeccioso articular. Consideramos que debe ser herramienta diagnóstica fundamental en cualquier unidad de salud y servicio médico de urgencias. El test de esterasa leucocitaria, por la simplicidad de su uso, puede ser realizado por enfermeras, médicos de pregrado, médicos generales y especialistas de otra rama médica que detecten un proceso infeccioso articular, con alto grado de concordancia al ser reproducido (Kappa de 0.753).
Este marcador diagnóstico es muy prometedor y debemos resaltar la rapidez con la que se pueden obtener resultados confiables de manera sencilla y a bajo costo; sugerimos que debe ser utilizado en individuos que acuden a control a consulta de seguimiento tras una artroplastía total de rodilla cuando se sospeche de un proceso infeccioso articular, en urgencias para la toma de decisión quirúrgica ante una artritis séptica de rodilla, proceso inflamatorio-reumático o sinovitis vellonodular e, incluso, de manera transquirúrgica para corroborar la ausencia de proceso infeccioso articular antes de la colocación de componentes protésicos en cirugías de revisión, ya que aumenta la habilidad del cirujano para detectar de manera intraoperatoria un proceso infeccioso.
Es necesario continuar realizando más estudios para establecer los casos falsos positivos de esta prueba, así como aumentar la precisión diagnóstica ante un proceso infeccioso articular con o sin implante asociado y disminuir las complicaciones de un tratamiento tardío.
Conclusiones
Con una sensibilidad de 100% y especificidad de 88.2%, un VPP de 68.4% y VPN de 100%, consideramos que la esterasa leucocitaria es una prueba de fácil uso, portátil, sensible y específica que puede descartar rápidamente un proceso infeccioso articular. Nuestro estudio demuestra los beneficios de esta prueba.











 nueva página del texto (beta)
nueva página del texto (beta)