Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta ortopédica mexicana
versión impresa ISSN 2306-4102
Acta ortop. mex vol.28 no.5 Ciudad de México sep./oct. 2014
Artículo de actualización
Tribología moderna en artroplastía total de cadera: pros y contras
Modern tribology in total hip arthroplasty: pros and cons
Gómez-García F*
Hospital Ángeles Mocel.
* Académico Titular de la Academia Mexicana de Cirugía,
Profesor Titular de la Residencia de Ortopedia, Universidad La Salle;
Hospital Ángeles Mocel, Coordinador de Cadera en la Clínica de Osteoartritis del Hospital Ángeles Pedregal,
Editor en Jefe de Acta Ortopédica Mexicana.
Dirección para correspondencia:
Acad. Dr. Felipe Gómez García
Gob. Ignacio Esteva 107-03,
Col. San Miguel Chapultepec, CP 11850,
Del. Miguel Hidalgo, México, DF.
E-mail: sla@prodigy.net.mx
RESUMEN. Los productos de desgaste y las reacciones adversas que se generan en las superficies de rodamiento constituyen uno de los mayores desafíos en las sustituciones protéticas, ya que cada día se someten a mayores demandas por un cada vez mayor número de pacientes jóvenes y adultos mayores con expectativas de vida prolongadas y notable actividad. El objetivo de esta revisión es analizar los pros y contras en cuanto a los avances de los componentes de rodamiento de las superficies articulares de las artroplastias totales de cadera contemporáneas. También se discutirán las estrategias que se han seguido a lo largo del tiempo, sus problemas, resultados y el papel que desempeña el cirujano en la prescripción del par tribológico que mejor se adapte a las necesidades de cada paciente. Al final se hacen recomendaciones prácticas para prescripción y manejo de los pares articulares contemporáneos en artroplastia total de cadera.
Palabras clave: artroplastia, cadera, prótesis, utilidad.
ABSTRACT. The wear products and adverse reactions that occur on bearing surfaces represent one of the greatest challenges in prosthetic replacements, as the latter experience increasing demands due to the large number of young and older adult patients that have a long life expectancy and remarkable activity. The purpose of this review is to analyze the pros and cons of the new advances in the bearing components of the articular surfaces of current total hip arthroplasties. We also discuss the strategies used historically, their problems, results and the surgeon's role in prescribing the tribologic couple that best fits each patient's needs. We conclude with practical recommendations for the prescription and management of the latest articular couples for total hip arthroplasty.
Key words: arthroplasty, hip, prosthesis, utility.
Introducción
La meta principal de un implante es lograr la máxima longevidad posible y la estabilidad es el punto cardinal para lograrlo. La estabilidad puede definirse como la serie de eventos que deben ocurrir entre el implante y el hueso para lograr una respuesta biológica equilibrada que permita la presencia de un cuerpo extraño potencialmente generador de efectos indeseables, que está sujeto a grandes esfuerzos y debe permanecer por largos períodos in situ sin que cause un detrimento significativo de las propiedades biológicas y mecánicas del receptor.
Hay dos tipos de estabilidad claramente definidos por el tiempo y por los eventos que tienen que acontecer para obtenerla. Una es la estabilidad primaria o mecánica, que se logra en el momento mismo de la operación y se alcanza por el diseño del implante, los materiales con que se fabrica, los métodos alternos de fijación y la técnica quirúrgica. La estabilidad secundaria o biológica se logra con el paso del tiempo a través de adecuados fenómenos biológicos de remodelamiento óseo, preservación de la salud general y ósea y de ciertas contingencias que pueden estar relacionadas con los materiales implantados. La estabilidad biológica es la responsable del buen funcionamiento a largo plazo de la prótesis y es en este tipo de estabilidad donde ejerce mayor influencia la tribología (ciencia que estudia la fricción, el desgaste y la lubricación que tienen lugar durante el contacto entre superficies sólidas en movimiento) entre los pares de rodamiento endoprotéticos.
La modificación a los diseños protéticos y a los materiales con los cuales se fabrican ha sido la estrategia preferida por autores y diseñadores para obtener mejores resultados de estabilidad. Con este motivo, han aparecido en el mercado una multitud de formas, tamaños de prótesis y superficies tribológicas hechas con diferentes materiales; cada una de ellas con una filosofía propia y justificaciones racionales para su utilización. Esta efervescencia en investigación, ideas, conceptos y teorías ha traído como consecuencia un gran debate en este campo y, entre otras cosas, un cierto grado de confusión entre los cirujanos ortopedistas acerca de cuáles son los implantes que tentativamente ofrecen mejores ventajas para sus pacientes. La tribología forma parte activa en lo anterior, por lo que es conveniente que estemos bien informados de los avances y limitaciones en este campo.
Objetivo
Revisar y analizar los pros y los contras de los avances en el diseño de componentes de rodamiento de las superficies articulares de las artroplastías totales de cadera contemporáneas, ya que esto representa hoy por hoy el desafío más importante en las sustituciones protéticas, pues cada día se les obliga a someterse a mayores demandas por un cada vez mayor número de pacientes jóvenes y adultos mayores con expectativas de vida prolongadas y notable actividad. También se discutirán las estrategias que se han seguido a lo largo del tiempo, sus resultados, problemas y el papel que desempeña el cirujano en la prescripción del par tribológico que mejor se adapte a las necesidades de cada paciente.
Polietileno
Las resinas de polietileno son simplemente una repetición en cadena de las moléculas de monómero de etileno. Las modalidades de baja densidad, alta densidad y ultra alto peso molecular se refieren a su peso molecular, a la longitud de sus cadenas y a la disposición de las mismas. Los polímeros tienen regiones cristalinas y amorfas que pueden sufrir afectaciones en sus propiedades fisicoquímicas dependiendo del porcentaje y la disposición que guarden entre sí las regiones que los componen (Figura 1).

En general, los polímeros con mayores porcentajes de regiones cristalinas tienen mejores módulos elásticos y muestran una mayor resistencia a la propagación de microfracturas; sin embargo, pueden ser más susceptibles a los efectos de la oxidación.
En la década de 1959, comenzó la fabricación comercial de resina de polietileno de ultra alto peso molecular (UHMWPE) y ha tenido avances y mejoras significativas con el paso del tiempo. La tabla 1 resume su evolución histórica.
Aunque hay diversas empresas que fabrican polietilenos de calidad médica, TICONA es actualmente el principal fabricante de resina de UHMWPE de grado médico, con plantas en Estados Unidos de Norteamérica y Alemania. Todas las resinas de TICONA tienen la designación "GUR", seguida por un indicador numérico. Las resinas de grado médico se denominan GUR 1020, 1120, 1050 y 1150. El primero de los cuatro números ("1") indica que el polímero es designado para el implante ortopédico. El segundo dígito señala la presencia ("1") o ausencia ("0") de estearato de calcio, compuesto añadido anteriormente para lubricar e inhibir la corrosión en las plantas fabricantes de UHMWPE y para disminuir el color amarillento de los implantes. El tercer número indica el peso molecular ("2" si va de dos a cuatro millones y "5" si es mayor a cuatro millones). El cuarto dígito es un código corporativo interno que se reserva para futuras nuevas resinas o modificaciones a las mismas. Con el abandono general de estearato de calcio en 1985, los materiales más populares son GUR 1020 y GUR 1050.
Polietilenos con elevado entrecruzamiento de enlaces
Es bien conocido que las partículas de desgaste producidas por los polietilenos de alta o ultra alta densidad son las que limitan la duración de los implantes, ya que generan una respuesta inflamatoria seguida de osteolisis periprotética y aflojamiento subsecuente de los implantes. La respuesta de la industria a este problema ha sido el desarrollo de polietilenos con elevado entrecruzamiento de enlaces, pues se ha demostrado que la resistencia al desgaste se mejora significativamente con el alto entrecruzamiento de sus cadenas.
Este elevado entrecruzamiento se obtiene mediante la creación de enlaces covalentes que interconectan los radicales libres de los polímeros originales. El proceso consiste esencialmente en generar una estructura que contenga fibras orientadas en múltiples direcciones, que es diferente a la orientación fibrilar que portan los materiales tradicionales, donde las fibras se orientan básicamente en el sentido de sus cadenas principales.
La explicación de cómo se aprovecha la propiedad mecánica de estructuración reticulada para disminuir la tasa de desgaste se puede exponer de la siguiente manera. Sabemos que durante las actividades cotidianas, las fuerzas que actúan sobre las articulaciones son multidireccionales, pero tienen un sentido de movimiento principal. Estos patrones de movilidad pueden ocasionar la aparición de deformaciones plásticas en ese sentido de movilidad. En materiales no biológicos, este tipo de deformación da origen a la aparición de partículas de desgaste. Al poseer los polietilenos altamente cruzados una estructura reticulada con moléculas orientadas en varios sentidos, se produce una mayor cohesión de sus estructuras, haciéndolas más resistentes a los efectos de movilidad multidireccional. Si, además, agregamos a lo anterior que estos polietilenos tienen una menor cantidad de radicales libres que puedan reaccionar con el oxígeno, se logra una menor tasa de oxidación. La mayor cohesión estructural y la menor oxidación limitan el desgaste acelerado. Las tasas de desgaste comprobadas en ensayos clínicos preliminares y en pruebas de laboratorio con este polietileno llegan a ser de niveles comparables a las obtenidas con superficies duras como la cerámica y el metal.
Como se verá más adelante, los polietilenos con enlaces altamente cruzados se fabrican con diversas tecnologías. La más utilizada es la aplicación de radiaciones ionizantes electromagnéticas tipo gamma o con haces de electrones a dosis de entre 5 y 10 Mrads, ya sea que se apliquen en frío o a temperaturas elevadas, en ambientes de aire o en atmósferas de nitrógeno. No obstante lo anterior, debe mencionarse que existe un límite de dosis de radiación; actualmente sabemos que cuando se aplican dosis superiores a 10 Mrads se logra un mayor entrecruzamiento de enlaces; sin embargo, a pesar de que el alto entrecruzamiento mejora la resistencia al desgaste, también reduce algunas de sus propiedades mecánicas, haciéndolo más frágil, menos duro y con menor resistencia a la tensión y al flujo frío. Lo anterior se traduce en una disminución de su módulo de elasticidad, dureza y capacidad de frenar la propagación de microfracturas estáticas y/o cíclicas. Estas alteraciones pueden contribuir a una falla in vivo del dispositivo, tal como la rotura por fatiga en regiones sujetas a gran tensión (por ejemplo, en el mecanismo de bloqueo del inserto contra la base metálica) o a traumas continuos (Figura 2).

También debe mencionarse que existe otra forma de lograr altos entrecruzamientos, que es la utilización de métodos químicos mediante la adición de peróxidos o silanes. El uso de peróxidos orgánicos puede lograr entrecruzamientos sustanciales en el polietileno, pero no ha sido aprobado por los organismos reguladores internacionales para su utilización en implantes ortopédicos. En general, estos métodos químicos se utilizan en diversos campos industriales, pero se encuentran en desuso para la elaboración de implantes ortopédicos.
Para limitar los efectos indeseables, se han desarrollado mejoras tecnológicas en la fabricación de los polietilenos. Por su importancia, destacan el tipo de resina de polietileno utilizada, el grado de densidad, el proceso de manufactura de las barras o placas para maquinar el implante, los métodos de entrecruzamiento de enlaces que se emplean -en los actuales polietilenos, el momento en que se adicionan agentes antioxidantes- y los diferentes métodos de esterilización y empaque (Figura 3).

Además de las características con las que se fabrica la resina, se han encontrado otras variables que también influyen en el comportamiento de los polietilenos, como la degradación in vivo secundaria a oxidación, el tiempo de almacenamiento del implante ya empaquetado antes de su uso, el flujo frío y el desgaste ocasionado por un tercer cuerpo. Para la prescripción de implantes de polietileno, se debe tener muy en cuenta que los procesos de fabricación son similares, pero hay ciertos matices que los diferencian y es en estas diferencias donde se expresan los efectos de comportamiento clínico de cada uno de ellos (Figura 4).

Como se puede observar en la figura 4, se tienen que efectuar dos pasos básicos obligatorios para producir los polietilenos con elevado entrecruzamiento. El primer paso es irradiarlo; sin embargo, un serio problema es que con ello se causa una separación entre las cadenas de polietileno, lo que resulta en la creación de radicales libres residuales (peroxi). Estos radicales libres pueden seguir varias rutas: a) reaccionar con otros compuestos químicos, principalmente con el oxígeno; b) unirse otra vez con sus cadenas originales y c) formar entrecruzamientos con otras cadenas poliméricas. Si no ocurre ni "a" ni "b", los radicales permanecen libres y tienden a ubicarse en las zonas cristalinas del polietileno.
Como es muy importante disminuir los radicales libres postradiación, se tiene que seguir un segundo paso, que es estabilizarlo. Este efecto se logra calentando al polietileno, ya que al hacerlo, el material pierde su conformación (temporal o definitivamente) en las diversas zonas que integran su estructura química. En este momento, los radicales libres pueden entrecruzarse o permanecer como tales. Por lo anterior, las diferentes compañías han desarrollado protocolos de fabricación para disminuir la cantidad de radicales libres residuales en estos polietilenos. Para el calentamiento se han utilizado temperaturas por debajo del punto de derretimiento (± 130 oC) (annealing) y por encima del mismo (melting). Calentar el material por debajo de la temperatura de derretimiento produce cambios temporales, mientras que al derretirlo por arriba de su temperatura de fusión, los cambios son irreversibles.
Otra forma de disminuir la oxidación es adicionar agentes antioxidantes como el tocoferol. Este punto se tratará más adelante.
Es relevante hacer notar que los procesos antes mencionados son diferentes entre los productos comercialmente disponibles (Tabla 2), por lo que cada producto es único y se requiere que cada uno de ellos sea estudiado y evaluado individualmente. Ha quedado al albedrío de las casas fabricantes cuál es la metodología elegida para incorporarla a sus productos y marcas comerciales, pero a los cirujanos nos corresponde el seguimiento de sus resultados a largo plazo para la adecuada prescripción de los mismos.
La tasa de desgaste como elemento de evaluación de la calidad de los polietilenos
Aunque existen diversas variables que determinan la reactividad biológica de los productos de desgaste -como el tamaño de las partículas y su naturaleza fisicoquímica-, la tasa de generación de los productos de desgaste es el principal problema; por lo tanto, este parámetro ha sido el más utilizado para medir su calidad.
No obstante que existen dificultades para medir el desgaste del polietileno in vivo y es difícil calcular o predecir la tasa anual de desgaste debido a la presencia de una enorme diversidad de factores intrínsecos y extrínsecos, se ha estimado que en polietilenos de ultra alto peso molecular convencionales (sin enlaces altamente cruzados), el desgaste puede ser de entre 0.008 y 0.24 mm/año. Estas tasas de desgaste fueron comprobadas, entre otros, por Saikko y colaboradores (Acta Orthop Scand. 1993), quienes compararon el desgaste in vitro de cabezas femorales modulares de cerámica alúmina versus un polietileno convencional utilizando cinco sistemas protéticos con cabezas de diferentes metales (acero inoxidable con Müller y Charnley-Elite, Mallory Head con ion-implanted Ti-6Al-4V y Co-Cr-Mo con Lubinus y PCA) sometidos a una marcha simulada de tres millones de ciclos. El menor promedio de desgaste fue en polietileno contra cerámica (0-0.008 mm/año), mientras que el mayor desgaste fue ocasionado en metal sobre polietileno (0.005-0.24 mm/año). El comparativo de las tribologías metálicas entre sí mostró que la cabezas de acero inoxidable ocasionaron las mayores tasas de desgaste, seguidas de las cabezas de Ti-6Al-4V. La menor tasa fue con cerámicas.
Con el empleo de estos novedosos procesos para la fabricación de polietilenos, se ha podido demostrar una disminución dramática en las tasas de desgaste cuando se compara el polietileno con elevado entrecruzamiento de enlaces contra los polietilenos estándar de ultra alto peso molecular fabricados con diversas tecnologías.
Esterilización
Para esterilizar a los componentes articulares de polietileno, se emplean principalmente dos métodos: 1) tratamiento de superficie o 2) aplicación de radiaciones ionizantes. Estos métodos tienen efectos específicos in vivo e in vitro en el desempeño del material.
Los métodos de superficie más frecuentemente utilizados para esterilizar al polietileno son 1) el uso de óxido de etileno (OEt) y 2) el gas plasma. Aunque el OEt es muy tóxico, es bien tolerado por el polietileno, ya que no reacciona químicamente con este material. La esterilización con gas plasma se efectúa a baja temperatura y requiere menor tiempo que el que se emplea con el OEt. Esta tecnología es más reciente que la del Oet, pero su utilización es aún limitada.
Ya se ha mencionado que un serio problema es que la radiación causa una separación entre las cadenas de polietileno que ocasiona la creación de radicales libres residuales que pueden combinarse con el oxígeno durante su almacenamiento y aun después de su implantación. La oxidación, la creación de enlaces cruzados y el número de enlaces cruzados son dependientes de la dosis de radiación suministrada y de la atmósfera donde la radiación toma lugar. Estos efectos ocasionan reacciones adversas en las propiedades mecánicas del polietileno.
Para un mejor entendimiento de los efectos que ocasiona la esterilización sobre el pronóstico de desgaste, haré referencia a una serie de estudios hechos por McKellop y colaboradores (J Bone Joint Surg Am. 2000 y J Orthop Res. 1999), quienes en dos estudios examinaron los efectos sobre el desgaste usando diferentes métodos de esterilización agregando o no estearato de calcio. Antes de iniciar las pruebas, todos los especímenes recibieron una dosis promedio de 2.7 Mrad y en ambas pruebas se emplearon dos diferentes ciclos de marcha simulada. En el primer estudio, el polietileno se sometió al proceso de envejecimiento térmico. En esta prueba, se revelan tasas de desgaste casi idénticas para copas acetabulares con pesos moleculares distintos; ocurre lo mismo en las copas con pesos moleculares del mismo rango con o sin un agregado de estearato de calcio. En el segundo estudio, el polietileno se envejeció aceleradamente usando temperaturas de 80 oC por 14 días. En este estudio, se pudo observar que las copas que fueron esterilizadas con radiación gamma en aire muestran tasas más bajas de desgaste que las esterilizadas con óxido de etileno, presumiblemente debido al entrecruzamiento de enlaces inducidos por la irradiación. Otra observación fue que las copas que se irradiaron mientras permanecían empacadas en un vacío parcial (para minimizar la presencia de oxígeno) inicialmente mostraron menores tasas de desgaste que las irradiadas en el aire, pero el desgaste fue similar cuando se penetró la capa más superficial oxidada y se alcanzó la zona subyacente más entrelazada.
Después del envejecimiento artificial para acelerar la degradación oxidativa de los materiales, las tasas de desgaste son marcadamente diferentes. Los análisis realizados después de desgaste indican que las copas radiadas (es decir, las altamente cruzadas) exhibieron una proporción menor de productos de desgaste. El examen microscópico mostró una longitud más corta de las fibrilaciones y una mayor cristalinidad. Fue evidente que la radiación gamma en un ambiente pobre en oxígeno reduce el nivel de oxidación y aumenta el nivel de entrecruzamiento en la región superficial de las copas.
Los investigadores concluyeron que antes del envejecimiento del polímero, los efectos de la radiación para esterilizarlo (incluso en un entorno de oxígeno) proporcionaron mejoras en las tasas de desgaste en comparación con aquellos componentes que nunca se esterilizaron o que fueron esterilizados con óxido de etileno. Sin embargo, la oxidación y la fragilidad resultante en el polietileno hacen que se pierdan las ventajas de la radiación.
Por lo que se ve, la aplicación de estas tecnologías para disminuir las tasas de desgaste y esterilización pueden tener como consecuencia la disminución de las propiedades físicas y mecánicas. Las propiedades que potencialmente pueden ser alteradas son las diferencias en la concentración de radicales libres, en oxidación, cristalinidad y resistencia tensional.
Efectos de los diversos materiales en cabezas
femorales sobre los polietilenos
Se ha demostrado en estudios in vitro e in vivo que el polietileno con gran cantidad de enlaces cruzados es superior al polietileno convencional en cuanto a sus propiedades de resistencia al desgaste y generación de partículas y que la combinación con superficies cerámicas (como el óxido de aluminio o la circona ceramizada) puede mejorar sus características de desgaste, ya que las cerámicas son más hidrófilas que cualquier aleación metálica, por lo que mejoran su lubricación. También es posible obtener superficies con mayor perfeccionamiento en el pulido en la cerámica que en los metales, por lo que disminuye el índice de fricción contra el polietileno; por su dureza, son más resistentes al rayado -lo que se traduce en una mayor protección contra accidentes- y a la presencia de terceros cuerpos.
Polietilenos medicados con vitamina E
La incorporación más reciente para prevenir el riesgo de oxidación en los polietilenos altamente cruzados, en especial por el problema que representan los radicales libres residuales después de irradiación, es la adición a la resina de vitamina E (alfa tocoferol). Esta alternativa se encuentra aún en fase de investigación; sin embargo, los resultados preliminares en laboratorio y en vivo son altamente esperanzadores. Para incorporar este elemento, se utilizan dosis de entre 0.1 y 0.3% del peso que se mezclan con la resina GUR 1050, que luego es irradiada y calentada. Actualmente, se continúan desarrollando tecnologías para incluir en todo el polietileno la presencia de la vitamina E y no sólo en la superficie, como se hizo en los polietilenos precursores.
Cuando este material se compara con el polietileno virgen que no contiene vitamina E, se encuentran tasas de oxidación entre 50 y 100 veces menores entre el UHMWPE medicado y el no tratado, mientras que el porcentaje de cristalinidad no varía entre uno y otro. Según Oral (Biomaterials. 2005), la mejoría en la resistencia a la fatiga ha sido hasta de 58%, lo que eliminaría la necesidad de tratamientos térmicos para excluir los radicales libres. Sin embargo, no existen aún suficientes estudios prospectivos, comparativos, aleatorizados, con tamaños de muestra suficientes y con seguimientos mayores a 10 años, por lo que debemos estar atentos a los resultados de los pacientes en seguimiento a largo plazo.
Respuesta clínica a los polietilenos altamente cruzados
Es conveniente recordar que el uso clínico de los polietilenos con alto entrecruzamiento se inició en 1998 y, por tanto, la experiencia clínica a mediano plazo es limitada. Los estudios disponibles hasta el momento son en su mayoría comparaciones, pruebas de materiales in vivo y en laboratorio y seguimientos cortos.
La bibliografía de reportes en fallas del polietileno altamente cruzado es muy escasa y, aparentemente, las tasas de falla son muy bajas si se toma en cuenta el número de implantaciones contra el número de fallas. No obstante lo anterior, desde hace tiempo han empezado a aparecer artículos en los cuales se observa una disociación entre los resultados de los estudios en laboratorio y los resultados clínicos cuando se analizan insertos de polietileno altamente entrecruzado que fueron retirados en revisiones por causas distintas a la fatiga de material. En ellos se ha observado pérdida del maquinado, así como la presencia de defectos que sugieren patrones de desgaste mucho mayores a los reportados en estudios con simuladores de cadera. También debe tenerse en cuenta que las características fisicoquímicas de las partículas del desgaste de los polietilenos altamente cruzados son diferentes en tamaño, forma y potencialidad reactiva biológica que las observadas en polietilenos convencionales, por lo que este punto constituye un foco de atención futura. Por las razones anteriores, es conveniente tener cautela a la hora de abrazar estas innovaciones. Afortunadamente, ha habido avances significativos en el desarrollo de este material y sólo es cuestión de tiempo para que se culmine el seguimiento de numerosos estudios que están en curso tendientes a cumplir el propósito de evaluar realmente el lugar que debe ocupar esta nueva herramienta terapéutica en la artroplastía total de cadera. Debemos recordar que los polietilenos con elevado entrecruzamiento de enlaces son diferentes entre sí.
Metal-metal
En los últimos años, ha habido un renacimiento de la tribología metal-metal. Los investigadores en el comportamiento de los metales y sus efectos en seres vivos nos dicen que todos los metales que contactan con sistemas biológicos sufren de un proceso electroquímico llamado corrosión, que tiene como efecto generar iones metálicos que al interrelacionarse con proteínas endógenas, pueden activar el sistema inmune y generar respuestas indeseables. Hoy sabemos que la tribología metal-metal genera iones y partículas que están directamente relacionados con el tipo de aleación metálica, el diseño de los componentes y el posicionamiento de los implantes.
El Dr. Hans Georg Willert publicó en el 2005 un artículo en el que correlaciona las reacciones de hipersensibilidad con la liberación de iones en implantes metal-metal que ocasionaron cambios indeseables en los tejidos periprotéticos. Este autor acuño el término de "ALVAL", que por sus siglas en inglés (aseptic lymphocytic vasculitis and associated lesion) significa una vasculitis aséptica ligada a linfocitos asociada a otras lesiones. Las lesiones son abundancia de fibrina, acúmulos de células macrofágicas y de eosinófilos con focos de necrosis. Actualmente, entendemos el ALVAL como aquellas lesiones representadas por una histología dominada por linfocitos B y células plasmáticas que sugieren una respuesta inmune, con un patrón histológico parecido, pero no igual, al de una reacción de hipersensibilidad tardía grado IV.
Desde la publicación del artículo de Willert, han aparecido una multitud de reportes que asocian la tribología metal-metal con diversos tipos de reacciones adversas, en especial, la hipersensibilidad mediada por células y la formación de seudotumores sólidos o con contenido líquido, algunos de ellos con necrosis granulomatosa. También se ha intentado explicar la patogénesis de las reacciones alérgicas asociándola a la presencia de ciertas inmunoglobulinas como la HLA DR+ CD8+e, interleucinas como la IL-8 y la IP-10, entre otras substancias.
Llama la atención que no sólo han aparecido alteraciones locales, sino también efectos sistémicos caracterizados por linfopenia de células T. Por otra parte, las características metalúrgicas (ej. bajo contenido de carbono) y las de diseño (ej. baja tolerancia de los implantes), al igual que el mal posicionamiento (ej. pinzamiento de bordes) han jugado un papel importante en el incremento de iones y partículas, con la consecuente aparición de fenómenos alérgicos y otras reacciones adversas. Todas estas alteraciones se manifiestan por dolor disfuncional o aflojamiento protético que obligan a un recambio. Están bajo observación los posibles efectos teratogénicos y de carcinogénesis a largo plazo.
Una situación que, en cierta forma, confunde es el hecho de que aunque hay suficientes evidencias de la relación entre iones y partículas metálicas con reacciones adversas, no todas las lesiones derivadas de ello presentan las mismas características clínico-patológicas ni el mismo patrón histológico. La confusión no sólo se limita a las descripciones histológicas de las lesiones, sino también a su nomenclatura, ya que las reacciones indeseables se describen con distintos nombres: alergia, hipersensibilidad, seudotumores, metalosis, ALVAL y generalizaciones tales como "reacciones adversas a metales".
En un intento para poner orden, se han presentado propuestas para clasificar y calificar los hallazgos histológicos. Esto se ha hecho mediante un descripción fraccionada de los hallazgos relacionados con la membrana sinovial, el tipo de infiltrado inflamatorio y cómo se organizan los tejidos.
No obstante estos avances, aún quedan preguntas por responder por patólogos, inmunólogos y cirujanos interesados en el estudio de este campo: ¿son diferentes los mecanismos inmunológicos?, ¿son distintas fases de un mismo proceso?, ¿son reacciones individuales a la misma noxa? y ¿qué hace falta para uniformar los criterios histológicos?
En fin, esta parte de historia es importante; sin embargo, algo que nos interesa sobremanera a nosotros los cirujanos comunes y corrientes es saber cuál es la importancia clínica. Para contestar esta pregunta, primero debemos saber cuál es la magnitud del problema. Sabemos que la incidencia de hipersensibilidad a metales en seres humanos en población general puede llegar hasta 15%; en trabajadores metalúrgicos, a 10% y en pacientes con implantes metálicos, a la nada despreciable cifra de 5.4%.
En cuanto a la incidencia de ALVAL, es difícil saberlo, en parte por las dificultades de clasificación de tejidos ya anteriormente mencionadas y por la escasez de patólogos bien calificados para identificarla. Sin embargo, en los peores reportes, la incidencia no sobrepasa de 3%.
Con relación a la incidencia de seudotumores, tenemos el mismo problema. En una serie multicéntrica canadiense que incluye 3,232 caderas, se pudo identificar sólo un seudotumor y en la serie inglesa del Nuffiel Orthopaedic Centre de 1,419 caderas, se detectaron 22 de estas lesiones. Muy recientemente, se han publicado estudios con pacientes "asintomáticos". En uno de ellos, se evaluaron un total de 201 caderas con una media de seguimiento de 61 meses usando para la detección ultrasonido y resonancia magnética. En estos pacientes "asintomáticos", se encontró una frecuencia de siete seudotumores (4%). Este estudio sugiere que la presencia de seudotumores en pacientes aparentemente "normales" puede aumentar la cifra de incidencia general de este problema.
Con las evidencias anteriores, podemos decir hasta hoy que son pocos los pacientes con prótesis meta-metal que desarrollan reacciones adversas que obliguen a efectuar un recambio.
Es importante mencionar que no todos los diseños metal-metal son iguales. El registro australiano de artroplastías documenta que hay modelos con altas tasas de falla. Menciona que las prótesis de resuperficialización ASR®, Durom® y Cormet® son las que tienen la mayor incidencia de falla. Recientemente se agregó a esta lista la prótesis Bionik®. Los implantes Cormet® ya fueron retirados del mercado australiano.
En cuanto al diagnóstico no invasivo, los estudios de mayor utilidad son la radiología simple, el ultrasonido, la tomografía axial y la resonancia magnética. Debe mencionarse que las pruebas clásicas utilizadas para detectar hipersensibilidad o alergia por otras especialidades médicas (pruebas de sensibilidad de migración y parches dérmicos) no tienen la suficiente sensibilidad ni especificidad, por lo que hay un consenso entre ortopedistas que no deben utilizarse. Los estudios de laboratorio considerados como estándar de oro para el diagnóstico de hipersensibilidad inducida por metales son los ensayos de proliferación linfocítica, análisis de algunas citoquinas usando ELISA e inhibición de migración linfocítica. Otras citoquinas como la IL-8 y la IP 10 aún están bajo estudio, pero podrían ser de futura utilidad. En fin, estamos aún lejos de tener una prueba única confiable para el diagnóstico de hipersensibilidad a metales en paciente con implantes ortopédicos, por lo que tendremos que utilizar diversos recursos para llegar al diagnóstico, sobre todo en etapas tempranas. Mientras tanto, debemos estar muy atentos con pacientes que se consideren como de alto riesgo, como los portadores de componentes pequeños, género femenino de talla baja, prótesis colocadas en terreno de alteraciones anatómicas significativas (ej. displasia acetabular), con posicionamiento inadecuado de los implantes y con antecedentes alérgicos a metales.
La Agencia Regulatoria de Medicamentos y Cuidados para la Salud del Reino Unido ha emitido una serie de recomendaciones para pacientes que se han sometido a una artroplastía con tribología metal-metal. Como medidas generales recomienda:
a) Hacer un seguimiento anual mínimo de cinco años o más frecuentemente si hay síntomas.b) Deben medirse los niveles de metales y hacer estudios imagenológicos con resonancia magnética y ultrasonido en pacientes con mal posicionamiento de implantes, cuando son portadores de prótesis de recubrimiento de tamaño pequeño, en los casos donde hay preocupaciones del paciente y el cirujano acerca del comportamiento del metal-metal y en modelos con elevadas tasas de falla.
c) Si los niveles de iones metálicos son elevados, reforzar la vigilancia y, en caso necesario, hacer estudios imagenológicos especiales.
d) Si estos estudios revelan reacciones en tejidos blandos periprotéticos, debe considerase la cirugía de revisión.
En el 2012, la Federal Drug and Food Administration (FDA) lanzó un memorándum (Executive Summary memorandum metal-on-metal hip implant systems) para alertar sobre el uso, indicaciones y manejo de pacientes portadores de implantes metal-metal.
Como comentario, mencionaremos que las reacciones adversas a materiales protéticos en implantes metal-metal son poco frecuentes, pero debemos vigilarlas y estar alertas a la evolución de su perspectiva histórica y al desarrollo de los métodos de diagnóstico temprano para esta entidad, que parece estar dominada por implantes con tribología de metal-metal.
Modularidad y reacciones adversas
La modularidad entre la cabeza femoral y el cono del vástago femoral tiene diversos beneficios, que incluyen, entre otros, la posibilidad de hacer ajustes de lateralización de la cadera y longitud de la extremidad, cambiar únicamente la cabeza femoral cuando es necesario y disminuir el inventario de implantes en los hospitales.
Sin embargo, desde hace tiempo sabemos que la unión íntima de metales diferentes (titanio/cobalto-cromo) puede causar corrosión galvánica y, cuando hay diseños defectuosos (en especial en cuanto a tolerancias), puede haber una corrosión por frotamiento (Figura 5). No obstante lo anterior, las mejoras en la fabricación y diseño de esta parte de las prótesis ha permitido el uso universal de modularidad entre cabeza/vástago.

Debido al éxito de la modularidad, se ha puesto escasa atención a los problemas que pueden surgir de la misma. Recientemente, se ha identificado que la corrosión generada en esta parte de los sistemas puede presentar alteraciones similares a las de la tribología metal-metal, como son elevados niveles de metales en suero, depósitos de metales en tejidos blandos periprotéticos o reacciones adversas a tejidos blandos.
Un nuevo espacio de atención es el que se relaciona con las reacciones adversas en la modularidad entre superficies metálicas, en especial, cuando hay combinación de materiales distintos. Debemos estar atentos a su evolución.
Cerámica-cerámica
Los pares cerámica-cerámica se han empleado desde los años setenta y han tenido una evolución histórica muy interesante donde las mejoras tecnológicas en la mezcla y fabricación de sus compuestos químicos y procesos termodinámicos (ej. el sinterizado), el diseño (ej. diferencias entre las curvaturas cóncavas y convexas) y la mejor comprensión del funcionamiento de los sistemas "cono Morse" (forma de los conos) han formado parte fundamental en el buen funcionamiento clínico (Figura 6).

Entre los pares de fricción actuales, la cerámica-cerámica posee el menor coeficiente de fricción de todas las tribologías existentes, ya que su pequeño tamaño de grano le permite tener una muy baja rugosidad en la superficie, su muy elevada dureza ofrece una mayor resistencia al rayado y su alta capacidad hidrofílica le permite una excelente lubricación. Además de lo anterior, las superficies articulares de cerámica se asocian a bajos niveles de osteolisis, entre otras razones, porque las cerámicas son bioinertes y porque las partículas de desecho que producen son de muy pequeño tamaño. Estas características hacen que en el ambiente articular se produzcan simples reacciones fibrosas en vez de inflamatorias como las observadas con el polietileno; es decir, las cerámicas producen una escasa respuesta biológica indeseable.
Las mejoras antes mencionadas y otras características (Tabla 3) han ocasionado que los resultados clínicos de las cerámicas sean cada vez mejores. No obstante las ventajas antes mencionadas, las cerámicas actuales presentan tres problemas principales, que son la fractura, el ruido al caminar y el despostillado sin ruptura.
Fractura de cerámicas. Aunque las cerámicas tienen una mucho mayor resistencia a las fuerzas compresivas que a la tensión y poseen una muy baja ductilidad cuando se exponen a cargas o impactos tensionales, el riesgo de fractura está potencialmente presente en esta tribología (Figura 7). En un estudio de centros europeos con cerca de 30 años de experiencia en el uso de cerámica-cerámica, se presentaron 13 fracturas de cerámica en 5,500 componentes implantados. La mayoría se atribuyó a un traumatismo aislado y, en los casos donde las fracturas ocurrieron sin trauma, la falla se atribuyó a deficiencias en la estructura de la cerámica o al diseño del componente. Este estudio, que incluye desde la primera a la tercera generación de cerámicas, ilustra que a pesar de las mejoras tanto a los materiales como a los diseños, no se eliminó por completo el riesgo de fractura. Hoy por hoy, se considera que el mayor riesgo de ruptura reside en el mal posicionamiento de los implantes.

En la historia de las cerámicas, se distinguen dos tipos principales de este material: a) las que tienen como base alúmina (hidróxido de aluminio [Al2O3]) -que ofrece alta estabilidad fisicoquímica y excelentes características tribológicas; sin embargo, presenta pobre dureza, por lo que no se utiliza para la fabricación de formas complejas ni para componentes muy delgados- y b) las hechas a base de circona (dióxido de circonio [ZiO2]) -que es más dura pero menos estable (fuerte variabilidad a la degradación in vivo) y cuyos resultados clínicos no han sido satisfactorios, ya que presentan fallas tempranas-. Estos resultados han abierto una polémica sobre el futuro de la circona como biomaterial único en la fabricación de implantes (Figura 6)
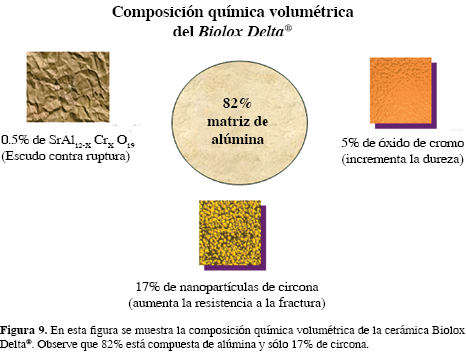
Recientemente, se ha obtenido un nuevo material compuesto por una matriz alúmina con inclusiones de circona (Al2O3 + ZiO2) llamado Biolox Delta® (CeramTec AG, Plochingen, Alemania), que mejora las características positivas de ambos materiales (Figura 8).

La composición química volumétrica de la cerámica compuesta Biolox Delta® se muestra en la figura 9. Aunque es un verdadero alarde de tecnología, debemos mencionar que esta combinación se encuentra en discusión por el problema que representa la degradación de los materiales, en especial de la circona (envejecimiento).
Recientemente, Hamilton y colaboradores (Clin Orthop Relat Res. 2010) publicaron un estudio donde comparan articulaciones de cerámica delta sobre cerámica delta contra cerámica delta sobre polietileno de ultra alta densidad con elevado entrecruzamiento de enlaces. Aunque el seguimiento fue corto (dos años mínimo, con promedio de 31.2 meses y rango de 21 a 49 meses), de los 177 pacientes a los que aplicaron sólo cerámicas, cuatro fueron revisados; en dos se detectaron eventos relacionados con el inserto acetabular (en uno se presentó un despostillamiento que ameritó revisión y en otro se detectaron fragmentos de cerámica durante el seguimiento radiográfico, pero no ha requerido revisión). No hubo ruidos en ningún caso. Debe mencionarse que se revisaron tres pacientes con cerámica delta versus polietileno por causas ajenas a la cerámica.
Ruidos articulares. En un estudio hecho in vivo por Glaser y colaboradores (J Bone Joint Surg Am. 2008) en pacientes portadores de prótesis totales de cadera con diferentes tribologías, se pudo demostrar que todos los pares articulares son capaces de producir ruidos (Tabla 4).
En cuanto a sus características, los ruidos pueden ser percibidos de diversas maneras y describirse como chasquidos, golpeteos (sonoros o sordos), aldabazos, rasquidos, rechinidos, crujidos, crepitaciones y chirridos y pueden presentarse durante todo el ciclo de la marcha, en alguna fase de la misma o durante ciertas actividades específicas. Los ruidos pueden o no ser audibles y son comunes después de un reemplazo articular total convencional, con una incidencia global que alcanza hasta 96%; sin embargo, no todos pueden oírse o "sentirse" por el paciente, pero en las superficies de "duro contra duro" pueden llegar a ser audibles incluso a distancia, lo que en los últimos años se ha reconocido como una complicación de este tipo de pares articulares.
En cuanto a su incidencia, se desconoce cuál es la real en ruidos de alta frecuencia (audibles), toda vez que diversos autores reportan una presencia clínica muy variada que va de menos de 1 hasta 20%.
La etiología de los ruidos es multifactorial y se encuentran implicados factores relacionados con el paciente (complexión, peso, estilos de vida, etcétera), con la prótesis (tipo de implante, defectos en la fabricación, mala posición y combinaciones de diferentes diseños), con el cirujano (mal posicionamiento) y con la superficie de rodamiento (microseparación, deficiencias en la lubricación, pinzamientos y terceros cuerpos intrarticulares).
Despostillamientos. Aunque es un accidente reportado en la literatura, es un evento sumamente raro que está relacionado, principalmente, con dos factores. El primero es una deficiente manipulación transquirúrgica y el segundo, la colisión entre el cuello femoral y el borde del inserto de cerámica. Esto último puede evitarse colocando cabezas con el mayor diámetro posible y prescribiendo diseños que tengan protección contra colisiones entre los componentes.
Metales ceramizados (Oxinium®)
La exigencia actual de mejores rendimientos para las artroplastías totales de cadera y rodilla está impulsando el desarrollo de materiales tribológicos alternativos. En Julio de 1995, Hunter (J ATSM Int. 2005) publicó estudios que introducen al óxido de circonio (Oxinium®-Smith & Nephew, Inc., Memphis, TN) como parte articular de los implantes ortopédicos. Este material es una aleación metálica de circonio con una superficie de cerámica de circona (circonio y circona no son lo mismo; circonio es un metal y circona una cerámica) que ofrece una sobresaliente resistencia al desgaste, pero sin la fragilidad de las cerámicas, por lo que este material combina lo mejor del metal y de las cerámicas sin crear el riesgo de las fracturas asociadas a los componentes cerámicos monolíticos.
La oxidación del circonio a una alta temperatura en presencia de aire transforma la superficie de la aleación metálica Zr-2.5Nb en una cerámica estable producto de una aleación entre circonio, niobio y oxígeno (circona) y se ha constituido en una esperanzadora alternativa para las aleaciones monolíticas de cromocobalto, ya que, comparativamente, se reduce el desgaste del polietileno (Figura 10) y puede atender las necesidades de los pacientes que presentan hipersensibilidad a los metales.

Aunque en el laboratorio el Oxinium® sufre 4,900 veces menos desgaste volumétrico y 640 veces menos huellas de arañazos profundos cuando se le compara con las aleaciones de cromocobalto tradicionales, el sustrato de circonio es relativamente suave (HV = 285) en comparación con cabezas femorales de cromocobalto (HV= ~ 420), lo que lo hace muy riesgoso cuando existe un tercer cuerpo o, bien, ocurre una dislocación donde las cabezas protéticas pueden dañarse al entrar en contacto involuntario con los metales de las copas acetabulares.
Kop y colaboradores (Arthroplasty. 2007) analizaron tres casos de retiros de cabezas femorales y demostraron los serios daños que se produjeron durante la luxación al realizar maniobras cerradas de reducción. Esto también lo han podido demostrar otros autores.
En casos de eventos de luxación con este nuevo material, es recomendable que las maniobras de reducción se ejecuten con mucha precaución para evitar daños significativos de cabeza y, por ello, llevar a un desgaste acelerado de polietileno. En el caso de una reducción cerrada exitosa, se recomienda el seguimiento estrecho del paciente. La reducción abierta con inspección de cabeza femoral y el intercambio de la misma pueden ser preferibles si se encuentran dificultades durante las maniobras de reducción cerrada o ha ocurrido una luxación recurrente. También deben vigilarse los pacientes en los que existe el riesgo o se sospecha la presencia de terceros cuerpos intrarticulares, ya sea metálicos o de cemento.
Recomendaciones prácticas para la prescripción y manejo de pares articulares en artroplastía total de cadera
La necesidad de tener diversas opciones para tratar a los pacientes jóvenes o viejos pero activos, ha hecho que tengamos que utilizar diversos recursos. En esta última parte del capítulo se hace un ejercicio en el que se sugieren algunas recomendaciones prácticas para la prescripción y manejo de los diferentes pares articulares. En las tablas 5 y 6 se resumen algunos conceptos que pueden ser útiles para facilitar la decisión de prescripción.
Polietilenos
1) Recomendaciones generales.
• Prefiera la combinación de cerámica-polietileno sobre la de metal-polietileno.
• En polietilenos convencionales, es mejor emplear cabezas de 28 mm.
• En polietilenos de ultra alta densidad con enlaces altamente cruzados, es admisible usar cabezas de diámetro mayor a 28 mm.
• Evitar insertos esterilizados con óxido de etileno (se oxidan).
• Preferir inserto con elevados enlaces cruzados esterilizado con radiaciones gamma, tratado con irradiación con electrones.
• Recordar que no todos los polietilenos altamente cruzados son iguales.
• Tener bajo observación los nuevos polietilenos, en especial, los medicados con vitamina E.
Metal-metal
1) Los pacientes considerados como de alto riesgo para desarrollar reacciones adversas son:
• Los portadores de componentes pequeños.• Los de género femenino y talla baja.
• Pacientes con riesgo o insuficiencia renal ya desarrollada.
• Pacientes con alteraciones anatómicas significativas (ej. displasia acetabular).
• Pacientes con antecedentes alérgicos a metales.
• Pacientes con posicionamiento inadecuado de los implantes.
2) Recomendaciones generales para pacientes que se someterán a una artroplastía con tribología metal-metal.
• Preferir copas con radios de 180o con alto contenido de carbono.• Evitar su uso en pacientes que requieran copas menores de 50-52 mm.
• Evaluar la conveniencia de usarla en mujeres en edad de embarazo.
• La técnica quirúrgica deberá ser muy exacta, especialmente en el adecuado posicionamiento de la copa. La anteversión o apertura lateral excesivas pueden producir pinzamiento de bordes y causar desgaste metálico aumentado.
3) En pacientes con implantes metal-metal ya instalados.
• Hacer un seguimiento anual mínimo de cinco años o más frecuentemente si hay síntomas.• Deben medirse los niveles de metales y hacer estudios imagenológicos con resonancia magnética y ultrasonido en pacientes con mal posicionamiento de implantes, cuando son portadores de prótesis de recubrimiento de tamaño pequeño, en los casos donde hay preocupaciones del paciente y el cirujano acerca del comportamiento del metal-metal y en modelos con elevadas tasas de falla.
• Si los niveles de iones metálicos son elevados (> 7 partes por millón), reforzar la vigilancia y, en caso necesario, hacer estudios imagenológicos especiales.
• Si estos estudios revelan reacciones en tejidos blandos periprotéticos, debe considerarse la cirugía de revisión aunque el implante esté radiológicamente estable.
Cerámica-cerámica
1) ¿Qué podemos hacer para disminuir las fracturas?
• Usar el tamaño de componentes lo más grande posible.• Evitar cuellos cortos, en especial, los de 28 mm de diámetro.
• Recordar que el cono 12/14 no es universal: ¡hay muchas variaciones!
• Asegurarse de que los componentes cerámicos y los metálicos sean compatibles.
• Revisar que los conos no estén dañados y acoplar los componentes correctamente.
• Impactar los componentes con la fuerza necesaria para que no haya expulsiones durante las actividades de marcha.
• Asegurarse de la compatibilidad entre la cabeza y el cono femoral. Nunca se deben mezclar componentes de diferentes empresas.
• Revisar que los conos no estén dañados y que los componentes se acoplen correctamente.
• Si el cono metálico está dañado, utilice cabezas especiales de recambio (Biolox® Option).
2) ¿Qué hacer en caso de que tenga que hacerse una revisión por una fractura de un componente cerámico?
• No use cabeza de metal ni polietileno para sustituir los componentes dañados. Use cerámica nuevamente (es muy resistente a los terceros cuerpos residuales de cerámica).• Irrigue abundantemente el área para eliminar las partículas pequeñas.
• Haga una sinevectomía completa.
•Revise meticulosamente los componentes dañados.
3) ¿Qué hacer cuando ocurre un despostillamiento intraoperatorio de los insertos?
• Son causadas por falta de familiaridad con la cerámica.• Las conexiones cónicas tienen que ponerse en su posición final antes de impactarse.
• Vigile que no haya colisión entre los implantes en las movilizaciones extremas de la cadera.
Oxinium®
1) Recomendaciones generales.
• Haga maniobras de reducción muy cuidadosas para evitar daños a la delgada capa de metal ceramizado.• No prescribirla en pacientes con alto riesgo de luxación.
• Es una buena alternativa para pacientes jóvenes o viejos activos con antecedentes de alergias a metales y puede cubrir las necesidades de los pacientes que presentan hipersensibilidad a los mismos.
• Deben vigilarse con mayor frecuencia los pacientes en los que existe el riesgo o se sospecha la presencia de terceros cuerpos intrarticulares, ya sea metálicos o de cemento.
2) ¿Qué se recomienda en casos de eventos de luxación?
• Las maniobras de reducción se deben ejecutar con mucha precaución para evitar daños significativos de cabeza.• En el caso de una reducción cerrada exitosa, es recomendable seguir al paciente lo más estrechamente posible.
• Prefiera una reducción abierta si se encuentran dificultades durante las maniobras de reducción cerrada o ha ocurrido una luxación recurrente. La finalidad es efectuar una cuidadosa inspección de cabeza femoral y, si está dañada, debe intercambiarse.
REFERENCIAS
Para mayor información:
1. Harris WH: Wear and periprosthetic osteolysis: the problem. Clin Orthop. 2001; 393: 66-70. [ Links ]
2. Santavirta S, Bohler M, Harris WH, et al: Alternative materials to improve total hip replacement tribology. Acta Orthop Scand. 2003; 74(4): 380-8. [ Links ]
3. Gómez GF: Estado actual de la prótesis femoral de cadera: SLA una consecuencia lógica en artroplastia total de cadera. Ed. McGraw Hill Interamericana; (ISBN 970-10-2548-2) 2000. [ Links ]
4. Atkinson JR, Dowling JM, Cicek RZ: Materials for internal prostheses: the present position and possible future developments. Biomaterials. 1980; 1: 89. [ Links ]
Polietilenos
Generalidades
5. Sychterz CJ, Young AM, Orishimo K, Engh CA: The relationship between shelf life and in vivo wear for polyethylene acetabular liners. J Arthroplasty. 2005; 20: 168-73. [ Links ]
6. Kurtz SM: The UHMWPE handbook: ultra-high molecular weight polyethylene in total joint replacement. San Diego, CA: Elsevier Academic Press; 2004: 4, 6. [ Links ]
7. Li S, Callaghan JJ: Polyethylene. Chapter 7. In: The adult hip. Philadelphia: Lippincott-Raven; 1998. [ Links ]
8. Heisel C, Silva M, Schmalzried TP: In vivo wear of bilateral total hip replacements: conventional versus crosslinked polyethylene. Arch Orthop Trauma Surg. 2005; 125: 555-7. [ Links ]
9. Geerdinck CH, Grimm B, Ramakrishnan R, Rondhuis J, Verburg AJ, Tonino AJ: Crosslinked polyethylene compared to conventional polyethylene in total hip replacement: pre-clinical evaluation, in vitro testing and prospective clinical follow-up study. Acta Orthop. 2006; 77: 719-25. [ Links ]
Polietilenos con elevados enlaces cruzados
10. Harris WH, Muratoglu OK: A review of current cross-linked polyethylenes used in total joint arthroplasty. Clin Orthop Relat Res. 2005; (430): 46-52. [ Links ]
11. Ries MD: Highly cross-linked polyethylene: the debate is over in opposition. J Arthroplasty. 2005; 20(4 Suppl. 2): 59-62. [ Links ]
12. Costa L, Jacobson K, Bracco P, et al: Oxidation of orthopaedic UHMWPE. Biomaterials. 2002; 23(7): 1613-24. [ Links ]
13. Costa L, Luda MP, Trossarelli L, et al: Oxidation in orthopaedic UHMWPE sterilised by gamma-radiation and ethylene oxide. Biomaterials. 1998; 19(7-9): 659-68. [ Links ]
14. Costa L, Luda MP, Trossarelli L, et al: In vivo UHMWPE biodegradation of retrieved prosthesis. Biomaterials. 1998; 19(15): 1371-85. [ Links ]
15. Gordon CD, D'Lima D, Clifford W, Colwell CW Jr: Highly cross-linked polyethylene in total hip arthroplasty. J of the Am Acad Orthop Surg. 2006; 4(9): 511-23. [ Links ]
16. Chiesa RMM, Giordano C, Siccardi F, Cigada A: Influence of heat treatment on structural, mechanical and wear properties of crosslinked UHMWPE. Journal of Applied Biomaterials and Biomechanics. 2004; 2: 20-8. [ Links ]
17. McKellop H, Shen FW, Lu B, Campbell P, Salovey R: Development of an extremley resistant high molecular weight polyethylene for total hip replacements. J Orthop Res. 1999; 17: 157-67. [ Links ]
18. Grobbelaar CJ, Plessis TAD, Marais F: The radiation improvement of polyethylene prostheses. J Bone Joint Surg Br. 1978; 60: 370. [ Links ]
19. Grobbelaar CJ, Weber FA, Spirakis A, DuPlessis TA, Cappert G, Cakic JN: Clinical experience with gamma irradiation-crosslinked polyethylene-A 14 to 20 year follow-up report. S Afr Bone Joint Surg. 1999; 11: 140. [ Links ]
20. Oonishi H, Takayama Y, Tsuji E: Improvement of polyethylene by irradiation in artificial joints. Radiat Phys Chem. 1992; 39: 495. [ Links ]
21. Muratoglu OK, Bragdon CR, O'Connor DO, et al: Unified wear model for highly crosslinked ultra-high molecular weight polyethylenes (UHMWPE). Biomaterials. 1999; 20: 1463. [ Links ]
22. Harris WH: Highly cross-linked, electron-beam-irradiated, melted polyethylene: some pros. Clin Orthop Relat Res. 2004; (429): 63-7. [ Links ]
23. Charlesby A: Cross-linking of polythene by pile radiation. Proc Roy Soc Lond A. 1952; 215: 187. [ Links ]
24. De Boer J, Pennings A: Crosslinking of ultra-high molecular weight polyethylene in the melt by means of 2.5-dimethyl-2.5-bis (tert-butyldioxy)-3-hexyne: 2. Crystallization behaviour and mechanical properties. Polymer. 1982; 23: 1944. [ Links ]
25. Atkinson JR, Cicek RZ: Silane cross-linked polyethylene for prosthetic applications: Part I. Certain physical and mechanical properties related to the nature of the material. Biomaterials. 1983; 4: 267. [ Links ]
26. Atkinson JR, Cicek RZ: Silane cross-linked polyethylene for prosthetic applications: Part II. Creep and wear behavior and a preliminary molding test. Biomaterials. 1984; 5: 326. [ Links ]
27. Muratoglu OK, Bragdon CR, O'Connor DO, Merri EW, Jasty EM, Harris WH: Electron beam crosslinking of UHMWPE at room temperature, a candidate bearing material for total joint arthroplasty. In: 23rd Annual Meeting of the Society for Biomaterials. New Orleans: 1997. [ Links ]
28. Baker DA, Hastings RS, Pruitt L: Study of fatigue resistance of chemical and radiation crosslinked medical grade ultrahigh molecular weight polyethylene. J Biomed Mater Res. 1999; 46: 573. [ Links ]
29. DiMaio WG, Lilly WB, Moore WB, Saun KA: Low wear, low oxidation radiation crosslinked UHMWPE. In: 44th Annual Meeting Proceedings of Orthopaedic Research Society. New Orleans: 1998; 363. [ Links ]
30. Brach del Prever EM, Crova M, Costa L, et al: Unacceptable biodegradation of polyethylene in vivo. Biomaterials. 1996; 17: 873-8. [ Links ]
31. Jasty M, Rubash HE, Muratoglu O: Highly cross-linked polyethylene: the debate is over in the affirmative. J Arthroplasty. 2005; 20(4 Suppl. 2): 55-8. [ Links ]
32. Collier JP, Currier BH, Kennedy FE, et al: Comparison of cross-linked polyethylene materials for orthopaedic applications. Clin Orthop Relat Res. 2003; (414): 289-304. [ Links ]
Efectos de la esterilización sobre los polietilenos
33. Kurtz SM, Muratoglu OK, Evans M, Edidin AA: Advances in the processing, sterilization, and crosslinking of ultra-high molecular weight polyethylene for total joint arthroplasty. Biomaterials. 1999; 20: 1659-88. [ Links ]
34. Kurtz SM, Rimnac CM, Hozack WH, Turner J, Marcolongo M, Goldberg VM, et al: In vivo degradation of polyethylene liners after gamma esterilization in air. J Bone Joint Surg Am. 2005; 87-A: 815-23. [ Links ]
35. Kurtz SM, Hozack WJ, Purtill JJ, Marcolongo M, Kraay MJ, Goldberg VM, et al: Otto aufranc award paper: significance of in vivo degradation of polyethylene in total hip arthroplasty. Clin Orthop Relat Res. 2006; 453: 47-57. [ Links ]
36. Affatato S, Bersaglia G, Foltran I, Taddei P, Fini G, Toni A: Performance of gamma and ETO-sterilized UHMWPE acetabular cups tested under severe simulator conditions. Part 1: role of the third body wear process. Biomaterials. 2002; 23: 4839-46. [ Links ]
37. McKellop H, Shen FW, Lu B, Campbell P, Salovey R: Effect of sterilization method and other modifications on the wear resistance of acetabular cups made of ultra-high molecular weight polyethylene: a hip-simulator study. J Bone Joint Surg Am. 2000; 82: 1708-25. [ Links ]
38. McKellop HA, Shen FW, Campbell P, Ota T: Effect of molecular weight, calcium stearate, and sterilization methods on the wear of ultra high molecular weight polyethylene acetabular cups in a hip joint simulator. J Orthop Res. 1999; 17: 329-39. [ Links ]
39. Besong AA, Tipper JL, Ingham E, et al: Quantitative comparison of wear debris from UHMWPE that has and has not been sterilised by gamma irradiation. J Bone Joint Surg Br. 1998; 80-B(2): 340-4. [ Links ]
40. McKellop H, Shen FW, Lu B, et al: Effect of sterilization method and other modifications on the wear resistance of acetabular cups made of ultra-high molecular weight polyethylene. A hip-simulator study. J Bone Joint Surg Am. 2000; 82-A(12): 1708-25. [ Links ]
Estudios comparativos entre cabezas femorales con diversos
materiales y polietilenos con elevados enlaces cruzados
41. Tipper JL, Gavin AL, Ingham E, Fisher J: Comparison of the wear, wear debris and functional biological activity of non-crosslinked and crosslinked GUR 1020 and GUR 1050 polyethylenes used in total hip prostheses. Trans. UHMWPE for arthroplasty: degradation, stabilization, and crosslinking. 2nd UHMWPE International Meeting. Torino, Italy: 2005. [ Links ]
42. Wroblewski BM, Siney PD, Dowson D, Colling SN: Prospective clinical and joint simulator studies of a new total hip arthroplasty using alumina ceramic heads and cross-linked polyethylene cups. J Bone Joint Surg Br. 1996; 78: 280. [ Links ]
43. Wroblewski B, Siney P, Fleming P: Low-friction arthroplasty of the hip using alumina ceramic and cross-linked polyethylene: a ten-year follow-up report. J Bone Joint Surg Br. 1999; 81: 54. [ Links ]
44. Oonishi H: Long term clinical results of THR: clinical results of THR of an alumina head with a cross-linked UHMWPE cup. Orthop Surg Traumatol. 1995; 38: 1255. [ Links ]
45. Hernigou P, Bahrami T: Zirconia and alumina ceramics in comparisson with stainless-steel heads. J Bone Joint Surg [Br]. 2003; 85-B: 504-9. [ Links ]
46. Derbyshire B, Fisher J, Dowson D, Hardaker C, Brummitt K: Comparative study of the wear of UHMWPE with zirconia ceramic and stainless steel femoral heads in artificial hip joints. Medical Engineering & Physics. 1994; 16(3): 229-36. [ Links ]
Complicaciones en los polietilenos altamente enlazados
47. Pruitt L, Koo J, Rimnac CM, Suresh S, Wright TM: Cyclic compressive loading results in fatigue cracks in ultra high molecular weight polyethylene. J Orthop Res. 1994; 13: 143. [ Links ]
48. Gillis A, Schmieg J, Bhattacharyya S, Li S: An independent evaluation of the mechanical, chemical and fracture properties of UHMWPE cross linked by 34 different conditions. Society for Biomaterials. 25th Annual Meeting Transactions. Providence, RI. 1999. [ Links ]
49. Bradford L, Baker DA, Graham J, Chawan A, Ries MD, Pruitt LA: Wear and surface cracking in early retrieved highly cross-linked polyethylene acetabular liners. J Bone Joint Surg Am. 2004; 86(6): 1271-82. [ Links ]
50. Bradford L, Baker D, Ries M, Pruitt LA, Hanssen A: Fatigue crack propagation resistance of highly crosslinked polyethylene. Clin Orthop Rel Res. 2004; 429: 68-72. [ Links ]
51. Tower SS, Currier JH, Currier BH, Lyford KA, Van Citters DW, Mayor MB: Rim cracking of the cross-linked longevity polyethylene acetabular liner after total hip arthroplasty. J Bone Joint Surg Am. 2007; 89(10): 2212-7. [ Links ]
52. Matthew O, Barrett MO, Douglas D, van Citters W, Hamilton WG: Mechanical failure of marathon cross-linked polyethylene acetabular liner after total hip arthroplasty. Am J of Orthop. 2011; 40(10): 523-26. [ Links ]
53. Estok DM, Bragdon CR, Plank GR, Huang A, Muratoglu OK, Harris WH: The measurement of creep in ultrahigh molecular weight polyethylene: a comparison of conventional versus highly cross-linked polyethylene. J Arthroplasty. 2005; 20(2): 239-43. [ Links ]
54. Besong AA, Hailey JL, Ingham E, et al: A study of the combined effects of shelf ageing following irradiation in air and counterface roughness on the wear of UHMWPE. Biomed Mater Eng. 1997; 7(1): 59-65. [ Links ]
55. Shen FW, McKellop H: Surface-gradient cross-linked polyethylene acetabular cups: oxidation resistance and wear against smooth and rough femoral balls. Clin Orthop Relat Res. 2005; (430): 80-8. [ Links ]
56. Rohrl S, Nivbrant B, Mingguo L, Hewitt B: In vivo wear and migration of highly cross-linked polyethylene cups a radiostereometry analysis study. J Arthroplasty. 2005; 20(4): 409-13. [ Links ]
57. Krushell RJ, Fingeroth RJ, Cushing MC: Early femoral head penetration of a highly cross-linked polyethylene liner versus a conventional polyethylene liner, a case-controlled study. J Arthroplasty. 2005; 20(Suppl. 3): 73-6. [ Links ]
Seguimiento clínico de polietilenos altamente cruzados
58. Dorr LD, Wan Z, Shahrdar C, Sirianni L, Boutary M, Yun A: Clinical performance of a durasul highly cross-linked polyethylene acetabular liner for total hip arthroplasty at five years. J Bone Joint Surg Am. 2005; 87(8): 1816-21. [ Links ]
59. Bragdon CR, Kwon YM, Geller JA, et al: Minimum 6-year follow-up of highly cross-linked polyethylene in THA. Clin Orthop Relat Res. 2007; 465: 122-7. [ Links ]
60. McCalden RW, MacDonald SJ, Rorabeck CH, Bourne RB, Chess DG, Charron KD: Wear rate of highly cross-linked polyethylene in total hip arthroplasty: a randomized controlled trial. J Bone Joint Surg. 2009; 91(4): 773-82. [ Links ]
61. Engh ChE Jr, Stepniewski AS, Stuart D, Ginn SD, Beykirch SE, Sychterz-Terefenko C, et al: A randomized prospective evaluation of outcomes after total hip arthroplasty using cross-linked marathon and non-cross-linked enduron polyethylene liners. J Arthrop. 2006; 21(6): 17-25. [ Links ]
Polietilenos medicados con alfatocoferol
62. Shibata N, Tomita N: The anti-oxidative properties of alpha-tocopherol in gamma-irradiated UHMWPE with respect to fatigue and oxidation resistance. Biomaterials. 2005; 26(29): 5755-62. [ Links ]
63. Oral E, Greenbaum ES, Malhi AS, Harris WH, Muratoglu OK: Characterization of irradiated blends of alpha-tocopherol and UHMWPE. Biomaterials. 2005; 26(33): 6657-63. [ Links ]
64. Oral E, Wannomae KK, Hawkins N, Harris WH, Muratoglu OK: Alpha-tocopherol-doped irradiated UHMWPE for high fatigue resistance and low wear. Biomaterials. 2004; 25(24): 5515-22. [ Links ]
Metal-metal
Reacciones adversas con metal-metal
65. Willert HG, Buchhorn GH, Fayyazi A, Flury R, Windler M, Köster G, et al: Metal-on-metal bearings and hypersensitivity in patients with artificial hip joints: a clinical and histomorphological study. J Bone Joint Surg (A). 2005; 87: 28-36. [ Links ]
66. Campbell PA, Nelson S, Tas T, et al: The immunopathology of ALVAL. AAOS 2011 Anual Meeting Scientififc Exhibit Number: SE01. [ Links ]
67. Hallab N, Merrit K, Jacobs J: Metal sensitivity in patients with orthopaedic implants. J Bone Joint Surg. 2001; 83-A(3): 428-36. [ Links ]
68. Hallab N, Mikecz K, Jacobs J: A triple assay technique for the evaluation of metal-induced, delay-type hypersensitivity responses in patients with or receiving total joint arthroplasty. J Biomed Mater Res. 2000; 53: 480-9. [ Links ]
69. Ball ST: Inflammatory cytokines are elevated in patients with adverse reactions to metal-on-metal THAs. AAOS, 2011 Meeting Podium No: 065. [ Links ]
70. Haddad FS, et al: Metal-on-metal bearings: the evidence so far. JBJS (Br). 2011; 93-B: 572-9. [ Links ]
71. Gonzalez MH, Carr R, Walton S, Mihalko WM: The evolution and modern use of metal-on. Metal bearings in total hip arthroplasty. Inst Courses Lec. 2011; 60: 247-55. [ Links ]
72. Lhotka C, Szekerea T, Steffan T, Zhubar K, Zweymuller K: Four year study of cobalt and chromium blood levels in patients managed with two different metal on metal total hip replacements. J Ortho Research. 2003; 21(2): 189-95. [ Links ]
73. Medicines and Healthcare products Regulatory Agency UK. Issued: 22 April 2010, Ref: MDA/2010/033. [ Links ]
74. FDA Executive Summary Memorandum Metal-on-Metal Hip Implant Systems. Prepared for the June 27-28, 2012 Meeting of the Orthopaedic and Rehabilitation Devices Advisory Panel Gaithersburg Hilton Gaithersburg, Maryland 1. [ Links ]
75. Lindgren JU, Brismar BH, Wikstrom AC: Adverse reaction to metal release from a modular metal-on-polyethylene hip prosthesis. J Bone Joint Surg Br. 2011; 93(10): 1427-30. [ Links ]
76. Doorn PF, Mirra JM, Campbell PA, Amstutz HC: Tissue reaction to metal on metal total hip prostheses. Clin Orthop Relat Res. 1996; (329 Suppl.): S187-205. [ Links ]
77. Mahendra G, Pandit H, Kliskey K, Murray D, Gill HS, Athanasou N: Necrotic and inflammatory changes in metal-on-metal resurfacing hip arthroplasties. Acta Orthop. 2009; 80(6): 653-9. [ Links ]
Seudotumores en prótesis metal-metal
78. Beaulé PE, Kim PR, Powell J, Mackenzie J, et al: A survey on the prevalence of pseudotumors with metal-on-metal hip resurfacing in Canadian academic centers. J Bone Joint Surg Am. 2011; 93(Suppl. 2): 118-21. [ Links ]
79. Glyn-Jones S, Pandit H, Kwon YM, Doll H, Gill HS, Murray DW: Risk factors for inflammatory pseudotumour formation following hip resurfacing. J Bone Joint Surg Br. 2009; 91(12): 1566-74. [ Links ]
80. Kwon YM, Ostlere SJ, McLardy-Smith P, et al: "Asymptomatic" pseudotumors after metal-on-metal hip resurfacing arthroplasty: prevalence and metal ion study. J Arthroplasty. 2011; 26(4): 511-8. [ Links ]
81. Pandit H, Glyn-Jones S, McLardy P, Gundle R, Whitwell D, Gibbons CL, et al: Pseudotumours associated with metal-on-metal hip resurfacings. J Bone Joint Surg Br. 2008; 90(7): 847-51. [ Links ]
82. Walsh AJ, Nikolaou VS, Antoniou J: Inflammatory pseudotumor complicating metal-on-highly cross-linked polyethylene total hip arthroplasty. J Arthroplasty. 2012; 27(2): 324, e5-8. Epub 2011 Apr 16. [ Links ]
83. Svensson O, Mathiesen EB, Reinholt FP, Blomgren G: Formation of a fulminant soft-tissue pseudotumor after uncemented hip arthroplasty. A case report. J Bone Joint Surg Am. 1988; 70(8): 1238-42. [ Links ]
84. Campbell P, Ebramzadeh E, Nelson S, Takamura K, De Smet K, Amstutz HC: Histological features of pseudotumor-like tissues from metal-on-metal hips. Clin Orthop Relat Res. 2010; 468(9): 2321-7. [ Links ]
Corrosión y efectos indeseables en implantes metal-metal
85. Cooper HJ, Della-Valle CJ, Berger RA, Tetreault M, Paprosky WG, Sporer SM, et al: Corrosion at the head-neck taper as a cause for adverse local tissue reactions after total hip arthroplasty. J Bone Joint Surg Am. 2012; 94(18): 1655-61. [ Links ]
86. Jacobs JJ, Urban RM, Gilbert JL, Skipor AK, Black J, Jasty M, et al: Local and distant products from modularity. Clin Orthop Relat Res. 1995; (319): 94-105. [ Links ]
87. Collier JP, Mayor MB, Williams IR, Surprenant VA, Surprenant HP, Currier BH: The tradeoffs associated with modular hip prostheses. Clin Orthop Relat Res. 1995; (311): 91-101. [ Links ]
88. Cook SD, Barrack RL, Baffes GC, Clemow AJ, Serekian P, Dong N, et al: Wear and corrosion of modular interfaces in total hip replacements. Clin Orthop Relat Res. 1994; (298): 80-8. [ Links ]
89. Collier JP, Surprenant VA, Jensen RE, Mayor MB: Corrosion at the interface of cobalt-alloy heads on titanium-alloy stems. Clin Orthop Relat Res. 1991; (271): 305-12. [ Links ]
90. Kop AM, Swarts E: Corrosion of a hip stem with a modular neck taper junction: a retrieval study of 16 cases. J Arthroplasty. 2009; 24(7): 1019-23. [ Links ]
91. Gilbert JL, Buckley CA, Jacobs JJ: In vivo corrosion of modular hip prosthesis components in mixed and similar metal combinations. The effect of crevice, stress, motion, and alloy coupling. J Biomed Mater Res. 1993; 27(12): 1533-44. [ Links ]
92. Gilbert JL, Buckley CA, Jacobs JJ, Bertin KC, Zernich MR: Intergranular corrosion-fatigue failure of cobalt-alloy femoral stems. A failure analysis of two implants. J Bone Joint Surg Am. 1994; 76(1): 110-5. [ Links ]
93. Goldberg JR, Gilbert JL, Jacobs JJ, Bauer TW, Paprosky W, Leurgans S: A multicenter retrieval study of the taper interfaces of modular hip prostheses. Clin Orthop Relat Res. 2002; (401): 149-61. [ Links ]
94. Goldberg JR, Gilbert JL: In vitro corrosion testing of modular hip tapers. J Biomed Mater Res B Appl Biomater. 2003; 64(2): 78-93. [ Links ]
95. Kawalec JS, Brown SA, Payer JH, Merritt K: Mixed-metal fretting corrosion of Ti6Al4V and wrought cobalt alloy. J Biomed Mater Res. 1995; 29(7): 867-73. [ Links ]
96. Kretzer JP, Jakubowitz E, Krachler M, Thomsen M, Heisel C: Metal release and corrosion effects of modular neck total hip arthroplasty. Int Orthop. 2009; 33(6): 1531-6. [ Links ]
97. Mroczkowski ML, Hertzler JS, Humphrey SM, Johnson T, Blanchard CR: Effect of impact assembly on the fretting corrosion of modular hip tapers. J Orthop Res. 2006; 24(2): 271-9. [ Links ]
98. Collier JP, Surprenant VA, Jensen RE, Mayor MB, Surprenant HP: Corrosion between the components of modular femoral hip prostheses. J Bone Joint Surg Br. 1992; 74(4): 511-7. [ Links ]
99. Bobyn JD, Tanzer M, Krygier JJ, Dujovne AR, Brooks CE: Concerns with modularity in total hip arthroplasty. Clin Orthop Relat Res. 1994; (298): 27-36. [ Links ]
100. Brown SA, Flemming CA, Kawalec JS, Placko HE, Vassaux C, Merritt K, et al: Fretting corrosion accelerates crevice corrosion of modular hip tapers. J Appl Biomater. 1995; 6(1): 19-26. [ Links ]
101. Cook SD, Barrack RL, Clemow AJ: Corrosion and wear at the modular interface of uncemented femoral stems. J Bone Joint Surg Br. 1994; 76(1): 68-72. [ Links ]
102. Lieberman JR, Rimnac CM, Garvin KL, Klein RW, Salvati EA: An analysis of the head-neck taper interface in retrieved hip prostheses. Clin Orthop Relat Res. 1994; (300): 162-7. [ Links ]
103. Mathiesen EB, Lindgren JU, Blomgren GG, Reinholt FP: Corrosion of modular hip prostheses. J Bone Joint Surg Br. 1991; 73(4): 569-75. [ Links ]
104. Urban RM, Jacobs JJ, Gilbert JL, Galante JO: Migration of corrosion products from modular hip prostheses. Particle microanalysis and histopathological findings. J Bone Joint Surg Am. 1994; 76(9): 1345-59. [ Links ]
Cerámica-cerámica
105. Skinner HB: Ceramic bearing surfaces. [Review] [50 refs] Clin Orthopo Rel Res. 1999; 83. [ Links ]
106. Hannouche D, et al: Ceramics in total hip replacement [report]. Clin Orthop Relat Res. 2005; 430: 62. [ Links ]
107. Hamadouche MB, Daussange P, Bolander J, et al: Alumina on alumina total hip arthroplasty: a minimum 18.5-years follow-up study [Article]. J Bone Joint Surg Am. 2002; 84-A: 69. [ Links ]
108. Bierbaum BE, et al: Ceramic on ceramic bearings in total hip arthroplasty. Clin Orthop Relat Res. 1999; 83. [ Links ]
109. Yoo JJ, et al: Alumina on alumina total hip arthroplasty: a five years minimum follow-up study. J Bone and Joint Surg Am. 2005; 87-A: 530. [ Links ]
110. Chevalier J: What future for zirconia as a biomaterial? Biomaterials. 2006; 27(4): 535-43. [ Links ]
111. Dalla-Pria P: Evolution and new application of the alumina ceramics in joint replacement. European Journal of Orthopaedic Surgery & Traumatology. 17(3): 253-6. [ Links ]
112. Hamilton WG, McAuley JP, Dennis DA, Murphy JA, Blumenfeld TJ, Politi J: THA with Delta ceramic on ceramic: results of a multicenter investigational device exemption trial. Clin Orthop Relat Res. 2010; 468(2): 358-66. [ Links ]
Complicaciones con cerámica-cerámica
113. Barrack RL, Burak C, Skinner HB: Concerns about ceramics in THA. Cl Orthop Rel Res. 2004; 429: 73-9. [ Links ]
114. Capello WN, D'Antonio JA, Manley MT: Alumina-on-alumina bearings in total hip arthroplasty: clinical results, osteolysis, breakage, and noise. J Arthroplasty. 2007; 22: 311. [ Links ]
115. Glaser D, Komistek RD, Cates HE, Mahfouz MR: Clicking and squeaking: in vivo correlation of sound and separation for different bearing surfaces. J Bone Joint Surg Am. 2008; 90(Suppl. 4): 112-20. [ Links ]
116. Rosneck J, Klika A, Barsoum W: A rare complication of ceramic-on-ceramic bearings in total hip arthoplasty. J Arthoplasty. 2008; 23: 311. [ Links ]
117. Jarrett CA, Ranawat A, Bruzzone M, Rodriguez J, Ranawat C: The squeaking hip: an underreported phenomenon of ceramic-on-ceramic total hip arthroplasty. J Arthroplasty. 2007; 22: 302. [ Links ]
118. Restrepo C, Parvizi J, Kurtz SM, Sharkey PF, Hozack WJ, Rothman RH: The noisy ceramic hip: is component malpositioning the cause? J Arthroplasty. 2008; 23: 643-9. [ Links ]
119. Walter WL, O'Toole GC, Walter WK, Ellis A, Zicat BA: Squeaking in ceramic-on-ceramic hips: the importance of acetabular component orientation. J Arthroplasty. 2007; 22: 496-503. [ Links ]
120. Chevillotte C, Trousdale RT, Chen Q, Guyen O, An KN: The 2009 frank stinchfield award: "hip squeaking": a biomechanical study of ceramic-on-ceramic bearing surfaces. Clin Orthop Relat Res. 2010; 468: 345-50. [ Links ]
121. Keurentjes JC, Kuipers RM, Wever DJ, Schreurs BW: High incidence of squeaking in THAs with alumina ceramic-on-ceramic bearings. Clin Orthop Relat Res. 2008; 466: 1438-43. [ Links ]
122. Murphy SB, Ecker TM, Tannast M: Incidence of squeaking after alumina ceramic-ceramic total hip arthroplasty. J Arthroplasty. 2008; 23: 327. [ Links ]
123. Restrepo C, Post Z, Kai B, Hozack WJ: The effect of stem design on the incidence of squeaking in ceramic on ceramic bearing total hip arthroplasty. J Bone Joint Surg Am. 2010; 92(3): 550-7. [ Links ]
124. Walter WL, Waters TS, Gillies M, Donohoo S, Kurtz SM, Ranawat AS, et al: Squeaking hips. J Bone Joint Surg Am. 2008; 90(Suppl. 4): 102-11. [ Links ]
Metales ceramizados
125. Hunter G, Dickinson J, Herb B, et al: Creation of oxidized zirconium orthopaedic implants. J ATSM Int. 2005; 2(7). [ Links ]
126. Long M, Riester L, Hunter G: Nano-hardness measurements of oxidized Zr-2.5Nb and various orthopaedic materials. Trans Soc Biomaterials. 1998; 21: 528. [ Links ]
127. Good V, Ries M, Barrack RL, et al: Reduced wear with oxidized zirconium femoral heads. J Bone Joint Surg. 2003; 85-A(suppl. 4): 105-10. [ Links ]
128. Nasser S, Mott M, Wooley P: A prospective comparison of ceramic and oxinium TKA components in metal hypersensitivity patients. San Diego, CA: Proceedings of the Annual Meeting of the American Academy of Orthopaedic Surgeons; 2006: 194. [ Links ]
129. Kop AM, Colin-Whitewood C, Johnston DJL: Damage of Oxinium femoral heads subsequent to hip arthroplasty dislocation: three retrieval case studies. J Arthroplasty. 2007; 22(5): 775-9. [ Links ]
130. Evangelista GT, Fulkerson E, Kummer F, Di Cesare PE: Surface damage to an Oxinium femoral head prosthesis after dislocation. J Bone Joint Surg Br. 2007; 89(4): 535-7. [ Links ]
131. McCalden RW, Charron KD, Davidson RD, Teeter MG, Holdsworth DW: Damage of an Oxinium femoral head and polyethylene liner following "routine" total hip replacement. J Bone Joint Surg Br. 2011; 93(3): 409-13. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/actaortopedica














