Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta ortopédica mexicana
versión impresa ISSN 2306-4102
Acta ortop. mex vol.28 no.3 Ciudad de México may./jun. 2014
Artículo original
Eficacia del pirofosfato de tiamina o cocarboxilasa en el rescate del pie diabético
Efficacy of thiamine pyrophosphate or carboxylase in the salvage of diabetic foot
Carmona-Cervantes J*
Hospital General de Chimalhuacán (I.S.E.M)
Nivel de evidencia: IV
* Ortopedia y Traumatología.
Dirección para correspondencia:
Dr. Jesús Carmona Cervantes
Antonio León Núm. 156,
Col. Juan Escutia,
Del. Iztapalapa, CP 09100, México, D.F.
Tel. 57 45 13 83
E-mail: carmona.jesus@hotmail.com
RESUMEN. El pie diabético representa una de las complicaciones más comunes en pacientes que han tenido una larga evolución. La etiología se circunscribe a la neuropatía, infecciones e isquemia, que actuando en conjunto contribuyen a la secuencia de necrosis tisular, ulceración y gangrena. Lo difícil que resulta su tratamiento hace necesaria la búsqueda de opciones que colaboren en la resolución de esta problemática, que se centra en la hiperglucemia crónica como detonante. El pirofosfato de tiamina o cocarboxilasa realiza múltiples actividades metabólicas y no metabólicas que han sido consideradas importantes en la solución de las alteraciones del diabético por lo que en el presente trabajo se muestran los resultados al emplearlo en pacientes con pie diabético. En un período comprendido entre Enero de 1998 y Julio de 2012 se trataron 29 pacientes con pie diabético: 19 Wagner tipo III y 12 Wagner tipo IV. El manejo consistió en administrar antibióticos, procedimientos quirúrgicos parciales y pirofosfato de tiamina. Se logró el control del proceso infeccioso, la aparición de tejido de granulación y cicatrización de la lesión en un período comprendido entre 2 y 6 meses de acuerdo a la gravedad del problema. Por los datos clínicos y la evolución de los pacientes, se concluye que la administración del pirofosfato de tiamina permitió el control de las disfunciones metabólicas y no metabólicas que conducen a las complicaciones del diabético, por lo que se debe considerar una herramienta para el tratamiento de los diabéticos en general y para el rescate del pie diabético en particular.
Palabras clave: pie diabético, tiamina, pirofosfato, glicación.
ABSTRACT. Diabetic foot represents one of the most common complications in patients with a long standing disease. The etiology is neuropathy, infections and ischemia that together contribute to the sequence of tissue necrosis, ulceration and gangrene. Since treatment is very difficult, we must look for several options to solve these problems caused by chronic hyperglycemia. Thiamine pyrophosphate or carboxylase perform multiple metabolic and non-metabolic activities that are considered important in the resolution of diabetic impairments, therefore, this work shows the results when using it in patients with diabetic foot. 29 patients with diabetic foot were treated between January 1998 and July 2012: 19 Wagner type III and 12 Wagner type IV. Management was the administration of antibiotics, partial surgical procedures and thiamine pyrophosphate. The infectious process was controlled, the appearance of granulation tissue and scarring of the lesion in a period of 2 to 6 months depending on the severity of the problem. Given the clinical data and evolution of the patients, we conclude that the administration of thiamine pyrophosphate was able to control metabolic and non-metabolic dysfunctions that lead to complications in diabetic patients, therefore we must consider it a tool in the treatment of diabetic patients in general and for diabetic foot salvage in particular.
Key words: diabetic foot, thiamine, pyrophosphate, glycation.
Introducción
La diabetes se caracteriza principalmente por la hiperglucemia crónica vinculada con el desarrollo de patologías específicas en la retina, glomérulos renales y nervios periféricos, todas ellas relacionadas con enfermedad arteriosclerótica acelerada que afecta a las arterias. La enfermedad arterial acelerada de las extremidades inferiores, junto con la neuropatía, genera las amputaciones en los diabéticos. La cascada degenerativa se inicia con la hiperglucemia, que al ser crónica, causa daño a través de cinco principales mecanismos:
1. Incremento en el flujo de glucosa y otros carbohidratos hacia la ruta de los polioles.2. Incremento en la formación de los productos terminales de glicosilación avanzada (AGE y ALE).
3. Incremento en la expresión y activación de los receptores para los AGE (RAGE).
4. Activación de las isoformas de la proteincinasa C (PKC).
5. Sobreactividad de la ruta de las hexosaminas.
Existen numerosas evidencias que indican que estos cinco mecanismos se activan por el efecto de la hiperglucemia al generar la sobreproducción de las especies reactivas de oxígeno (ROS) y de nitrógeno (NOS). En el diabético, la formación de las ROS y NOS en la microvasculatura se atribuye a la hiperglucemia intracelular, mientras que en la macrovasculatura y el corazón, parece ser consecuencia de un incremento en la oxidación de los ácidos grasos.
El desarrollo de la neuropatía es resultado, como se ha demostrado en modelos animales e in vitro, de alteraciones metabólicas inducidas por la hiperglucemia crónica,1 que produce la activación de las enzimas aldosa reductasa y sorbitol deshidrogenasa de la ruta de los polioles, lo cual resulta en la conversión intracelular de la glucosa a sorbitol y fructuosa.2 La hiperglucemia y el estrés oxidativo que se desarrolla como consecuencia de la misma también contribuyen a la glicosilación anormal de proteínas neurales y de la matriz extracelular, así como a la activación anormal de la proteincinasa C, que agrava la disfunción e isquemia neuronal.3 La acumulación de los polioles disminuye en las neuronas la síntesis de mioinositol, necesario para la conducción del impulso eléctrico. Además, la conversión química de la glucosa redunda en una disminución en el contenido del nicotín adenín dinucleótido fosfato (NADP), el cual se requiere para la detoxificación de las especies reactivas de oxígeno y para la síntesis del óxido nítrico. Esto produce un incremento gradual del estrés oxidativo en las neuronas y de la vasoconstricción, conduciendo a la isquemia, lo que producirá el daño y muerte neuronal.4
La enfermedad vascular periférica es otro factor que contribuye al desarrollo de las úlceras en más de 50% de los casos. Comúnmente afecta las arterias tibial y peroneal de la pantorrilla. La disfunción de las células endoteliales y de las fibras musculares lisas de las arterias periféricas es consecuencia de la hiperglucemia crónica, ya que se genera una disminución gradual de los vasodilatadores derivados del endotelio, lo que promueve la vasoconstricción. Asimismo, la hiperglucemia se asocia con un incremento en el tromboxano A2, un vasoconstrictor y agonista de la agregación plaquetaria, lo que lleva a un incremento en el riesgo de hipercoagulabilidad, siendo también un potencial para las alteraciones en la matriz extracelular vascular para la producción de estenosis del lumen arterial. También la hipertensión y la hiperlipidemia, factores comunes en los diabéticos, contribuyen al desarrollo de la enfermedad arterial periférica, produciendo la enfermedad arterial oclusiva que resulta en la isquemia de los miembros inferiores, incrementando el riesgo de ulceraciones.5
Los problemas de pie diabético son la principal causa de hospitalización en pacientes con diabetes, siendo la ulceración el factor de riesgo más común para la pérdida de los miembros inferiores, ya que si no se da un tratamiento adecuado, estas lesiones pueden conducir a infecciones, gangrena y amputación. Los mecanismos fisiopatogénicos del pie diabético son la neuropatía, las infecciones, la disfunción microvascular e isquemia, que actuando en conjunto contribuyen a la secuencia de necrosis tisular, ulceración y gangrena. Entre estos factores, la neuropatía periférica, detonada por la isquemia, es aparentemente el factor predisponente para las ulceraciones, ya que esta relación se llega a presentar hasta en 80% de los diabéticos. Pryce, un médico inglés, fue el primero en describir en 1887,6 que "hay numerosas evidencias que apoyan que la causa principal de las úlceras perforantes es la degeneración neural periférica y que la diabetes es la generadora de ello". Actualmente, se considera que la neuropatía, la infección y la enfermedad arterial periférica forman la tríada que lleva a los eventos de gangrena (Figura 1) y amputación del pie diabético, todo desencadenado por la hiperglucemia crónica.7

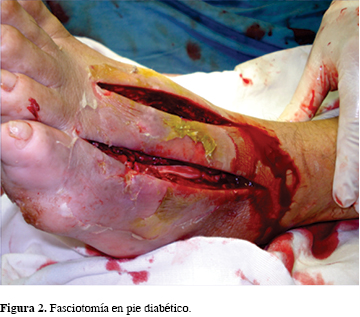
Una vez que la úlcera se desarrolla, hay un alto riesgo de que su progresión lleve finalmente a la amputación. Se ha demostrado que la ulceración precede a la amputación por arriba de 85% de los casos,8 lo cual puede prevenirse si se adoptan las medidas pertinentes. El objetivo del presente trabajo es mostrar los resultados de un tratamiento que incluye, además de los métodos convencionales de administración de antibióticos, fasciotomías y debridación (Figura 2), la administración de pirofosfato de tiamina o cocarboxilasa, molécula que participa regulando muchas de las disfunciones que se presentan en la diabetes y sus complicaciones;9,10,11 también, porque se ha reportado que la diabetes se asocia a una deficiencia de tiamina.10
Material y métodos
Se llevó a cabo un estudio observacional, longitudinal, descriptivo. En un período comprendido de Enero de 1998 a Junio del 2012 se trataron 29 pacientes con pie diabético, 24 masculinos y 5 femeninos, 27 unilaterales y 2 bilaterales, en un rango de edad de 28 hasta 75 años (promedio, 56 años), bajo los siguientes criterios:
Criterios de inclusión
a) Pie diabético Wagner tipo III y IV.b) Ambos sexos.
c) Sin compromiso vascular.
d) Control metabólico.
e) Control del proceso infeccioso.
f) Mayor de 45 años.
g) Paciente anticoagulado y con vasodilatadores.
Criterios de exclusión
a) Pie diabético Wagner 0, I, II y V.b) Con compromiso vascular.
c) Sin control metabólico.
d) Sin control infeccioso.
e) Pacientes con amputación infra- o supracondílea.
Criterios de eliminación
a) Pacientes alérgicos a cualquiera de los componentes del tratamiento.b) Pacientes que no se apegasen al tratamiento.
Se utilizó la clasificación del Dr. Wagner (1987), que es uno de los sistemas de clasificación más empleados (Wagner Ulcer Classification System), basado en la profundidad de la lesión y en la extensión del tejido necrosado, aunque varios autores cuestionan esta clasificación debido a que no considera la isquemia ni la infección.12
Grado I: Úlcera superficial.Grado II: Úlcera extendida que involucra ligamentos, tendones, cápsula de la articulación o fascia con o sin absceso u osteomielitis.
Grado III: Úlcera profunda con absceso u osteomielitis.
Grado IV: Gangrena en una porción del pie.
Grado V: Gangrena extensiva al pie.
Se analizaron, además, los parámetros más representativos para la valoración clínica de la microcirculación, circulación periférica y central, registro Doppler, sensibilidad, temperatura, coloración, propioceptividad, sin faltar los criterios bioquímicos: química sanguínea, hemoglobina glicosilada, cuantificación del lactato, deshidrogenasa láctica y pirúvica, transcetolasa eritrocítica, agregación plaquetaria e índices de fibrinólisis.
Se desarrolló el tratamiento dirigido al control del proceso infeccioso mediante la impregnación con antibióticos, fasciotomías, debridación del tejido necrótico infectado, anticoagulante y la administración de pirofosfato de tiamina (PFT) o cocarboxilasa por la vía intravenosa o intramuscular. Al paciente hospitalizado se le administraron 25 ml de pirofosfato de tiamina (40 mg por ml) diluidos en 250 ml de solución de cloruro de sodio a 0.9% a pasar en 4 horas cada 48 hrs. Los pacientes ambulatorios recibieron 4 ml de PFT + 1 ml de lidocaína simple al 2% por la vía intramuscular tres veces por semana, cubriéndose la zona tratada por la debridación con sulfadiazina de plata.
Resultados
Se atendieron 29 pacientes y un total de 31 pies comprometidos, 19 correspondieron a la clasificación Wagner tipo III y 12 al tipo IV; 17 derechos y 14 izquierdos; 27 unilaterales y dos bilaterales. Quirúrgicamente, se realizaron 11 fasciotomías, dos resecciones de cabeza de metatarsianos y 17 amputaciones de dedos. La cicatrización del defecto de partes blandas por el debridamiento osciló entre dos y seis meses. Las manchas hipercrómicas y la coloración del pie mejoraron significativamente con el manejo del pirofosfato de tiamina durante tres a seis meses, según el caso (Figuras 1 y 2).
Discusión
Los resultados obtenidos en el rescate del pie diabético con el uso del pirofosfato de tiamina o cocarboxilasa se fundamentan en las múltiples actividades metabólicas y no metabólicas que realiza esta molécula en el organismo y que se encuentran disminuidas o ausentes en los pacientes con diabetes, según se ha comprobado en diversos modelos animales, así como en estudios clínicos y que están descritas en la literatura.
El PFT realiza la descarboxilación oxidativa del piruvato a través de la piruvato deshidrogenasa (PDH), sinérgicamente estimulada por la insulina, PEP y AMP, pero inhibida competitivamente por el ATP, NADH y acetil-CoA.13 Estudios independientes han mostrado que el PFT, además de formar parte del complejo de la PDH, regula la actividad del complejo de forma exógena, ya que su actividad se incrementa en relación directa a la concentración del PFT; lo anterior se comprobó en un estudio realizado en linfoblastos, fibroblastos y miocitos obtenidos de biopsias de 200 niños japoneses afectados de lactacidemia.14 También el PFT realiza una descarboxilación oxidativa en los derivados del ácido α-cetocarboxílico de los aminoácidos de cadena ramificada. A través de estas funciones, el PFT promueve la activación del ciclo de Krebs para la obtención de energía celular. Otras de las disfunciones del diabético, las dislipidemias, también se ven mejoradas con el PFT, ya que los ácidos grasos saturados en alta concentración disminuyen la síntesis de glucógeno inducida por insulina, así como la producción de lactato. También se reduce la oxidación de la glucosa. La disfunción mitocondrial inducida por los ácidos grasos saturados se relaciona con las alteraciones en el metabolismo de la glucosa regulado por la insulina; el PFT participa en la regulación de estos procesos15 de manera directa e indirecta.
El metabolismo de los ácidos grasos de cadena larga y muy larga, así como de otros lípidos, se lleva a cabo en los peroxisomas mediante la 2-Hidroxifitanoil-CoA-Liasa, actualmente llamada 2-Hidroxiacil-CoA-Liasa 1 (HCAL1), enzima activada por el pirofosfato de tiamina o cocarboxilasa.16
La transcetolasa es una enzima dependiente del pirofosfato de tiamina; participa en la fragmentación de la molécula de glucosa por la vía de las pentosas. Como producto de la reacción, se forma el nicotín adenín dinucleótido fosfato reducido (NADPH), que juega un papel fundamental en la síntesis del glutatión, compuesto esencial en la defensa del organismo contra el daño producido por el estrés oxidativo. La reducción en la actividad de la transcetolasa, por deficiencia del pirofosfato de tiamina, interfiere con todos estos procesos bioquímicos fundamentales.
Uno de los graves problemas de la diabetes es la formación de elevados índices de los productos de glicosilación avanzada (AGE), los cuales son degradados por el PFT; se ha propuesto que el mecanismo mediante el que el PFT elimina los AGE es el siguiente: interactúa con las formas aldehído de cadena abierta de los azúcares reductores, que son los sitios de glicación de las proteínas, de una manera similar a como lo realizan el piridoxal y el fosfato de piridoxal, en los que se ha demostrado que compiten con los carbohidratos para formar la base de Schiff con el grupo amino de las proteínas y, así, ejercen un efecto competitivo e inhibidor de su formación. Otra propuesta es que funcionan como trampas para los grupos carbonilo intermediarios reactivos; sin embargo, se ha propuesto un mecanismo alternativo, la quelación. Por el efecto que ejercen los inhibidores de la formación de AGE a concentraciones milimolares, se propone que la inhibición es resultado de una función quelante o antioxidante más que por efecto de atrapar los grupos carbonilo.17 La importancia del efecto que ejerce el PFT radica en que actúa a nivel de los productos Amadori y post-Amadori; es decir, en los compuestos tardíos, que son tan deletéreos.18,19 Estudios muy recientes han demostrado que la formación de los AGE es precedida por conversiones oxidativas catalizadas por iones metálicos de transición. Como además de la T y el PFT, otras sales de tiazolio inhiben la formación de los AGE, se propone que es el anillo tiazólico el inductor de la degradación de los radicales α-diacetona de las proteínas y de la inhibición de la autooxidación de los AGE mediante las especies de oxígeno reactivas (ROS). También se ha visto que la T y el PFT actúan directamente como antioxidantes, reaccionando con las ROS y evitando la peroxidación de lípidos.20 Como se podrá concluir, el PFT controla muchas de las alteraciones metabólicas de la diabetes, con lo que se puede recuperar el pie diabético.
Conclusiones
Por los datos clínicos y la evolución de los pacientes, se concluye que la administración del PFT permitió el control de las disfunciones metabólicas y no metabólicas que conducen a las complicaciones del diabético, por lo que se debe considerar una herramienta para el tratamiento de los diabéticos en general y para el rescate del pie diabético en particular.
REFERENCIAS
1. Simmons Z, Feldman E: Update on diabetic neuropathy. Curr Opin Neurol. 2002; 15: 595-603. [ Links ]
2. Feldman EL, Russell JW, Sullivan KA, Golovoy D: New insights into the pathogenesis of diabetic neuropathy. Curr Opin Neurol. 1999; 15: 553-63. [ Links ]
3. Huijberts MS, Schaper NC, Schalkwijk CG: Advanced glycation end products and diabetic foot disease. Diabetes Metab Res Rev. 2008; 24(S1): 19-24. [ Links ]
4. Clayton W. Jr., Elasy TA: A review of the pathophysiology, classification, and treatment of foot ulcers in diabetic patients. Clin Diabetes. 2009; 27(2): 52-8. [ Links ]
5. Panju A: Does the clinical examination predict lower extremity peripheral arterial disease? JAMA. 2006; 295(5): 536-46. [ Links ]
6. Pryce TD: A case of perforating ulcers of both feet associated with diabetes and ataxic symptoms. Lancet. 1887; 11: 11-2. [ Links ]
7. Levin ME: An overview of the diabetic foot: pathogenesis, management and prevention of lesions. Int J Diab Dev Countries. 1994; 14: 40-8. [ Links ]
8. Bowering G: Diabetic foot ulcers. Pathophysiology, assessment, and therapy. Can Fam Physician. 2001; 47: 1007-16. [ Links ]
9. Hammes HP, Du X, Edelstein D, Taguchi T, Matsumura T: Benfotiamine blocks three major pathways of hyperglycemic damage and prevents experimental diabetic retinopathy. Nat Med. 2003; 9: 294-9. [ Links ]
10. Thornalley PJ: Advanced glycation end products: what is their relevance to diabetic complications? Diabetes Obes Metab. 2007; 9(3): 233-45. [ Links ]
11. Thornalley PJ: High dose thiamine therapy for patients with type 2 diabetes and microalbuminuria: a randomised, double-blind placebo-controlled pilot study. Diabetologia. 2009; 52: 208-12. [ Links ]
12. Oyibo SO, Jude EB, Tarawneh I, Nguyen HC, Harkless LB, Boulton AJ: A comparison of two diabetic foot ulcer classification systems: the Wagner and the University of Texas wound classification systems. Diabetes Care. 2001; 24: 84-8. [ Links ]
13. Ciszak EM, Korotchkina LG, Dominiak PM, Sidhu S, Patel MS: Structural basis for flip-flop action of thiamin pyrophosphate-dependent enzymes revealed by human pyruvate dehydrogenase J Biol Chem. 2003; 278(23): 21240-6. [ Links ]
14. Naito E, Ito E, Yokota I, Saijo T, Matsuda J, Kuroda Y: Thiamine-responsive lactic acidaemia: role of pyruvate dehydrogenase complex. Eur J Pediatr. 1998; 157: 648-52. [ Links ]
15. Hirabara SM, Curi R, Maechler P: Saturated fatty acid-induced insulin resistance is associated with mitocondrial dysfunction in skeletal muscle cells. J Cell Physiol. 2010; 222(1): 187-94. [ Links ]
16. Fraccascia P, Casteels M, De Schtyver, Van Veldhoven PP: Role of thiamine pyrophosphate in oligomerisation, functioning and import of peroxisomal 2- hydroxyacyl-CoA-lyase. Biochim Biophys Acta. 2011; 1814(10): 1226-33. [ Links ]
17. Price DL, Rhett PM, Thorpe SR, Baynes JW: Chelating activity of advanced glycation end-products inhibitors. J Biol Chem. 2001; 276(52): 48967-72. [ Links ]
18. Booth AA, Khalifah RG, Hudson BG: Thiamine pyrophosphate and pyridoxamine inhibit the formation of antigenic advanced glycation end products: comparison with aminoguanidine. Biochem Biophys Res Commun. 1996; 220: 113-9. [ Links ]
19. Booth AA, Khalifah RG, Todd P, Hudson BG: In vitro kinetic studies of formation of antigenic advanced glycation end products (AGEs) - Novel inhibition of post-Amadori glycation pathways. J Biol Chem. 1997; 272(9): 5430-7. [ Links ]
20. Shapoval GS, Babii LV, Kruglyak OS, Vovk AI: Antioxidant activity of thiamine and its structural analogs in reactions with electrochemically generated hydroxyl radicals and hydrogen peroxide. Theor Exp Chem. 2011; 47(1): 55-60. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/actaortopedica














