1.1 Introducción
Los sensores de gases más utilizados se basan en óxidos metálicos semiconductores cuya conductividad eléctrica se ve modulada como consecuencia de la reacción producida entre el semiconductor y los gases presentes en la atmósfera. El dióxido de estaño es uno de los semiconductores que presenta más interés tecnológico como material activo en sensores de gases. Las propiedades de sensado del dióxido de estaño [SnO2] (sensibilidad, selectividad y reproducibilidad) dependen de varios factores, siendo los más relevantes el tamaño de partícula, distribución de tamaño de partícula y área superficial específica. La utilización de SnO2 nanocristalino beneficia sustancialmente el sensado de gases, debido a la magnificación de los efectos superficiales. Los sensores químicos de gases requieren la utilización de materiales dieléctricos, que tienen la propiedad de reaccionar eléctricamente con la atmósfera que los rodea. El uso de los sensores químicos de gases se ha incrementado, y se ha observado un gran avance en la ciencia de los materiales, particularmente en los llamados Sistemas Micro-electromecánicos.
El agregado de contaminantes en óxidos metálicos semiconductores permite alterar sus características eléctricas. Mediante la detección de las variaciones de conductividad eléctrica en las películas sólidas delgadas de SnO2 por el fenómeno de adsorción, se detectan las partículas de gas presentes en el ambiente (Ante la presencia de un gas, el óxido del metal hace que el gas se disocie en iones cargados con el resultado de una transferencia de electrones. Un par de electrodos parcialmente embebidos en el óxido del metal mide el cambio de conductividad del sensor. Este cambio es proporcional a la concentración del gas).
Los sensores de gases semiconductores, ya sean de películas gruesas, películas delgadas de metal-óxido-semiconductore (MOS -metal oxide semiconductor- por sus siglas en inglés), micro-maquinado, entre otros, requieren ser calefactados de manera localizada y uniforme entre 200 y 450 °C (para mantenerlo a una temperatura óptima para la detección de gas). Debido a que su sensibilidad depende fuertemente de la temperatura de operación, es necesario controlar cuidadosamente dicha temperatura. Por tal motivo, el calefactor integrado de platino cumple la doble función de calefactar y controlar la temperatura deseada.
Los sensores, pueden detectar una gran gama de gases en rangos de ppm o combustibles. Se pueden conseguir diferentes características de respuesta variando los materiales, las técnicas del proceso y la temperatura de trabajo. Su simplicidad de construcción resulta en una vida de 10 a 25 años libre de problemas. Son robustos, aguantan choques y vibraciones siendo válido para servicio antiexplosión.
Los sensores químicos de gases requieren la utilización de materiales dieléctricos, que tienen la propiedad de reaccionar eléctricamente con la atmósfera que los rodea. El uso de los sensores químicos de gases se ha incrementado, y se ha observado un gran avance en la ciencia de los materiales, particularmente en los llamados Sistemas Micro-electromecánicos.
La detección de mezclas combustibles o tóxicas gas/aire permite prevenir accidentes de bienes y personas, tanto en ambientes industriales como domésticos. Este artículo describe las propiedades físicas de los dieléctricos, las modificaciones químicas y electrónicas que sufre el dióxido de titanio [TiO2] al verse expuesto a una atmosfera que contenga oxígeno. Este artículo describe las propiedades físicas de los dieléctricos, las modificaciones químicas y electrónicas que sufre el TiO2 al verse expuesto a una atmosfera que contenga oxígeno.
1.2 Propiedades Físicas de los Dieléctricos
Las propiedades físicas de los dieléctricos, son las eléctricas: polarización, conductividad, pérdidas dieléctricas, entre otras [1]. Los dieléctricos se han utilizado como aislantes. Su importancia es su conductividad y las pérdidas dieléctricas pequeñas. Los dieléctricos se emplean no sólo como elementos pasivos en diversos circuitos eléctricos, sino como elementos mediante los cuales es posible realizar la transformación de energía mecánica en energía eléctrica. Algunos usos de los dieléctricos son: capacitores, para detectar, amplificar y modular señales eléctricas y ópticas [1,2].
1.2.1 Conductividad Eléctrica
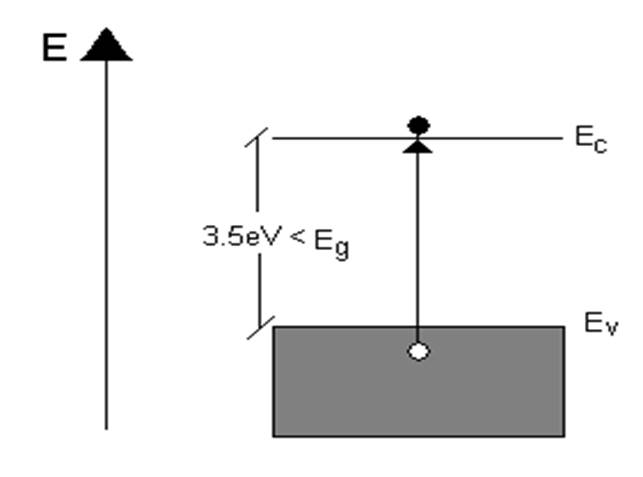
Los dieléctricos pertenecen a los sólidos con anchura de la banda de energías prohibidas (E g ) mayor que 3.5 eV [1-3] (Figura 1.1). A temperatura ambiente, la excitación de electrones entre la banda de valencia y la banda de conducción es poco probable; la concentración de portadores libres es muy pequeña. En esas condiciones, la conductividad intrínseca es:
Si en el dieléctrico hay átomos de impureza y/o defectos, se generaran portadores de carga libre. A temperatura ambiente, la conductividad será mayor [6,7], los portadores de carga pueden ser tanto electrones (mayoritarios) como huecos [8] (minoritarios) si es donador, este dieléctrico se llama dieléctrico por exceso o del tipo-n. Si la impureza es de carácter aceptor, los portadores de carga mayoritaria serán (huecos) y el dieléctrico es por defecto o del tipo- p [1,3,9].
Si al dieléctrico se le aplica un campo eléctrico, los portadores libres adquieren movimiento y se produce la conductividad. La naturaleza de los portadores de carga mayoritarios (electrones o huecos), el mecanismo de conducción recibe, el nombre de electrónico [5,7,10]. Cuando la concentración de electrones es muy pequeña, la conductividad es insignificante. El mecanismo de generación de portadores puede ser no sólo térmico [3,10,11].
Los electrones de conducción también pueden generarse mediante la absorción de luz de longitud de onda conveniente o de partículas aceleradas [1,3,11].
Si la conducción (σ) tiene carácter intrínseco, entonces al igual que los semiconductores [12,13], se tiene que:
Aquí, n y p = concentraciones de electrones y huecos libres, y μ n y μ p , = movilidades y e = carga elemental (1.6021x10-19C). La dependencia de la conductividad eléctrica con la temperatura, en los dieléctricos se describe por la expresión [1,5,7,8,14,15]:
La dependencia exponencial de σ (T), se debe a que la concentración de portadores varía con la temperatura según la ley exponencial [15-17]:
(ΔE= es el ancho de la banda prohibida, k b = la constante de Boltzmann, T = temperatura, h = cte de Planck y m * = masa efectiva del electrón), mientras que la movilidad (μ) presenta una variación más lenta con la temperatura. Si predomina la dispersión de los portadores por las vibraciones acústicas de la red, entonces, la dependencia en la movilidad con la temperatura se expresa como:
En muchos dieléctricos la movilidad de los electrones y de los huecos es muy pequeña, estos valores tan bajos de la movilidad se deben a que los electrones o huecos se encuentran formando las cuasipartículas denominadas polarones [11,12].
En los dieléctricos puede existir otro mecanismo de transporte de la carga llamado polarónico. La conducción por polarones [1,3,5,11] se produce cuando los electrones o huecos están fuertemente ligados con la red cristalina. Si la concentración de portadores de carga libres es baja, se produce una (polarización) [5,7]. En la que las cargas se desplazan se forma un polarón [1,3,5,19].
El electrón mueve al polarón. La conducción por polarones es característica de los cristales iónicos, en los cuales la interacción coulombiana es grande, su masa efectiva es millares de veces mayor que los valores de m * característicos de los metales y de los semiconductores. La movilidad de los portadores en los dieléctricos es millares de veces menor que su movilidad en los metales y en los semiconductores.
Cuando los campos eléctricos aplicados al dieléctrico son débiles1 no pueden variar la concentración ni la movilidad de los portadores de carga. Los valores de las magnitudes de n y de μ siguen siendo muy bajos y su aportación a la conducción es insignificante [1,3,5,19]. En el caso de los campos eléctricos intensos. La magnitud de la energía del campo eléctrico puede ser suficiente para que se rompa el polarón. Como consecuencia, la movilidad aumenta. También a causa de la ionización por choque, la concentración de electrones liberados hacia la banda de conducción aumenta. Todo esto hace que crezca la conducción por electrones [1,3,5,7,11,19].
En algunos dieléctricos a altas temperaturas predomina la conducción por iones [1,3,5,15,19], en la cual la corriente es transportada por iones positivos (cationes) y/o negativos (aniones). Los aniones se mueven hacia el ánodo y los cationes hacia el cátodo. En los dieléctricos sólidos la traslación de un ión de una posición de equilibrio a otra se puede realizar solamente cuando superan las fuerzas que lo unen a las partículas vecinas [1,3,5,19]. Es decir, el ión tiene que superar la barrera energética E 0.
1.2.2 Estados Localizados Relacionados con la Superficie
Además de las impurezas y defectos, todo cristal real contiene otra alteración relacionada con la superficie [8,20,21]. En la superficie libre suelen existir estados electrónicos asociados a la superficie cuyas energías se localizan en la banda prohibida, entre las bandas de valencia y de conducción del dieléctrico [22-24].
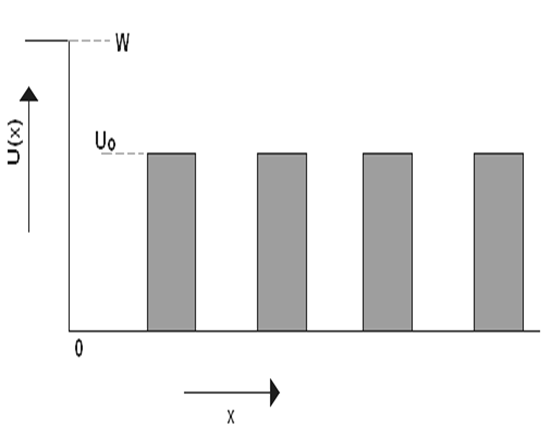
Usamos una cadena unidimensional limitada para demostrar cómo la limitación de las dimensiones del dieléctrico (cristal) influye sobre el espectro energético de los electrones, En este caso la dependencia de la energía potencial U(x) de un electrón respecto de la distancia x, puede ser representada, geométricamente, como se muestra en la Figura 1.2.
Si el vacío está en la región x<0, la energía potencial de un electrón en esta región puede hacerse igual a cero.
En el dieléctrico la energía potencial tiene forma periódica [22,24]:
En una dimensión
Según la solución de la ecuación de onda, la energía del estado referido al nivel del vacío es [24]:
Donde:
ћ es la constante de Planck (h/2π),
m es la masa del electrón en reposo,
k es nπ/L=nπ/Na, n = 1, 2, 3, …, N, y
a es la constante de una red lineal.
Dentro del dieléctrico la función de onda de un estado electrónico asociado a la superficie tendrá la forma, para x> 0 [23,24],
Donde el factor e qx sirve para enlazar el electrón a la superficie.
Los estados electrónicos pueden estar ocupados o vacíos, los cuales modifican las concentraciones de equilibrio local de electrones y de huecos, manifestándose en forma de un desplazamiento del nivel de Fermi respecto a los bordes de la banda. Debido a que el nivel de Fermi se origina una curvatura de las bandas cerca de la superficie del dieléctrico [24].
Algunos óxidos metálicos semiconductores (SnO2, TiO2, WO3,) pueden considerarse como dieléctricos, y su superficie, es altamente reactiva con los gases de la atmósfera que lo rodean, produciéndose entre ambas, una interacción química y electrónica al instante del contacto.
1.3 Absorción de Oxígeno en la Superficie de un Óxido Metálico
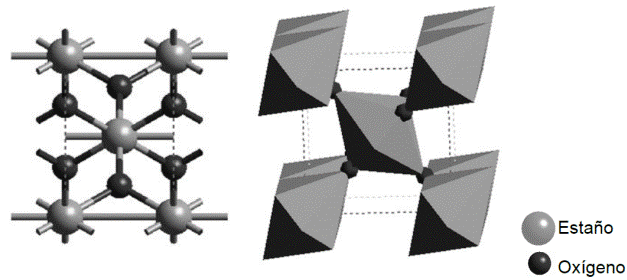
Los sensores de gases basados en óxidos metálicos se utilizan frecuentemente en atmósferas de aire para detectar la presencia de pequeñas concentraciones de gases inflamables o tóxicos, por lo que la superficie siempre está expuesta a una presión parcial de oxígeno constante, con una magnitud del orden de 0.2 atm [25-40]. En la revisión bibliográfica realizada, se localizaron trabajos reportados a base de dióxido de estaño [SnO2] [30,31]. Dada la similitud entre los radios covalentes del TiIV y el SnIV, además de poseer el mismo grado de oxidación, análogamente el TiO2 (rutilo) es isomorfo con el SnO2 (casiterita) [32]. El SnO2 en fase cristalina presenta una estructura tetragonal tipo rutilo. La celda unitaria tiene 6 átomos, 2 de Sn y 4 de O (ver Figura 1.3). Consecuentemente podemos aplicar dichos mecanismos de respuesta del SnO2 al TiO2.
El dióxido de titanio [TiO2] se comporta como un semiconductor tipo-n, debido al exceso del metal. Si una superficie ideal de TiO2 (ver Fig. 1.4) se expone a una atmósfera conteniendo oxígeno (aire), la superficie es químicamente y electrónicamente modificada al reaccionar con las diferentes especies de oxígeno contenidas en la atmósfera, (O 0 y/o O 0 2 ) [28]. Los radicales son especies de oxígeno ionizados, (O 2 - , O - y O -2 ), y permanecen estables en procesos isotérmicos. El tipo de especie dominante es función de la temperatura de exposición del TiO2 al oxígeno. El recubrimiento de la superficie por estas especies de oxígeno está limitado a 1012-1013 átomos/cm-2 (límite de Weisz) [34,35]. En la Figura 1.5 se muestran las diferentes reacciones.
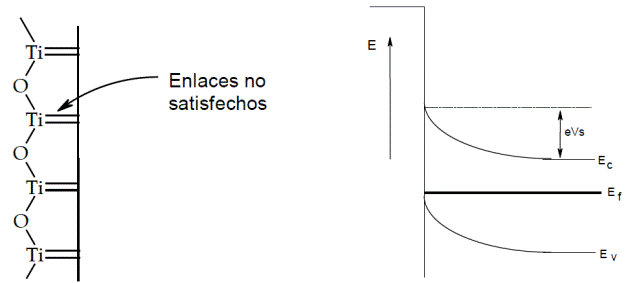
Figura 1.4 Arreglo estructural de una superficie ideal de TiO2 y su diagrama de bandas de energía. Ec, Ef, y Ev, son las energías correspondientes a la banda de conducción, nivel de fermi y banda de valencia respectivamente.

Figura 1.5 Reacciones desarrolladas en la interfase de una superficie de TiO2 y una atmósfera conteniendo oxígeno.
En la Figura 1.6 se muestran las diferentes especies de oxígeno relevantes en las reacciones superficiales y su energía de adsorción. En los valores de las energías, se estima que la diferencia entre la energía de las especies O -2 adsorbida (O -2 )ads, y la O -2 reticular (O -2 )ret, es del orden de 20eV y entre ½(O 2 )gas y ½(O -2 )ads de 1.5eV[28,35].
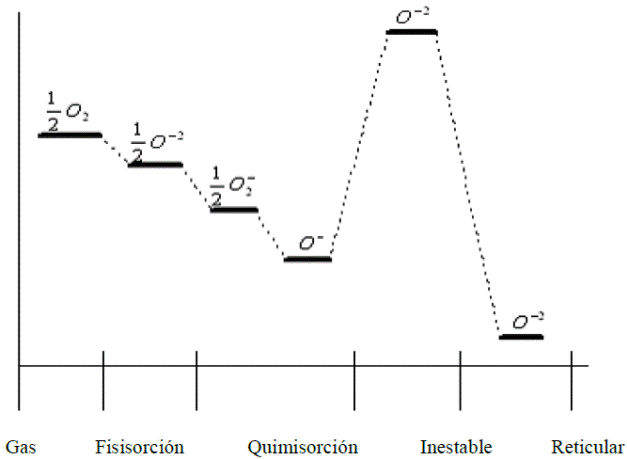
Figura 1.6 Diagrama de energía de las diferentes especies de oxígeno en fase gaseosa, adsorbidas en la superficie y en la red [28, 35].
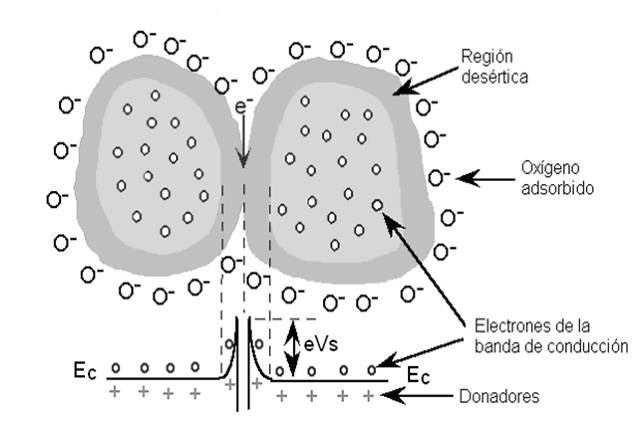
Los electrones usados para la ionización del oxígeno provienen del TiO2, en la región próxima a la superficie, se crea una región desértica de portadores libres (electrones), llamada región de carga espacial o de deserción. En ésta se genera una barrera de potencial, al igual que en las regiones de contacto intergranulares [27-29]. La Figura 1.7 muestra el contacto intergranular y barrera de potencial consecuente a la formación de iones en esa región.
La altura de la barrera de potencial, eV s , está dada por la ecuación de Schottky,
Donde:
N t = [O 2 - ]+[O - ]+[O -2 ], es la densidad superficial de especies de oxígeno adsorbidas
εε 0 es la permitividad del TiO2
N d es la densidad volumétrica que proveen los electrones de conducción.
Aproximación para la conductancia a una temperatura T, está dada por la siguiente ecuación [36]:
Donde:
G 0 es un factor que contiene la conductancia en el volumen de granos y efectos geométricos.
En condiciones reales la magnitud de eV s es función de la temperatura, de la concentración de otras especies oxidantes y reductoras en la atmósfera, P O y P R , y del tiempo de exposición a esa atmósfera, t, esto es:
En un proceso isotérmico y en atmósfera controlada se usa la Ec. (1.11). La altura de la barrera aumenta con la temperatura debido a que la concentración de especies de oxígeno adsorbidos también se incrementa con esta [27-29].
En las películas delgadas, la región de carga especial se extiende a través de toda la profundidad de la película.
Si el oxígeno adsorbido se difunde hacia el volumen, ocupando sitios intersticiales y/o vacantes, el material tenderá a ser electrónicamente compensado, disminuyendo así su conductividad. Para que la difusión ocurra se requiere de una energía térmica que active el proceso.
Este será irreversible mientras no se tenga la exodifusión total del oxígeno. En el presente caso, se logró una reversibilidad parcial del proceso mediante un tratamiento térmico en vacío o en nitrógeno (N 2 ), a temperaturas superiores a las que se realiza el proceso de adsorción-difusión.
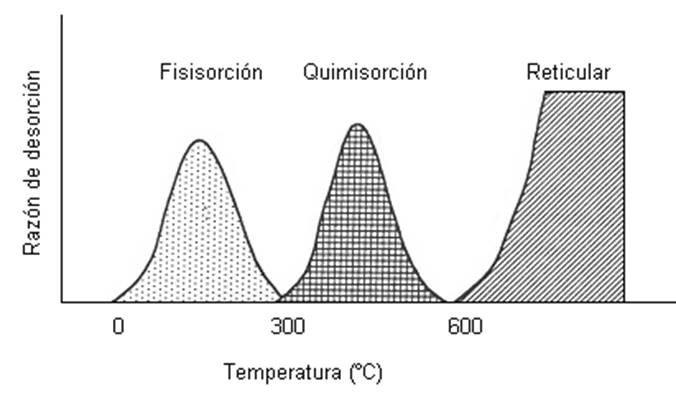
Es posible evaluar experimentalmente la concentración de gas desorbido de dos maneras: 1) mediante el monitoreo de la conductividad como función de la temperatura [37], 2) mediante la espectroscopía de masas [38,39] y 3) desorción a temperatura programada (TPD por sus siglas en inglés).
En ambos experimentos se determina que el oxígeno es desorbido en tres intervalos de temperatura. A temperaturas bajas (20-300 °C), fisisorbido (es cuando la interacción entre el oxígeno y la superficie sólida se debe sólo a las fuerzas del tipo Van der Waals [40]). En un intervalo intermedio de temperaturas (300-600 °C), las especies quimisorbidas (es cuando reacciona químicamente el oxígeno y la superficie sólida [40]), y en un rango de temperaturas altas (T>600 °C) el oxígeno es exofundido desde el volumen (ver Fig. 1.8).
En la Figura 1.9 se muestra el comportamiento de la región de carga espacial en un óxido metálico, como es el caso del TiO2, cuando es expuesto al oxígeno.

Figura 1.9 Comportamiento de la región de carga espacial en un óxido metálico. i) Distribución de carga. ii) Banda de conducción cerca de la superficie. iii) Concentración de electrones en la banda de conducción. Donde: S son los estados localizados relacionados con la superficie generados por la adsorción del oxígeno y nc es la concentración de electrones dentro del volumen.
1.4 Catálisis Heterogénea
Catálisis es el conjunto de procedimientos y conocimientos que permiten que la velocidad con la que transcurre una reacción se incremente in-situ. La catálisis es un fenómeno químico superficial. Una substancia puede actuar como catalizador en un sistema específico dependiendo de su naturaleza química [42]. En la catálisis heterogénea el fenómeno catalítico está relacionado con las propiedades químicas de la superficie del sólido que se ha elegido como catalizador [42].
Para que ocurra este fenómeno catalítico, se requiere una interacción química entre el catalizador y el sistema reactivos-productos [43]. Esta interacción no debe modificar la naturaleza química del catalizador a excepción de su superficie. Este requerimiento nos lleva al concepto de adsorción (fijación en la superficie de un sólido) [40,42-44].
La adsorción de moléculas de un fluido en la superficie de un sólido está relacionada a la catálisis heterogénea [42,43]. Todos los sólidos tienen la propiedad de fijar (adsorber) en su superficie las moléculas, átomos, o iones que se encuentran a su alrededor [44]. Una superficie puede formarse por la ruptura de un cristal perteneciente a un sólido como por ejemplo el TiO2.
En el proceso de ruptura del cristal, algunos enlaces se rompen, lo que origina que cada átomo en la superficie posea uno o más enlaces no satisfechos [44]. Cualquier átomo que se localice en la superficie creada se encuentra en una posición tal que, el número de vecinos que poseía antes de la formación de la superficie ha disminuido y experimenta un conjunto de fuerzas no balanceadas [45]. En la Figura 1.10, se muestra la representación de una superficie y balance de fuerzas en la superficie y el interior del sólido como por ejemplo el TiO2.
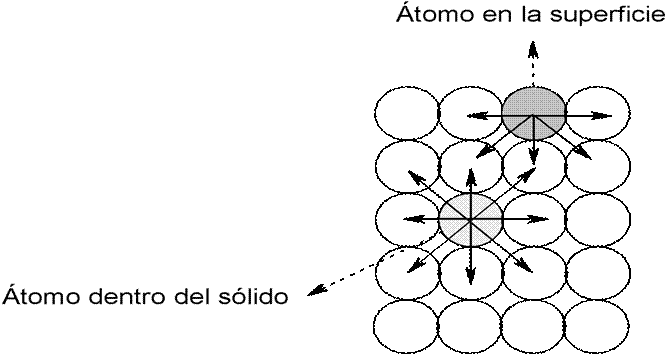
Figura 1.10 Representación de una superficie y balance de fuerzas en la superficie y el interior del sólido.
Si una molécula con afinidad hacia estos enlaces no satisfechos se acerca lo suficiente, se producirá un re-arreglo electrónico con el sistema. El resultado es la fijación de la molécula en la superficie a través de una adsorción química o quimisorción [46].
Otra forma de adsorción es la que ocurre por fuerzas del tipo Van der Waals, entre un átomo o una molécula y la superficie. En este caso no existe re-arreglo electrónico en el sistema y sólo las fuerzas de atracción dipolar son las responsables de la adsorción. Es llamada adsorción física o fisisorción [46].
En la quimisorción los enlaces nuevos formados en la superficie son en alguna medida polares debido a la diferencia de electronegatividad entre los átomos. Esto produce un cambio en el número de electrones de conducción en la superficie, lo cual se puede poner en evidencia a través de medidas de conductividad eléctrica [45-50].
1.4.1 La Cinética de Reacciones Heterogeneas Catalizadas
Cualquier reacción que tome lugar en una superficie comprende cinco pasos consecutivos (Figura 1.11) [46]:
Difusión de reactivos a la superficie
Adsorción de los reactivos
Reacción en superficie
Desorción de los productos
Difusión de los productos hacia la fase fluida.
1.5 Sensores de Gases
Existen diferentes técnicas de detección de gases, entre las que se encuentran:
Uso de instrumentación química, donde la muestra del gas se lleva a través de un tubo hacia el equipo de análisis. La detección está basada en alguna de las siguientes técnicas: cromatografía de gases, espectroscopías de emisión de flama, infrarroja o ultravioleta, espectrometría de masas, etc.
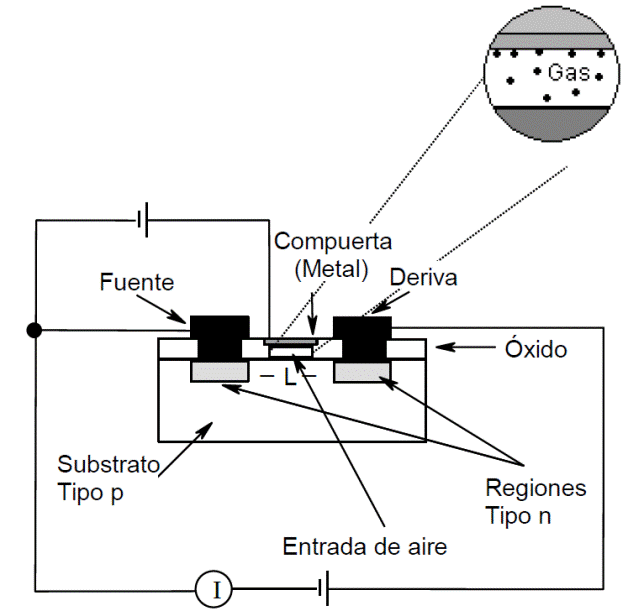
Sensores de gases de estado sólido. Existen dos tipos de sensores: los que se basan en el transistor de efecto campo (FET por sus siglas en inglés) y los sensores basados en óxidos metálicos. En el caso de los transistores de efecto de campo [14-20,29,50], la acción química del gas a detectar ocurre donde normalmente debería estar la compuerta de un transistor de efecto de campo de metal-óxido-semiconductor (MOSFET por sus siglas en inglés) (ver Figura 1.12), y la actividad química cambia el potencial en la compuerta. Debido a que el sensor es un MOSFET modificado, se da una amplificación intrínseca que resulta en una sensitividad alta. En el otro caso, los sensores constan de un óxido metálico entre dos electrodos metálicos [27-29] (Figura 1.13), por medio de los cuales se mide su conductancia eléctrica a determinadas temperaturas y humedad constante.
Eléctrica a determinadas temperaturas y humedad constante.
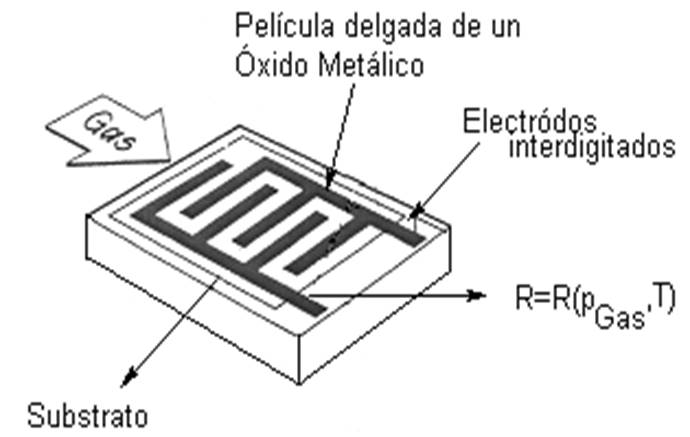
Figura 1.13 Estructura de un sensor de gas basado en un óxido metálico fabricado mediante tecnología de películas delgadas.
1.5.1 Sensores Químicos De Gases
Un sensor químico de gases es un dispositivo que presenta una respuesta medible de naturaleza eléctrica, magnética, óptica, térmica, etc., cuando la composición química de la atmósfera que lo rodea es alterada [25-29].
Funcionan con una película sensible al gas que está compuesta principalmente por cristales de óxido-metal del tipo “n” - normalmente es dióxido de estaño [SnO2], óxido de indio [InO3], óxido de tungsteno [WO3], entre otros -. Estos sensores son muy eficientes ya que pueden operar en un rango amplio de ambientes húmedos. En estos sensores, una reacción química ocurre cuando el gas hace contacto con el sensor provocando que la resistencia eléctrica en el sensor decrezca. En los sensores que usan el dióxido de estaño, la sensibilidad para diferentes gases varía con la temperatura, por lo que hay un filamento que se calienta por medio de una corriente eléctrica.
Los sensores químicos de gases se pueden clasificar con base en alguna de sus características como por ejemplo [25-29]:
1.5.2 Sensitividad
La sensitividad (s), se define como la diferencia de la resistencia eléctrica superficial medida en presencia del gas a detectar (R gas ), en este caso aire con un exceso de oxígeno, menos la de referencia (R 0 ), medida en aire, y esta diferencia normalizada respecto al valor de la referencia, esto es [25-29],
El cambio de la resistencia superficial de un óxido metálico cuando se alteran las condiciones en la atmósfera, se debe principalmente al cambio en la concentración de electrones libres debido al intercambio de carga con las especies gaseosas adsorbidas. Por lo tanto, para tener una sensitividad alta en la detección de un gas, es necesario que el óxido metálico tenga un área sensible (razón área superficial/volumen) máxima. Esto es posible empleando materiales porosos o películas delgadas.
1.6 Conclusiones
La ingeniería de materiales semiconductores es, actualmente, uno de los métodos más eficaces empleados para optimizar los sensores de gases basados en óxidos metálicos semiconductores. Permite obtener mejoras significativas en parámetros de funcionamiento tales como la selectividad del sensor y la sensibilidad a los gases y, además, explorar nuevas y atractivas posibilidades para la monitorización medioambiental.
Un sensor químico de gases es un dispositivo que presenta una respuesta medible de naturaleza eléctrica, magnética, óptica, térmica, etc., cuando la composición química de la atmósfera que lo rodea es alterada. El cambio de la resistencia superficial de un óxido metálico cuando se alteran las condiciones en la atmósfera, se debe principalmente al cambio en la concentración de electrones libres debido al intercambio de carga con las especies gaseosas adsorbidas.
Finalmente, todos los sensores arrojarán una diferencia de potencial, la cual variará dependiendo de la concentración del gas. Para determinar la concentración de un gas en el aire se recurre al término de partes por millón -ppm-, que básicamente consiste en determinar cuántas unidades de algo hay por cada un millón de otras unidades. Esta forma de medición es relativa, por lo que debe consultarse las unidades que estén usándose.











 text new page (beta)
text new page (beta)