1. Introducción
De un modo u otro todas las formas de vida dependen del agua por lo que una cantidad suficiente de esta debe estar disponible para cada organismo [1]. Se estima que un habitante en un país desarrollado consume alrededor de 5 litros diarios en forma de alimentos y bebidas, cantidad que se eleva dramáticamente si se considera el uso doméstico [2]. Actualmente en México se considera que el 20.5 % de los ríos, lagos y embalses son de excelente calidad, mientras el 79.5 % restante presenta un grado de contaminación, debida a descargas no municipales [3]. En aguas residuales el 30 % corresponde a compuestos inorgánicos y el 70 % corresponde a compuestos orgánicos [4], por lo que disminuir la concentración de ambos compuestos de las aguas residuales utilizando productos de desecho como el quitosano proveniente de la corteza de algunos crustáceos, permitirá dar un segundo uso a estos productos disminuyendo un problema social como la contaminación del agua.
El quitosano es un polisacárido que se encuentra de forma natural en los caparazones de crustáceos y forma parte de los exoesqueletos de los insectos, así como también en las paredes celulares de muchos hongos, levaduras y algas [5]. Este polímero es biodegradable, biocompatible y no tóxico debido a que no produce respuesta del sistema inmune, características que unidas a su naturaleza policatiónica generan diversas aplicaciones, donde el carácter hidrófilo e hidrófobo del quitosano, dado por los grupos amino y acetilamino, respectivamente, hacen que este polímero tenga diversas características según la proporción de unidades acetiladas y desacetiladas que conformen el copolimero [6]-[8].
Procesos de bioadsorción se han utilizado para la eliminación de compuestos orgánicos como proteínas y ácidos fúlvicos e inorgánicos como metales y fosfatos [9]-[12], sin embargo, procesos de adsorción en conjunto de estos compuestos no han sido estudiados por un solo tipo de matriz polimérica, por lo que en el presente trabajo se evaluó la capacidad de los HQ para recuperar compuestos orgánicos e inorgánicos de una muestra de agua.
3. Métodos experimentales
3.1 Síntesis de HQ
Se preparó una solución de ácido acético 0.4M y una de NaOH 1M, se disuelve el quitosano en la solución de ácido acético a una concentración de 3.8 % y manteniéndola en agitación constante durante 6 horas a 70°C. La solución se gotea en la solución de NaOH y se deja en agitación por 24 horas, una vez concluido el tiempo de agitación se lavan las perlas.
3.2 Caracterización
Las características morfológicas de los HQ se observaron utilizando un microscopio óptico marca Krüss Optronic modelo MBL2000-T a 40 y 100X.
También se caracterizaron mediante la técnica de FTIR para determinar los grupos funcionales presentes, así como observar si se presentaron cambios por la adsorción de los compuestos utilizando un equipo marca Aligent, modelo Variant 640-IR a 16 barridos con resolución de 4 cm-1. El porcentaje de humedad de los HQ se determinó colocando las muestras en un desecador al vacío hasta obtener un peso constante.
3.3 Adsorción de compuestos orgánicos e inorgánicos
Soluciones de cloruros, proteínas y ácidos fúlvicos, así como una mezcla de estas se prepararon a concentraciones de 63.41, 104.9 y 150 mg/L, respectivamente. 10 mL de cada una de estas soluciones se pusieron en contacto con 2g de HQ y se colocaron en frascos de polietileno de alta densidad. Los frascos se colocaron en un agitador marca Heidolph Inkubator 1000 - Promax 1020 a 200 rpm durante 180 minutos y se tomaron muestras cada 10 minutos para posteriormente ser analizadas.
3.4 Cinéticas del proceso de adsorción
Los datos experimentales de los diferentes procesos de adsorción se utilizaron para evaluar la capacidad de adsorción de los materiales (Ec. 1) y posteriormente fueron ajustados a los modelos de Lagergren (Ec. 2) y Ho-McKay (Ec. 3) con la finalidad de describir la cinética de adsorción.
Donde “qt” es la capacidad de adsorción en el tiempo “t”, “Co” y “Ct” son la concentración inicial y final del adsorbato, respectivamente, “V” representa el volumen de la solución, “m” es la masa del adsorbente, “qe” es la capacidad de adsorción en el equilibrio, k1 y k2 son las constantes de velocidad de pseudo-primer y pseudo-segundo orden respectivamente.
4. Resultados y discusión
4.1 Caracterización
4.1.1 Porcentaje de humedad
El porcentaje de agua retenida en las muestras de las esferas analizadas fue de 94.8 %, por lo que el HQ puede ser clasificado como un hidrogel de alta hidratación de acuerdo con Amashta[13]. Lo que permite que el material tenga una alta permeabilidad y buenas propiedades en la superficie para la adsorción.
4.1.2 Microscopia óptica
Las imágenes obtenidas por microscopia óptica del hidrogel se muestran en la Figura 1, donde se observa la estructura semiesférica del hidrogel, además de permitir visualizar la estructura superficial e interna del material, donde al observar la estructura interna del material a través del corte de la perla a una ampliación de 100X con un contraste de luz baja, donde se distingue la porosidad del material que no es observable a una ampliación de 40X.
4.1.3 Espectroscopia de infrarrojo por transformada de Fourier
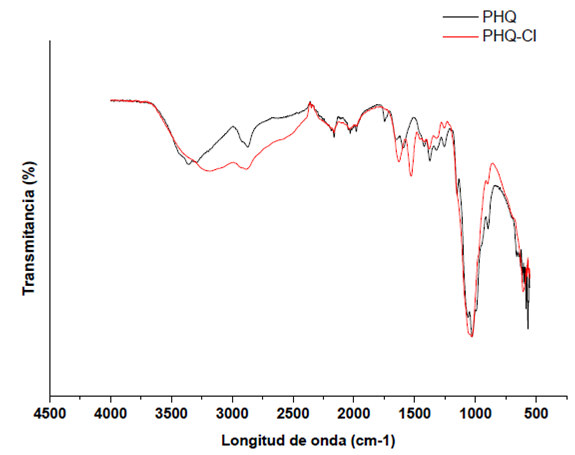
En las Figuras 2 a 4 se muestran los espectros tanto del HQ como de las esferas que fueron sometidas al proceso de adsorción de los diferentes compuestos. En la cual se observa que la absorción de los diferentes compuestos provoca que en las bandas comunes de vibración de tensión de N-H, encontradas entre 3300 a 3500 cm-1, se observa un desplazamiento en la banda correspondiente a 3356 cm-1, así como un cambio en su intensidad, lo cual sumado a un cambio en la intensidad y desplazamiento de la banda de la amina primaria encontrada en 1591 cm-1, puede ser un indicativo de una interacción electrostática entre la amina protonada y el cloruro (NH3 +Cl-) o los grupos COOH de la proteína y el ácido fúlvico (NH3 +RCOO-) [14]-[16]. Además, el aumento de la intensidad de las bandas a 1735, 1654 y 1373 cm-1 pueden ser asignadas a una vibración de estiramiento por enlaces C=O y C-N, comprobarían la adsorción de la proteína y el ácido fúlvico por parte del HQ [12], [17], [18].
4.2 Adsorción de compuestos orgánicos e inorgánicos
En la Figura 5 se observa el comportamiento de la cantidad removida de cada uno de los compuestos por gramo del material adsorbente con respecto al tiempo de contacto en forma individual. Encontrando a los 70, 130 y 180 minutos, el máximo de adsorción para cloruros, proteína y ácido fúlvico respectivamente, sin embargo para este último, un proceso de semisaturación se observa desde los 90 minutos, lo cual puede atribuirse a que el proceso esté ocurriendo en dos pasos: 1) Un proceso de difusión de capa límite donde la superficie del adsorbente se encuentra relativamente libre de ácido fúlvico y donde la cinética de adsorción puede considerarse como un proceso controlado por la difusión de moléculas de ácido fúlvico de la solución al adsorbente, donde tan pronto como las moléculas de ácido fúlvico llegan a la superficie del adsorbente instantáneamente se unen al grupo amino protonado (NH3 +) de las PHQ, y 2) un proceso de difusión intrapartícular, ya que se observa que una vez pasado el periodo de adsorción inicial el aumento en las cantidades de adsorción con el tiempo fue muy lento, esto debido a la disminución o indisponibilidad de grupos -NH3 + en la superficie del adsorbente y a que las moléculas de ácido fúlvico entrantes encuentran interacciones electrostáticas desfavorables de las moléculas de ácido fúlvico adsorbidas. Donde el HQ muestra una mejor capacidad de adsorción de los compuestos orgánicos.
Mientras que al encontrarse en conjunto la capacidad máxima de adsorción se encontró a los 110, 170 y 140 minutos para los cloruros, proteína y ácido fúlvico respectivamente (Figura 6). Observándose una diminución en la capacidad de adsorción de cloruros y proteína, debido a una competencia por los grupos NH3 +, donde la preferencia del HQ por las moléculas de ácido fúlvico sobre las de proteína se debe al pH necesario para que las moléculas de cada sustancia se encuentren desprotonadas y puedan unirse con el grupo amino protonado. Donde el pH necesario para que la molécula de ácido fúlvico se encuentre desprotonada, es menor que el de la proteína (3 y 4.9, respectivamente), por lo cual serían estas las primeras en adherirse a los grupos amino protonados del HQ [12], [17].
4.3 Cinéticas del proceso de adsorción
De acuerdo a las constantes cinéticas mostradas en la Tabla 1, las cinéticas de adsorción se ajustan de mejor manera al modelo de Ho-McKay, indicando un proceso de quimisorción, resultado de las fuerzas de interacción electrostáticas entre los componentes cargados positivamente de los adsorbentes (NH3 +) y los iones Cl- o los radicales RCOO- cargados negativamente de los sorbatos [19].
Tabla 1 Parámetros obtenidos de modelos cinéticos de adsorción.
| Modelo | Interferente / adsorbente | Parámetros | r2 |
|---|---|---|---|
| Lagergren | Cloruros - PHQ |
|
0.9932 |
| Proteína - PHQ |
|
0.9840 | |
| Ácido fúlvico - PHQ |
|
0.9097 | |
| Ho-McKay | Cloruros - PHQ |
|
0.9880 |
| Proteína - PHQ |
|
0.9860 | |
| Ácido fúlvico - PHQ |
|
0.9646 |
El HQ tiene una mejor capacidad de adsorción de los compuestos orgánicos (proteína y ácido fúlvico) que del componente inorgánico (Cl-) aunque la velocidad de adsorción de Cl- es mayor. Si bien la capacidad de adsorción del material húmedo es relativamente bajo al compararlo con otros procesos utilizando materiales sintéticos al recalcular la capacidad de adsorción para cada uno de los procesos de adsorción de los compuestos de interés, considerando que el adsorbente tiene un 94.79 % de humedad la capacidad de adsorción se ve aumentada a 111.19, 102.41 y 36.74 mg/g de proteína, ácido fúlvico y cloruros, respectivamente, siendo similar o superior al de otros materiales como óxidos férricos de grafeno, membranas catiónicas, alúmina, entre otros para la recuperación de compuestos orgánicos e inorgánicos, con la ventaja de ser un material orgánico biodegradable [20]-[22].
4. Conclusiones
A partir del uso de materiales de desecho como la quitina proveniente de las cáscaras de crustáceos se pueden producir compuestos de valor agregado una vez refinado el producto. Los cuales pueden adsorber compuestos contaminantes del agua a niveles similares o superiores a materiales sintéticos.
Los HQ presentan una mejor capacidad de adsorción de compuestos orgánicos por lo que su uso en aguas domésticas o de industrias alimentarias puede ser altamente efectivo al ser estos los principales productos de desecho.
El proceso por el que se da la adsorción de los compuestos es la quimisorción por lo que un estudio sobre las capacidades regenerativas del material se hace necesario a futuro.











 nueva página del texto (beta)
nueva página del texto (beta)